Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.26 no.4 Bogotá Oct./Dec. 2011
Cáncer de mama durante el embarazo
Breast cancer during pregnancy
1 Sección Cirugía de Seno, Departamento de Cirugía, Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia
2 Cirujana General, Departamento de Cirugía, Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia
Correspondencia: Fabio Torres, MD. Correo eléctronico: fabiotowers@hotmail.com
Bogotá.
Fecha de recibido: 8 de septiembre de 2011. Fecha de aprobación: 8 de septiembre de 2011.
Resumen
Introducción. El cáncer de mama asociado al embarazo incluye las lesiones mamarias malignas que se presentan durante el periodo de gestación o hasta un año después del parto.
En este artículo se presenta un caso y se revisan las opciones actuales de diagnóstico y tratamiento.
Presentación del caso. Se trata de una mujer de 32 años, con aparición de masa mamaria en la cuarta semana del embarazo. El diagnóstico de cáncer de mama se hizo en la semana 12. Se inició tratamiento con quimioterapia la semana 20, con mala evolución clínica, por lo cual se practicó mastectomía radical modificada en la semana 32. No se presentaron efectos adversos en el feto ni complicaciones maternas.
El neonato de 39 semanas no presentó alteraciones de peso, talla ni en su adaptación neonatal.
Discusión. El cáncer de mama asociado al embarazo es el segundo tumor maligno más frecuente durante la gestación. El diagnóstico suele ser tardío, lo cual deteriora el pronóstico para la mujer debido al estadio avanzado. Las metas de tratamiento son las mismas que para la mujer no gestante, basadas en el control local y a distancia de la enfermedad. Aún no es claro si el embarazo representa por sí solo un factor de mal pronóstico para este tipo de cáncer.
Conclusiones. Debido a las dificultades que plantea la realización de estudios durante el periodo de gestación, el conocimiento actual es insuficiente para establecer las mejores opciones de tratamiento del cáncer de mama asociado al embarazo.
Palabras clave: neoplasias de la mama; carcinoma ductal de mama; diagnóstico; factores de riesgo; masculino.Introduction: Pregnancy-associated breast cancer is defined as the malignant mammary lesion appearing during pregnancy or within the first year after delivery. In this paper we present a case of pregnancy-associated breast cancer and review current options for diagnosis and treatment.
Case presentation: Thirty two year old woman with onset of breast mass in her fourth week pregnancy. The diagnosis of breast cancer was established at week 12, and began neoadjuvant therapy until week 20 with no response. Modified radical mastectomy was performed at week 32 without effects on the fetus, or maternal complications.
Discussion: Pregnancy-associated breast cancer is the second most common malignant tumor during pregnancy; the diagnosis is often delayed, a fact that impairs prognosis due to advance in stage. The goals of treatment are the same for non-pregnant women: local control of the malignant tumor and prevention of systemic spread. It is unclear whether pregnancy is an independent adverse risk factor for outcomes in pregnancy-associated breast cancer.
Conclusions: Current evidence is insufficient to define the best treatment options for breast cancer associated with pregnancy.
Key words: breast neoplasms; diagnosis; pregnancy; complications, neoplastic; neoadjuvant therapy.Introducción
En general, el cáncer afecta una de cada 1.000 mujeres embarazadas y representa una tercera parte de las causas de muerte materna durante la gestación 1. Específicamente, el cáncer de mama asociado al embarazo es el segundo tumor más frecuente en este periodo e incluye las lesiones mamarias malignas que se presentan durante el periodo de gestación o hasta un año después del parto. Se presenta en uno de cada 3.000 a 10.000 embarazos, con una incidencia global de 3.500 nuevos casos por año 2-7.
Uno de los problemas del cáncer de mama asociado al embarazo, es el diagnóstico tardío debido a que los síntomas se atribuyen frecuentemente a los cambios fisiológicos de la gestación 2. Además, no hay pautas de diagnóstico y tratamiento basadas en la información existente debido a las limitaciones obvias para realizar estudios prospectivos controlados en las mujeres embarazadas. Tampoco hay suficiente información sobre los efectos a largo plazo en los fetos expuestos a la quimioterapia 5.
Aunque los tratamientos existentes representan riesgos para el bienestar del feto, las metas de tratamiento del cáncer de mama asociado al embarazo son las mismas que en la mujer no embarazada: control local del cáncer y evitar la diseminación a distancia 2.
En este artículo se revisan las opciones actuales de diagnóstico y tratamiento, y se presenta un caso de cáncer de mama asociado al embarazo.
Revisión de la literatura y discusión
Definición y epidemiología
Se ha establecido que entre 10 y 15 % de todos los tumores de mama en mujeres menores de 40 años, ocurren durante la gestación 2-5. Esta frecuencia varía según el grupo de población: mientras en países como Zaria y Nigeria, el cáncer de mama asociado al embarazo representa 26 % de los tumores de mama en mujeres menores de 50 años, en Estados Unidos este porcentaje es de 3 a 4 % 4.
A pesar de la frecuencia tan alta de cáncer de mama en nuestro país, no hay datos exactos de su incidencia en el periodo de embarazo 8. Además, se espera un incremento en su incidencia debido a la tendencia al aumento en la edad materna para el primer embarazo 7. Se ha establecido que el riesgo se incrementa entre dos y tres veces cuando la primera gestación ocurre después de los 30 años 3,9.
La mayoría de expertos considera que estos tumores han estado presentes, al menos, dos años antes de su detección clínica. Incluso, los tumores diagnosticados hasta un año después del parto probablemente se encontraban durante el periodo de embarazo 3. En un estudio de 130 mujeres, la edad de gestación promedio al diagnóstico fue de 13,1 semanas y, la edad materna, de 34 años. Es usual la presentación en estadios localmente avanzados 10, ocurriendo retrasos en el diagnóstico entre uno y dos meses 2.
Al igual que en mujeres no gestantes menores de 40 años, la biología tumoral no suele ser favorable; el patrón de receptores de estrógenos, progesterona y HER-2/neu, es comparable con el de mujeres no embarazadas con cáncer de mama. En general, 29 a 42 % de los cánceres de mama asociados al embarazo son positivos para receptores de estrógenos, 27 a 35 %, para receptores de progesterona y, 25 a 58 %, para HER-2/neu 2 ,10-12.
Pronóstico
Debido al diagnóstico tardío, a potenciales efectos hormonales durante la gestación y a posibles factores intrínsecos del embarazo, las mujeres con cáncer de mama asociado al embarazo se presentan con enfermedad más avanzada y tienen mal pronóstico.
Los estudios existentes muestran resultados controversiales respecto a la relación directa del embarazo como factor de riesgo en el cáncer de mama. La mayoría de autores han encontrado que, al controlar por edad y estadio tumoral, la supervivencia no resulta significativamente diferente en comparación con los tumores en mujeres no gestantes 2-3,12. Sin embargo, en algunos estudios recientes se ha encontrado que el embarazo sí podría comportarse como un factor independiente de mal pronóstico en los tumores mamarios, con una ligera disminución en la supervivencia en comparación con controles de edad similar 10-13.
Diagnóstico
La principal presentación del cáncer de mama asociado al embarazo es la masa mamaria palpable no dolorosa 6. Aunque 80 % de las masas durante el embarazo son de origen benigno, cualquier lesión que persista más de dos semanas requiere estudio histopatológico. Las descargas por el pezón y el signo de “rechazo de la leche”, son de presentación infrecuente 5,7.
El estudio de elección para el diagnóstico de lesiones mamarias durante el embarazo es la ecografía. Tiene gran sensibilidad en mamas densas y, además, es inocua para el feto. Por el contrario, la mamografía en mujeres gestantes tiene alta tasa de falsos negativos y baja sensibilidad (menor de 70 %). A pesar de esto, continúa siendo una herramienta fundamental en el estudio de este tipo de cáncer para la detección de microcalcificaciones. La exposición del feto a la radiación durante la mamografía (0,004 Gy) está por debajo de los niveles permitidos, por lo cual se acepta su uso (0,01 Gy) 4,14.
La resonancia magnética continúa siendo controversial en el embarazo. Tiene dificultades para discriminar el aumento de la irrigación presente en forma fisiológica durante la gestación, de la inducida por una enfermedad tumoral. No se ha establecido su seguridad debido a potenciales efectos de cavitación en el feto por los campos magnéticos de alta energía y a la asociación del gadolinio con malformaciones fetales en los modelos animales 5,14. Si hay indicación para su práctica debido a sospecha de enfermedad metastásica o contralateral, se recomienda esperar hasta el segundo trimestre 4.
El estudio histológico con biopsia por incisión o con aguja tipo tru-cut, es preferible a la citología por aspiración; la biopsia por aspiración con aguja fina (BACAF) se ha asociado a falsos positivos y a falsos negativos. Además, las muestras de tejido permiten confirmar el cáncer invasivo y estudiar la biología tumoral, lo cual es útil para dirigir el tratamiento. En algunos casos, las biopsias con tru-cut se han asociado con mayor frecuencia con abscesos y fístulas mamarias en mujeres embarazadas 4,6.
Los estudios de extensión deben limitar la exposición del feto a la radiación ionizante. Las anormalidades fetales aparecen con dosis mayores de 0,02 Gy. Sin embargo, la dosis máxima permitida durante el embarazo es de 0,01 Gy. Durante el primer trimestre, la estadificación se debe hacer únicamente con radiografía de tórax y ecografía abdominal. La gammagrafía ósea y la tomografía abdominal se deben evitar durante este periodo. Según la sospecha clínica y sólo si es indispensable, se debe practicar resonancia magnética sin gadolinio para el estudio de metástasis cerebrales, hepáticas y óseas 5,6.
Tratamiento
La decisión inicial en el cáncer de mama asociado al embarazo para la madre y el equipo de tratamiento, es sobre la continuidad del embarazo. Un aspecto que se debe considerar es que la terminación de la gestación elimina las consideraciones terapéuticas respecto al riesgo fetal. Podría plantearse cuando el diagnóstico se hace durante las primeras semanas y el retraso en el tratamiento afecta el pronóstico materno. Sin embargo, no hay datos que apoyen la interrupción de la gestación como medida terapéutica y no se han demostrado ventajas en la supervivencia con el aborto. Algunos estudios incluso muestran peores resultados para la madre 1-3.
Cirugía
En múltiples series se ha evaluado la seguridad de la cirugía durante la gestación. La mayoría de los estudios muestra que el tratamiento quirúrgico es usualmente bien tolerado por la madre y el feto, aun teniendo en cuenta el aumento en el riesgo de bajo peso al nacer debido a parto prematuro y restricción del crecimiento intrauterino. Estos últimos se han visto principalmente relacionados con los procedimientos quirúrgicos urgentes 15,16.
Tanto la mastectomía radical modificada como la cirugía conservadora con disección axilar, están aceptadas para el manejo de la enfermedad local en cualquier trimestre 16. Debido a la contraindicación para la radioterapia durante el embarazo, el potencial uso de la cirugía conservadora se reduce si el diagnóstico del cáncer de mama asociado al embarazo se hace en los primeros meses. El riesgo de recurrencia local al retrasar la radioterapia más de seis meses es inaceptable y la cirugía conservadora se reserva para las mujeres con diagnóstico entre el segundo y el tercer trimestre, posponiendo la radioterapia hasta el posparto 6. La mastectomía radical modificada elimina este riesgo y, por esta razón, está indicada como tratamiento inicial para tumores desde estadio I a III en cualquier trimestre de la gestación 3.
Ganglio centinela
Las metástasis linfáticas axilares son frecuentes en las pacientes con cáncer de mama asociado al embarazo, por lo cual algunos autores recomiendan la disección axilar rutinaria. Sin embargo, una pequeña proporción de las pacientes con este tipo de cáncer se presentan en estadios tempranos y podrían beneficiarse de la disección del ganglio centinela 17. Este procedimiento, de uso rutinario en las mujeres no embarazadas, es todavía controversial durante el embarazo por los potenciales riesgos para el feto 3.
En los estudios de simulación se ha encontrado que la distribución del radiotrazador en este procedimiento es mínima y la radiación del feto con una inyección de 0,5 a 2,5 mCi de 99Tc, es de 0,0043 Gy, aproximadamente 6,18. Para algunos autores la biopsia del ganglio centinela puede practicarse en forma segura con riesgos mínimos para el feto en cualquier etapa del embarazo, y se está haciendo en forma rutinaria, al igual que en mujeres no embarazadas 2,6,17. La recomendación es practicar la biopsia dos a tres horas después de la inyección de 3 a 5 MBq de coloides marcados con 99Tc. Es importante seguir algunas recomendaciones para minimizar la exposición del feto, como evitar el contacto con otros pacientes que puedan ser fuentes de radioactividad, y reducir el tiempo entre la gammagrafía y la cirugía 17.
Radioterapia
La radioterapia está contraindicada durante el embarazo y la recomendación es iniciarla en el posparto. La exposición del feto a la radiación ionizante es proporcional a la edad de gestación. En el primer trimestre, la dosis promedio estimada es de 0,036 a 0,038 Gy. Sin embargo, a medida que el feto se aproxima al tórax materno, la radiación recibida alcanza los 2 Gy 16. Las consecuencias de la radiación incluyen pérdida del embarazo, teratogénesis, retraso mental, disminución del crecimiento intrauterino y carcinogénesis en los primeros años de vida del niño 14.
Quimioterapia
Se han propuesto esquemas de tratamiento complementario. El tiempo de inicio de la quimioterapia es fundamental para el éxito del tratamiento. Aunque el tratamiento quirúrgico puede hacerse en cualquier etapa del embarazo, la quimioterapia debe retrasarse hasta una etapa segura para el feto. La mayoría de los procesos de organogénesis ocurren entre la semana 3 y 10 de gestación, por lo que el riesgo de malformaciones fetales con quimioterapia durante el primer trimestre está entre 14 y 19 %. Durante el segundo y tercer trimestres, el riesgo de malformaciones asociadas a la quimioterapia está entre 1,3 y 3,8 % 15.
En cuanto a los efectos fetales, la decisión ideal sería aplazar el tratamiento sistémico hasta después del parto. Sin embargo, esto comprometería las probabilidades de supervivencia para la madre, por lo que se hace necesario iniciar esquemas de tratamiento con quimioterapia neoadyuvante durante la gestación, especialmente en tumores localmente avanzados. En general, la decisión depende del estadio y la agresividad tumoral. Las mujeres con diagnóstico durante el primer trimestre, necesitan tener en cuenta el impacto de retrasar la quimioterapia hasta el segundo trimestre o tomar la decisión de interrumpir el embarazo. En estas pacientes, el tratamiento sería la mastectomía radical modificada durante el primer trimestre, iniciando tratamiento complementario en el segundo trimestre, en vez de posponer tanto el tratamiento quirúrgico como el sistémico hasta después de la semana 12 2,15.
Los agentes quimioterapéuticos son similares a los usados en las mujeres no gestantes. Sin embargo, se deben tener consideraciones específicas en el embarazo. Debido a los cambios fisiológicos, la farmacocinética de los agentes se modifica, con alteraciones de sus efectos terapéuticos y tóxicos. Las dosis se deben ajustar según el peso actual y la superficie corporal materna 15,16.
La combinación más aceptada es la de 5-fluoracilo, doxorrubicina y ciclofosfamida. Las antraciclinas han mostrado toxicidad aceptable 16. El metotrexato está contraindicado por alto riesgo de abortos y malformaciones 15. Los taxanos se utilizan como medicamentos de segunda línea; en una revisión de la literatura científica, no se presentaron abortos, muertes intrauterinas ni malformaciones relacionadas directamente con el uso de taxanos. La única malformación posiblemente relacionada, incluyó un caso de estenosis pilórica en un neonato cuya madre recibió poliquimioterapia (doxorrubicina, ciclofosfamida, paclitaxel y docetaxel) 19,20.
Agentes biológicos
Existe insuficiente información para el uso del trastuzumab en el embarazo. Actualmente, está contraindicado su uso debido principalmente a que el HER-2 se expresa en los tejidos embrionarios. Se conocen 11 casos en la literatura científica, especialmente de mujeres con cáncer metastásico de mama. El efecto encontrado ha sido el aumento del riesgo de oligohidramnios y anhidramnios durante el segundo y tercer trimestres, probablemente relacionado con la interferencia en el desarrollo renal debido a la expresión del receptor del factor de crecimiento epidérmico en el riñón fetal 15,21,22. No hay información hasta el momento para el uso de lapatinib.
Tratamiento hormonal
No está recomendado el uso de antiestrógenos durante el embarazo. En modelos animales se ha encontrado que el tamoxifeno causa alteraciones en el desarrollo de aparato reproductivo, específicamente, se interrumpe el desarrollo del útero, similar a los efectos conocidos del dietilbestrol. En un estudio con modelos animales, se demostró actividad estrogénica sobre las glándulas mamarias fetales con efecto carcinogénico secundario 23.
Existen muy pocos casos publicados en humanos y los efectos son diversos; en series aisladas de casos no se han encontrado efectos tóxicos 4. En un estudio de 100 mujeres que tomaban tamoxifeno al quedar embarazadas, sólo se encontró un caso de ambigüedad sexual 24. Además del efecto tóxico potencial del tamoxifeno durante la gestación, es necesario considerar una posible falla del tratamiento, debido a que los altos niveles de estrógenos mantienen los receptores ocupados, bloqueando de esta forma el efecto antagonista del tamoxifeno 25. Los inhibidores de la aromatasa también están contraindicados durante el embarazo 26.
Reporte de caso
Se presenta el caso de una mujer de 32 años que, en la cuarta semana del embarazo, notó una masa dolorosa en el seno derecho. En la ecografía se encontró un nódulo fibromatoso retroareolar (BI-RADS 4), del que se obtuvo una biopsia por aspiración con aguja fina (BACAF) que indicó una mastitis, sin hallazgos de neoplasia maligna. Recibió tratamiento antibiótico con doxiciclina sin mejoría clínica, por lo cual se programó para cuadrantectomía. La paciente no aceptó la intervención por su embarazo. Sin embargo, durante la semana 12 de gestación, consultó a urgencias por aumento del tamaño de la masa, dolor y fiebre.
En el examen físico inicial se encontró una paciente en buenas condiciones, sin alteración de sus signos vitales; el examen mamario demostró una masa de 5 x 4 cm, dura, mal definida, inmóvil y dolorosa, en la zona retroareolar de la mama derecha, con leve eritema y calor, sin retracción de la piel, ni secreción por el pezón. No se evidenciaban adenopatías axilares y la mama izquierda era normal.
En la valoración de urgencias consideraron como diagnóstico un absceso mamario e iniciaron tratamiento antibiótico con ampicilina-sulbactam durante cinco días. Se practicó una nueva ecografía mamaria (figura 1a) en la que se observó una lesión sólida retroareolar derecha de contornos mal definidos, de 3 x 3 cm, con vascularización en el estudio Doppler, asociada a una adenomegalia axilar ipsilateral y lesiones en la mama izquierda de aspecto benigno (BIRADS 4b). En el hemograma se encontró leucocitosis con neutrofilia. En la ecografía pélvica transvaginal se encontró un feto único vivo, con biometría para 13 semanas y 1 día, acorde con la edad de gestación menstrual.
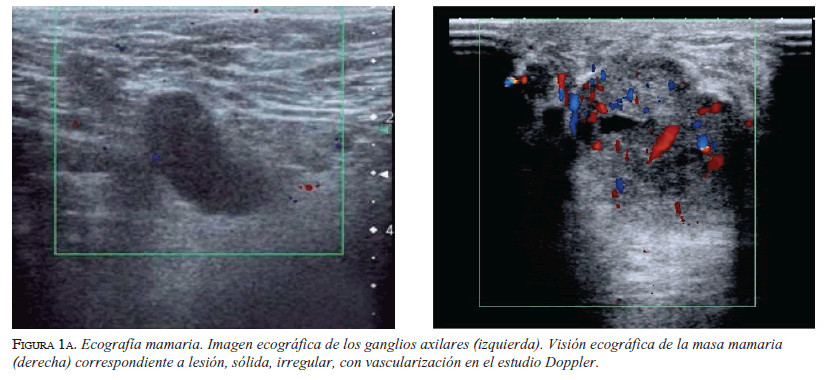
Se practicó un estudio por punción de la masa y se obtuvieron 6 ml de líquido hemopurulento, el cual se envió para cultivo, y se hizo una biopsia con aguja tru-cut, guiada por ecografía. El resultado histológico fue un carcinoma ductal infiltrante moderadamente diferenciado, sin invasión linfovascular, con receptores de estrógenos del 10% (débil), 80 % de progesterona, 40 % de expresión de la proteína nuclear Ki-67 y del receptor HER-2 negativo.
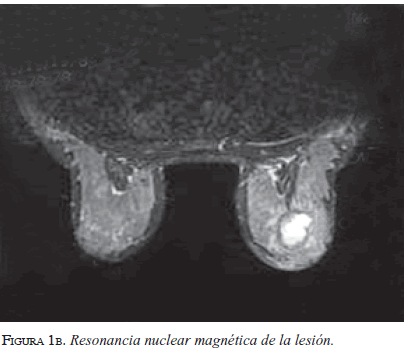
Los estudios de extensión en hígado, hueso y pulmón, fueron negativos para enfermedad tumoral metastásica. En la mamografía bilateral con protección abdominal se encontró hiperplasia glandular difusa, por gestación, con mayor densidad retroareolar derecha (BIRADS 6). Debido al hallazgo de una lesión contralateral de comportamiento indefinido, se hizo una resonancia magnética de seno sin gadolinio (figura 1b) con secuencias de difusión, en la cual se observó una lesión de aspecto benigno en el lado izquierdo, cuya histopatología correspondió a papiloma. Con los estudios realizados, se consideró un tumor en estadio IIIb, T4bN2M0. A pesar del crecimiento rápido de la masa y la aparición de adenopatías axilares palpables en la semana 17, la paciente decidió continuar con el embarazo e iniciar la quimioterapia después de la semana 20, para evitar los efectos sobre el feto.
En el segundo trimestre se inició tratamiento con quimioterapia antineoplásica no posquirúrgica en esquema de tres ciclos, seguida de tres ciclos con paclitaxel, los cuales fueron tolerados por la madre y el feto. En la evaluación tumoral clínica y ecográfica posterior a la quimioterapia, se encontró una lesión mamaria de 7 x 5 x 6 cm con aumento del compromiso axilar.
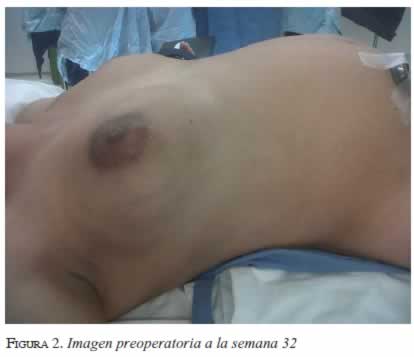
Debido a la falta de mejoría con la quimioterapia de inducción, se sometió a mastectomía radical modificada derecha y cuadrantectomía de la lesión mamaria izquierda, en la semana 32 (figura 2). Los hallazgos en la cirugía fueron una lesión tumoral de 10 x 8 cm en la glándula mamaria derecha, con un conglomerado ganglionar axilar del mismo lado de 7 x 10 cm. En la mama izquierda se encontró una lesión nodular localizada previamente con arpón.
La cirugía transcurrió sin complicaciones, y la paciente se dejó hospitalizada para vigilancia, control del sangrado posquirúrgico y monitoreo materno-fetal. El procedimiento no desencadenó actividad uterina y se demostró bienestar fetal con monitorización seriada.
La histopatología definitiva fue de un carcinoma metaplásico de 5 x 5 cm, de grado III, sin evidencia de compromiso en piel y con márgenes de sección libres. Hubo compromiso tumoral en dos de 19 ganglios axilares.
En la semana 38, la paciente se programó para parto por cesárea, la cual se practicó sin complicaciones. El recién nacido pesó 2.910 g, presentó adaptación normal, puntaje de Apgar de 9/10 a los 5 minutos y de 10/10 a los 10 minutos. La placenta y el líquido amniótico fueron normales.
Posterior al parto, se inició tratamiento complementario con ixabepilona. Hasta el momento de publicación del artículo, la paciente presentaba mejoría clínica adecuada con la quimioterapia. El producto del embarazo, con cuatro meses de vida, no había presentado alteraciones en su desarrollo.
Conclusiones
El caso presentado es una muestra del dilema ético y terapéutico al cual se enfrentan la madre y el equipo médico ante el diagnóstico de una lesión maligna en el embarazo. En nuestro país, la legislación vigente permite el aborto en condiciones en las cuales la continuación del embarazo constituya peligro para la vida o la salud de la mujer 27. Aunque no se ha demostrado beneficio en el pronóstico, la interrupción de la gestación cuando los tumores se presentan en las primeras semanas del embarazo evitaría el retraso del inicio del tratamiento quirúrgico y del tratamiento complementario.
Otro aspecto que se debe resaltar es la importancia de sospechar el diagnóstico en las lesiones persistentes. Aunque la mayoría de masas mamarias son benignas, las mujeres embarazadas con masas recurrentes requieren estudio histopatológico para descartar neoplasia maligna, idealmente con aguja de tipo tru-cut.
A pesar de las dificultades que plantean los estudios en el embarazo, se requiere mayor información para definir los efectos, en la mujer y en el producto del embarazo, cuando se presenta una enfermedad maligna durante el periodo de gestación.
Bibliografía
1. Surbone A, Peccatori F, Pavlidis N. Why is the topic of cancer and pregnancy so important? Why and how to read this book. Recent Results Cancer Res. 2008;178:1-2. [ Links ]
2. Cardonick E, Dougherty R, Grana G, Gilmandyar D, Ghaffar S, Usmani A. Breast cancer during pregnancy: Maternal and fetal outcomes. Cancer J. 2010;16:76-82. [ Links ]
3. Sukumvanich P. Review of current treatment options for pregnancy-associated breast cancer. Clin Obstet Gynecol. 2011;54:164-72. [ Links ]
4. Psyrri A, Burtness B. Pregnancy-associated breast cancer. Cancer J. 2005;11:83-95. [ Links ]
5. Rovera F, Frattini F, Coglitore A, Marelli M, Rausei S, Dionigi G, et al. Breast cancer in pregnancy. Breast J. 2010;16(Suppl.1):S22-5. [ Links ]
6. Gentilini O. Breast cancer during pregnancy: Epidemiology, surgical treatment, and staging. In: Surbone A, Peccatori F, Pavlidis N, editors. Cancer and pregnancy. Verlag Berlin Heidelberg: Springer; 2008. p. 39-44. [ Links ]
7. López RR, García JLS, Mitjans OD. Cáncer de mama y embarazo. Revista Cubana de Obstetricia y Ginecología. 2007;33. Disponible en http://scielo.sld.cu/pdf/gin/v33n3/gin07307.pdf [ Links ]
8. Piñeros M, Murillo R. Incidencia de cáncer en Colombia: importancia de las fuentes de información en la obtención de cifras estimativas. Revista Colombiana de Cancerología. 2004;8:5-14. [ Links ]
9. Wiesner C. Determinantes psicológicos, clínicos y sociales del diagnóstico temprano del cáncer de mama en Bogotá, Colombia. Revista Colombiana de Cancerología. 2007;11:13-22. [ Links ]
10. Rodríguez AO, Chew H, Cress R, Xing G, McElvy S, Danielsen B, et al. Evidence of poorer survival in pregnancy-associated breast cancer. Obstet Gynecol. 2008;112:71-8. [ Links ]
11. Moreira WB, Brandao EC, Soares AN, Lucena CE, Antunes CM. Prognosis for patients diagnosed with pregnancy-associated breast cancer: A paired case-control study. Sao Paulo Med J. 2010;128:119-24. [ Links ]
12. Halaska MJ, Pentheroudakis G, Strnad P, Stankusova H, Chod J, Robova H, et al. Presentation, management and outcome of 32 patients with pregnancy-associated breast cancer: A matched controlled study. Breast J. 2009;15:461-7. [ Links ]
13. Bonnier P, Romain S, Dilhuydy JM, Bonichon F, Julien JP, Charpin C, et al. Influence of pregnancy on the outcome of breast cancer: A case-control study. Int J Cancer. 1997;72:720-7. [ Links ]
14. Orecchia GL, Tosi G. Prenatal irradiation and pregnancy: The effects of diagnostic imaging and radiation therapy. In: Surbone FP, Pavlidis N, editors. Recent results in cancer research. 1st edition. Berlin: Springer; 2008. p. 3-20. [ Links ]
15. Litton JK, Theriault RL. Breast cancer and pregnancy: Current concepts in diagnosis and treatment. Oncologist. 2010;15:1238-47. [ Links ]
16. Navrozoglou I, Vrekoussis T, Kontostolis E, Dousias V, Zervoudis S, Stathopoulos EN, et al. Breast cancer during pregnancy: A mini-review. Eur J Surg Oncol. 2008;34:837-43. [ Links ]
17. Gentilini O, Cremonesi M, Trifiro G, Ferrari M, Baio SM, Caracciolo M, et al. Safety of sentinel node biopsy in pregnant patients with breast cancer. Ann Oncol. 2004;15:1348-51. [ Links ]
18. Keleher A, Wendt R 3rd, Delpassand E, Stachowiak AM, Kuerer HM. The safety of lymphatic mapping in pregnant breast cancer patients using Tc-99m sulfur colloid. Breast J. 2004;10:492-5. [ Links ]
19. Cardonick E, Usmani A, Ghaffar S. Perinatal outcomes of a pregnancy complicated by cancer, including neonatal follow-up after in utero exposure to chemotherapy: Results of an international registry. Am J Clin Oncol. 2010;33:221-8. [ Links ]
20. Mir O, Berveiller P, Goffinet F, Treluyer JM, Serreau R, Goldwasser F, et al. Taxanes for breast cancer during pregnancy: A systematic review. Ann Oncol. 2010;21:425-6. [ Links ]
21. Fanale MA, Uyei AR, Theriault RL, Adam K, Thompson RA. Treatment of metastatic breast cancer with trastuzumab and vinorelbine during pregnancy. Clin Breast Cancer. 2005;6:354-6. [ Links ]
22. Goodyer MJ, Ismail JR, O'Reilly SP, Moylan EJ, Ryan CA, Hughes PA et al. Safety of trastuzumab (Herceptin) during pregnancy: Two case reports. Cases J 2009; 2: 9329. [ Links ]
23. Halakivi-Clarke L, Cho E, Onojafe I, Liao DJ, Clarke R. Maternal exposure to tamoxifen during pregnancy increases carcinogen-induced mammary tumorigenesis among female rat offspring. Clin Cancer Res. 2000;6:305-8. [ Links ]
24. Tewari K, Bonebrake RG, Asrat T, Shanberg AM. Ambiguous genitalia in infant exposed to tamoxifen in utero. Lancet. 1997;350:183. [ Links ]
25. Isaacs RJ, Hunter W, Clark K. Tamoxifen as systemic treatment of advanced breast cancer during pregnancy -case report and literature review. Gynecol Oncol. 2001;80:405-8. [ Links ]
26. S. Aebi, Loibl S. Breast cancer during pregnancy: Medical therapy and prognosis. In: Surbone A, Peccatori F, Pavlidis N, editors. Cancer and pregnancy. 1st edition. Berlin: Springer; 2008. p. 45-55. [ Links ]
27. García JA. Consideraciones sobre la despenalización del aborto en Colombia. Iatreia. 2010;23:294-301. [ Links ]














