Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.34 no.1 Bogotá Jan./Mar. 2014
https://doi.org/10.7705/biomedica.v34i1.1606
ARTÍCULO ORIGINAL
1 Grupo de Inmunodeficiencias Primarias, Universidad de Antioquia, Medellín, Colombia
2 Infectología Pediátrica, Hospital Pablo Tobón Uribe, Medellín, Colombia
3 Facultad Nacional de Salud Pública, Universidad de Antioquia, Medellín, Colombia
Contribución de los autores:
Claudia M. Trujillo-Vargas: diseño y coordinación científica del proyecto.
Isaura Pilar Sánchez y Lucía C. Leal-Esteban: estandarización y aplicación de los ensayos.
Julio C. Orrego-Arango, Carlos G. Garcés-Samudio y José Luis Franco: evaluación clínica e inclusión de los pacientes.
Rubén Darío Gómez-Arias: análisis estadístico de los resultados
José Luis Franco: asesoría científica y análisis de los datos
Isaura Pilar Sánchez, José Luis Franco y Claudia M. Trujillo-Vargas: redacción del artículo.
Recibido: 08/04/13; aceptado: 01/11/13
Introducción. Existen pocos datos sobre los defectos que afectan el desarrollo y función de los linfocitos asesinos naturales ( natural killers, NK) en pacientes con un incremento anormal en la recurrencia de infecciones.
Objetivo. Realizar una evaluación sistemática de las diferentes subpoblaciones y la función de estas células en pacientes con infecciones recurrentes.
Materiales y métodos. Se incluyeron 20 pacientes con infecciones graves o recurrentes y se analizaron las subpoblaciones y la respuesta citotóxica de los linfocitos NK en sangre periférica. Los resultados de los pacientes se compararon con controles sanos pareados por edad y sexo.
Resultados. Los pacientes con episodios infecciosos activos presentaron anormalidades transitorias en el porcentaje o el número absoluto de linfocitos NK. Se caracterizaron, además, cinco pacientes con alteraciones persistentes en la distribución de las subpoblaciones de linfocitos NK. Estas alteraciones se debieron principalmente a la disminución de células CD56 dim CD16 bright . Se evidenciaron, también, defectos en la función de los linfocitos NK en algunos de nuestros pacientes; sin embargo, estas alteraciones fueron transitorias y se asociaron principalmente a la fase activa de la enfermedad.
Conclusiones. Nuestros resultados evidencian defectos transitorios en el número y función de los linfocitos NK en pacientes con infecciones recurrentes o graves, además de alteraciones persistentes en los LNK CD56 dim CD16 bright en algunos individuos. Es necesario profundizar en los mecanismos que conllevan al desarrollo de estos defectos inmunes y estudiar cómo estas alteraciones influyen en la respuesta inmune.
Palabras clave: células asesinas naturales, subgrupos linfocitarios, pruebas inmunológicas de citotoxicidad, infección.
doi: http://dx.doi.org/10.7705/biomedica.v34i1.1606
Variation in NK cell number and function in individuals with recurrent or severe infections
Introduction: The information about defects affecting natural killer cell (NK) development and activity in patients with an abnormal increase of recurrent infections is scarce.
Objective: To perform a systematic analysis of NK abnormalities in patients with recurrent infections.
Materials and methods: Our study enrolled twenty patients with severe or recurrent viral infections. Natural killer cell subsets, surface receptors expression and cytotoxicity were analyzed. Results were compared with those from age- and sex-matched healthy controls.
Results: Transient alterations were observed in the percentages and absolute numbers of NK cells in patients with infection active episodes. We also described five patients with stable disturbances in the distribution of NK cell subpopulations. These defects are mainly due to a decrease in the CD56 dim CD16 bright cells in peripheral blood. In addition, NK cell function abnormalities were observed in some patients, however, those were always transient and mainly associated to active disease.
Conclusions: These findings demonstrate transient alterations in the percentages and absolute numbers of NK cells in patients with recurrent or severe infection. Also, stable disturbances in CD56 dim CD16 bright NK cells are observed in these patients. Nevertheless, these parameters must be thoroughly studied to determine the mechanisms that entail these immune abnormalities and investigate how they alter the immune response.
Keys words: Killer cells, natural; lymphocyte subsets; cytotoxicity tests, immunologic; infection.
doi: http://dx.doi.org/10.7705/biomedica.v34i1.1606
Los linfocitos asesinos naturales ( natural killer , NK) representan una población de linfocitos efectores de la inmunidad innata con un papel crítico en la respuesta temprana contra las infecciones intracelulares y células tumorales (1). Estos linfocitos median diferentes funciones que incluyen citotoxicidad natural, citotoxicidad celular dependiente de anticuerpos, producción de quimiocinas y citocinas inmunorreguladoras y coestimulación de otras células inmunes para su activación y función, lo cual las convierte en un vínculo de interacción entre la inmunidad innata y la adaptativa (2,3).
Luego de su desarrollo en la médula ósea, los linfocitos NK migran a la sangre periférica donde constituyen de 5 a 20 % de los linfocitos totales dependiendo de la edad (2). El 90 % de estas células en sangre periférica expresa niveles intermedios de CD56 y altos de CD16 (CD56 dim CD16 bright ) en la membrana, así como de perforinas intracelulares, además de poseer una amplia capacidad citotóxica (1,2,4). Por otra parte, el 10 % restante expresa niveles altos de CD56 y bajos o ausentes de CD16 (CD56 bright CD16 dim/- ) y de perforinas, exhibiendo poca actividad citotóxica. Esta subpoblación, sin embargo, produce niveles elevados de IFN- g en respuesta a la estimulación con citocinas como la IL-12 (4-6). La expresión diferencial de los receptores CD56 y CD16 en la membrana entre estas dos subpoblaciones de linfocitos NK indica que representan dos grupos de células funcionalmente distintas (4-6). Se han descrito, además, otras subpoblaciones de linfocitos NK basadas en la expresión de CD56 y CD16 (células CD56 dim CD16 - y CD56 - CD16 + ), sin embargo, su relevancia funcional aún no es totalmente clara (7).
La importancia de la participación de los linfocitos NK en la respuesta inmune se ha demostrado por defectos genéticos que conllevan deficiencias de estas células y que incluyen tanto deficiencias exclusivas de los linfocitos NK como aquellas que hacen parte de un defecto inmunológico más generalizado (8,9). En el grupo de deficiencias exclusivas de linfocitos NK se han reportado algunos casos de deficiencias absolutas, las cuales se definen por la ausencia absoluta y persistente de estas células en todos los tejidos (10-14). Por su parte, las deficiencias funcionales de linfocitos NK se caracterizan por valores absolutos normales en sangre periférica y tejidos, con defectos principalmente en la actividad citotóxica de estas células (15-18). Los genes responsables de estos defectos no se han identificado en la mayoría de los casos (19,20). Los pacientes con estas deficiencias tienen mayor propensión a infecciones virales graves, principalmente por el virus de Epstein Barr (EBV), herpes simple (HSV), molusco contagioso, varicela zoster (VZV), citomegalovirus (CMV) y, ocasionalmente, también a bacterias como Hemophilus influenzae, Streptococcus pneumoniae, Staphylococccus aureus, el bacilo de Calmette-Guérin e infecciones fúngicas invasivas (10,11,15-18).
Por otra parte, existen inmunodeficiencias primarias en las cuales el espectro de defectos genéticos incluye alteraciones en el desarrollo y función de los linfocitos NK. Entre ellas tenemos la inmunodeficiencia grave combinada, la deficiencia del complejo mayor de histocompatibilidad de clase I, la deficiencia de adhesión leucocitaria de tipo I, la agammaglobulinemia ligada al cromosoma X o la inmunodeficiencia común variable, y síndromes linfoproliferativos y hemofagocíticos, entre otros (21-27). Los pacientes afectados no sólo presentan vulnerabilidad aumentada a infecciones virales y neoplasias malignas sino que también exhiben infecciones bacterianas recurrentes y enfermedades hematopoyéticas (21-27). Además, existen otras alteraciones que resultan en deficiencias de la función de los linfocitos NK tales como el xeroderma pigmentoso causado por mutaciones en el gen XPA (28), el síndrome de Bloom, por mutaciones en el gen BLM (29) y la anemia de Fanconi causada por defectos en los genes FANCA-G (30). Aunque estos pacientes tienden a presentar principalmente neoplasias, también son propensos a infecciones respiratorias y a aquellas inducidas por el virus del papiloma humano (HPV) (29,30). Lo anterior demuestra que las anormalidades inmunes en los linfocitos NK de pacientes con sospecha de inmunodeficiencias primarias son un hallazgo frecuente y sugiere la necesidad de evaluar su número y función para establecer patrones de vulnerabilidad a ciertos microorganismos.
El presente estudio incluyó a 20 pacientes con infecciones graves o recurrentes y con sospecha de inmunodeficiencias primarias. Se evaluó el porcentaje, número absoluto, subpoblaciones, expresión de perforinas, función citotóxica, translocación de CD107a en los linfocitos NK de pacientes y controles sanos pareados por edad y sexo mediante citometría de flujo. Está demostrado que muchas enfermedades pueden afectar el número y función de los linfocitos NK en humanos, pero se requiere una evaluación rigurosa de estas alteraciones para confirmar si son estables en el tiempo y si se asocian con alteraciones genéticas.
Materiales y métodos
Muestras de sangre de pacientes y controles
Se recolectaron muestras de sangre periférica con heparina de 20 pacientes con infecciones graves o recurrentes (31,32). De estos, seis eran hombres y 14 mujeres, ocho eran niños menores de 12 años y 12 eran adultos (cuadro 1).
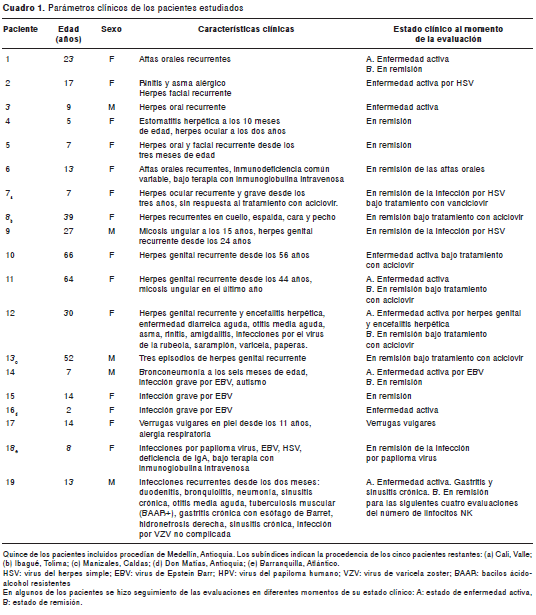
Los resultados de los análisis en cada uno de los pacientes se compararon con los de controles sanos pareados por edad y sexo. Ocho pacientes (1 a 8) presentaban infecciones orales o faciales por HSV recurrentes y diagnosticadas clínicamente, cinco (9 a 13) padecían de infecciones recurrentes genitales por HSV, tres (14 a 16) tenían infecciones graves por EBV con cargas virales en sangre mayores a 10.000 copias/ ml, dos pacientes (17 y 18) presentaban verrugas vulgares por HPV y otros dos pacientes (19 y 20) presentaban diversas infecciones recurrentes, principalmente neumonías, pero sin diagnóstico clínico definido.
El estado clínico de los pacientes en el momento de la evaluación del número y función de los linfocitos NK fue variable, algunos presentaban infecciones activas y estaban hospitalizados y otros estaban en estado de remisión (cuadro 1). Cuando las evaluaciones iniciales realizadas a los pacientes se encontraban alteradas, se realizó seguimiento para determinar si estas eran constantes en el tiempo (cuadro 1).
Cuantificación del número y subpoblaciones de linfocitos NK y expresión de perforina por citometría de flujo
El número absoluto de neutrófilos, eosinófilos, linfocitos totales y monocitos se calculó sobre la base de un conteo total y diferencial de células en extendido de sangre periférica usando la coloración de Wright y microscopía convencional. El porcentaje, número absoluto y fenotipo de las subpoblaciones de linfocitos NK (CD3-/CD16+/CD56+) se cuantificó por citometría de flujo empleando anticuerpos monoclonales conjugados con diferentes fluorocromos para los marcadores de superficie CD3/CD19-APC, CD14-PerCP, CD16-FITC, CD56-PeCy7 (Becton Dickinson BD, San Jose, CA). La sangre periférica (100 µl) se incubó con los correspondientes anticuerpos monoclonales por 20 minutos a temperatura ambiente en la oscuridad. Seguidamente, se lisaron los eritrocitos por incubación con solución de lisis 1X (Becton Dickinson BD, San Jose, CA), siguiendo las instrucciones del fabricante. Finalmente, las células se fijaron con 250 µl de formaldehído al 2 %.
La detección de perforinas intracelulares se realizó por incubación de 100 µl de sangre periférica con 250 µl de solución tampón cytofi x/cytoperm ( Becton Dickinson BD, San Jose, CA) por 20 minutos a 4 °C, seguida por dos lavados con solución perm/ wash (Becton Dickinson BD, San Jose, CA). Inmediatamente se adicionaron anticuerpos monoclonales antiperforina o el control de isotipo conjugado con ficoeritrina a las muestras y se incubaron por 30 minutos a 4 °C. Luego de tres lavados con solución perm/wash , las células se resuspendieron en PBS + 1% de SBF. Las lecturas de citometría de flujo se realizaron en un citómetro FacsCanto II y los análisis se hicieron con el software FlowJo V8-2 (TreeStar, Inc. Ashland, OR, USA).
Para el análisis se seleccionaron, en primer lugar, los linfocitos según las características de tamaño versus granularidad, excluyendo del análisis los monocitos (CD14+), los linfocitos T (CD3+) y B (CD19+). Finalmente, las células restantes se analizaron para determinar las subpoblaciones de linfocitos NK CD56 dim CD16 bright , CD56 bright CD16 dim/- , CD56 dim CD16 - y CD56 - CD16 + de acuerdo con la expresión diferencial de CD16 y CD56, así como la expresión intracelular de perforinas.
Ensayo de citotoxicidad
Para evaluar la respuesta citotóxica en los linfocitos NK, se realizó un ensayo de mortalidad usando éster succinimidil de diacetato de 5,6- carboxifluoresceína (CFSE) (Invitrogen TM , Carlsbad, CA, USA) en 11 de los pacientes evaluados. Sólo en una oportunidad, en el paciente 12, se utilizó perclorato de 3,3-dioctadecil carbocianina (DIOC18) (Molecular Probes, Eugene, OR, USA) para marcar las células blanco (línea celular K562 de eritroleucemia humana) y yoduro de propidio (Becton Dickinson BD, San Jose, CA) para evaluar la mortalidad de estas células. Los ensayos usando CFSE y DIOC18 son comparables de acuerdo con los controles incluidos en los experimentos. Las células mononucleares de sangre periférica se estimularon en presencia o no de IL-2 e IL-15 recombinante humana (25 ng/ml) (Becton Dickinson BD, San Jose, CA) y se incubaron a 37 °C y CO 2 por 24 horas. Seguidamente, estas células se expusieron a células blanco K562 marcadas con CFSE o DIOC18 durante 4 horas a 37 °C y 5 % de CO 2 en diferentes proporciones efector: blanco. Luego, se adicionaron 4 µl de solución de yoduro de propidio (50 µg/ml) a las células, y se analizaron en un citómetro de flujo Epics XL (Beckman Coulter, Brea, CA, USA). Los niveles de citotoxicidad se expresaron como el porcentaje de células blanco K562 CFSE+ o DIOC18+/IP+ después de la normalización de los datos debido a la muerte celular espontánea (células blanco K562 CFSE+ o DIOC18+/IP+ incubadas en medio de cultivo solamente).
Ensayo de translocación de CD107a
El CD107a es una molécula presente en la membrana de los gránulos citotóxicos de los linfocitos NK y linfocitos T CD8+ en reposo que se transloca a la membrana celular luego de la estimulación. La translocación de esta molécula permite evaluar la capacidad de fusión de los gránulos citotóxicos con la membrana celular de los linfocitos NK, lo cual descarta defectos en la degranulación de las células citotóxicas de los pacientes (33,34). Para evaluar la translocación de CD 1 07 a a la superficie celular se emplearon células mononucleares de sangre periférica en todos los pacientes y linfocitos NK purificados por selección negativa con perlas magnéticas (Invitrogen TM /Dynal, Oslo-Norway) en el paciente 14. Luego de 24 horas de cultivo con o sin estimulación previa con IL-2 e IL-15 como se describió anteriormente, las células mononucleares de sangre periférica o linfocitos NK se expusieron a las células blanco K562 en una proporción 1:1 en presencia del anticuerpo monoclonal anti-CD 107 a-PeCy5 (BD) durante tres horas a 37 ° C y 5 % CO2. Para evitar el reingreso de las moléculas de CD107a expuestas en la membrana se adicionó 0,5 µl de solución GolgiStop TM (Becton Dickinson BD, San Jose, CA) al cultivo después de una hora de incubación. La translocación espontánea de CD107a se evaluó en las células mononucleares de sangre periférica o linfocitos NK cultivados sin ningún estímulo. Finalmente, después de un lavado con PBS (Sigma-Aldrich), las células se marcaron con anticuerpos monoclonales anti-CD56/CD16-FITC, anti- CD3/CD19 -APC y anti- CD14 -pacific blue para ser analizadas en un citómetro FacsCanto II (Becton Dickinson BD, San Jose, CA). La expresión de CD107a en superficie se evaluó en los LNK CD3-/CD19-/CD14-/CD16+/CD56+ en el software FlowJo, verión 8-2.
Análisis estadístico
Las diferencias en los porcentajes y números absolutos de linfocitos NK en sangre periférica de pacientes y controles se analizaron utilizando la prueba de Mann Withney. Para asociar las variaciones en los porcentajes de las diferentes subpoblaciones de linfocitos NK en sangre periférica de pacientes y controles se utilizó el coeficiente de correlación de Spearman. Para comparar la respuesta citotóxica y translocación de CD107a en linfocitos NK de sangre periférica de pacientes y controles se usó la prueba Kruskal-Wallis. Se consideró significativo un valor de p<0,05. Los análisis estadísticos se realizaron utilizando el software GraphPad Prism, versión 5.0.
Consideraciones éticas
Este estudio fue aprobado por el Comité de Bioética de la Universidad de Antioquia y se obtuvieron los consentimientos informados tanto de los pacientes, de sus padres (en el caso de pacientes menores de edad) y de las personas sanas que sirvieron de controles.
Resultados
Las variaciones en el porcentaje y número absoluto de los linfocitos NK son frecuentes pero transitorias en pacientes con infecciones recurrentes o graves.
La cuantificación del porcentaje y número absoluto de linfocitos NK por citometría de flujo se realizó en todos los pacientes incluidos en este estudio a excepción del paciente 14. La comparación con base en la prueba U de Mann Withney mostró que los porcentajes y números absolutos de linfocitos NK en sangre periférica estaban disminuidos en los pacientes con episodios de infección activa en comparación con los valores de los controles sanos (figura 1a y b) (35). Sin embargo, cuando el análisis se realizó en aquellos pacientes en remisión no hubo diferencias significativas entre los valores de la media de los porcentajes y números absolutos de linfocitos NK comparados con los valores obtenidos en controles sanos (figura 1a y b) (35). Por otra parte, al comparar el número de los linfocitos NK en sangre periférica de pacientes con infecciones activas con el de aquellos en remisión, se observaron únicamente diferencias significativas en la media de los porcentajes de linfocitos NK (figura 1a). No se observaron diferencias en los números absolutos de linfocitos NK en sangre periférica entre estos dos grupos de pacientes (figura 1b).
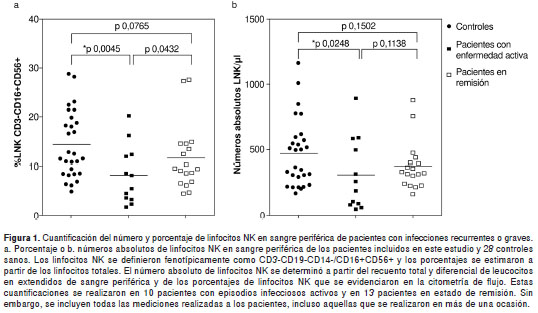
Cuando se analizaron los valores de referencia de linfocitos NK en sangre periférica reportados en la literatura, los pacientes 1, 10, 11, 15, 17, 19 y 20 presentaron porcentajes disminuidos de linfocitos NK en sangre periférica (35). Sin embargo, sólo los pacientes 10, 11 y 19 presentaron números absolutos de estos linfocitos por debajo de los valores normales reportados para la edad (35). En el paciente 13, aunque el porcentaje los linfocitos NK fue normal, el número absoluto de estas células en sangre periférica fue superior a los valores normales establecidos para la edad (no se presentan los datos) (35).
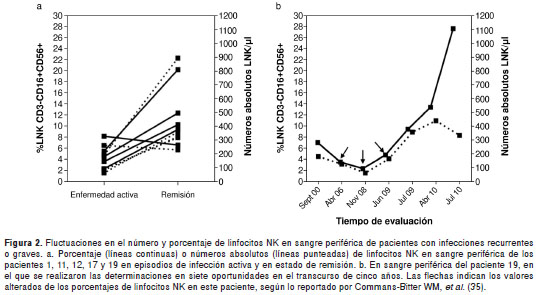
Para evaluar si las anormalidades encontradas en nuestros pacientes eran constantes en el tiempo y no debidas a fluctuaciones en los niveles de linfocitos NK como resultado de variaciones hormonales o presencia de infecciones activas, entre otros factores (36-38), se analizó en varios puntos del tiempo el porcentaje y número absoluto de linfocitos NK en los pacientes 1, 10-12, 17 y 19. Las anormalidades en el porcentaje y número absoluto de linfocitos NK en los pacientes 1, 10, 11 y 17 fueron transitorias como lo demostró la normalización de estos valores en las posteriores evaluaciones realizadas en períodos variables de tiempo comparados con los valores normales para la edad (figura 2a) (35). Como control se incluyó al paciente 12, cuyo porcentaje y número absoluto de linfocitos NK permanecieron normales durante todas las evaluaciones (figura 2a). Además, estos análisis se llevaron a cabo en un rango de tiempo más amplio en el paciente 19, con siete evaluaciones realizadas en períodos variables. Aunque el paciente mostró disminución en el porcentaje de linfocitos NK durante la segunda, tercera y cuarta evaluaciones con un lapso de tiempo de 31 y 7 meses entre ellas, estos valores se normalizaron un mes después de la cuarta evaluación, manteniéndose dentro de los rangos normales para la edad hasta la última evaluación realizada (figura 2b) (35). Los números absolutos de linfocitos NK en este paciente se mantuvieron dentro de los valores normales para la edad durante todas las evaluaciones (figura 2b). Estos resultados demuestran que las alteraciones en los porcentajes o números absolutos de los linfocitos NK en los pacientes incluidos en este estudio son transitorias y están asociadas a infecciones activas.
Las alteraciones en la distribución de las sub-poblaciones de los linfocitos NK CD56 dim CD16 bright son persistentes en algunos pacientes con infecciones recurrentes.
Inicialmente se validó en controles sanos el análisis para la identificación de las cinco subpoblaciones de linfocitos NK en sangre periférica reportadas en la literatura (7) según la expresión de los marcadores CD56 y CD16 (figura 3a-d). Cuando se analizó la distribución de las subpoblaciones de linfocitos NK en nuestros pacientes, se observó una disminución en el porcentaje de linfocitos NK CD56 dim CD16 bright (menor de 90%) en los pacientes 1-8, 10-13, 16-18 y 20 (figura 3e). Este hallazgo se correlacionó con un aumento en el porcentaje de linfocitos NK CD56 dim CD16 - en los pacientes 2-8, 10, 12, 13, 16, 18 y 20 (figura 3e). Sin embargo, estas variaciones se observaron también en 23 de los 28 controles sanos evaluados (figura 3e). No se observó una correlación entre las fluctuaciones en los porcentajes de linfocitos NK CD56 dim CD16 bright y los linfocitos NK CD56 bright CD16 -/dim (figura 3e).
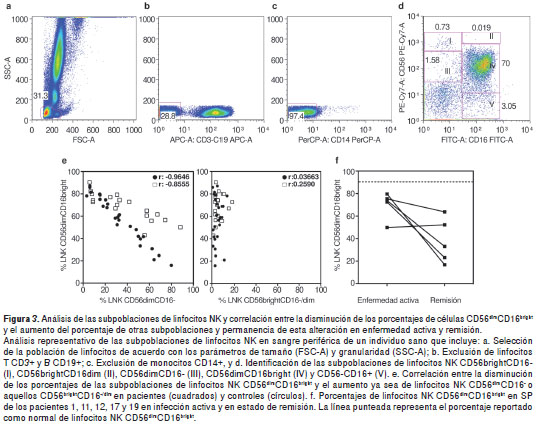
Por su parte, en los pacientes 1 y 10, la disminución en el porcentaje de los linfocitos NK CD56 dim CD16 bright se correlacionó con un aumento en el porcentaje de las células CD56 - CD16 + (no se presentan los datos). Se realizó un seguimiento de las alteraciones en la distribución de las subpoblaciones de linfocitos NK en los pacientes 1, 10, 11, 12, 17 y 19 (figura 3f). El paciente 10 fue el único en el que los valores se normalizaron tanto en número, porcentaje y distribución de las subpoblaciones de linfocitos NK en la segunda evaluación realizada tres meses después de la evaluación inicial durante un fase activa de la enfermedad, lo cual es interesante (no se presentan los datos). Estos datos demuestran que cinco de los pacientes incluidos en el presente estudio mostraban alteraciones persistentes en la distribución de las subpoblaciones de linfocitos NK en sangre periférica, principalmente por disminución en los linfocitos NK CD56 dim CD16 bright , y que dichas variaciones no se presentaban necesariamente durante la fase activa de las infecciones.
En algunos pacientes con infecciones recurrentes por HSV se alteró la respuesta citotóxica de los linfocitos NK.
Paralelamente se evaluó la capacidad de los linfocitos NK para lisar células K562 in vitro por medio de la tinción con DIOC18 (en el paciente 12) o CFSE/IP por citometría de flujo en diferentes proporciones de efector: blanco. Esta prueba, a diferencia de otras técnicas utilizadas para el estudio de la citotoxicidad, permite el análisis directo de la muerte de células blanco a nivel de una sola célula con alta sensibilidad, especialmente a bajas proporciones de efector:blanco (39,40) (figura 4a-c). La evaluación de la respuesta citotóxica de los linfocitos NK provenientes de células mononucleares de sangre periférica se realizó en los pacientes 2, 4-8, 12, 13, 17-19. No se observaron diferencias significativas en la citotoxicidad de los linfocitos NK de los pacientes con infecciones activas y de los controles sanos tanto en células no estimuladas como en aquellas estimuladas con IL-2 (figura 4d) o IL-15 (no se presentan los datos).
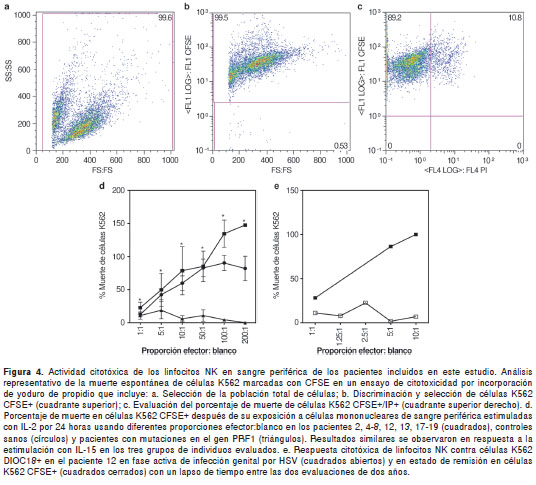
Para confirmar estos resultados se comparó la respuesta citotóxica de los linfocitos NK de estos pacientes y de los controles sanos con aquella observada en los linfocitos NK de un grupo control adicional de pacientes con mutaciones confirmadas en el gen PRF1, un defecto que suprime la función citotóxica de los linfocitos NK (41). Los resultados mostraron que la función citotóxica de los linfocitos NK de los pacientes y controles incluidos en nuestro estudio difirieron significativamente de aquella de los pacientes con defectos en PRF1 (figura 4d), confirmando la integridad de la función citotóxica en los linfocitos NK de los individuos incluidos en este estudio.
Cuando se analizaron los datos de manera individual se observaron alteraciones en la respuesta citotóxica de los linfocitos NK sólo en los pacientes 1 y 12. En el paciente 12, la citotoxicidad de los linfocitos NK sin estímulo y bajo la estimulación con IL-2 (figura 4e) o IL-15 (no se presentan los datos) estaba acentuadamente disminuida en comparación con lo observado en el control sano cuando el paciente se encontraba en fase activa de infección genital por HSV. Sin embargo, dos años después, durante la fase asintomática de la infección, evaluamos nuevamente la respuesta citotóxica en este paciente y fue normal (figura 4e). Los niveles de perforina se encontraban normales en esta paciente al igual que en los otros pacientes y controles sanos evaluados (4-9, 12, 13, 17-20). Por su parte, en el paciente 1, aunque se observó una buena respuesta citotóxica tras el estímulo con IL-2 y la exposición a las células K562, no se observó respuesta a la IL-15 en comparación con los niveles de citotoxicidad basal (sin el estímulo con citocinas) de los linfocitos NK de sangre periférica (no se presentan los datos). Este paciente se retiró del estudio por encontrarse totalmente asintomático y, por lo tanto, no fue posible repetir este análisis para confirmar el hallazgo.
Alteración transitoria en la translocación de CD107a en los linfocitos NK de un paciente con infección grave por EBV en respuesta a IL-2 o IL-15
El ensayo de translocación de la molécula CD107a fue validado en células no estimuladas y en respuesta a IL-2 (figura 5a-e) o IL-15 (no se presentan los datos) en individuos sanos y posteriormente en todos los pacientes incluidos en este estudio. Los resultados no mostraron diferencias significativas entre los valores de la media de los porcentajes de linfocitos NK CD107a+ en respuesta a la estimulación con IL-2 en los pacientes con infecciones activas y los controles sanos (figura 5f).
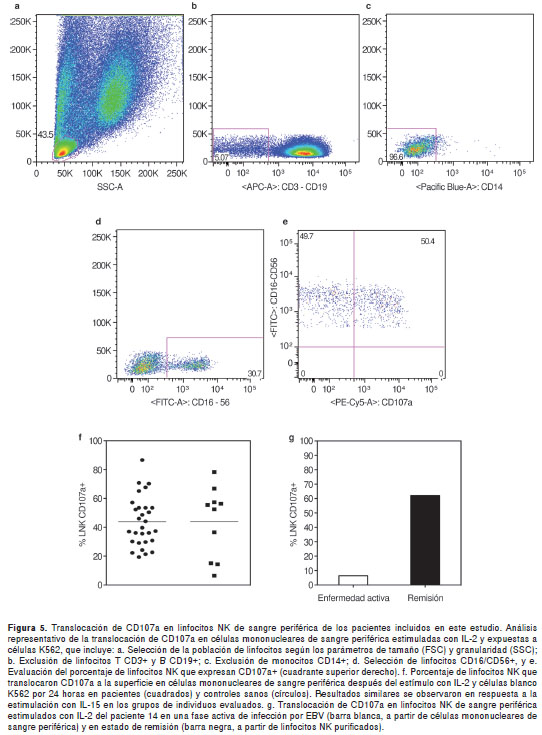
Datos similares se observaron en células sin estímulo o en respuesta a la estimulación con IL-15 en los dos grupos de individuos evaluados (no se presentan los datos). Sólo en el paciente 14 durante su enfermedad activa, se observó en células mononucleares de sangre periférica una disminución en la capacidad de los LNK para translocar CD107a a la superficie celular luego de su activación con IL-2 (figura 5g) o L-15 (no se presentaron los datos) y la exposición a células blanco K562. Sin embargo, al realizar el análisis en LNK purificados del paciente durante su período de convalecencia, tres meses después de la evaluación inicial, se obtuvieron valores comparables a lo observado en estas células en un control sano (figura 5g). De otra parte, en células mononucleares de sangre periférica de los pacientes 11, 15 y 18 se observó un incremento en la expresión de CD107a en la superficie de los linfocitos NK en comparación con el mismo dato en controles sanos (no se presentan los datos).
Discusión
El presente estudio incluyó a 20 pacientes, de los cuales 18 presentaban infecciones virales, principalmente por HSV, EBV y HPV y dos pacientes con números disminuidos de linfocitos NK y diversas infecciones de naturaleza bacteriana y viral. Once presentaron infecciones activas y remisiones durante el estudio y nueve siempre permanecieron en remisión. El hallazgo más frecuente en estos pacientes fue la alteración tanto en el número como en el porcentaje o distribución de las subpoblaciones de linfocitos NK (18 de los pacientes).
En la literatura científica se registran algunos estudios encaminados a la evaluación de los linfocitos NK en pacientes con infecciones virales recurrentes por HSV; sin embargo, no se han demostrado alteraciones cuantitativas en estas células en sangre (42,43), excepto en tres casos de niños con encefalitis herpética que presentaron una reducción importante tanto del porcentaje como del número absoluto de linfocitos NK en sangre periférica (44).
Un aspecto importante en las deficiencias exclusivas de linfocitos NK es su permanencia en el tiempo, ya que factores exógenos como el uso de fármacos, el estrés psicosocial y el ciclo menstrual en la mujer pueden afectar temporalmente el número y función de estas células en sangre periférica (36-38). En los pacientes en los que pudimos realizar varias mediciones en sangre periférica, las variaciones en el porcentaje y número absoluto de linfocitos NK fueron transitorias, como quedó demostrado con la normalización de estos valores en posteriores evaluaciones. Con frecuencia se observó disminución en la subpoblación de linfocitos NK CD56 dim CD16 bright a expensas de un aumento en los linfocitos NK CD56 dim CD16 - , incluso en gran parte de los controles sanos incluidos en el estudio.
Algunos estudios sobre la variabilidad fenotípica y funcional de los linfocitos NK en humanos han revelado la existencia de cinco subpoblaciones en sangre periférica tal como lo mostraron nuestros resultados y los de reportes previos (7,45). Se ha demostrado que luego de la activación de los linfocitos NK CD56 dim CD16 bright inducida por células blanco, se observa disminución de la expresión de CD16 mediada por metaloproteasas, adquiriendo así el fenotipo CD56 dim CD16 - (46). Es probable que el incremento en el porcentaje de linfocitos NK CD56 dim CD16 - observado en los pacientes incluidos en este estudio se deba a un estado de activación de estas células debido a las infecciones virales recurrentes o a episodios infecciosos asintomáticos (en el caso de los controles sanos).
Por otra parte, es importante resaltar el aumento en el porcentaje de linfocitos NK CD56 - CD16 + en dos de nuestros pacientes con infecciones por HSV oral y genital, respectivamente. Al respecto se ha observado que las infecciones virales crónicas tienen un impacto negativo sobre la función de los linfocitos NK, induciendo la aparición de linfocitos NK con fenotipo aberrante como las células CD56 - CD16 + . Esta subpoblación de linfocitos NK se encuentra en porcentajes muy bajos en sangre periférica de individuos sanos, pero en pacientes con infección crónica por el virus de inmunodeficiencia humana tipo 1 (VIH-1), estas células CD56 - CD16 + representan casi de 20 a 40% de todos los linfocitos NK y de 3 a 6% de todos los linfocitos, incremento que ocurre principalmente a expensas de la subpoblación de linfocitos NK CD56 dim (47). Este mismo fenotipo se ha observado en pacientes con infección crónica por virus de la hepatitis C (HCV), pero con valores de linfocitos NK CD56 - CD16 + no tan aumentados como los observados en pacientes con VIH-1 (47). Un aspecto importante de la función de los LNK CD56 - CD16 + es su baja capacidad de degranulación y citotoxicidad celular dependiente de anticuerpos, así como la producción de bajos niveles de citocinas, pero niveles elevados de quimiocinas (47).
Los resultados del presente estudio demuestran, entonces, que las infecciones virales recurrentes inducen alteraciones persistentes en la distribución de las subpoblaciones de los linfocitos NK. Sin embargo, es necesario ampliar los estudios en estos pacientes para determinar el papel de dichas células en la homeostasis del sistema inmune y en el control de la infección y correlacionar estas alteraciones con el estado clínico del paciente.
En uno de nuestros pacientes observamos una disminución acentuada de la citotoxicidad de los linfocitos NK contra células blanco, aunque con números normales de linfocitos NK en sangre periférica. Este hallazgo se produjo durante una fase activa de infección por HSV; sin embargo, la respuesta citotóxica de los linfocitos NK del paciente se recuperó durante la remisión.
En este contexto, pocos estudios han demostrado que pacientes con infecciones graves por HSV, sin ningún otro defecto inmunológico, presenten niveles significativamente disminuidos de actividad citotóxica en los linfocitos NK (48,49). Sin embargo, un reporte reciente en 23 pacientes con historia de infección oral recurrente por HSV y 24 muestras de tres diferentes controles sanos mostró una gran variabilidad en la respuesta citotóxica de las células NK frente a células blanco K562 en pacientes y controles. Solamente dos pacientes presentaron una respuesta citotóxica deficiente en los linfocitos NK no activados y activados con IL-2 en repetidas evaluaciones (50). En ese estudio no se esclareció si algún defecto molecular o patólogico era el responsable de la deficiente respuesta citotóxica en estos pacientes, razón por la cual es difícil de interpretar la disminución en la función citotóxica de estas células en pacientes con infecciones recurrentes por herpes debido a que tales infecciones podrían afectar de manera transitoria la función de los linfocitos NK (49).
Otros resultados del presente estudio también demostraron que en uno de los pacientes la translocación de CD107a a la superficie celular de los linfocitos NK a partir de células mononucleares de sangre periférica después del estímulo con citocinas y la exposición a células blanco estaba acentuadamente disminuida en comparación con los valores obtenidos en un control sano en fase activa de infección grave por EBV. Posteriormente, la translocación de CD107a en superficie de los linfocitos NK purificados se evaluó durante la fase de remisión del paciente, encontrándose niveles de expresión comparables a los del control sano.
Un estudio previo demostró que las infecciones virales, especialmente por EBV, pueden alterar la expresión de moléculas citotóxicas y aquellas implicadas en la fusión de los gránulos citolíticos. Estas alteraciones en la respuesta citotóxica de los linfocitos NK inducidas por virus podrían dar como resultado el desarrollo de linfohistiocitosis hemofagocítica secundaria (51). Asimismo, se ha reportado que los pacientes con infección crónica por EBV presentan niveles reducidos del receptor LAIR-1, asociado a la disminución de la función citotóxica de las células NK, inclusive en células activadas con IL-2 (LAK). Dichos resultados sugieren que LAIR-1 es crítico para el desarrollo o función de las células NK, y que su expresión podría ser regulada negativamente por infecciones crónicas por virus herpes.
En general, presentamos un estudio detallado del número y función de los linfocitos NK en pacientes que cursaban con infecciones recurrentes o graves y sin un diagnóstico establecido, lo que nos permitió descartar defectos en el número y función de estas células en ellos. Nuestros resultados demuestran que existen pacientes con infecciones recurrentes o graves que presentan variaciones persistentes en la distribución de las subpoblaciones de linfocitos NK en sangre periférica. Además, se encontraron otras variaciones transitorias en los linfocitos NK que pueden estar correlacionadas con un estado de infección viral activa.
Este trabajo nos motiva a continuar con la búsqueda de estrategias para el esclarecimiento de los defectos genéticos causantes de inmuno-deficiencias primarias en Colombia.
Ninguno de los autores declara tener conflicto de intereses de tipo financiero, político o académico para la realización del presente trabajo.
Este trabajo se realizó con el apoyo económico del Departamento Administrativo de Ciencia, Tecnología e Innovación, Colciencias (Proyecto 111540820536), de la Estrategia de Sostenibilidad de la Vicerrectoría de Investigación, Universidad de Antioquia, 2009-2011 y 2011-2012 para el Grupo de Inmunodeficiencias Primarias y la Facultad Nacional de Salud Pública.
Correspondencia: Isaura Pilar Sánchez, Calle 62 N° 52-59, laboratorio 530, Sede de Investigación Universitaria, Universidad de Antioquia, Medellín, Colombia Teléfonos: (574) 219 6472 y 219 6471. isapisan@yahoo.com
1. Farag SS, Caligiuru MA. Human natural killer cell development and biology. Blood Rev. 2006;20:123-37. http://dx.doi.org/10.1016/j.blre.2005.10.001 [ Links ]
2. Orange JS, Ballas ZK. Natural killer cells in human health and disease. Clin Immunol. 2006;118:1-10. http://dx.doi.org/10.1016/j.clim.2005.10.011 [ Links ]
3. Moretta L, Bottino C, Pende D, Mingari MC, Biassoni R, Moretta A. Human natural killer cells: Their origin, receptors and function. Eur J Immunol. 2002;32:1205-11. [ Links ]
4. Cooper MA, Fehniger TA, Turner SC, Chen KS, Ghaheri BA, Ghayur T, et al. Human natural killer cells: A unique innate immunoregulatory role for the CD56 (bright) subset. Blood. 2001;97:3146-51. [ Links ]
5. Cooper MA, Fehniger TA, Caligiuri MA. The biology of human natural killer-cell subsets. Trends Immunol. 2001; 22 :633 -40. http://dx.doi.org/10.1016/S1471-4906(01)02060-9 [ Links ]
6. R omagnani C, Juelke K, Falco M, Morandi B, D´Agostino A, Costa R, et al. CD56 bright CD16-killer Ig-like receptor- NK cells display longer telomeres and acquire features of CD56dim NK cells upon activation. J Immunol. 2007;178:4947-55. [ Links ]
7. Poli A, Michel T, Thérésine M, Andrès E, Hentges F, Zimmer J. CD56 bright natural killer (NK) cells: An important NK cell subset. Immunology. 2009;126:458-65. http://dx.doi.org/10.1111/j.1365-2567.2008.03027.x [ Links ]
8. Orange JS. Human natural killer cell deficiencies and susceptibility to infection. Microbes Infect. 2002;4:1545-58. http://dx.doi.org/10.1016/S1286-4579(02)00038-2 [ Links ]
9. Orange JS. Human natural killer cell deficiencies. Curr Opin Allergy Clin Immunol. 2006;6:399-409. [ Links ]
10. Eidenschenk C, Dunne J, Jouanguy E, Fourlinnie C, Gineau L, Bacq D, et al. A novel primary immunodeficiency with specific natural-killer cell deficiency maps to the centromeric region of chromosome 8. Am J Hum Genet. 2006;78:721-27. http://dx.doi.org/10.1086/503269 [ Links ]
11. Biron CA, Byron KS, Sullivan JL. Severe herpes virus infections in an adolescent without natural killer cells. N Engl J Med. 1989;320:1731-5. http://dx.doi.org/10.1056/NEJM198906293202605 [ Links ]
12. Bernard F, Picard C, Cormier-Daire V, Eidenschenk C, Pinto G, Bustamante JC, et al. A novel developmental and immunodeficiency syndrome associated with intrauterine growth retardation and a lack of natural killer cells. Pediatrics. 2004;113:136-41. [ Links ]
13. Etzioni A, Eidenschenk C, Katz R, Beck R, Casanova JL, Pollack S. Fatal varicella associated with selective natural killer cell deficiency. J Pediatr. 2005;146:423-5. http://dx.doi.org/10.1016/j.jpeds.2004.11.022 [ Links ]
14. Ballas ZK, Turner JM, Turner DA, Goetzman EA, Kemp JD. A patient with simultaneous absence of "classical" natural killer cells (CD3–, CD16+, and NKH1+) and expansion of CD3+, CD4–, CD8–, NKH1+ subset. J Allergy Clin Immunol.1990;85:453-9. http://dx.doi.org/10.1016/0091-6749(90)90155-W [ Links ]
15. de Vries E, Koene HR, Vossen JM, Gratama JW, von dem Borne AE, Waaijer JL, et al. Identification of an unusual Fcg receptor IIIa (CD16) on natural killer cells in a patient with recurrent infections. Blood.1996;88:3022-7. [ Links ]
16. Fleisher G, Starr S, Koven N, Kamiya H, Douglas SD, Henle W. A non-linked syndrome with susceptibility to severe Epstein-Barr virus infections. J Pediatr. 1982;100:727-30. [ Links ]
17. Komiyama A, Kawai H, Yabuhara A,Yanagisawa M, Miyagawa Y, Ota M, et al. Natural killer cell immunodeficiency in siblings: Defective killing in the absence of natural killer cytotoxic factor activity in natural killer and lymphokine-activated killer cytotoxicities. Pediatrics. 1990;85:323-30. [ Links ]
18. Aoukaty A, Lee I-F, Wu J, Tan R. Chronic active Epstein-Barr virus infection associated with low expression of leukocyte- associated immunoglobulin-like receptor-1 (LAIR-1) on natural killer cells. J Clin Immunol. 2003;23:141-5. http://dx.doi.org/10.1023/A:1022580929226 [ Links ]
19. Gineau L, Cognet C, Kara N, Lach FP, Dunne J, Veturi U, et al. Partial MCM4 deficiency in patients with growth retardation, adrenal insufficiency, and natural killer cell deficiency. J Clin Invest. 2012;122:821-32. http://dx.doi.org/1010.1172/JCI61014 [ Links ]
20. Hughes CR, Guasti L, Meimaridou E, Chuang CH, Schimenti JC, King PJ, et al. MCM4 mutation causes adrenal failure, short stature, and natural killer cell deficiency in humans. J Clin Invest. 2012;122:814-20. http://dx.doi.org/10.1172/JCI60224 [ Links ]
21. Wood SM, Ljunggren HG, Bryceson YT. Insights into NKcell biology from human genetics and disease associations . Cell Mol Life Sci. 2011;68:3479-93. http://dx.doi.org/10.1007/s00018-011-0799-y [ Links ]
22. Noguchi M, Yi H, Rosenblatt HM, Filipovich AH, Adelstein S, Modi WS, et al . Interleukin-2 receptor gamma chain mutation results in X-linked severe combined immunodeficiency in humans. Cell. 1993;73:147-57. http://dx.doi.org/10.1016/0092-8674(93)90167-O [ Links ]
23. de la Salle H, Hanau D, Fricker D, Urlacher A, Kelly A, Salamero J, et al. Homozygous human TAP peptide transporter mutation in HLA class I deficiency. Science. 1994;265:237-41. http://dx.doi.org/10.1126/science.7517574 [ Links ]
24. Castriconi R, Dondero A, Cantoni C, Della Chiesa M, Prato C, Nanni M, et al. Functional characterization of natural killer cells in type I leukocyte adhesion deficiency. Blood. 2007;109:4873-81. http://dx.doi.org/10.1182/blood-2006-08-038760 [ Links ]
25. Aspalter RM, Sewell WA, Dolman K, Farrant J, Webster AD. Deficiency in circulating natural killer (NK) cell subsets in common variable immunodeficiency and X-linked agammaglobulinemia. Clin Exp Immunol. 2000;121:506-14. http://dx.doi.org/10.1046/j.1365-2249.2000.01317.x [ Links ]
26. Benoit I, Wang X, Pabst HF, Dutz J, Tan R. Defective NK cell activation in X-linked lymphoproliferative disease. J Immunol. 2000;165:3549-53. [ Links ]
27. Stepp SE, Dufourcq-Lagelouse R, Le Deist F, Bhawan S, Certain S, Mathew PA, et al. Perforin gene defects in familial hemophagocytic lymphohistiocytosis. Science. 1999;286:1957-9. http://dx.doi.org/10.1126/science.286.5446.1957 [ Links ]
28. Norris PG, Limb GA, Hamblin AS, Hawk JL. Impairment of natural-killer-cell activity in xeroderma pigmentosum. N Engl J Med. 1988;319:1668-9. http://dx.doi.org/10.1056/ NEJM198812223192512 [ Links ]
29. Ueno Y, Miyawaki T, Seki H, Hara K, Sato T, Taniguchi N, et al. Impaired natural killer cell activity in Bloom´s syndrome could be restored by human recombinant IL-2 in vitro . Clin Immunol Immunopathol. 1985;35:226-33. [ Links ]
30. Froom P, Aghai E, Dobinsky JB, Quitt M, Lahat N. Reduced natural killer activity in patients with Falconi´s anemia and in family members. Leuk Res. 1987;11:197-9. [ Links ]
31. Franco JL, Orrego JC, Montoya CJ, Patiño PJ. Síndrome de infección recurrente. En: Correa JA, Gómez JF, Posada R, editores. Fundamentos de Pediatría. Tercera edición. Medellín: Editorial Corporación para Investigaciones Biológicas; 2007. [ Links ]
32. Orrego JL, Montoya CJ, Gómez RD, Franco JL, Patiño PJ, Vargas ME, et al. Epidemiological assessment of mucocutaneous infections in patients with recurrent infection syndrome. Int J Dermatol. 2005;44:724-30. http://dx.doi.org/10.1111/j.1365-4632.2004.02106.x [ Links ]
33. Marcenaro S, Gallo F, Martini S, Santoro A, Griffiths G M, Aricó M, et al. Analysis of natural killer–cell function in familial hemophagocytic lymphohistiocytosis (FHL): Defective CD107a surface expression heralds Munc13-4 defect and discriminates between genetic subtypes of the disease. Blood. 2006;108:2316-23. http://dx.doi.org/10.1182/blood-2006-04-015693 [ Links ]
34. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 2004;294:15-22. http://dx.doi.org/10.1016/j.jim.2004.08.008 [ Links ]
35. Comans-Bitter WM, de Groot R, van den Beemd R, Neijens HJ, Hop WC, Groeneveld K, et al. Immunophenotyping of blood lymphocytes in childhood. Reference values for lymphocyte subpopulations. J Pediatr. 1997;130:388-93. http://dx.doi.org/10.1016/S0022-3476(97)70200-2 [ Links ]
36. Cederbrant K, Marcusson-Stahl M, Condevaux F, Descotes J. NK-cell activity in immunotoxicity drug evaluation. Toxicology. 2003;185:241-50. http://dx.doi.org/10.1016/S0300-483X(02)00613-3 [ Links ]
37. Zorrilla EP, Luborsky L, McKay JR, Rosenthal R, Houldin A, Tax A, et al. The relationship of depression and stressors to immunological assays: a meta-analytic review. Brain Behav Immun. 2001;15:199-226. http://dx.doi.org/10.1006/brbi.2000.0597 [ Links ]
38. Northern AL, Rutter SM, Peterson CM. Cyclic changes in the concentrations of peripheral blood immune cells during the normal menstrual cycle. Proc Soc Exp Biol Med. 1994;207:81-8. [ Links ]
39. Höppner M, Luhm J, Schlenke P, Koritke P, Frohn C. A flow cytometry based cytotoxicity assay using stained effector cells in combination with native target cells . J Immunol Methods. 2002;267:157-63. http://dx.doi.org/ 10.1016/S0022-1759(02)00167-9 [ Links ]
40. Valiathan R, Lewis JE, Melillo AB, Leonard S, Ali KH, Asthana D. Evaluation of a flow cytometry based assay for natural killer cell activity in clinical settings . Scand J Immunol. 2011;75:455-62. http://dx.doi.org/10.1111/j.1365-3083.2011.02667.x [ Links ]
41. Sánchez IP, Leal-Esteban LC, Álvarez-Álvarez JA, Pérez-Romero CA, Orrego JC, Serna ML, et al. Analyses of the PRF1 gene in individuals with hemophagocytic lymphohystiocytosis reveal the common haplotype R54C/A91V in Colombian unrelated families associated with late onset disease. J Clin Immunol. 2012;32:670-80. http://dx.doi.org/10.1007/s10875-012-9680-5 [ Links ]
42. Carter C, Savic S, Cole J, Wood P. Natural killer cell receptor expression in patients with severe and recurrent Herpes simplex virus-1 (HSV-1) infections. Cell immunol. 2007; 246:65-74. http://dx.doi.org/10.1016/j.cellimm.2007.06.002 [ Links ]
43. Björkström NK, Svensson A, Malmberg KJ, Eriksson K, Ljunggren HG. Characterization of natural killer cell phenotype and function during recurrent human HSV-2 infection . PLoS One. 2011;6:e27664. http://dx.doi.org/10.1371/journal.pone.0027664 [ Links ]
44. Almerigogna F, Fassio F, Giudizi MG, Biagiotti R, Manuelli C, Chiappini E, et al. Natural killer cell deficiencies in a consecutive series of children with herpetic encephalitis. Int J Immunopathol Pharmacol. 2011 ;24:231-8. [ Links ]
45. Nagler A, Lanier L, Cwirla S, Phillips J. Comparative studies of human FcRIII-positive and negative natural killer cells. J Immunol. 1989;143:3183-91. [ Links ]
46. Grzywacz B, Kataria N, Verneris MR. CD56 (dim) CD16 (+) NK cells down regulate CD16 following target cell induced activation of matrix metalloproteinases . Leukemia. 2007; 21:356-9. [ Links ]
47. Björkström NK, Ljunggren HG, Sandberg JK. CD56 negative NK cells: Origin, function, and role in chronic viral disease. Trends Immunol. 2010 ;31:401-6 . http://dx.doi.org/10.1016/j.it.2010.08.003 [ Links ]
48. Ching C, Lopez C. Natural killing of herpes simplex virus type 1-infected target cells: Normal human responses and influence of antiviral antibody. Infect Immun. 1979;26:49-56. [ Links ]
49. Lopez C, Kirkpatrick D, Read SE, Fitzgerald PA, Pitt J, Pahwa S, et al. Correlation between low natural killing of fibroblasts infected with herpes simplex virus type 1 and susceptibility to herpesvirus infections. J Infect Dis. 1983;14:1030-5. http://dx.doi.org/10.1093/infdis/147.6.1030 [ Links ]
50 . Devlin LA, Haughton DJ, Crockard AD, Edgar JD. Natural killer cell cytotoxicity in patients with recurrent herpes infections: Diagnostic utility of a flow cytometric assay. J Clin Pathol. 2010;63:244-8. http://dx.doi.org/10.1136/jcp.2009.066753 [ Links ]
51. Janka GE. Hemophagocytic syndromes. Blood Rev. 2007 ; 21:245-53. http://dx.doi.org/10.1016/j.blre. 2007.05.001 [ Links ]













