Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.72 no.145 Medellín Jan./Apr. 2005
CONSTRUCCIÓN Y EVALUACIÓN DE UNA CELDA DE COMBUSTIBLE DE INTERCAMBIO PROTÓNICO
CONSTRUCTION AND EVALUATION OF A PROTON EXCHANGE FUEL CELL
OMAR GUTIÉRREZ
Facultad de Minas, Universidad Nacional de Colombia, Medellín
RENSON PAREJA
Facultad de Minas, Universidad Nacional de Colombia, Medellín
CARLOS MONSALVE
Facultad de Minas, Universidad Nacional de Colombia, Medellín
GONZALO TRUJILLO
Facultad de Minas, Universidad Nacional de Colombia, Medellín
BIBIAN HOYOS
Escuela de Procesos y Energía, Facultad de Minas, Universidad Nacional de Colombia, Medellín
CARLOS SÁNCHEZ
Escuela de Procesos y Energía, Facultad de Minas, Universidad Nacional de Colombia, Medellín
JAVIER GONZÁLEZ
Escuela de Procesos y Energía, Facultad de Minas, Universidad Nacional de Colombia, Medellín. jgonzalez@senamed.edu.co
Recibido para revisar 1 de Marzo de 2004, aceptado 10 de Mayo de 2004, versión final 10 de Mayo de 2004
RESUMEN: se propone un diseño de una celda de combustible de membrana de intercambio protónico (PEMFC) alimentada con hidrógeno. Los electrodos porosos de platino soportados en carbón activado fueron fabricados por los métodos de impregnación, reducción y prensado en caliente; obteniéndose electrodos con una carga de platino de 0.4 mg/cm2. Las condiciones para obtener el soporte poroso fueron: una composición de 15% de teflón y 85% de carbón, presión de 100 Kgf/cm2, temperatura de 300 ºC y 20 minutos de prensado en caliente. Dos platos de grafito conductor maquinados con canales ínter digitados fueron diseñados y fabricados para ser usados como platos distribuidores de gas. Se obtuvieron, mediante cargas variables, las curvas de polarización de la celda y se comparan con las curvas correspondientes de una celda comercial.
PALABRAS CLAVES: Celdas de Combustible, Electrolito Polimérico, Preparación de Catalizadores, Ensambles Membrana Electrodo, Curvas de Polarización.
ABSTRACT: One design of a hydrogen proton exchange membrane fuel cell (PEMFC) is proposed. Porous carbon supported platinum electrodes were manufactured by impregnation, reduction and hot-press methods; noble metal loading of 0.4 mg/cm2 was achieved. The conditions to obtain the porous support were: composition of 15 % teflon and 85 % carbon, pressure of 100 Kgf/cm2, temperature of 300 ºC and 20 minutes of hot-pressing. The pattern of gas flow distribution was made possible by machined interdigitated channels into conductor graphite plates. Several tests were run varying the load resistance to obtain the polarization curves. Comparison with a commercial PEMFC is also made.
KEYWORDS: Fuel Cell, Polymer electrolyte, Catalysts Preparation, Membrane Electrode Assemblies, Polarization Curves.
1. INTRODUCCIÓN
La búsqueda de fuentes de energía ambientalmente amigables y competentes en rentabilidad respecto a las fuentes energéticas convencionales, continúa creciendo y es evidente que la generación futura de energía será algo diferente a la del presente.
Muchas de las industrias de hoy, incluyendo fabricantes de automotores, están invirtiendo recursos considerables en encontrar e implementar nuevas tecnologías para sustituir los métodos de producción tradicionales y permanecer competitivas en los mercados futuros. Una de estas tecnologías de innovación son las celdas de combustible (CC), que aunque han estado entre nosotros desde hace muchos años, sólo recientemente los avances tecnológicos las han hecho competitivas con los métodos de producción tradicionales de energía (Eaton, 2001).
Las celdas de combustible son dispositivos que transforman energía química (de un combustible y un oxidante) de manera directa en energía eléctrica (siendo por tanto más eficientes), empleando, de acuerdo al tipo de celda, combustibles sólidos, líquidos o gaseosos.
Entre las celdas que operan con combustibles gaseosos, están las celdas de hidrógeno / oxigeno, que son las más estudiadas, y que tienen la ventaja de una reacción de oxidación de hidrógeno con una cinética convenientemente rápida (en medio ácido usando platino como catalizador (Bruce, 1999).
Una de las aplicaciones más importantes de las CC es la de implementarlas en ciclos de potencia combinados tales como: Central Eléctrica – Gasificación de Carbón – Celda de Combustible o Planta de Gasificación de Carbón – Celda de Combustible. De este ciclo se aprovechan los gases generados en la gasificación, que mediante un proceso de reformado se transforman en una mezcla rica en hidrógeno, que irá como combustible a la celda, aprovechándose su contenido exergético (que de otro modo se desperdiciaría); de esta forma se optimiza la eficiencia global del proceso (Lobachyov, 1995). Sin embargo, en los ciclos antes citados se presentan limitaciones técnicas con las celdas, puesto que la mezcla gaseosa contiene (además de hidrógeno), metano, nitrógeno, dióxido de carbono y monóxido de carbono. Este último compuesto se adsorbe fuertemente sobre el platino, ocasionando una reducción en los sitios activos libres para la reacción del hidrógeno, disminuyendo la cantidad de corriente que la celda puede entregar.
En busca de soluciones al problema de envenenamiento en la celda, se han explorado aleaciones del platino con renio, estaño, rutenio, iridio y osmio (Gotz, 1998), en las que los metales que acompañan al platino se encargan ya sea, de evitar que el CO se adsorba, o de oxidar el CO adsorbido a CO2, de modo que, en este último caso, aparte de evitar el envenenamiento de la celda, las aleaciones utilizan el CO como un combustible adicional que aportará un aumento en la corriente que entrega la celda (Denis y otros, 1999; Gasteiger y otros, 1995; Giorgi, 2001; Hubert, 1995; Arico,1997).
En este trabajo se presenta el diseño, construcción y caracterización de una celda de combustible de intercambio protónico que es apta para ser alimentada con los combustibles hidrógeno / oxígeno e hidrógeno / aire.
Se presenta aquí el diseño de los platos distribuidores de los gases que entran a la celda y se pretende encontrar una formulación para elaborar los electrodos porosos de platino soportados en carbón. Este soporte es una mezcla de carbón y teflón que se elabora por el método de prensado en caliente.
El objetivo es encontrar las condiciones de presión, temperatura y tiempo de prensado que mejores resultados presenten en cuanto a porosidad y resistencia mecánica del soporte. Con estas variables definidas, se pasa a la fabricación de los electrodos y una vez ensamblada la celda, se somete a una serie de pruebas de carga (resistencias) para obtener las curvas de polarización, y con base en éstas, se caracteriza el desempeño de la celda. Adicionalmente, la celda diseñada y construida en este trabajo se compara con una celda de combustible comercial.
2. PROCEDIMIENTO DE CONSTRUCCIÓN
La PEMFC diseñada y desarrollada en este trabajo está constituida fundamentalmente por las siguientes partes: electrodos porosos (ánodo y cátodo), electrolito polimérico (membrana de Nafion), platos distribuidores de gases (de grafito conductor) y placas de cobre colectoras de electricidad (Figura 1 y tabla 1).
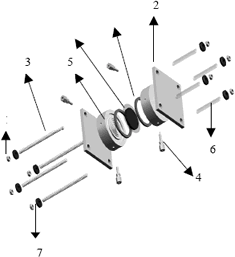
Figura 1. Partes de la celda de combustible construida
Figure 1. Parts of manufactured fuel cell
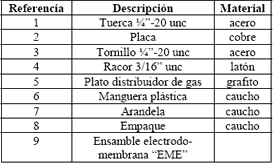
Tabla 1. Partes de la celda de combustible construida
Table 1. Parts of manufactured fuel cell
En la Figura 1 aparecen los electrodos y la membrana como un solo objeto, este es el ensamble electrodo-membrana-electrodo (EME), el cual va en medio de los platos distribuidores. Todo el conjunto anterior (es decir, EME, empaques y platos distribuidores) va en medio de las dos placas de cobre, las cuales se unen a través de tornillos debidamente aislados eléctricamente que permiten el ajuste de la celda.
Se describe a continuación el procedimiento de elaboración de los electrodos y el tratamiento previo que debe dársele a la membrana de intercambio para obtener finalmente el arreglo electrodo - membrana -electrodo (EME). Después se presenta el diseño de los platos distribuidores y su posterior ensamble con el EME y con las placas de cobre colectoras de electricidad.
2.1 PREPARACIÓN DE LOS ELECTRODOS POROSOSPor razones económicas los electrodos no se fabrican de catalizador puro. En vez de esto, se acostumbra elaborar soportes de carbón, dispersando sobre estos el catalizador (Arico y otros, 1994; Essalik y otros, 1994)
El carbón usado como soporte se caracteriza por tener una alta conductividad eléctrica y un reducido tamaño de partícula (material particulado o fino) dotando al electrodo de una gran área superficial (por su macro y microporosidad), muy propicia para la reacción heterogénea que allí tendrá lugar. Además, el efecto combinado de la macro y microporosidad permite una mejor distribución y alcance de los combustibles en los sitios de reacción. El procedimiento de preparación de cada electrodo se describe a continuación:
- Etapa de Impregnación. Una masa de 1.16 g de carbón Vulcan XC72R se suspende en 25 ml de agua destilada en un baño de ultrasonido a 80ºC, luego se adicionan lentamente 50 ml de solución 5*10-3 M de ácido cloroplatínico (H2PtCl6.6H2O), manteniendo la agitación y la temperatura constantes. La mezcla resultante se mantiene en ultrasonido por una hora, con el objetivo de lograr una completa impregnación del ácido cloroplatínico con el carbón.
- Etapa de reducción y filtrado. Con la etapa de impregnación se consiguen poner en contacto el platino con el carbón, sin embargo este permanece aún en forma iónica y es necesario reducirlo a su forma metálica y unirlo químicamente al carbón para activar su capacidad catalítica.
Existen muchos agentes reductores según el tipo de catalizador, para el platino se recomienda usar formiato de sodio 0.5 M (Gotz, 1998; Essalik y otros, 1994) adicionando gota a gota 1.5 veces la cantidad estequiométrica para garantizar la total reducción del platino presente. Una vez adicionado el formiato de sodio, la mezcla se mantiene por una hora más en el ultrasonido a 80ºC.
Luego de la etapa de reducción, la masa resultante es filtrada y enjuagada con abundante agua destilada caliente para remover residuos e impurezas; la mezcla o pasta retenida en el papel filtro es retirada y llevada a un recipiente que se pone sobre una estufa de calentamiento.
- Etapa de secado y prensado. Durante el proceso de secado y estando la mezcla aun relativamente húmeda, se le adicionan, por cada gramo de mezcla de electrodo a preparar, 0.14 g de Teflón (que actúa como agente ligante o aglomerante), 0.15 g de Nafion (también es ligante y facilita el transporte de los cationes desde el electrodo hasta la membrana de intercambio) y se recomienda adicionar una gota de tritón (agente que homogeniza la dispersión de los demás componentes y modifica las propiedades superficiales de la pasta).
En este punto del proceso se tiene una mezcla pastosa con los siguientes componentes: Pt metálico soportado en carbón, telón, nafion, tritón y agua. El siguiente paso, consiste en evaporar la humedad presente en la pasta.
Luego de evaporar totalmente el agua presente, se toma 1 gramo de la mezcla y se lleva a una prensa.
El prensado se realiza en caliente (Arico y otros, 1994; Pyle y otros, 1993), controlando la temperatura con una resistencia que rodea la prensa.
El método de prensado en caliente (hot-press) tiene como finalidad obtener un electrodo compacto y resistente mecánicamente, además para el caso particular de este trabajo se espera obtener un electrodo con una carga de platino de 0.4 mg/cm2.
Las condiciones de prensado en caliente implementadas en este trabajo fueron el producto de una búsqueda experimental, probando diferentes valores de la relación carbón/teflón (respecto a la masa total del electrodo), y variando la presión, temperatura y tiempo de prensado; buscando encontrar un equilibrio entre resistencia mecánica y porosidad para el soporte.
La relación carbón/teflón tiene una fuerte incidencia en la preparación de los soportes puesto que una baja cantidad de teflón no le confiere al electrodo solidez en su estructura, y una cantidad excesiva de teflón, puede, debido a su naturaleza polimérica, taponar u obstruir los poros del electrodo impidiendo el transporte de los gases e iones a través de la matriz estructural del electrodo. Adicionalmente, durante el calentamiento del prensado, el teflón se puede dilatar, acumulando tensiones que al momento de desmontar la prensa buscan liberarse destruyendo el electrodo.
En la Tabla 2 se presentan las diferentes pruebas que se realizaron para encontrar la relación carbón/teflón y las condiciones de prensado en caliente para elaborar un soporte de contextura aceptable (resistente mecánicamente y con superficie homogénea y sin fisuras). Como punto de partida, se usó la relación 85%carbón - 15%teflón recomendada en la literatura (Paganin, 1996; Essalik, 1994).
Tabla 2. Pruebas para el proceso de fabricación del soporte poroso.
Table 2. Test to obtain porous support
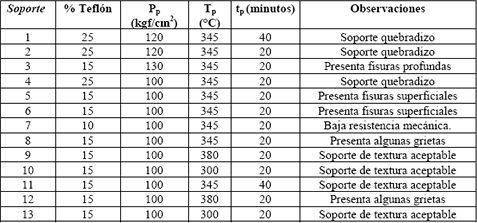
De los trece soportes construidos, se descartaron aquellos que resultaron quebradizos, y los restantes se sometieron a una inspección con el microscopio. De esta revisión se eligieron los electrodos de las pruebas 9, 10, 11 y 13 los cuales presentaron mayor homogeneidad superficial. A estos cuatro soportes se les determinó la porosidad por el método de humidificación en vacío. Los resultados se presentan en la Tabla 3.
Tabla 3. Porosidad de los soportes seleccionados
Table 3. Porosity of selectioned supports

Con base en éstas pruebas se concluye que las condiciones para llevar a cabo el prensado son las asociadas al soporte 10: se mantuvo (mediante la resistencia eléctrica) la temperatura en 300°C durante 20 minutos, manteniendo la presión de prensado en 100 Kgf/cm2. Transcurridos los veinte minutos se retiró la resistencia, y cuando la prensa alcanzó la temperatura ambiente, esta se desmontó obteniéndose un electrodo con una carga de platino de 0.4 mg/cm2, un diámetro de 4cm y un espesor de 1.5 mm aproximadamente.
2.2 TRATAMIENTO DE LA MEMBRANA DE INTERCAMBIO PROTÓNICO
Es necesario, antes de ensamblar la celda, pretratar la membrana de nafion para lograr que esta tenga un óptimo desempeño como conductora de iones H+. Este tratamiento busca purificar la membrana (removiendo los contaminantes superficiales) y enriquecerla con iones H+.
La membrana se cortó en forma circular con un diámetro de 5 cm, de forma que en el EME sobresalga con un margen de 0.5 cm radialmente.
La membrana se trató sumergiéndola en seis diferentes medios, cada uno de los cuales se mantuvo a 80 ºC. La membrana permaneció por una hora en cada recipiente. La secuencia de medios de tratamiento utilizada fue:
- a) 100 ml de agua destilada: hidrata la membrana y disuelve contaminantes superficiales.
b) 100 ml de solución de peróxido de hidrógeno al 3%: remueve contaminantes orgánicos presentes en la superficie de la PEM.
c) 100 ml de ácido sulfúrico 0.1 M: remueve los contaminantes metálicos presentes en forma iónica y sulfata la superficie de la PEM.
d) 100 ml de agua destilada: enjuaga y remueve el ácido sulfúrico de la superficie de la membrana a la vez que la hidrata.
e) y f) 100 ml de agua destilada: se repite el enjuague e hidrata.
2.3. ENSAMBLE MEMBRANA-ELECTRODOS
El arreglo ánodo-membrana-cátodo se obtuvo mediante prensado en caliente adoptando las siguientes condiciones de prensado (Pyle, 1993; Squadrito, 2001):
Los electrodos y la membrana fueron impregnados con solución de nafion, para facilitar su adherencia, y posteriormente alineados en una configuración tipo emparedado. Posteriormente el EME fue calentado a 90ºC durante una hora, luego se aumentó la temperatura hasta 130ºC (temperatura de transición vítrea de la membrana) por media hora más. Con el EME a 130°C, se le aplicó una presión de 20 Kgf/cm2 durante tres minutos, al cabo de los cuales se retiró el calentamiento hasta alcanzar la temperatura ambiente, momento en el cual se retiró el EME de la prensa.
2.4 DISEÑO DE LOS PLATOS DISTRIBUIDORES DE GASES
Los platos distribuidores diseñados y construidos para este trabajo constan de una serie de canales circulares maquinados de forma concéntrica sobre un delgado bloque de grafito (Figura 2). Este diseño tiene como propósito fundamental lograr el mayor contacto de los combustibles con los electrodos, con el objeto de darle tiempo a los procesos de transporte y reacción de los gases hacia y en los sitios catalíticos.

Figura 2. Platos distribuidores de gas.
Figure 2. Gas distributes plates
Adicionalmente cada plato va acompañado de un empaque que se ajusta en el canal más externo y ancho, el cual contribuye a ajustar la membrana que sobresale del EME, evitando el escape de gases y el cruce de estos de un electrodo a otro.
Con el EME y los platos distribuidores elaborados, se hizo el acople final de todas las piezas ajustando las placas de cobre con tornillos aislados eléctricamente.
La celda ensamblada fue sometida, antes de ponerse en funcionamiento, a pruebas de escape de gases sumergiéndola en una cubeta de agua.
3. EVALUACIÓN DE LA CELDA
La evaluación de la PEMFC se llevó a cabo mediante la obtención de curvas de polarización y curvas de eficiencia, tomando valores de corriente contra potencial para un intervalo de cargas resistivas entre 20000 y 20 ohmios.
Inmediatamente después de ajustar la celda para que no presente fugas y antes de poner en funcionamiento continuo a la celda construida, se realizó una prueba preliminar que arrojó los resultados mostrados en la tabla 4.
Tabla 4. Prueba Preliminar
Table 4. Preliminar test
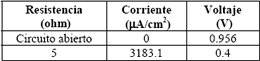
El valor de potencial de circuito abierto que se obtuvo de la prueba preliminar es un resultado satisfactorio ya que en la literatura se reportan valores de potencial de circuito abierto entre 0.9 y 1.0 V para celdas tipo PEM con dispersión catalítica de 0.4 mgPt/cm2 (Olender y otros, 1982). Además es un valor muy cercano al potencial estándar de la celda de hidrógeno/oxígeno que es de 1.23 V.
En las figuras 3 y 4 se presentan las curvas de polarización obtenidas para la celda construida en este trabajo y para una celda comercial (DAYS). En estas Figuras los puntos corresponden a los datos experimentales y las líneas continuas al ajuste de dichos puntos usando el modelo semi-empírico propuesto por Srinivisan (Paganin y otros, 1996):
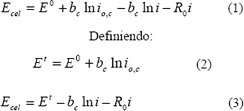
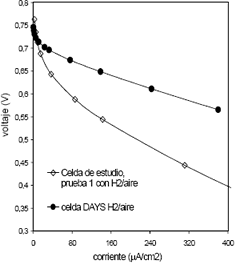
Figura 3. Curvas de polarización: celda Comercial con hidrógeno (3 psi)/aire atmosférico a 25ºC; Celda de estudio con hidrógeno (3 psi)/aire (3.5 psi) a 25ºC.
Figure 3. Polarization curves: commercial cell with hydrogen (3 psi)/air to 25ºC; Studied Cell with hydrogen (3 psi)/air (3.5 psi) to 25ºC.
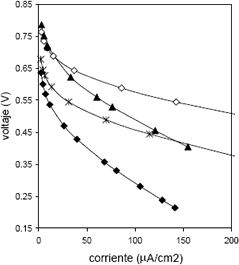
Figura 4. Curvas de polarización para la celda construida: Prueba 1 con H2 (3 psi)/Aire (3.5 psi); Prueba 2 con H2 (3 psi)/Aire (3.5 psi), 30 horas de operación; Prueba 3 con H2 (3 psi)/Aire (3.5 psi), 40 horas de operación; Prueba 4 con H2 (3 psi)/O2 (3.5 psi), 40 horas de operación.
Figure 4. Polarization curves to manufactured cell: Test 1 with H2 (3 psi)/Air (3.5 psi); Test 2 with H2 (3 psi)/Air (3.5 psi), 30 hours of operation; Test 3 with H2 (3 psi)/Air (3.5 psi), 40 hours of operation; Test 4 with H2 (3 psi)/O2 (3.5 psi), 40 hours of operation.
Con Ecel el voltaje de la celda en operación; E0 el potencial estándar para la celda de hidrógeno / oxígeno; bc la pendiente de Tafel para la reacción de reducción de oxígeno; i la densidad de corriente de la celda en operación; i0,c la densidad de corriente de intercambio catódica y el término R0 representa la resistencia total asociada a todos los componentes y accesorios físicos (incluyendo el electrolito) que constituyen la celda.
En la ecuación 1 se supone que la resistencia del electrolito es independiente de la densidad de corriente y que en la celda no se presentan sobre-potenciales de concentración. Se considera además que el potencial de operación es función de los sobre-potenciales ohmico y de activación catódico ya que la alta cinética de la reacción de oxidación de hidrógeno sobre platino hace despreciable la contribución anódica al sobre-potencial
La celda construida en este trabajo y la celda DAYS presentaron un potencial de circuito abierto en operación (Figura 3) de 0.763 y 0.756 V, respectivamente. La celda comercial, aunque presenta un menor valor de potencial de circuito abierto, mantiene un voltaje mayor para mayores densidades de corriente.
Las pruebas posteriores con la celda de estudio (Figura 4) revelan una degradación del EME, que se manifiesta en la disminución del potencial de circuito abierto, debida al uso continuado de la celda. Después de 40 horas de operación la celda presentó un mejor desempeño al ser alimentada con oxígeno en el compartimiento catódico.
Los parámetros del modelo de Srinivisan obtenidos para las dos celdas se muestran en la tabla 5. Allí se puede notar que el mayor valor de Et, corresponde a la prueba con hidrógeno/oxígeno de la celda construida. Esto se justifica por el hecho de que el valor del parámetro Et esta determinado por los valores de la fuerza electromotriz de la celda E0 y por i0,c, que son proporcionales a la concentración de los reactivos (Squadrito y otros, 2001).
Tabla 5. Parámetros para el modelo Srinivasan de las pruebas realizadas a la celda construida y a la celda DAYS
Table 5. Parameters to obtain Srinivasan model of test with manufactured cell and DAYS cell
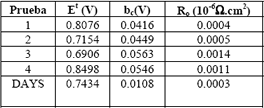
En la tabla 5 se puede observar que las pruebas 2 y 3, con hidrógeno / aire, y la prueba 4 (con hidrógeno / oxígeno) de la celda construida, presentan mayores valores de bc que la prueba 1, lo que indica que el potencial de operación de la celda disminuye con mayor rapidez a medida que aumenta el tiempo de uso.
En la Figura 5 se presenta las curvas de eficiencia obtenidas para la celda construida y la celda comercial. Los valores de eficiencia se calcularon siguiendo el método propuesto por Carretle y otros (2001), que tiene en cuenta la contribución de factores tales como: la cantidad de corriente entregada por la celda con respecto a la teórica esperada, la relación entre los voltajes reales de operación y el potencial estándar, los aspectos relacionados con el combustible (la no utilización completa del mismo) y las pérdidas debidas al calor intercambiado con el ambiente.
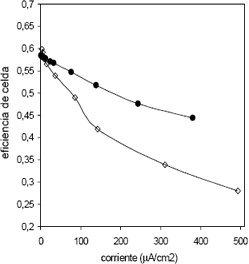
Figura 5. Curvas de eficiencia: celda Comercial con hidrógeno (3 psi)/aire atmosférico a 25ºC; Celda de estudio, prueba 1 con H2 (3 psi)/Aire (3.5 psi).
Figure 5. Eficience curves: Commercial cell with hydrogen (3 psi)/air to 25ºC; Studied cell, test 1 with H2 (3 psi)/Air (3.5 psi).
Como se puede notar de la Figura 5, la eficiencia de las celdas va disminuyendo a medida en que se incrementa la densidad de corriente de operación de ambas celdas. Sin embargo, la eficiencia de la celda construida decae con mayor rapidez que la eficiencia de la celda DAYS, esto a la luz de la ecuación 1 permite concluir que los sobrepotenciales de activación y ohmico de la celda construida son mayores.
4. CONCLUSIONES
Con base en las pruebas que se realizaron para construir el soporte del electrodo, se concluye que el soporte con mejores características de consistencia mecánica, porosidad y homogeneidad superficial se obtiene del proceso de prensado en caliente a una presión de 100 Kgf/cm2, una temperatura de 300 ºC, manteniendo las anteriores condiciones de presión y temperatura durante 20 minutos, y preparando la mezcla del soporte en la relación 85 % carbón - 15% teflón.
La metodología de elaboración de los electrodos porosos propuesta en este trabajo tiene las siguientes ventajas:
- Permite construir celdas de combustible de hidrógeno con valores de densidades de corriente de intercambio comparables con las entregadas por una celda comercial, lo que significa que en este aspecto la celda desarrollada en este trabajo es competitiva con las celdas del mercado tecnológico.
- La morfología porosa de los electrodos aumenta la probabilidad de reacción de los gases combustibles elevando la tasa de utilización de los mismos.
De los valores del parámetro Et , se deduce que en las pruebas realizadas con hidrógeno/aire, la prueba 1 presentó las mayores densidades de corriente de intercambio catódica respecto a las otras pruebas, superando incluso a la celda comercial DAYS, debido a la poca degradación del EME en esta prueba.
Después de 40 horas de funcionamiento, la prueba realizada con hidrógeno/oxígeno presentó el mayor valor de densidad de corriente de intercambio catódica y sostuvo el potencial en valores mayores que en las pruebas con hidrógeno/aire, esto se debe a que la densidad de corriente de intercambio y el sobrepotencial de activación catódico, son función de la concentración de oxígeno. Del análisis de desempeño de la celda se puede concluir que el tiempo de operación del EME tiene un efecto desfavorable sobre el desempeño de la celda construida.
La celda DAYS presentó el menor valor de resistencia interna, 0.0003 (mW.cm2), para un EME con un espesor entre 15-50 mm; la celda construida aquí, presentó en la prueba 1 una resistencia interna de 0.0004 (mW.cm2) para un espesor del ensamble EME de 3 mm, esto permite afirmar que los materiales usados para ensamblar la celda construida son competitivos con los comerciales. Los sobrepotenciales asociados a la celda construida son más sensibles a los cambios en la densidad de corriente generada, esto puede validarse por la caída rápida de potencial de dicha celda comparada con el potencial de operación de la celda comercial para iguales cambios en la densidad de corriente. Lo cual esta corroborado por los valores obtenidos del parámetro bc .
La celda desarrollada en este trabajo presentó eficiencias de celda entre el 30 y el 60%, y la celda comercial operó entre el 44 y el 60% de eficiencia.
AGRADECIMIENTOS
Este trabajo se pudo llevar a cabo gracias a la financiación de SENA-COLCIENCIAS (código del proyecto: 1118-06-12474) y de la Universidad Nacional de Colombia – sede Medellín.
LISTA DE SÍMBOLOS
Pp Presión de prensado
Tp Temperatura de prensado del electrodo
tp Tiempo de prensado
Ecel Potencial de celda
E0 Potencial estándar de celda
bc Pendiente de Tafel para la reacción catódica.
io,c Densidad de corriente de intercambio.
i Densidad de corriente neta
R0 Suma de las resistencias
Et Parámetro de la ecuación 3
LISTA DE ABREVIATURAS
CC: Celda de combustible.
EME: Ensamble de electrodo-membrana-electrodo.
PEMFC: Celda de combustible de membrana de intercambio protónico ( proton exchange membrane fuel cell).
RHE: Electrodo reversible de hidrógeno (reversible hydrogen electrode ).
REFERENCIAS
[1] Arico A., et. al. Methanol oxidation on carbon-supported platinum-tin, electrodes in sulfuric acid, Journal of Power Sources, Vol. 50, 296-301, 1994. [ Links ]
[2] Arico, A., et. al. Carbon monoxide electrooxidation on porous Pt/Ru electrodes in sulphuric acid, J. Appl. Electrochem, Vol. 27, No. 11, 1277-1278, 1997. [ Links ]
[3] Bruce, L. Conceptual design and modeling of a fuel cell scooter for urban ASIA, Princeton University U.S, School of Engineering and Applied Sciences, November 1999, 85-90, en línea http://www.splinglass.net [citado 17 de abril de 2002]. [ Links ]
[4] Carretle, B., et al. Fuel Cells Fundamentals and Applications, FUEL CELLS 2001, No. 1, 5-8, 2001. [ Links ]
[5] Denis, M., et. al. High energy ball-milled Pt and Pt-Ru catalyst for polymer electrolyte fuel cells and their tolerance to CO, J. Appl. Electrochem., Vol. 29, No. 8, 951-960, 1999. [ Links ]
[6] Eaton, B. One Dimensional, Transient Model of Heat, Mass, and Charge Transfer In a Proton Exchange Membrane, Virginia U.S, May 9/2001, 8-12, en línea http://scholar.lib.vt.edu/these/available, [citado: 15 de abril de 2002]. [ Links ]
[7] Essalik A,. et. al. Quantitative determination of dispersed platinum in carbon by cyclic voltametry, J. Appl. Electrochem, 404-410, August 1994. [ Links ]
[8] Gasteiger, H., et. Al. H2 and CO Electrooxidation on Well-Characterized Pt, Ru, and Pt-Ru 1. Rotating Disk Electrode Studies of the Pure Gases Including Temperature Effects, J. Phys. Chem, 99, 8290– 8301, 1995. [ Links ]
[9] Giorgi, L. H2 and H2/CO oxidation mechanism on Pt/C, Ru/C and Pt-Ru/C electrcatalysts, J. Appl. Electrochem., Vol. 31, No. 2, 325 – 334, 2001. [ Links ]
[10] Gotz, M. and Wendt, H. Binary and ternary anode catalyst formulations including the elements W, Sn and Mo for PEMFCs operated on methanol or reformate gas, Electrochimica Acta, Vol. 43, No. 24, 3637-3644, 1998. [ Links ]
[11] Hubert, A., et. al. H2 and CO Electrooxidation on Well-Characterized Pt, Ru, and Pt-Ru. 2. Rotating Disk Electrode Studies of CO/H2 Mixtures at 62º C, J. Phys. Chem, 99, 16764-16780, 1995. [ Links ]
[12] Jung, S. and Nguyen T. Multicomponent transport in Porous Electrodes of Proton Exchange Membrane Fuel Cells Using the Interdigitated Gas Distributors,J Electrochem. Soc, Vol. 146, No. 1, 38-45, 1999. [ Links ]
[13] Lobachyov, K., Richter, H. Combined Cycle Gas Turbine Power Plant with Coal Gasification and Solid Oxide Fuel Cell, ASME, Vol. 35, 231-240, 1995. [ Links ]
[14] Olender, H. and Breen, Mc. Design of a cell for electrode kinetic investigations of cell reaction, J. Electrochem. Soc, Vol.29, No. 1, 135-136, January 1982. [ Links ]
[15] Paganin V., et. Al. Development and Electrochemical studies of gas diffusion electrodes for polymer electrolyte fuel cells, J. Appl. Electrochem, Vol. 26, No. 3, 298-303,1996. [ Links ]
[16] Pyle W,. et. al. Making Electricity with Hydrogen, Home Power, No. 35, July 1993, 44-48, http://www.Homepower.com (citado octubre 17 de 2001). [ Links ]
[17] Squadrito, G., et. al. Effects of the Diffusion Layer Characteristics on the Performance of Polymer Electrolyte Fuel Cell Electrodes, J. Appl. Electrochem, Vol. 31, No 4, 449 – 450, 2001. [ Links ]














