Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.73 no.150 Medellín Nov. 2006
PRODUCCIÓN DE ETANOL A PARTIR DE LA CÁSCARA DE BANANO Y DE ALMIDÓN DE YUCA
ETHANOL PRODUCCTION OF BANANA SHELL AND CASSAVA STARCH
JOHN F. MONSALVE G.
Grupo de bioprocesos-Grupo de Combustibles alternativos, Universidad Nacional de Colombia-Sede Medellín
VICTORIA ISABEL MEDINA DE PEREZ
Grupo de bioprocesos-Grupo de Combustibles alternativos, Universidad Nacional de Colombia-Sede Medellín
ANGELA ADRIANA RUIZ COLORADO
Grupo de bioprocesos-Grupo de Combustibles alternativos, Universidad Nacional de Colombia-Sede Medellín, aaruiz@unalmed.edu.co
Recibido para revisar 4 de Noviembre de 2005, aceptado 13 de Marzo de 2006, versión final 12 de Mayo de 2006
RESUMEN: En este trabajo se evaluó la hidrólisis ácida del almidón presente en yuca y de la celulosa presente en cáscara de banano y su posterior fermentación a etanol, se ajustaron los medios de fermentación para los microorganismos Saccharomyces cerevisiae NRRL Y-2034 y Zymomonas mobilis CP4. Se caracterizó la cáscara de banano, la cual posee un contenido de almidón, celulosa y hemicelulosa que representan más del 80 % de la cáscara ameritando el estudio de ésta como fuente de carbono. La hidrólisis ácida de cascara de banano produce 20 g/l de azúcares reductores. Para la Yuca con 170 g/l de almidón a; pH 0.8 en 5 horas se logra conversión completa a azúcares reductores y no se nota ningún efecto inhibitorio por parte de los cultivos realizados con cáscara de banano y yuca por la presencia de cianuro en la yuca y por la formación de compuestos tóxicos al hidrolizar la celulosa en banano. Para la fermentación realizada con Sacharomyces cerevisiae se logra una concentración de etanol de 7.92±0.31% y no se aprecia una producción considerable de etanol (menor de 0.1 g/l) para ninguno de los medios fermentados con Zymomonas mobilis.
PALABRAS CLAVE: Cáscara de banano, Yuca, Almidón, Etanol.
ABSTRACT: In this work the acid hydrolysis of the starch was evaluated in cassava and the cellulose shell banana and its later fermentation to ethanol, the means of fermentation were adjusted for the microorganisms Saccharomyces cerevisiae NRRL Y-2034 and Zymomonas mobilis CP4. The banana shell has been characterized, which possesses a content of starch, cellulose and hemicellulose that represent more than 80% of the shell deserve the study of this as source of carbon. The acid hydrolysis of the banana shell yield 20g/l reducing sugar was obtained as maximum concentration. For the cassava with 170 g/l of starch to pH 0.8 in 5 hours complete conversion is achieved to you reducing sugars and any inhibitory effect is not noticed on the part of the cultivations carried out with banana shell and cassava by the cyanide presence in the cassava and for the formation of toxic compounds in the acid hydrolysis the cellulose in banana shell. For the fermentation carried out with Sacharomyces cerevisiae a concentration of ethanol of 7.92±0.31% it is achieved and a considerable production of ethanol is not appreciated (smaller than 0.1 g/l) for none of the means fermented with Zymomonas mobilis.
KEY WORDS: Banana shell, Cassava, Starch, Ethanol.
1. INTRODUCCIÓN
La crisis energética que comenzó en 1973 disminuyó la oferta de petróleo e incrementó su precio en forma exorbitante, por lo cual, se impuso la racionalización del uso de la energía, hacer un uso más eficiente de ella, y de la diversificación de las fuentes y suministros de estas (Acosta A. 2004). Se planteó la urgente necesidad de encontrar y desarrollar fuentes alternativas de energía, como otros combustibles fósiles (carbón, gas), energía nuclear o recursos energéticos renovables (Kádár et al 2003). Para Colombia en 1979 culminaron 50 años de exportación neta de petróleo y se inicio la importación; a pesar de esta situación, para las últimas décadas se encontraron pozos que solucionaron temporalmente el abastecimiento interno de petróleo. Una alternativa más factible que el petróleo, el carbón y los reactores nucleares en los países en desarrollo, es la utilización directa e indirecta de la energía a partir de residuos vegetales; es una energía renovable, abundante, descentralizada y limpia.
El almidón y su hidrólisis lo hace materia prima de uso inmediato en procesos alimenticios, dulces naturales, detergentes, papel, alimentación animal (Li et al., 2002) y de uso posterior para la producción de alcohol como energía renovable. Se han realizado varios estudios sobre la transformación con hidrólisis de diversas fuentes vegetales, entre ellos, Lapuerta y Agudelo( 2003), reportaron hidrólisis de almidón de yuca al 3% a pH de 1.1 obteniéndose hidrólisis completa en 60 minutos.
Kunlan et al. (2000) evaluaron el efecto de diferentes sales inorgánicas en la hidrólisis con microondas obteniendo glucosa en un corto tiempo; en general la hidrólisis ácida es realizada con HCl o H2SO4 (en un intervalo de 2-5%), a temperaturas cercanas a los 160ºC y presiones de 10 atm (Sun and Chemg, 2002) siendo estas condiciones factores cruciales en la formación de compuestos tóxicos, temperaturas moderadas (<160ºC) proveen una adecuada hidrólisis de hemicelulosa, con poca descomposición de azúcares; de otro lado, temperaturas superiores a 160ºC favorecen la hidrólisis de celulosa y productos de descomposición de lignina que toxifican el jarabe azucarado (McMillan, 1994; Mussatto S., Conceicao I, 2004; Palmqvist and Hahn-Hagerdal, 2000b; Mussatto S., Conceicao I, 2004).
La cáscara de banano está compuesta principalmente por celulosa, hemicelulosa y lignina, su composición varía dependiendo del origen del material (Olsson L. y Hahn-Hiigerdal B., 1996). También se han realizado trabajos utilizando enzimas para la hidrólisis de material vegetal como los reportados por Molina (2003), donde se estudian las condiciones de sustrato, enzima y tiempo para obtener altas conversiones. La cáscara de banano es una fuente abundante de material celulósico, es el constituyente externo del banano y representa alrededor del 40% en peso. En Colombia es producido principalmente en Antioquia en la zona de Urabá y se rechazan en promedio el 20 % de la producción anual (200.000 Ton/año aproximadamente), (FUNDAUNIBAN, Martinez A,A. y Valencia L, 2003), convirtiéndose en un problema de contaminación ambiental en las regiones de producción.
El etanol tiene innumerables aplicaciones: Bebidas fermentadas para consumo humano como vinos, aguardiente, vodka, ron, brandy, etc, En la industria se emplea en gran cantidad de procesos como: disolución de la nitrocelulosa, disolvente de colorantes en las industrias alimenticias y textil; disolvente de: resinas; jabón, aceites, ceras, etc.; y oxidación en la fabricación de ácido acético, vinagre, acetaldehído. Como solvente se utiliza. Asi también se puede mezclar con la gasolina, para mejorar sus propiedades, se recomienda una mezcla en proporción del 10 al 25%, ya que se logra un índice de octano entre 70 y 75, mayor que el de la gasolina sin mezclar. Las mezclas de etanol – gasolina permiten aumentar la compresión en el motor, dan un funcionamiento más regular, su recalentamiento es menor y por tanto se puede utilizar a un mayor número de revoluciones (Mendez, 1979).
En este trabajo se evalúa la hidrólisis ácida de yuca y cáscara de banano como un alternativa para la producción de jarabe azucarado y su posterior fermentación hasta alcohol con Saccharomyces cerevisiae NRRL Y-2034 y Zymomonas mobilis CP4.
2. METODOLOGÍA Y METODOS DE ANÁLISIS
2.1 Tratamiento de la cáscara de banano
La cáscara de banano se redujo a un tamaño de partícula entre 0.1 y 0.5 mm y posteriormente se realizó el método básico de eliminación de lignina, reportado por Hoyos y Pérez (2005), sumergida en una solución de NaOH 0.1N: a los 15 minutos se adicionan 0.816 g. de sulfato de calcio y se deja en reposo por 3 horas, se separa el material particulado de la solución. La hidrólisis ácida se llevó a cabo adicionando 50 ml de ácido sulfúrico al 5% por cada 100 gramos de cáscara de banano, a una temperatura de 125°C y 15 psi, durante 15 minutos, como lo reporta Sun and Cheng (2002).
2.2 Tratamiento de la yuca
La yuca fue lavada con el fin de eliminar el material particulado proveniente del cultivo y se retiró la cáscara de la pulpa. Se molió en un molino de discos hasta un tamaño de partícula con retención en malla 60 del 46.61% y en malla 100 del 12.15%, se evaluaron concentraciones de almidón de 170, 180 y 200g/l, se realizó hidrólisis ajustando el pH a 0.8 con ácido sulfúrico al 20% (40 - 50 ml/ 500 g), se llevó a un baño María a 94°C por 6 horas a 395 rpm, a presión atmosférica con reflujo. El hidrolizado es separado del bagazo pasándolo por un filtro, es diluido hasta 90 g/l y se filtró nuevamente a través de papel Whatman No. 1, se neutralizó con NaOH 5N y se almacenó a 8°C hasta su utilización. Para la hidrólisis de yuca se realizo un diseño experimental de dos factores, concentración y tiempo, con tres niveles para la concentración y siete para el tiempo.
2.3 Fermentación
Después de la hidrólisis, los jarabe de banano y yuca se separaron de los componentes que precipitaron, por centrifugación en una centrífuga Dynac, se ajustó el pH a 6.6 con NaOH 5 N, y la concentración de azúcares reductores para el jarabe de yuca a 20, 40 y 60 g/l y para el jarabe de la cáscara de banano a 20 g/l. Este medio fue complementado con fosfato (KH2PO4), nitrógeno ((NH4)2SO4), extracto de levadura y MgSO4.7H2O como medio de fermentación óptimo para la bacteria Zymomona mobilis (Cano y Naranjo, 2002). Para la cepa de Sacharomyces cerevisiae, se ajustó el pH del medio a 4 y se ajustó la concentración de azúcares reductores a 90 g/l para el jarabe de yuca como lo reporta Ruiz y Arias (1997). La fermentación se realizó en Erlenmeyers de 250 ml, con un volumen efectivo de trabajo de 50 ml. en anaerobiosis a 30°C y 200 rpm, en un agitador orbital Gufa, por 72 horas según lo reportado por Young J. et al., (2005), para la Z. mobilis y de 5 horas para Sacharomyces cerevisiae (Ruiz y Arias, 1997).
2.4 Medios de cultivo.
Los medios de cultivo para los inóculos fueron preparados con glucosa 2%, extracto de levadura 0.5%, (NH4)2SO4 0.1%, KH2PO4 0.1%, MgSO4*7H2O 0.05% (Cano y Naranjo, 2002). Se prepararon medios a partir de glucosa anhidra y jarabe glucosado a 20, 40 y 60 g/l y se complementaron con 0.96 g/l de (NH4)2SO4, 0.02 g/l KH2PO4, 6.5 g/l extracto de levadura, y 0.5 g/l MgSO4*7H2O. Para la cáscara de banano se prepararon medios con concentraciones de 20 g/l de azúcares reductores.
2.5 Microorganismo
Se evaluaron dos tipos de microorganismos, la bacteria Zymomonas mobilis, CP4, la cual fue donada por el Doctor Alfredo Martínez del Instituto de Biotecnología de la Universidad Nacional Autónoma de México y Saccharomyces cerevisiae NRRL Y-2034, donada por el Departamento de Agricultura de los Estados Unidos, unidad de Investigación en Bioprocesos y Microbiología Genómita, Doctor C. P. Kurtzman.
2.6 Métodos analíticos
La determinación de biomasa se realizó por el método de peso seco según Cuesta y Monsalve (2005). La determinación de azúcares reductores en los hidrolizados y medios de cultivo se determinaron utilizando el método de ácido 3,5-dinitrosalicílico (DNS), las absorbancias se midieron en un espectrofotómetro Spectronic 20, a 540 nm. (Ferrer et al. 2002). El contenido de etanol se determinó por cromatografía gaseosa como lo reporta Martínez y valencia (2003). Para el efecto se prepararon estándares de 0.1, 1, 3 y 5% de etanol, las muestras son filtradas en membranas de 0.20 mm antes de la lectura en el cromatógrafo.
3. RESULTADOS Y ANÁLISIS DE RESULTADOS
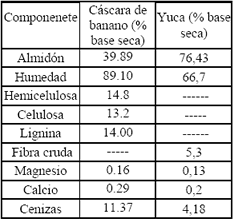
Se realizó caracterización de la yuca y la cáscara de banano; los resultados se presentan en la Tabla 1. La cáscara de banano posee un contenido de almidón, celulosa y hemicelulosa que representan más del 80 % de la cáscara ameritando el estudio de ésta como fuente de carbono.
Tabla 1. Características químicas de yuca y cáscara de banano, Laboratorio de Microbiología, Universidad Nacional de Colombia Sede Medellín.
Table 1. Chemical characteristic of cassava and banana shell. , Laboratorio de Microbiología, Universidad Nacional de Colombia Sede Medellín.
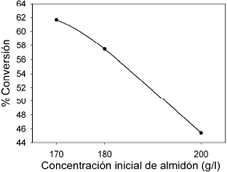
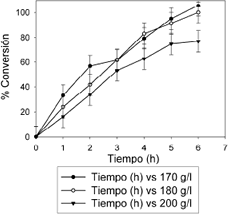
3.1 Hidrólisis ácida
El diseño estadístico muestra con un nivel de confianza del 95% y un factor de regresión (R2) de 0.94 que la concentración, el tiempo y la interacción entre ellos son significativos en la hidrólisis y no se descarta ninguno de los valores obtenidos. El modelo muestra que a menor concentración de polisacáridos, la hidrólisis tarda menos tiempo, como se ve en la figura 1 y 2. Trabajando con 170 g/l , se logra convertir todo el almidón en azúcares reductores en 5 horas. El diseño estadístico no descarta ninguno de los factores (T<0.001) pero no resulta significativa la interacción entre concentración y tiempo ni las interacciones cuadráticas, por tanto el modelo que describe el proceso de hidrólisis es:
Y = 9.91 + 15.69T – 11.08 C
Donde:
Y= Porcentaje de hidrólisis
T= Tiempo de hidrólisis en horas
C = Porcentaje de almidón en la solución.
R2 =88.96%
Figura 1. Comportamiento general de la conversión de almidón de yuca contra la concentración de almidón en el hidrolizado.
Figure 1. General performance of starch cassava conversion Vs concentration in hydrolytic starch.
Figura 2. Porcentaje de conversión del almidón contra el tiempo para 170, 180 y 200 g/l.
Figure 2. Percent conversion for starch Vs time for 170, 180 and 200 g/l.
Al hidrolizar la cáscara de banano se obtiene un jarabe de 20g/l como máxima concentración. Teóricamente con la cáscara se puede obtener un jarabe con concentración superior a 31.54 g/l si solo se hidroliza el almidón presente en la cáscara, posiblemente al realizar la eliminación de lignina se pierden azúcares solubles, además de solubilizar parte de la celulosa con la lignina y posiblemente realizar una hidrólisis básica del almidón.
3.2 Producción de etanol
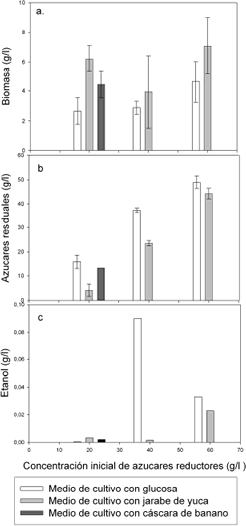
Fermentación con Zymomonas mobilis con una concentración inicial de azúcares reductores iniciales de 20, 40 y 60 g/l, y un tiempo total de fermentación de 72 horas, se observa que se tiene concentraciones de biomasa superiores a 6 g/l (Figura 3.a.) cuando se trabaja con jarabe de yuca; además se logran concentraciones superiores a las reportadas por Young J. et al.,(2005), Min Zhang et al., (1995) trabajando sin agitación. Para el medio con glucosa se logran concentraciones similares trabajando a 60 g/l e inferiores trabajando a 20 y 40 g/l y la producción de biomasa es mejor con medios cáscara de banano y jarabe de yuca. Molina et al (2003) reporta que concentraciones de cianuro en la pulpa de yuca que varían entre 67.57 y 582.53 mg/Kg dependiendo de la variedad y no se encuentra cianuro en el almidón extraído, no se nota ningún efecto inhibitorio por la presencia de cianuro ya que Z. mobilis crece mejor en el medio preparado con yuca que el preparado con glucosa.
Z. mobilis consume más fuente de carbono en estos medios, lo cual explica la mayor cantidad de biomasa. No se aprecia una producción considerable de etanol (menor de 0.1 g/l) para ninguno de los medios fermentados con Z. mobilis.
Figura 3. Fermentación con Z. mobilis a 20, 40 y 60 g/l de azúcares con cáscara de banano, yuca y glucosa. a) Biomasa producida en 72 horas de cultivo para Z. mobilis. b) Azúcares residuales. c) Producción de etanol.
Figure 3. Fermentation with Z. mobilis to 20, 40 and 60 g/l of sugar with banana shell, cassava and glucose. a) Production biomass at 72 hours in culture Z. mobilis . b) Residual Sugar. c) Ethanol production
Para la fermentación realizada con Sacharomyces cerevisiae se logra una concentración de etanol de 7.92±0.31% superiores a las reportadas por Katarzyna Szambelan et al. (2004) y Molina et al. (2003), lo que muestra que los medios preparados a partir de yuca y cáscara de banano favorecen el crecimiento de Z. mobilis.
4. CONCLUSIONES.
La cáscara de banano posee un contenido de almidón, celulosa y hemicelulosa que representan más del 80 % de la cáscara ameritando el estudio de ésta como fuente de carbono.
Al hidrolizar la cáscara de banano se obtiene un jarabe de 20g/l como máxima concentración.
Con 170 g/l de almidón de yuca a pH 0.8 en 5 horas se logra conversión completa a azúcares reductores.
No se nota ningún efecto inhibitorio por parte de los cultivos realizados con cáscara de banano y yuca por la presencia de cianuro en la yuca y por la formación de compuestos tóxicos al hidrolizar la celulosa en banano.
Para la fermentación realizada con Sacharomyces cerevisiae se logra una concentración de etanol de 7.92±0.31%
No se aprecia una producción considerable de etanol (menor de 0.1 g/l) para ninguno de los medios fermentados con Z. mobilis
Tanto la yuca como la cáscara de banano son fuentes potenciales para la producción de etanol.
BIBLIOGRAFÍA
[1] ACOSTA Amilkar, Sosiedad Colombiana de Economistas, Bogota Junio de 2004. [ Links ]
[2] DELGENES J. P., MOLETTA R. y. NAVARRO J. M. Effects of lignocellulose degradation roducts on ethanol fermentations of glucose and xylose by Saccharomyces cerevisiae, Zymomonas mobilis, Pichia stipitis, and Candida shehatae. Enzyme and Microbial Technology 19:220-225, 1996. [ Links ]
[3] HOYOS Lina y PÉREZ Yubeli, Pretratamiento del Material Lignocelulósico de la planta de banano y su fruto para la producción de jarabe, Universidad Nacional de Colombia Sede Medellín, 2005. [ Links ]
[4] MARTÍNEZ A.A., Valencia l.l.. Evaluación del rendimiento de etanol en una fermentación continua con Zymomonas mobilis, Trabajo dirigido de grado, Universidad Nacional De Colombia, Sede Medellín 2003. [ Links ]
[5] MUSSATTO S., Conceicao I., Alternatives for detoxification of diluted-acid lignocellulosic hydrolyzates for use in fermentative processes: a review. Bioresource Technology 93 (2004) 1–10[ [ Links ]STANDARDIZEDENDPARAG]
[6] PARAJ_o, J.C., Dom_inguez, H., Dom_inguez, J.M., 1998. Biotechnological production of xylitol. Part 3: Operation in culture media made from lignocellulose hydrolysates. Bioresource Technol. 66, 25–40.
[7] CARRASCO J.E., Martínez J.M., Sarmentero J. P. y Molina A .Ingeniería Química 1992. [ Links ]
[8] OLSSON L. y Hahn-Hiigerdal B. Fermentation of lignocellulosic hydrolysates for ethanol production. Enzyme and Microbial Technology 18:312-331, 1996[ [ Links ]STANDARDIZEDENDPARAG]
[9] BEGUIN, P., Aubert, J.-P., 1994. The biological degradation of cellulose. FEMS Microbiol. Rev. 13, 25–58. [ Links ]
[10] BELDMAN, G., Voragen, A.G.J., Rombouts, F.M., Pilnik, W., 1988. Synergism in cellulose hydrolysis by endoglucanases and exoglucanases purified from Trichoderma viride. Biotechnol. Bioeng. 31, 173–178. [ Links ]
[11] EXCOFFIER, G., Toussaint, B., Vignon, M.R., 1991. Saccharification of steam-exploded poplar wood. Biotechnol. Bioeng. 38, 1308–1317. [ Links ]
[12] XIN, Z., Yinbo, Q., Peiji, G., 1993. Acceleration of ethanol production from paper mill waste fiber by supplementation with b-glucosidase. Enzyme Microb. Technol. 15, 62–65. [ Links ]
[13] SZCZODRAK J. and Fiedurek J., Technology for conversion of lignocellulosic biomass to ethanol Biomass and Bioenergy Vol. 10, Nos S/6, pp. 367-375, 1996[ [ Links ]STANDARDIZEDENDPARAG]
[14] RUIZ, A. y Arias Evelio. Fermentación Alcohólica de Mucílago de Café con Levaduras, Universidad Nacional de Colombia Sede Medellín, 1997. [ Links ]
[15] TAO F., . Miaob J.Y., Shi G.Y., Zhang K.C., 2003. Ethanol fermentation by an acid-tolerant Zymomonas mobilis under non-sterilized condition Process Biochemistry xxxx2004xxxx [ Links ]
[16] SUN, Y., Cheng, J., 2002. Hydrolysis of lignocellulosic materials for ethanol production: A review. Bioresource Technol. 83, 1–11. [ Links ]
[17] YOUNG Jae Jeon, Charles J. Svenson, Peter L. Rogers. Over-expression of xylulokinase in a xylose- metabolising recombinant strain of Zymomonas mobilis. School of Biotechnology and Biomolecular Sciences, University of New South Wales, Sydney 2052, Australia. FEMS Microbiology Letters 244 (2005) 85–92 [ Links ]