Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.73 no.150 Medellín Nov. 2006
SÍNTESIS, CARACTERIZACIÓN Y EVALUACIÓN FOTOCATALÍTICA DE SISTEMAS ZrO2-SiO2
SYNTHESIS, CHARACTERIZATION AND PHOTOCATALYTIC EVALUATION OF ZrO2-SiO2 SYSTEMS
GLORIA RESTREPO
Grupo Procesos Fisicoquímicos Aplicados /Universidad de Antioquia, gloma@udea.edu.co
JUAN M. MARÍN
Grupo Procesos Fisicoquímicos Aplicados /Universidad de Antioquia
LUIS RIOS
Grupo Procesos Fisicoquímicos Aplicados /Universidad de Antioquia
MARÍA ISABEL MEJÍA
Grupo Procesos Fisicoquímicos Aplicados /Universidad de Antioquia
MANUEL MACÍAS
Grupo Fotocatálisis Heterogénea: Aplicaciones /Instituto de Ciencia de Materiales de Sevilla (ICMSE), 41092 Isla de la Cartuja, Sevilla, España
JOSÉ A. NAVÍO
Grupo Fotocatálisis Heterogénea: Aplicaciones /Instituto de Ciencia de Materiales de Sevilla (ICMSE), 41092 Isla de la Cartuja, Sevilla, España, navio@icmse.csic.es
Recibido para revisar 5 de Octubre de 2005, aceptado 13 de Marzo de 2006, versión final 18 de Mayo de 2006
RESUMEN: La incorporación de un óxido a la matriz de un segundo produce cambios en las propiedades superficiales del sistema inicial, así como modificaciones en la estructura electrónica del material; de hecho, la recombinación de portadores de cargas en un material semiconductor se ve modificada por la incorporación de otro elemento a la red del semiconductor. En particular, las propiedades estructurales, morfológicas, superficiales y catalíticas del óxido de zirconio se ven afectadas al depositarlo sobre otro que actúe como matriz de soporte. En este trabajo se han preparado óxidos mixtos ZrO2-SiO2 empleando el método sol gel de precipitación seguido de diversos tratamientos térmicos. Los materiales así obtenidos fueron caracterizados por diversas técnicas evaluándose además su actividad fotocatalítica en la degradación del 3-nitrofenol. Si bien el comportamiento fotocatalítico del sistema ZrO2-SiO2 no difiere del que exhiben los óxidos simples ZrO2 y SiO2, las propiedades de estos materiales tipo óxido mixto sí están fuertemente condicionadas no sólo por el método de preparación sino por los tratamientos de calcinación.
PALABRAS CLAVE: Fotocatálisis, Óxido de zirconio, Óxido mixto, Sol-gel.
ABSTRACT: The incorporation of an oxide to the matrix of another one produces changes in the superficial properties of the initial system, as well as modifications in the electronic structure of the material. In fact, the recombination of charge carriers in a semiconductor material is modified by the incorporation of another element to the semiconductor network. In particular, the structural, morphological, superficial and catalytic properties of the zircon oxide are affected when it is deposited on another that acts as a support matrix. In the present work, the mixed oxides ZrO2-SiO2 have been prepared using the sol gel method of precipitation followed by diverse thermal treatments. So obtained materials were characterized by diverse techniques and also were tested their photocatalytic activity for the degradation of 3-nitrophenol. Although the photocatalytic behavior of the system ZrO2-SiO2 is not different from the one that exhibits the simple oxides ZrO2 and SiO2, the properties of these mixed oxides strongly depend on the preparation methods and the calcination treatments.
KEYWORDS: Photocatalysis, Zircon oxide, Mixed oxide, Sol-gel.
1. INTRODUCCIÓN
El dióxido de zirconio, ZrO2, es un material que tiene aplicaciones en campos muy diversos, entre ellas sus cada vez más crecientes aplicaciones en catálisis. Otras aplicaciones de interés se encuentran en el campo de la ingeniería y de las cerámicas refractarias [1-4]. Se ha puesto de manifiesto que las propiedades mecánicas del ZrO2 que le dan aplicación en estos campos, varían enormemente según la fase cristalina que esté presente [3-10]. Asimismo, en el campo de la catálisis se puede correlacionar la actividad catalítica con la fase cristalina en la que se encuentra el sistema, siendo la fase tetragonal del ZrO2 la que presenta mayor actividad catalítica [3-4,7,11-12]. Por este motivo se han hecho diversos estudios con el fin de estabilizar la fase tetragonal hasta temperaturas que resultan ser relativamente altas [4, 8, 13-14], ya que en principio se asocia la presencia de esta fase con la manifestación de dichas propiedades mecánicas y catalíticas.
Por otra parte, la gran capacidad de aplicación del ZrO2 en catálisis parece estar relacionada con su carácter bifuncional ácido–base [9-13][10,15-20]. En este sentido, una forma de generar en un óxido nuevos centros ácidos, y quizás de una naturaleza más fuerte es mediante la incorporación de un segundo óxido en la estructura del primero [12,14,21] o bien modificar las propiedades ácido–base superficiales mediante la incorporación de especies SO4= en la superficie del ZrO2 simple o disperso en una matriz de sílica gel [3, 15-16, 22-25]
Dentro del campo de la catálisis heterogénea, se ha puesto de manifiesto que el ZrO2 exhibe además propiedades fotocatalíticas aunque ha quedado establecido que la actividad fotocatalítica de este óxido por unidad de superficie es mucho menor que la que presenta el dióxido de titanio comercial (Degussa, P-25) [26]. En este sentido, al igual que la incorporación de un óxido a la matriz de un segundo produce cambios en las propiedades ácido–base superficiales del sistema inicial, también se producen cambios en la estructura electrónica del material. De hecho, es bien conocido que la recombinación de portadores de cargas en un material semiconductor se ve modificada por la incorporación de otro elemento en la red del semiconductor [27]. En este sentido, Anpo [28] ha descrito un aumento de la actividad fotocatalítica del TiO2 cuando este se encuentra altamente disperso sobre una matriz de SiO2 y para bajos contenidos en TiO2 (menores del 20% en peso). El presente estudio tiene por objetivo obtener correlaciones entre las propiedades estructurales, morfológicas y superficiales del sistema ZrO2-SiO2 con su comportamiento fisicoquímico.
2. EXPERIMENTAL
Para la síntesis del óxido mixto ZrO2-SiO2 (5% en peso de ZrO2), se ha empleado la técnica sol-gel de precipitación, partiendo por separado de una suspensión acuosa de sílica gel comercial y de una disolución acuosa de ZrOCl2.8H2O. La mezcla se lleva a cabo a 0ºC y la suspensión final se mantiene en agitación constante durante todo el proceso a esta temperatura. La gelificación de esta suspensión se consigue por adición de amoníaco acuoso hasta llegar a un valor de pH = 10. El gel así obtenido es filtrado, lavado y secado a 100ºC durante 24 horas, y luego se somete a diversos tratamientos térmicos.
La caracterización del óxido mixto ZrO2-SiO2 fue realizada empleando Análisis Termo-Gravimétrico (ATG) y Termo-Diferencial (ATD), Difracción de Rayos X (DRX), Área Superficial BET, Espectroscopia Infrarroja (IR), Microscopía Electrónica de Barrido (SEM), Microscopía Electrónica de Transmisión(TEM), Energías Dispersivas de Rayos X (EDAX) y espectroscopia UV-Visible de Reflectancia Difusa (UV-Vis/RDS).
Los estudios de fotoadsorción fueron realizados empleando un reactor fotoquímico (Applied Photophysics Ltd., modelo RQ125) provisto de una lámpara de mercurio de presión media (400 W) que emite una radiación predominantemente en el intervalo 365-366 nm. Como reacción de ensayo se empleó la oxidación fotocatalítica del 3-nitrofenol (5x10-3 M). El fotocatalizador (1 g/L de disolución) fue suspendido en la solución de 3-nitrofenol, la cual fue irradiada por un tiempo total de 10 h con burbujeo permanente de oxígeno.
3. RESULTADOS Y DISCUSIÓN
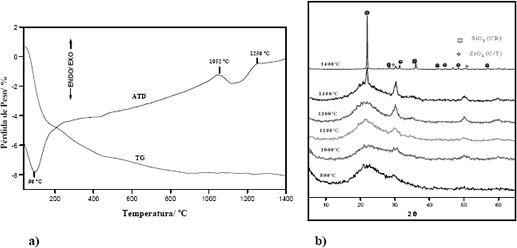
La Figura 1 muestra los diagramas de ATD/ATG y DRX para el sistema ZrO2-SiO2, observándose los procesos de cristalización de fases del ZrO2 y el SiO2 en el intervalo de 800-1300ºC. Es destacable el hecho que el ZrO2 cristalice en la forma metaestable cúbica/tetragonal (C/T) a una temperatura alrededor de 1100ºC y que esta fase permanezca presente en el sistema aún a temperaturas de 1400ºC, ya que a 1000ºC la fase monoclínica es la única fase termodinámicamente estable del ZrO2. Este comportamiento puede atribuirse a la estabilización de los efectos energéticos de tensión y superficiales y a la existencia de un tamaño de cristal que hace que esta fase sea la más estable [29-32]. Por otra parte, la presencia de la matriz SiO2 parece favorecer la fase cúbica/tetragonal ejerciendo un cierto efecto de bloqueo sobre la transformación cúbica/tetragonal monoclínica.
Figura 1. Diagramas de a) ATD/ATG y b) DRX para el óxido mixto ZrO2-SiO2.
Figure 1. Diagrams of a) ATD/ATG and b) DRX for the mixed oxide ZrO2-SiO2.
La estabilidad relativa de las fases cúbica(C), tetragonal (T) y monoclínica (M) del óxido de zirconio a altas temperaturas, está influenciada por dos importantes factores: el tamaño de partícula y el efecto del SiO2 presente en el composite. Con relación a este último, su influencia puede ser parcialmente debida a la menor energía interfacial para la interfase SiO2–C/T–ZrO2 que para la interfase ZrO2– M–SiO2; además la menor simetría de los pequeños cristales de SiO2 que están en contacto entre sí, puede favorecer la transformación a una fase también de baja simetría (fases iguales) como lo es la fase cúbica/tetragonal del ZrO2 [33].
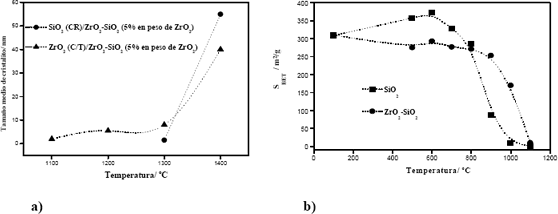
El tamaño medio de los pequeños cristales y su evolución con la temperatura, como se ve en la Figura 2, se ha estimado empleando el método descrito en la literatura [34]. Se observa un incremento rápido y simultáneo del tamaño de los pequeños cristales de las dos fases presentes en el sistema ZrO2-SiO2 que ocurre entre 1300-1500ºC, intervalo de temperatura en el que el sistema presenta su mayor grado de cristalinidad. Asimismo, en la Figura 2 se muestra la variación de la superficie específica con la temperatura y se aprecia cómo la incorporación del ZrO2 en la matriz del SiO2 conlleva a una disminución de la superficie específica y mantiene la superficie del óxido mixto constante, retardándose la sinterización del sistema.
Figura 2. Evolución de a) Tamaño medio y b) Superficie Específica, SBET, del óxido ZrO2-SiO2 en función de la temperatura de calcinación.
Figure 2. Evolution of a) Medium size and b) Specific Surface, SBET, of the ZrO2-SiO2 oxide based on the temperature of calcination.
Los aspectos morfológicos y microestructurales de los sistemas ZrO2-SiO2 y su evolución con la temperatura han sido estudiados por SEM y TEM, Figura 3. A 100ºC se observan partículas de morfología regular, con caras planas, bordes redondeados y una superficie ligeramente rugosa y agrietada. A 1400ºC las partículas presentan una superficie más lisa y son regulares y con tendencia a formas esféricas.
Figura 3. Imágenes a) SEM y b) TEM para el óxido mixto ZrO2-SiO2, calcinado a 100ºC y 1400ºC.
Figure 3. Images a) SEM and b) TEM for the mixed oxide ZrO2-SiO2, calcined at 100ºC and 1400ºC.
La imagen TEM muestra una partícula de SiO2 (según DRX) de bordes agudos sobre la cual aparecen distribuidos granos de tamaños diferentes y que se asocian con la fase cristalina cúbica/tetragonal del ZrO2. El análisis general por EDX reveló la presencia de Zr y Si y la difracción de electrones indicó que la muestra se comportaba como un monocristal de SiO2 que,
de acuerdo con el resultado de rayos X, debe ser cristobalita conteniendo una cierta cantidad de ZrO2 en la fase cúbica/tetragonal.
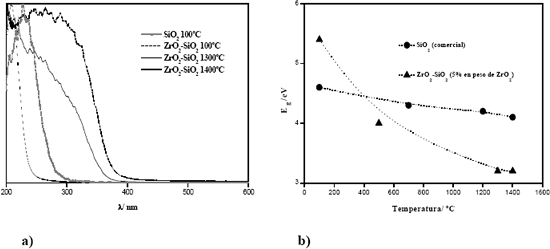
Los estudios por Espectroscopía de Reflectancia Difusa, RDS, Figura 4, indican que con la temperatura de calcinación se desarrolla una nueva banda de absorción y se produce un desplazamiento hacia el visible, evidenciado en la variación del band gap, lo que conduciría a materiales con propiedades ópticas diferentes.
Figura 4. a) Espectros UV-Vis/RD y b) variación del band gap con la temperatura, para el óxido simple SiO2 y el óxido mixto ZrO2-SiO2.
Figure 4. a) Spectrums UV-Vis/RD and b) variation of band gap with the temperature, for the simple oxide SiO2 and the mixed oxide ZrO2-SiO2.
3.1 Estudios de Fotoactividad
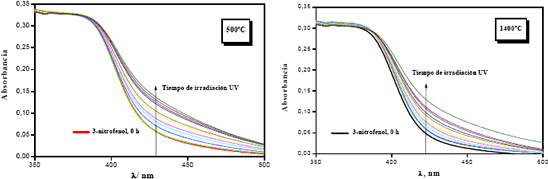
En la Figura 5 se presentan los espectros de absorción UV-Vis de la disolución de reacción, tras los distintos tiempos de iluminación cuando se usa el óxido mixto ZrO2–SiO2 calcinado durante 3 horas a 500ºC y a 1400ºC.
Figura 5. Espectros UV-vis del medio de reacción para la degradación fotocatalítica del 3-nitrofenol con ZrO2-SiO2 (5% en peso de ZrO2) calcinado a 500ºC y 1400ºC durante 3 horas.
Figure 5. UV-vis spectrums of reaction medium for the photocatalytic degradation of 3-nitrophenol with ZrO2-SiO2 (5% weight of ZrO2) calcined at 500ºC and 1400ºC during 3 hours.
Se observa que a lo largo del tiempo de iluminación empleado (10 h), no se producen variaciones significativas en los espectros registrados en el intervalo l  400 nm. Sin embargo, ligeras (pero significativas) variaciones se observan en el intervalo l = 400–500 nm. Puede observarse que en ambas muestras aparece un ligero aumento de la absorción en este intervalo lo que se asocia con la aparición de nuevas bandas en esta zona sin que se modifiquen las características previas del espectro de absorción en la zona de l
400 nm. Sin embargo, ligeras (pero significativas) variaciones se observan en el intervalo l = 400–500 nm. Puede observarse que en ambas muestras aparece un ligero aumento de la absorción en este intervalo lo que se asocia con la aparición de nuevas bandas en esta zona sin que se modifiquen las características previas del espectro de absorción en la zona de l  400 nm. En el medio de reacción se detecta la presencia de NO2- y NO3- sin aparición de CO2, lo que indica una leve fotodegradación del 3-nitrofenol, más no su mineralización.
400 nm. En el medio de reacción se detecta la presencia de NO2- y NO3- sin aparición de CO2, lo que indica una leve fotodegradación del 3-nitrofenol, más no su mineralización.
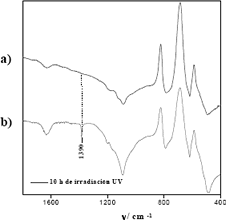
Las especies NO2-/NO3- pueden también provenir de la fotooxidación del ion NH4+, ya que el sistema oxo–hidroxo complejo de zirconio tiene la capacidad de retener tales iones en medio básico durante el proceso de preparación, lo cual se evidencia en la Figura 6, espectros IR de la superficie del ZrO2–SiO2 calcinado durante 3 horas a 1400ºC antes de ser empleado en los estudios de fotoactividad y la superficie de esta muestra tras la fotoreacción del 3-nitrofenol (10 horas de irradiación). Como puede observarse, el pico centrado a 1390 cm-1 que corresponde a las vibraciones de tensión del ión NH4+ desaparece tras el proceso de irradiación.
Figura 6. Espectros IR para el óxido mixto ZrO2-SiO2 (5% en peso de ZrO2) calcinado 3 h a 1400ºC, a) antes y b) después del proceso de irradiación.
Figure 6. IR spectrums of mixed oxide ZrO2-SiO2 (5% in weight of ZrO2) calcined 3h at 1400ºC, a) before and b) after irradiation process.
4. CONCLUSIONES
La textura, estructura y morfología de estos sistemas está fuertemente condicionada no sólo por el método de preparación sino también por los fenómenos difusionales y de transferencia de masa que tienen lugar cuando son sometidos a diferentes tratamientos de calcinación, destacándose el hecho que la a fase cúbica/tetragonal del óxido de zirconio permanece presente tras tratamientos de calcinación a temperaturas mayores a 1100ºC, no observándose a ninguna temperatura de las estudiadas la fase monoclínica, indicando este hecho que la matriz soporte SiO2 ejerce un efecto estabilizante de la fase C/T del ZrO2.
No se encontraron diferencias apreciables del comportamiento fotocatalítico del óxido mixto ZrO2-SiO2 respecto al que presenta los óxidos simples ZrO2 y SiO2.
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Antioquia, al Instituto de Ciencia de Materiales de Sevilla ICMSE, a COLCIENCIAS y a la Agencia Española de Cooperación Internacional AECI.
REFERENCIAS
[1] ANTONY, A. M., Science and Technology of Zirconia, American Ceramic Society, Columbus, 1988. [ Links ]
[2] BECHER, P. F. Acta Metall, 34, 1885, 1986. [ Links ]
[3] WU, Z.WANG, ZHAO, Y.XIANG AND LIU, D.SHENG, Micropor. Mesopor. Mater., 68, 127, 2004. [ Links ]
[4] AGUILAR, D. H.; TORRES-GONZÁLEZ, L. C. AND L. M. TORRES-MARTINEZ, Journal of Solid State Chemistry, 158, 349, 2000. [ Links ]
[5] GARVIE, R. G.; HANNICK, R. H.; PASCOE, R. T. Nature, 258, 703, 1975. [ Links ]
[6] KAMIYA, K.; SAKKA, S.; TATAMICHI, Y. J. Mater. Sci., 15, 1765, 1980. [ Links ]
[7] ONO, T.; KIGAWA, M.; SYONO, Y. J. Mater. Sci., 20, 2483, 1985. [ Links ]
[8] HEUER, A. H. J. AM. Ceram. Soc., 70, 689, 1987. [ Links ]
[9] KUO, D.H.; CHIEN, C.H AND HUAN, C.H., Thin Solid Films, 47, 420-421, 2002. [ Links ]
[10] RANA, M.S.; MAITY, S.K.; ANCHEYTA, J.; MURALI DHAR, G. AND PRASADA RAO, T.S.R., Applied Catalysis A: General, 268, 89, 2004. [ Links ]
[11] COMELLI, R. A.; VERA, G. R. PATERA, J. M. J. CATAL., 96, 151, 1995. [ Links ]
[12] YOSHIDA, H.; CHASKAR, M.G.; KATO, Y. AND HATTORI, T., J. of Photochemistry and Photobiology A: Chemistry, 160, 47, 2003. [ Links ]
[13] CLAUSSEN, N.; TUHEL, M.; HEUER, A. H. (eds.) in: Advances in Ceramics, Vol. 12, American Ceramic Society, Columbus, 1984. [ Links ]
[14] LUCOVSKY, G.; RAYNER, G.B.; KANG, D.; HINKLE, C.L. AND HONG, J.G., Applied Surface Science, 234, 429, 2004. [ Links ]
[15] XU, B. Q.; YAMAGUSHI, T.; TANABE, K. Chem. Lett., 149, 1989. [ Links ]
[16] XU, B. Q.; YAMAGUSHI, T.; TANABE, K. Chem. Lett., 281, 1989. [ Links ]
[17] RYLAND, L. L. B.; TAMELE, M. W.; WILSON, J. N. Catalysis, New York, Emmett P. H. (ed.), 7, 1, 1960. [ Links ]
[18] TANABE, K. In: Solid Acids an Bases. Their Catalytic Applications, Academic Press, New York, 1970. [ Links ]
[19] TANABE, K. In: Catalysis. Science and Technology, Anderson, J. R.; Boudart, M. (eds), Springer Verlag, Berlin, 2, 231, 1981. [ Links ]
[20] DINES, T.J.; MACGREGOR, L.D. AND ROCHESTER, C.H., Journal of Colloid and Interface Science, 245, 221, 2002. [ Links ]
[21] KUNG, H. H., Transition Metal Oxides: Surface Chemistry and Catalysis, En: Studies in Surface Sci. and Catal., 45, 1989. [ Links ]
[22] NAVÍO, J. A.; COLÓN, G., SÁNCHEZ-SOTO, P. J.; MACÍAS, M. Chem.Of Materials, 9, 1256, 1997. [ Links ]
[23] NAVÍO, J. A.; COLÓN, G.; MACÍAS, M.; CAMPELO, J. M.; ROMERO A. A.; MARINAS, J. M. J. Of Molec. Catal. A: Chem., 135, 155, 1998. [ Links ]
[24] YANG, H.; LU, R.; SHEN, L,; SONG, L.; JINGZHE ZHAO, J.; WANG, Z. AND WANG, L., Materials Letters, 57, 2572, 2003. [ Links ]
[25] LLOPEZ, T.; NAVARRETE, J.; GOMEZ, R.; NOVARO, O.; FIGUERAS, F. AND ARMENDARIZ, H., Applied Catalysis A: General, 125, 217, 1995. [ Links ]
[26] HERRMANN, J. M.; DISDIER, J.; PICHAT, P. J. Chem. Soc. Faraday Trans., I, 77, 2815, 1981. [ Links ]
[27] GOODENOUGH, J. B. In: Photochemistry, Photocatalysis and Photoreactors, NATO-ASI, Series G, Schiavello, M. (ed), Reidel, Dordrecht, 146, 3, 1985. [ Links ]
[28] ANPO, M. Res. Chem. Intermediate, 11, 67, 1989. [ Links ]
[29] ESCALONA, E.; PEÑARROYA M. Mat. Lett., 14, 318, 1992. [ Links ]
[30] GARVIE, R. C. J. Mater. Sci., 82, 218, 1985. [ Links ]
[31] MERCERA, P.D. L.; VAN OMMEN, J. G.; Doesburg, E. B. M.; Burggraaf, A. J.; Ross, J. R. J. Appl. Catal., 57, 127, 1990. [ Links ]
[32] SRINIVASAN, R.; CAMDEN, R.; HUBBARD, O.; BURL, O.; DAVIS, B. Chem. Mater., 5, 27, 1993. [ Links ]
[33] NAGARAJAN, V. S.; RAO, K. J. J. Mater. SCI., 24, 2140, 1989. [ Links ]
[34] MONRÓS, G.; MARTÍ, M. C.; CARDA, J.; TENA, M. A.; ESCRIBANO, P.; ANGLADA, M. J. Mater. Sci., 28, 5852, 1993. [ Links ]