Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
DYNA
versão impressa ISSN 0012-7353versão On-line ISSN 2346-2183
Dyna rev.fac.nac.minas v.73 n.150 Medellín nov. 2006
THERMOLYSIS OF SUBSTITUTED ß-HYDROXYKETONES-ß-ARYL. A COMPUTATIONAL STUDY.
JAIRO QUIJANO
Laboratorio de Fisicoquímica Orgánica. Universidad Nacional de Colombia, jquijano@unalmed.edu.co
EDERLEY VÈLEZ
Laboratorio de Fisicoquímica Orgánica. Universidad Nacional de Colombia
RAFAEL NOTARIO
Instituto de Química –Física Rocasolano. Consejo Superior de Investigaciones Científicas de España- CSIC-Serrano 119-28006, Madrid-España.
CAMILO QUIJANO
Laboratorio de Fisicoquímica Orgánica. Universidad Nacional de Colombia
ANDRÉS ESCOBAR
Laboratorio de Fisicoquímica Orgánica. Universidad Nacional de Colombia
Recibido para revisar 15 de Mayo de 2005, aceptado 6 de Julio de 2005, versión final 12 de Septiembre de 2005
RESUMEN: Estudios teóricos de la termólisis de b-hidroxicetonas-b-aril sustituidas (m,p) para producir mezclas de aldehídos aromáticos y acetona a 429,15K se llevaron a cabo utilizando métodos ab-initio a niveles MP2/6-31G(d)//HF/6-31G(d). Los perfiles de reacción para los sustituyentes m y p estudiados muestran en todos los casos que la segunda etapa de la reacción tautomerización de acetona (DG =217.6 kJmol-1) es la etapa mas lenta. La primera etapa incluye un estado de transición cíclico de seis miembros y sobre ésta se centraron los estudios de una posible relación lineal de energía libre. Los resultados muestran que no hay una buena correlación Hammett indicativo de efecto perpendicular a la coordenada de reacción.
PALABRAS CLAVE: Termólisis, Estado de transición (TS), Hammett, Yukawa T-suno, Ab-initio
ABSTRACT: Theoretical studies on the thermolysis of (m,p) substituted b -hydroxiketones-b-aryl to produce a mixtures of aromatic aldehydes and acetone at 429,15K were carried out using ab-initio theoretical methods, at the MP2/6-31G(d)//HF/6-31G(d) levels of theory. The reaction profiles for the studied substituents m and p show in all the cases that the second step of the tautomerization reaction of acetone (DG =217.6 kJmol-1) is the slowest. The first step includes a six-membered cyclic transition state and on this one the studies of a possible Linear Free Energy Relationship were centered. The results show there is no a very well agreement with the Hammett correlation indicative of perpendicular effect to the reaction coordinate.
KEY WORDS: Thermolysis, Transition state(TS), Hammett, Yukawa T-suno, Ab-initio
1. INTRODUCCIÓN
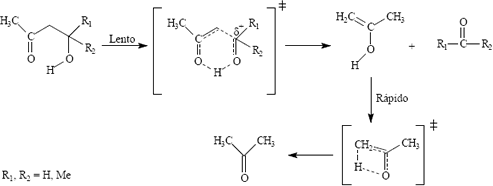
Las ß-Hidroxicetonas alifáticas termolizan en fase gaseosa y/o en solución, en una reacción que es la reversa de la condensación aldólica [1, 2,3] para producir mezclas de cetonas y/o aldehídos. Todas las termólisis de estos compuestos tienen entropías de activación negativas (DS<0), lo que ha sugerido la posibilidad que su mecanismo transcurra vía estado de transición cíclico semipolar de seis miembros es su primera etapa (lenta) con posterior tautomerización del enol producido (etapa rápida) como se muestra en la figura 1.
Figura 1. Mecanismo propuesto para la termólisis de b-Hidroxicetonas
Figure 1: Suggested mechanism for thermolysis of b-Hidroxycetones
En los casos de las reacciones en solución de xileno [2] y en fase gaseosa [1,3] se ha encontrado un leve incremento en la velocidad de la misma cuando aumenta la sustitución metílica (alcohol: 3°>2°>1°) (13.3:3.2:1.0).
Estos resultados han sugerido que el carbono donde se encuentra el hidroxilo, aumenta su carácter positivo en el estado de transición lo que seguramente es neutralizado por los efectos donadores de electrones del grupo metilo (hiperconjugación).
Con el fin de estudiar más a fondo este efecto particular y conocer si el estado de transición posee un carácter carbocatiónico parcial se procedió a estudiar computacionalmente varias b-hidroxicetonas-b-aril sustituidos en para y meta con el fin de analizar una posible relación lineal de energía libre y estudiar la variación del estado de transición a lo largo de la coordenada de reacción (efectos Hammond) o por el contrario efectos perpendiculares a la misma (anti Hammond). En la literatura química sólo se encuentra un estudio de relaciones tipo Hammett para 1-aril-3-buten-1-ol y en su termólisis a 346°C se obtuvo r=-0.26, indicando una pequeña carga desarrollada en C1 [4].
Mucho se ha discutido sobre gráficos de Hammett curvos, en términos de un desplazamiento de la etapa determinante de la velocidad en una reacción con varias etapas (curvatura cóncava o convexa) [5,6,7,8]. Sin embargo, excepto para los casos SN1/SN2 y E2 extremo. En sistemas benzílicos donde los sustituyentes sobre el átomo central cambian la estructura del estado de transición (TS) de tres a cuatro centros, es raro encontrar un ejemplo inequívoco de gráficas de Hammett no lineales debidos a variación en la estructura del estado de transición (TS) [9].
Estudios experimentales de la cinética en solución de o-xileno (1%) a 429.15K, realizadas en nuestro laboratorio10 han mostrado que los gráficos de Hammett11 (log k vs s), poseen correlación muy pobre (r2= 0.8831, r=0.44), que mejora un poco al ajustar estos datos con la ecuación (1) de Yukawa-Tsuno [12] (r2=0.9618, r=-0.325).
![]()
No obstante lo anterior y con el fin de analizar si los sustituyentes utilizados ofrecen sólo una pequeña perturbación como para inducir una variación detectable del estado de transición que se corrige con el tratamiento de Yukama-Tsuno, realizamos un estudio teórico, en fase gaseosa de varios b-hidroxicetonas b-aril(m,p) sustituidas a la temperatura de los experimentos.
2. DETALLES COMPUTACIONALES
Los cálculos se llevaron a cabo utilizando preliminarmente el paquete Spartan-Pro [13] para el análisis conformacional de reactantes y productos. Posteriormente se utilizó el software Gaussian 98 [14]. Los parámetros geométricos de todos los reactantes, estados de transición (TS) y los productos de todas las reacciones estudiadas fueron optimizados a niveles de teoría MP2/6-31G(d)//HF/6-31G(d), para obtener los perfiles de reacción reportados. Cada estructura estacionaria se caracterizó como un mínimo o un punto de silla de primer orden por cálculos de frecuencia. En todos los casos se utilizó un factor de escalamiento para las energías vibracionales del punto cero (ZPE) de 0.9135.
Para cada reacción se realizaron cálculos de Coordenada Intrínseca de Reacción (IRC) para verificar que el estado de transición localizado conectaba con los correspondientes puntos mínimos estacionarios asociados con reactantes y productos.
En algunos casos se realizaron cálculos Single – Point a niveles más altos que MP2/6-31G(d).
Las características de enlace de las diferentes especies se investigaron utilizando el análisis de Reed y Weinhold [15,16] conocido como Natural Bond Orbital (NBO). Este formalismo provee valores de cargas atómicas naturales y también los índices de enlace de Wiberg [17] utilizados para seguir el progreso de una reacción. Se selecciono la teoría clásica del estado de transición (TST) [18,19] para calcular los parámetros cinéticos. Las constantes de velocidad, k(T), para cada etapa elemental se calcularon asumiendo que el coeficiente de transmisión utilizado en la teoría TST es igual a uno; quedando la expresión:
![]()
Donde kB, h y R son las constantes de Boltzman, Planck y Universal de los gases respectivamente. DG=(T) es la energía libre de activación estándar a la temperatura absoluta T.
Las energías de activación, Ea, y el factor de Arrhenius A, se calcularon utilizando las ecuaciones 2 y 3 derivadas de la teoría TST (para etapas unimoleculares).
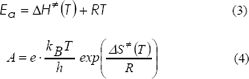
3. RESULTADOS Y DISCUSIÓN
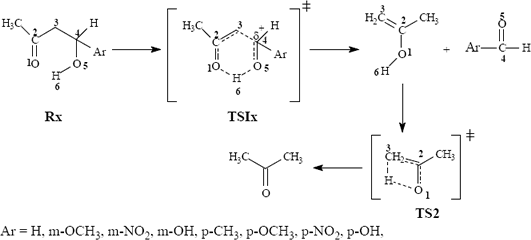
Se estudió a nivel de teoría MP2/6-31G(d)//HF/6-31G(d) el mecanismo mostrado en la figura 2.
Figura 2. Mecanismo postulado para la termólisis de las ß-Hidroxicetonas-ß-aril sustituidas estudiadas.
Figure 2: Mechanism postulated for the thermolysis of studied ß-Hidroxycetones-ß-aril substituted.
Perfil de reacción
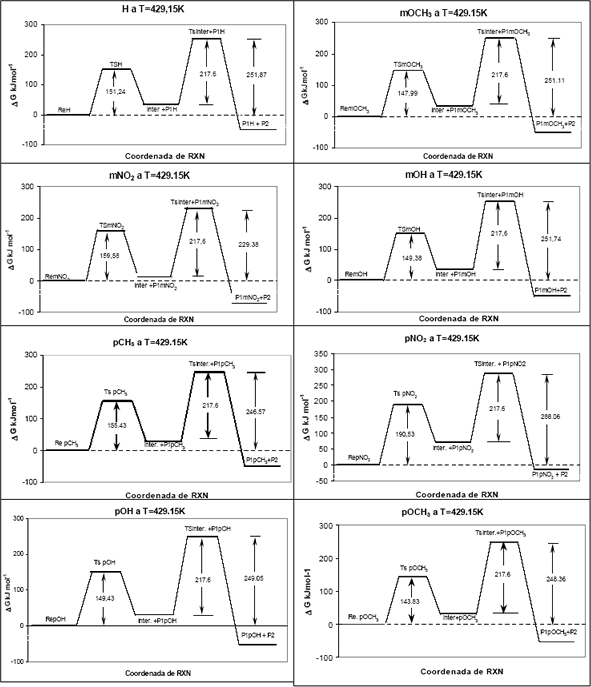
A continuación se muestran los perfiles de energía libre a 429.15K y MP2/6-31G(d)//HF/6-31G(d) para cada uno de los sustituyentes.
Como en todas las reacciones estudiadas, la segunda etapa tiene la misma barrera: tautomerización de acetona (217.6 KJ mol-1) que es la más lenta, nos dedicaremos a la primera etapa pues esta incluye los grupos para y meta sustituidos en el anillo aromático.
Parámetros estudiados de los reactantes y TSs
Teniendo en cuenta que la segunda etapa es común para todas las reacciones, se presentan en la Tabla 1 algunos parámetros importantes para la primera etapa, tales como los índices de enlace de Wiberg, Bi y los porcentajes de evolución %EV.
Tabla 1: Índices de enlace de Wiberg y porcentajes de evolución calculados a HF/6-31G(d) de b aril cetonas –x sustituidas y sus TS.
Table 1: Wiberg bond index and percentage of evolution calculated at HF/6-31G(d) of ß-Hidroxycetones-ß-aril substituted and its TSs.
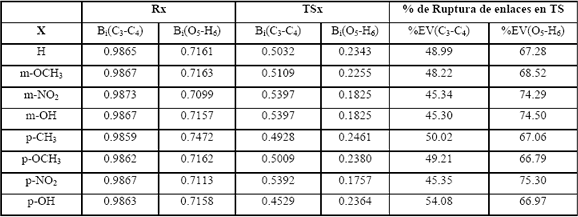
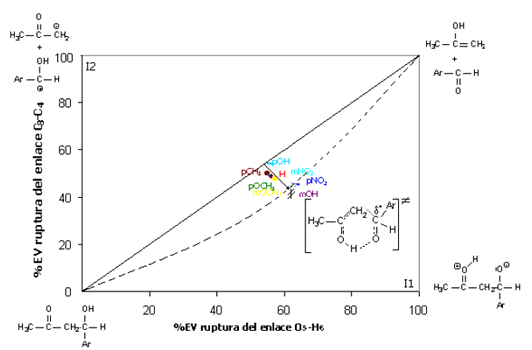
Puede notarse que en todos los TS está más avanzada la ruptura del enlace O5-H6 que C3-C4. Al colocar estos resultados en un diagrama de More OFerral-Thorton-Jencks, Figura 4, considerando dos posibles intermediarios I1 e I2 y una reacción concertada pura, los sustituyentes en el arilo realizan en efecto perpendicular a la coordenada de reacción y el TS sería entonces parecido al intermedio I1 y no al I2, lo que daría cuenta de una pequeña estabilización de la carga desarrollada en C4. Si fuese parecido a I2 sí habría una gran estabilización de los sustituyentes en el anillo arílico.
Figura 3: Perfiles de Energía Libre calculados al nivel MP2/6-31G(d)//HF/6-31G(d) a 429.15K para cada uno de los compuestos estudiados.
Figure 3: Free energy profiles evaluated at MP2/6-31G(d)//HF/6-31G(d) level, at 429.15K for the each one studied compounds.
Figura 4: Diagrama de More OFerral-Thorton-Jencks para la reacción estudiada a 429.15K
Figure 4: More OFerral-Thorton-Jencks diagram of the studied reaction at 429.15K
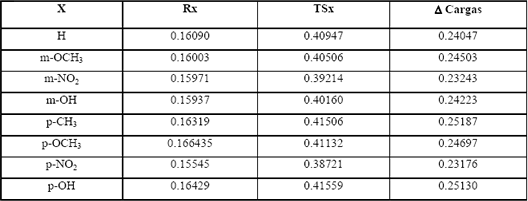
En la Tabla 2 se observan las cargas NBO de el C4 para reactantes y TS, así como su incremento relativamente constante, indicando la poca separación de carga entre estas especies.
Tabla 2: Cargas NBO calculadas a HF/6-31G(d) para reactantes y TS en C4 a 429.15 K
Table 2: NBO charges calculated at HF/6-31G(d) level of reactants and TS on C4 atom, at 429.15K
En la Tabla 3 se presentan los resultados de las constantes de velocidad y parámetros de activación a 429.15K.
Tabla 3: Parámetros de activación y constantes de velocidad a 429.15K, Calculados a MP2/6-31G(d)//HF/6-31G(d).
Table 3: Activation parameters and rate constants at 429.15K, calculated at MP2/6-31G(d)//HF/6-31G(d) level.
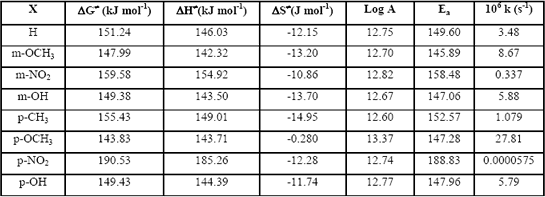
Con los resultados de las constantes de velocidad y los sm y sp, se realizó el gráfico de Hammett, obteniéndose una pobre correlación (r2= 0.7363) indicativo de efectos perpendiculares a la coordenada de reacción, que no se mejora con el tratamiento de Yukawa-Tsuno, enmascarando el hecho real de ser éste tipo de reacciones anti Hammond y por tanto no susceptible a ser estudiado por la ecuación de Hammett ya que las perturbaciones no se realizan sobre la coordenada de reacción, sino perpendicular a ella.
4. CONCLUSIONES
De este estudio computacional podría concluirse que, aunque los resultados preliminares de constantes de velocidad indican que grupos extractores de electrones del anillo bencénico desestabilizan el TS, como es el caso del pNO2 y por tanto hacen la velocidad menor, Tabla 3, no necesariamente se obtiene una buena correlación de Hammett cuando éstas perturbaciones no ocurren a lo largo de la coordenada de reacción, pues no siguen el postulado de Hammond como es el caso de las termólisis estudiadas.
El cálculo de los índices de enlace de Wiberg es de gran utilidad en la elucidación de los mecanismos de reacción ya que permite realizar los diagramas de More OFerral, Thorton y Jencks para ubicar hacia cuál intermediario se desplazaría del TS (efectos perpendiculares del TS). Los TS son levemente tardíos como corresponde a reacciones endergónicas, situación ésta que puede observarse en los perfiles de reacción y en los diagramas de More OFerral, Thorton y Jencks mencionados. En este caso esta más avanzada la ruptura del enlace O5-H6 y C3-C4. Es necesario realizar estudios computacionales adicionales de efectos isotópicos cinéticos de deuterio para tener un panorama más contundente sobre la variación del estado de transición con la naturaleza de los grupos aril sustituidos.
AGRADECIMIENTOS
DIME – Universidad Nacional de Colombia, Sede Medellín, proyecto: (Relaciones Lineales de Energía Libre para la termólisis de b-Hidroxicetonas meta y para aril sustituidas Código CINDEC: 030802534. COLCIENCIAS, proyecto: Estudio Experimental y Teórico de la Termólisis de Metil Ésteres b-Hidroxiácidos. Código: 1118-05-11481.
COLCIENCIAS – Programa Jóvenes Investigadores (Carlos Andrés Escobar y Ederley Vélez). Dirección General de Investigación Española, Ministerio de Ciencia y Tecnología. (Project No. BQU20001499).
REFERENCIAS
[1] SIMITH, G. G., YATES, B. L. (1965). J. Chem. Soc. 7242. [ Links ]
[2] YATES, B. L., QUIJANO, J. (1969). J. Org. Chem. 34: 2506. [ Links ]
[3] ROTINOV, A., CHUCHANI, G., MACHADO, R., RIVAS, C., QUIJANO, J. y col. (1992). Int. J. Chem. Kinetics. 24 (10): 909. [ Links ]
[4] SIMITH, G. G., VOORHEES, K. J. (1970). J. Org. Chem. 35: 2182 Pross, A. (1977) Adv. Phys. Org. Chem. 14: 69. [ Links ]
[5] HOZ, S., BAN-ZOIN, M. (1980) J. Chem. Soc., Chem. Commun. 453. [ Links ]
[6] SWAIN, C. G., LANGSDORF, W. P. (1951 ) J. Am. Chem. Soc. 73: 2813. [ Links ]
[7] BUNNETT, J . F., SRIDHARAN, S., CAVIN, W. P. (1979) J. Org. Chem. 44: 1463[ [ Links ]STANDARDIZEDENDPARAG]
[8] AMMAL S. C., MISHIMA M., AND YAMATAKA H. (2003) J. Org. Chem. 68: 7772-7778. [ Links ]
[9] ESCOBAR C. A. Y QUIJANO, J. Resultados aún no publicados. [ Links ]
[10] HAMMETT, L. P. (1970) Physical Organic Chemistry, Reaction Rates, Equilibria and Mechanisms, 2nd ed,. (Ed) McGraw-Hill: New York. [ Links ]
[11] YUKAWA, Y., TSUNO, Y. BULL. (1959) Chem Soc. Jpn. 32: 971. [ Links ]
[12] HEHHRE, W. S., DEPPMEIER, B. J., Klunzinger. P. E. (1999) Wavefunction, Inc. Irvine, CA 92612 USA. http:// www.wavefun.com[ [ Links ]STANDARDIZEDENDPARAG]
[13] Gaussian 98, (2002) Revision A.11.3, M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, V. G. Zakrzewski, J. A. Montgomery, Jr., R. E. Stratmann, J. C. Burant, S. Dapprich, J. M. Millam, A. D. Daniels, K. N. Kudin, M. C. Strain, O. Farkas, J. Tomasi, V. Barone, M. Cossi, R. Cammi, B. Mennucci, C. Pomelli, C. Adamo, S. Clifford, J. Ochterski, G. A. Petersson, P. Y. Ayala, Q. Cui, K. Morokuma, N. Rega, P. Salvador, J. J. Dannenberg, D. K. Malick, A. D. Rabuck, K. Raghavachari, J. B. Foresman, J. Cioslowski, J. V. Ortiz, A. G. Baboul, B. B. Stefanov, G. Liu, A. Liashenko, P. Piskorz, I. Komaromi, R. Gomperts, R. L. Martin, D. J. Fox, T. Keith, M. A. Al-Laham, C. Y. Peng, A. Nanayakkara, M. Challacombe, P. M. W. Gill, B. Johnson, W. Chen, M. W. Wong, J. L. Andres, C. Gonzalez, M. Head-Gordon, E. S. Replogle, and J. A. Pople, Gaussian, Inc., Pittsburgh PA. [ Links ]
[14] REED A.E, WEINHOLD F. (1983) J. Chem. Phys. 78: 4066-4073. [ Links ]
[15] REED AE, CURTISS L.A., WEINHOLD F. (1988) Chem. Rev. 88: 899-926. [ Links ]
[16] WIBERG K.B. (1968) Tetrahedron. 1968, 24: 1083. [ Links ]
[17] GLASSTONE, S.,. LAIDLER, J. I., EYRING, H. (1941) The Theory of Rate Processes, (Ed) Mc Graw-Hill, New York. [ Links ]
[18] BENSON, S. W. (1960) Foundation of Chemical Thermodynamics. (Ed) Mc Graw-Hill, New Cork. [ Links ]
[19] LOWRY, THOMAS H. AND RICHARDSON, KATHLEEN S. Mechanism and theory in organic chemistry. Estados Unidos: (Ed) Harper & Row Publishers. 3 ed. Capítulo 2. [ Links ]