Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.73 no.150 Medellín Nov. 2006
INFLUENCIA DEL CONTENIDO DE ÓXIDO DE MAGNESIO Y DEL TRATAMIENTO TÉRMICO EN LA DISOLUCIÓN DE Ca+2 DE UN MATERIAL CERÁMICO BIOACTIVO DEL TIPO 31SiO2–11P2O5–(58-x)CaO–xMgO
INFLUENCE OF MAGNESIUM OXIDE CONTENT AND HEAT TREATMENT IN DISSOLUTION OF Ca+2 OF A CERAMIC MATERIAL BIOACTIVE TYPE 31SiO2–11P2O5–(58-x)CaO–xMgO
EMIGDIO JOSÉ MENDOZA
Ingeniería de Materiales, Universidad de Antioquia, GIPIMME, ejmendoz@unalmed.edu.co
LEONARDO ALFONSO ZAMORA
Ingeniería de Materiales, Universidad de Antioquia, GIPIMME, elazm731@udea.edu.co
FABIO VARGAS GALVIS
Ingeniería de Materiales, Universidad de Antioquia, GIPIMME, vargasf@udea.edu.co
Recibido para revisar 1 de Octubre de 2005, aceptado 12 de Diciembre de 2005, versión final 14 de Marzo de 2006
RESUMEN: Los materiales bioactivos generan un enlace cohesivo con los tejidos vivos debido a la formación de una capa superficial de hidroxicarbonato de apatita. Esta capa se forma por el intercambio de iones calcio (Ca2+) y fosfato (PO4)3- que ocurre entre el biomaterial y los fluidos circundantes. El presente trabajo establece la influencia que tiene sobre un material bioactivo, la presencia de óxido de magnesio en su tendencia de cristalización por tratamiento térmico. Además, relaciona el tipo de fases generadas con el grado de intercambio de iones Ca2+ entre el vitrocerámico y un fluido fisiológico simulado. El estudio se inició con la obtención de muestras vítreas de diferentes porcentajes de óxido de magnesio, posteriormente se determinó la temperatura de tratamiento térmico a la que el material se convierte en vitrocerámico; por último, las muestras fueron inmersas en una solución Ringer para disolución de Ca+2 mediante ensayo in vitro. La caracterización del grado de cristalinidad de las muestras se realizó mediante difracción de rayos x (DRX) y microscopía óptica de luz reflejada (MO), y la disolución de Ca2+ en la solución Ringer se determinó mediante absorción atómica. Los resultados muestran que en el intercambio de iones calcio con la solución, no es determinante la cantidad presente de óxido de calcio en el vitrocerámico, sino la forma en la que el ión Ca2+ se encuentra dentro de la estructura del biomaterial.
PALABRAS CLAVE: Cerámicos bioactivos, Tratamiento térmico, Intercambio iónico.
ABSTRACT: Bioactive materials produce a cohesive bound with life tissue because a layer surface formation of hidroxiapatite (HA). The interchange between calcium (Ca2+) phosphate (PO4)3- of materials ions and the surrounding fluids produce the HA surface layer. This paper establish the influence of de magnesium oxide on the crystallization by heat treatment of the material. Also the relation ship between the phases type with the calcium ions (Ca2+) interchange when the vitroceramic material is in simulated physiological fluid, is analyzed. This study was started by the obtention of vitroceramics samples with different magnesium oxide percentages. After heat treatment temperature which the material get on vitroceramic, was fixed. Finally, the samples were immersed in a Ringer solution for Ca2+ dissolution by invitro test. The cristalinity level of the samples was caracterized by X ray diffraction (DRX) and reflected light optical microscopy. The Ca2+ disolution in the Ringer solution was measured by atomic absortion. The results should that the amount of the calcium oxide in the vitroceramic is not deterministic in the calcium interchange ions. In spite of way which the Ca2+ ions is in the biomaterial structure.
KEY WORDS: Bioactive ceramics, Heat treatment, Ion interchange.
1. INTRODUCCIÓN
Un material bioactivo es aquel que al entrar en contacto con los fluidos fisiológicos de un organismo no es rechazado y por el contrario desarrolla una capa superficial que es compatible con los tejidos vivos [1]. Por esta razón son ampliamente usados en la reparación y sustitución de estructuras orgánicas deterioradas, cumpliendo una función interfacial entre el tejido vivo y el implante ortopédico [2].
La bioactividad de vidrios y vitrocerámicos bioactivos está dada por una serie de reacciones superficiales que involucran: intercambio de iones alcalinos, rompimiento de enlaces Si-O-Si y generación de grupos silanoles (Si-OH), regeneración de la capa superficial de sílice, precipitación de iones calcio y fosfato en la superficie, cristalización de una capa de hidroxicarbonato de apatita y finalmente unión al tejido vivo [3].
Los vidrios y vitrocerámicos bioactivos están compuestos fundamentalmente por óxidos de silicio, calcio y fósforo. Numerosos elementos han sido incorporados y estudiados con el fin de determinar su influencia en el comportamiento en servicio de estos materiales [4,5].
Con este trabajo se busco determinar el efecto del óxido de magnesio y del tratamiento térmico en la disolución del Ca+2, que es uno de los principales iones que determinan la reactividad química de los vidrios de la familia 31SiO2 – 11P2O5 – (58-x)CaO – xMgO; mediante el estudio de la formación de fases cristalinas a través de tratamiento térmico y de la disolución de calcio por inmersión en un fluido fisiológico simulado (solución Ringer).
2. PROCEDIMIENTO EXPERIMENTAL
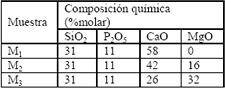
Con el fin de evaluar el efecto que presenta el contenido de magnesio, se prepararon tres muestras cuya composición química se presenta en la Tabla 1.
Tabla 1. Composición química de cada una de las muestras.
Table1. Chemical Composition of each one of the samples.
Las muestras objeto de estudio se obtuvieron por fusión en horno a gas y crisoles de óxido de magnesio (MgO). Una vez la mezcla de óxidos utilizados como materia prima alcanzó la temperatura de fusión, fueron vaciados en un recipiente con agua a fin de generar una estructura lo más vítrea posible.
Las muestras obtenidas se caracterizaron por DRX utilizando como fuente un ánodo de cobre, barrido 2q entre 5º y 65º a una velocidad de 2º por minuto, y MO realizando pulido mecánico con carburo de silicio de 5 mm. De esta forma se determinó el tipo de fases constituyentes y el grado de arreglo cristalino presente en cada una de ellas, tomando esto como punto de partida para la realización y análisis de los tratamientos térmicos subsecuentes.
2.1 Tratamientos térmicos
La reactividad química de un biomaterial depende fuertemente de la clase y proporción de arreglos cristalinos presentes en su estructura, pasando desde muy reactivo para muestras totalmente vítreas hasta muy estables para estructuras cristalinas.
A su vez, el grado de cristalización generado a partir del material en estado vítreo, depende directamente de la temperatura a la cual se realiza el tratamiento térmico.
Con el fin de determinar la temperatura necesaria para promover la cristalización parcial de las muestras de estudio, se realizó tratamiento térmico a 700ºC (T1), 900ºC (T2) y 1100°C (T3) durante 1 hora, a diferentes muestras de composición química M2, obtenidas en la fusión inicial. La muestra M2 se empleo ya que posee una composición química intermedia entre M1 y M3.
Finalmente y de acuerdo con los resultados que mostraron un grado de cristalización parcial a 900ºC, en la muestra M2; las muestras M1 y M3 fueron tratadas térmicamente a esta misma temperatura, con el fin de obtener una cristalización parcial de su estructura, la cristalinidad obtenida fue determinada mediante DRX y MO.
2.2 Prueba de disolución de ca2+ en solución ringer
El grado de intercambio iónico que presenta cada una de las muestras en presencia de un fluido fisiológico simulado, se estudió por exposición de éstas a una solución Ringer, la cual permaneció a 37ºC y agitación constante. El montaje dispuesto simula las condiciones de operación de estos materiales dentro de un organismo vivo.
En el ensayo in vitro se expusieron al fluido fisiológico una muestra sin tratamiento térmico de M2 y muestras M1, M2 y M3 tratadas térmicamente a T2. Finalmente, se extrajo una cantidad del líquido obtenido después de 12, 24 y 72 horas de inmersión de las muestras en el fluido fisiológico y se determinó la cantidad de calcio disuelto mediante absorción atómica.
3. RESULTADOS Y DISCUSIÓN
3.1 Muestras obtenidas del proceso de fusión
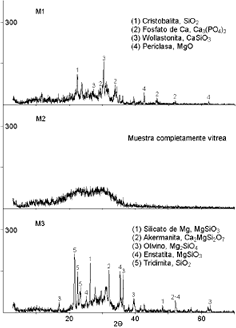
En la Figura 1 se presentan los resultados del ensayo de DRX para cada una de las muestras obtenidas en el proceso de fusión.
Figura 1. Difractogramas de rayos X para las muestras obtenidas del proceso de fusión.
Figure 1. DRX for the obtained samples of the melt process.
Los picos presentes, que son indicadores de algún grado de cristalinidad, muestran en el espectro para M1 y M3, que el proceso de enfriamiento posterior a la fusión del material no fue lo suficientemente rápido para lograr su vitrificación total. Sin embargo, la baja intensidad de los picos indica que el grado de cristalización de estas muestras es bajo, con respecto a lo mostrado en el difractograma obtenido para la muestra M2, el cual es característico de un material completamente vítreo.
En el difractograma para la muestra M3 predominan la formación de fases ricas en magnesio, esto se debe a que el ión Mg2+ tiene mayor movilidad que el ión Ca2+, por lo cual su difusión dentro de la estructura del material es mayor, y ante un incremento energético tenderá a formar compuestos cristalinos con facilidad.
El espectro de la muestra libre de óxido de magnesio en su formulación (M1), presenta además de fases de calcio una fase de magnesio, que se atribuye a contaminación debido a la reacción con el crisol durante el proceso de fusión. No obstante, la baja intensidad de los picos característicos de dicha fase, indica que su presencia en forma cristalina, dentro del biomaterial es mínima.
Por otro lado, el difractograma correspondiente a la muestra M2 presenta un espectro libre de picos, lo cual indica que el material se encuentra en un estado completamente vítreo.
3.2. Tratamientos térmicos
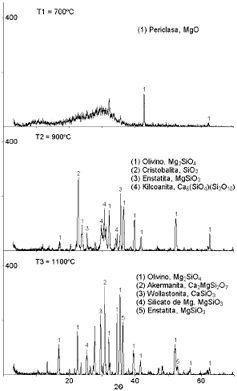
La Figura 2 presenta los espectros de difracción de rayos x correspondientes a los diferentes tratamientos térmicos realizados a las muestras M2. En ella se puede observar un incremento en el número de fases generadas a medida que aumenta la temperatura de tratamiento térmico. De igual manera, la intensidad de los picos presentes indica una mayor proporción de fases a medida que se incrementa la temperatura.
Figura 2. Difractogramas de rayos X obtenidos a las diferentes temperaturas de tratamiento térmico realizados a las muestras M2.
Figure 2. DRX obtained to the different temperatures of thermal treatment carried out to the samples M2.
En este punto es importante aclarar que ninguna de las muestras ha alcanzado un estado totalmente cristalino, por lo cual la estructura interna de cada una de ellas esta dada por una serie de fases cristalinas inmersas en una matriz vítrea.
A la temperatura de tratamiento T1 apenas se aporta la energía necesaria para originar la difusión del ión Mg2+ (de mayor movilidad) en la estructura vítrea y promover la formación de una fase cristalina (periclasa).
De otro lado, las temperaturas T2 y T3 promueven la formación de un mayor número de fases en la estructura del biomaterial. A la temperatura T2, prevalecen fases ricas en magnesio, lo cual supone que la mayor parte del calcio presente en la muestra, se encuentra disperso en la matriz vítrea del biomaterial.
A medida que se incrementa la temperatura de tratamiento hasta T3, se promueve la formación de un mayor número de fases. Además, la energía suministrada es tal que las fases cristalinas de calcio empiezan a tomar importancia dentro del biomaterial, disminuyendo así su reactividad química.
De lo anterior se establece la temperatura T2 como aquella que promueve la cristalización de fases de magnesio permitiendo que el calcio, al encontrarse en la matriz vítrea, quede propenso al ataque de los fluidos fisiológicos.
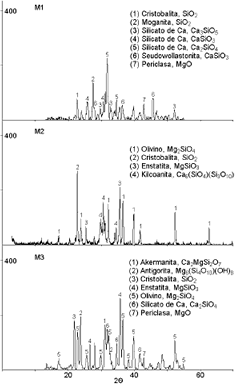
La muestra M1 y M3 tratadas térmicamente a 900°C (T2) durante 1 hora, mostraron un incremento en la cristalinidad respecto al que se tenía antes del tratamiento térmico. Los espectros obtenidos mediante DRX para estas muestras son mostrados en la Figura 3.
Figura 3. Difractogramas de rayos X para las muestras tratadas térmicamente a 900ºC.
Figure 3.DRX for the samples tried thermally at 900ºC.
En la muestra M1 después del tratamiento térmico se produjeron fases cristalinas correspondientes a silicatos de calcio, lo que indica que a la temperatura a la cual se realizó este tratamiento, el calcio presente en la muestra alcanza un nivel de energía suficiente para formar fases cristalinas.
En esta muestra, cuyo contenido de óxido de magnesio es 0%, la intensidad del pico correspondiente a MgO (periclasa) es tan baja como la que se tenía antes del tratamiento térmico, esto se debe a que la cantidad de esta fase en la muestra se encuentra en forma cristalina y en una proporción insignificante y es producto de la contaminación generada por el crisol durante el proceso de fusión.
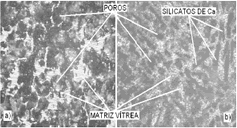
En la Figura 4 se puede observar por microscopia óptica de luz reflejada, el cambio microestrutural producido por el tratamiento térmico (T.T.) a 900ºC realizado a la muestra M1.
Figura 4. Microestructuras de M1, atacadas con H3PO4: a) sin T.T. 100x, b) con T.T. a 900ºC, 100x.
Figure 4. Microstructures of M1, attacked with H3PO4: a) without T.T. 100x, b) with T.T. at 900ºC, 100x.
En la Figura 4(a) se observó una matriz vítrea acompañada de una cantidad de poros producidos durante la obtención de la muestra. En la Figura 4(b), además de la matriz vítrea y de la cantidad de poros, se observó formación de fases cristalinas aciculares correspondientes a silicatos de calcio.
Tal y como se planteó anteriormente, en la muestra M2 después del tratamiento térmico a 900°C durante 1 hora, se observó formación de silicatos de magnesio y en menor proporción de silicatos de calcio, esto se debe a que a esta temperatura, la movilidad del ión Mg2+ es mayor que la del ión Ca2+, por lo cual la mayor cantidad de este último ión aún se debe encontrar en la matriz vítrea. Adicionalmente a esta temperatura parte de la sílice SiO2 presente en la muestra M2 se cristalizó formando cristobalita. Ver Figura 3.
En la Figura 5 se muestra el cambio microestrutural producido por el tratamiento térmico en la muestra M2. En la Figura 5(a), se observó una microestructura característica de una matriz vítrea. En la Figura 5(b) se observó formación de compuestos cristalinos aciculares correspondientes a silicatos de magnesio y calcio, además de cristobalita.
Figura 5. Microestructuras de M2, atacadas con H3PO4: a) sin T.T. 100x, b) con T.T. a 900ºC, 100x.
Figure 5. Microstructures of M2, attacked with H3PO4: a) without T.T. 100x, b) with T.T. at 900ºC, 100x.
En la Muestra M3 después del tratamiento térmico se observó formación de nuevos silicatos de magnesio, así mismo aumentó la proporción de los compuestos ya existentes, esto se evidenció en una mayor cantidad e intensidad de los picos obtenidos en el ensayo de DRX, que se muestra en la Figura 3.
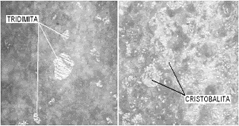
En la Figura 6 se muestra el cambio microestructural producido por el tratamiento térmico en la muestra M3. En la Figura 6(a) se observó cristales de tridimita en una matriz vítrea. En la Figura 6(b) se observó cristobalita.
Figura 6. Microestructuras de M3, atacadas con H3PO4: a) sin T.T. 100x, b) con T.T.a 900ºC, 100x.
Figure 6. Microstructures of M3, attacked with H3PO4: a) without T.T. 100x, b) with T.T. at 900ºC, 100x.
3.3. Ensayo in vitro
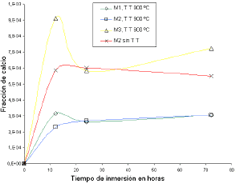
La cantidad de Ca2+ disuelto durante la inmersión de las muestras M1, M2, M3 tratadas térmicamente y la muestra M2 sin tratamiento térmico, en la solución Ringer, fue determinado mediante análisis de absorción atómica, los resultados obtenidos son mostrados en la Figura 7.
Figura 7. Fracción de calcio disuelto en solución Ringer.
Figure 7. Fraction of calcium dissolved in Ringer solution.
De la Figura 7 se puede establecer que en las muestras M1 y M2 tratadas térmicamente, la disolución de iones de Ca2+ es más baja que la disolución en la muestra M3 tratada térmicamente y M2 sin tratamiento térmico.
Esto se puede atribuir a que en las muestras M1 y M2, tratadas térmicamente, buena parte del calcio presente formó silicatos de calcio cristalinos y kilcoanita (compuesto cristalino rico en calcio), respectivamente. Dado que los compuestos cristalinos tienen energía libre superficial más baja que los vítreos, su resistencia a la disolución es mayor, por lo tanto las muestras que poseen compuestos cristalinos ricos en Ca2+ tienen una mayor resistencia a la disolución de este ión.
El cambio abrupto en cuanto a la fracción de calcio disuelto para la muestra M3 a las 12 horas de inmersión, se puede atribuir a la reactividad química superficial que conlleva a la formación de fases inestables en la superficie del vitrocerámico, sin embargo, a medida que el sistema va alcanzando el equilibrio con el tiempo va disminuyendo su reactividad.
En la muestra M3 tratada térmicamente, a pesar de que existe menor cantidad de calcio, que en las muestras M1 y M2, su disolución fue mayor, esto se debe a que la mayor cantidad de Ca2+ se encuentra en la matriz vítrea, por lo que la resistencia a la disolución de esta muestra es menor. Adicionalmente, en esta muestra, buena parte del Mg2+, se convirtió en silicatos de magnesio cristalinos, lo que aumentó la energía libre superficial de la matriz vítrea en la que se encuentra el Ca2+ haciéndolo más susceptible a la disolución.
La muestra M2 sin tratamiento térmico al ser completamente vítrea posee baja resistencia a la disolución del Ca2+.
4. CONCLUSIONES
Al incrementar el contenido de óxido de magnesio en la formulación de un biomaterial de la familia 31SiO2 – 11P2O5 – (58-x)CaO – xMgO, se promueve la formación de fases cristalinas ricas en este óxido durante el tratamiento térmico, desplazando la formación de compuestos cristalinos de calcio. Esta tendencia de cristalización se hace más evidente a medida que se incrementa la temperatura a la cual se realiza el tratamiento.
De igual manera, a medida que aumenta la presencia de fases cristalinas ricas en óxido de magnesio, el intercambio iónico entre el vitrocerámico y el fluido fisiológico es mayor a partir de un valor dado en el contenido de éste óxido; ya que al aumentar el grado de cristalización se incrementa la energía libre superficial de los iones de calcio debido a la migración de los iones de magnesio para formar arreglos cristalinos.
La formación, a partir del material vítreo, de fases cristalinas ricas en Ca2+, disminuye su disolución debido a:
- La energía libre superficial de las fases cristalinas que contienen Ca2+ es menor que la del Ca2+ en la estructura vítrea.
- A medida que se forman fases cristalinas que contienen Ca2+, disminuye la cantidad de este Ion disponible en la estructura vítrea que puede ser disuelto ante el contacto con la solución Ringer.
BILIOGRAFÍA
[1]. PARK J.B., LAKES R.S., Biomaterials and Introduction, ed. 2nd, Plenum Press, New York, 1992. [ Links ]
[2]. RAVAGLIOLI A., KRAJEWSKI A., Bioceramics, Ed. Chapman & may, New York (USA), 1992. [ Links ]
[3]. HENCH L. L., Surface Modification of Bioactive Glass and Ceramics, en: Clark D. E. y Zoitos B. K., Corrosion of Glass, Ceramics and Ceramics Superconductors, Ed. Noyes Publications. 2000. [ Links ]
[4]. OLIVEIRA J.M., CORREIA R.N., Y FERNÁNDEZ M.H., Effects of Si Speciation on the Vitro Bioactivity of Glasses, Biomaterials (23): 371-379, 2002. [ Links ]
[5]. HÖLAND W., Biocompatible and Bioactive Glass–Ceramics, State of the Art and New Directions, Journal of Non-Crystalline solids (219): 192 – 197, 1997. [ Links ]