Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.74 no.151 Medellín Jan./Apr. 2007
LECHO FIJO DE ÓXIDO DE MAGNESIO
FLAMELESS COMBUSTION OF NATURAL GAS ON
MAGNESIUM OXIDE PACKED BED
ELÍAS GÓMEZ
Grupo de Ciencia y Tecnología del Gas y Uso Racional de la Energía, Universidad de Antioquia, egomez@udea.edu.co
ALEJANDRO JARAMILLO
Grupo de Ciencia y Tecnología del Gas y Uso Racional de la Energía, Universidad de Antioquia, ejaja457@udea.edu.co
MAURICIO SÁNCHEZ
Grupo de Ciencia y Tecnología del Gas y Uso Racional de la Energía, Universidad de Antioquia, msanchez@udea.edu.co
Recibido para revisar 2 de Noviembre de 2005, aceptado 28 de Marzo de 2006, versión final 16 de Junio de 2006
RESUMEN: Se diseñaron sistemas para combustión de gas natural sobre MgO partiendo del modelo pseudo-homogéneo bidimensional. Se construyeron dos reactores de lecho fijo: uno de acero al carbono y otro cerámico, dotados de calentamiento eléctrico y controles de temperatura y flujo. El MgO mostró actividad para la oxidación completa de gas natural sin emisión de CO e hidrocarburos, manteniendo la temperatura de los gases de combustión por debajo de 1400°C. La oxidación del gas natural se inició desde 500°C y según las condiciones de flujo la conversión completa estuvo entre 650°C y 800°C. Las conversiones se obtuvieron con una menor cantidad de MgO que la predicha por el modelo lo cual puede explicarse desde el punto de vista cinético por la presencia de hierro y calcio en la superficie del catalizador, que podrían estar mejorando la actividad del MgO.
PALABRAS CLAVE: Combustión sin llama, Gas natural, Óxido de magnesio, Reactores de lecho empacado
ABSTRACT: Systems for the combustion of natural gas over MgO with a two-dimensional pseudohomogeneous model were designed. Two packed bed reactors were built: one of carbon steel and the other of ceramic material, both with electric heating and flow and temperature controls. MgO showed activity for the complete oxidation of natural gas without CO or hydrocarbon emissions, maintaining combustion gases temperature below 1400°C. Natural gas oxidation was initiated at 500°C and depending on flow conditions, complete conversion was between 650°C and 850°C. CH4 Conversion was obtained with a catalyst quantity lower than the model predicted value which can be explained from the kinetic point of view because of the presence of iron and calcium on the catalyst surface as MgO activity promoters.
KEY WORDS: Flameless combustion, Natural gas, Magnesium oxide, Packed bed reactors
1. INTRODUCCIÓNPor la creciente demanda energética mundial y las regulaciones ambientales es necesario desarrollar tecnologías alternativas o mejoradas para uso limpio y eficiente de la energía. Tales desarrollos se plantean desde el punto de vista de nuevos conceptos en los diseños o de tecnologías combinadas que permiten alcanzar mejor desempeño de los equipos de combustión. En combustión térmica de gas natural se han visto avances respecto a los procesos tradicionales, los cuales, dadas las altas temperaturas de operación, son generadores importantes de NOx y requieren de materiales especiales para su construcción, sumado a los problemas de estabilidad de la llama, riesgos de explosión y restricciones a operar entre límites de inflamabilidad [1].
Con las tecnologías catalíticas, donde una mezcla combustible-aire se acondiciona para promover su combustión mediante una superficie activa, se han reportado mejoras respecto a la combustión térmica relacionadas con menor temperatura para comenzar la combustión, disminución de emisiones contaminantes vía control de la temperatura alcanzada trabajando con composiciones fuera del rango de inflamabilidad, mayor estabilidad de la combustión y oxidación completa del combustible sin formación de inquemados ni monóxido de carbono [2,3]. Los materiales que han mostrado ser más activos son los metales nobles como Pd y Pt soportados en ?-Al2O3, [1, 3, 4]. Igual que los óxidos de metales de transición, presentan problemas de estabilidad a temperaturas superiores a 800°C y sus costos son elevados. La necesidad de materiales térmicamente más estables y más baratos ha llevado al desarrollo de catalizadores basados en óxidos mixtos como: perovskitas, espinelas, y hexaaluminatos y óxidos de metales alcalinoterreos (CaO, MgO, BaO), estos últimos con alta estabilidad térmica; sin embargo todos ellos con actividad catalítica inferior a la de los metales nobles [1, 3, 5].
El óxido de magnesio, MgO, usado tradicionalmente como soporte de metales nobles por su estabilidad térmica (Tfusion: 2850°C), mostró ser un promotor de la combustión de metano más estable que los hexaaluminatos [6, 7], lo cual sumado al bajo costo de materia prima lo hace muy interesante para promover la combustión sin llama de gas natural.
El presente trabajo se enfoca en el diseño de un prototipo de reactor para llevar a cabo la combustión sin llama de gas natural, a diferentes condiciones de flujo, sobre un lecho fijo de óxido de magnesio preparado a partir de materias primas nacionales de bajo costo. Los resultados experimentales obtenidos se confrontaron con los predichos por el modelo matemático bidimensional usado para el diseño. Se examinaron las características de la combustión en lo referente a conversión del metano y a la emisión de hidrocarburos sin quemar y monóxido de carbono, para diferentes velocidades de mezcla aire-metano y temperatura de precalentamiento.
2. DISEÑO DEL REACTOR
2.1 Modelo matemático
Para el modelo pseudohomogéneo en estado estacionario, asumiendo perfil de velocidad plano, aceptando que la dispersión axial puede evitarse a partir del diseño del lecho con una longitud 50 veces mayor al diámetro de partícula [2, 8] y sin considerar gradientes térmicos y de concentración intrapartícula, las ecuaciones de conservación de especies (1), energía (2) y cantidad de movimiento (3) ó ecuación de Ergun [9], pueden expresarse en coordenadas cilíndricas como:
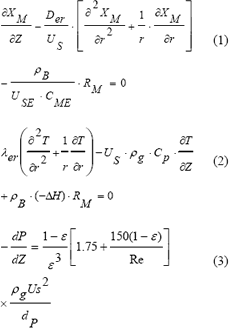
con condiciones iniciales:
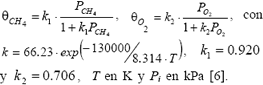
El modelo matemático constituido por las ecuaciones (1), (2) y (3), permite, al resolverlas de manera simultánea, encontrar el diseño apropiado para alcanzar un grado de conversión de metano deseado y conocer el estado del sistema en función de CM, T y P.
Con el fin de evitar la formación de NOx térmicos se limita la temperatura de los gases de salida a 1400°C y se define una potencia neta máxima para el sistema de 100 W a partir de la cual se obtienen los flujos de gas natural y aire. El diseño inicial se realiza entonces para un flujo de 5.0 SLPM (litros estándar por minuto) de mezcla aire-gas natural con 3.11% de CH4. Se parte de que el reactor se construirá con tubería reforzada de acero al carbón sin costuras la cual es ampliamente usada en hornos y calderas, de 1.5 pulgadas de diámetro nominal y con las siguientes características: diámetro externo, Do = 48.3 mm; diámetro interno, Di = 38.1 mm y espesor de pared, t = 5.08 mm. Estas dimensiones se tomaron después de comparar diferentes tamaños y tipos de tuberías según la capacidad de flujo y la facilidad para empacar el lecho. El lecho se empacó con partículas con tamaño promedio de 2.18 mm. Las propiedades físicas se estimaron con las expresiones
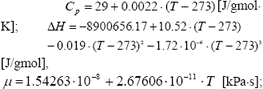
y para las condiciones de flujo Re = 1.35.
Nauman [10] presenta una curva que relaciona Re y Pem de la cual se determina que para corrientes gaseosas ![]()
el cual puede corregirse para la relación dp/dt= 2.38/38.1= 0.625, según:
![]()
obteniéndose Pem = 3.76 y Der = 1.5875 cm2/s.
La conductividad térmica efectiva, ler, es compleja de estimar y aunque existe gran cantidad de trabajos no se ha logrado que alguno gane aceptación general acerca de sus resultados [10, 11, 12, 13]. Froment [14] hace una comparación de los diferentes trabajos previamente reportados para la determinación de la conductividad térmica efectiva, ler, y a partir de dichas curvas se realizó una regresión lineal en función del número de Reynolds de partícula y se obtiene . Así ler = 0.0182 J/ cm.s.K.
Una vez estimados los parámetros efectivos de transporte se requirió la ecuación cinética para la combustión de metano sobre MgO. Berg y Järås [6] reportaron una expresión de velocidad basado en el mecanismo de Langmuir-Hinshelwood para la reacción global de oxidación del metano según:
![]()
con una expresión general;
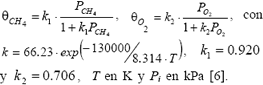
Tales expresiones pueden convertirse en términos de las fracciones molares de entrada de oxígeno y metano y la conversión de metano así:
![]()
La expresión global de velocidad para la combustión del metano es entonces:
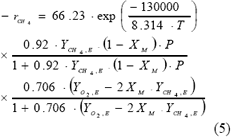
Dada la alta no linealidad de (1), (2) y (3) al introducir la expresión de velocidad (5), se hizo necesaria la utilización de un método numérico como diferencias finitas para resolver de manera simultánea el sistema de ecuaciones; en este se aseguró la estabilidad de la solución tomando incrementos pequeños. Las ecuaciones algebraicas resultantes se resolvieron con la ayuda de una rutina en MatlabTM y las soluciones se reportaron de manera gráfica como perfiles axiales de temperatura, conversión y presión y perfiles radiales de conversión y temperatura.
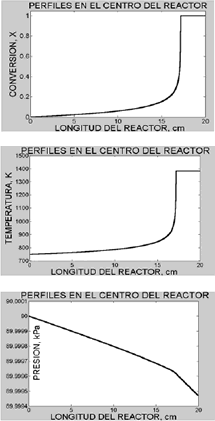
La Figura 1 muestra la solución para una temperatura de entrada al lecho de 475°C (748K) y una presión de 90 kPa. La imagen superior muestra los perfiles de conversión a lo largo del reactor; de manera similar se muestran los perfiles para temperatura y presión en las imágenes del centro e inferior de la figura 1. Puede verse como la conversión total se alcanza con 17 cm de lecho, la temperatura no supera los 1400°C y la caída de presión es solo de 0.001 kPa.
Figura 1. Perfiles axiales de conversión, temperatura y presión en el reactor catalítico.
Figure 1. Axial conversión, temperatura and pressure profiles in the catalytic reactor
Los perfiles radiales resultaron ser planos a lo largo de todo el reactor tanto para la conversión de metano como para la temperatura. En el caso de una temperatura de entrada de 600°C (873K) el modelo muestra que se requiere una longitud de lecho de 2.0 cm para alcanzar la conversión completa, los perfiles radiales siguen siendo planos y la caída de presión poco significativa, menor de 0.1% de la presión de suministro.
3. CONSTRUCCIÓN DE REACTORES
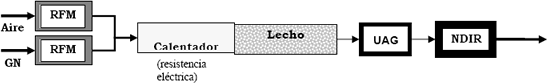
El reactor de acero al carbón se construyó con tubos sin costura calibre 80, diámetro nominal 1½ con bridas soldadas de 150 psi (1.0 MPa) con la configuración mostrada en figura 2; en el tubo de 30 cm de longitud se ubicaron siete termopares tipo R y 4 tomas de muestra. Se equipó con una sección de calentamiento externa por resistencia eléctrica en espiral de 2 kW de 50 cm de largo. Se acopló un controlador de temperatura PID Autonics con un termopar tipo K ubicado justo a la entrada del lecho. Para mantener el flujo y la concentración de los gases alimentados al lecho se incorporó un controlador másico (RFM) con electrónica local marca Omega. El sistema se aisló con una manta cerámica de 5.0 cm de espesor y se montó en un piso de ladrillo refractario de 10 cm de espesor. Para la medición de la concentración de los gases alimentados y productos de la reacción, se instaló una unidad de acondicionamiento de gases (UAG) en serie con un analizador de gases tipo Infrarrojo No Dispersivo (NDIR) marca Maihak, el cual muestra directamente el porcentaje en volumen de oxígeno, metano, monóxido y dióxido de carbono.
Figura 2. Esquema de la configuración del reactor construido en acero al carbón.
Figure 2. Scheme of the constructed carbon steel reactor configuration
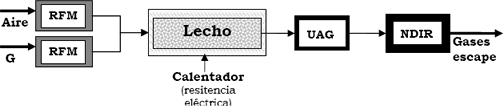
El reactor cerámico se construyó a partir de un tubo silico-aluminoso de 22 cm de longitud y 1.5 cm de diámetro interno con cinco sensores de temperatura tipo R a lo largo del reactor y con un sistema de calentamiento de resistencia eléctrica sobre el lecho empacado, como se muestra en el esquema de la Figura 3. El lecho se dotó con el mismo sistema de control de flujo y medición descrito para el reactor metálico. El reactor cerámico se cubrió con ladrillos refractarios maquinados para tener la forma geométrica precisa del reactor y posteriormente se aisló con 2.5 cm de manta cerámica.
Figura 3. Esquema de la configuración del reactor construido en material cerámico.
Figure 3. Scheme of the constructed ceramic reactor configuration
El material de empaque para el lecho catalítico se preparó formando una suspensión de 500 gramos de MgO comercial en 2.0 litros de agua con agitación durante 1.5 horas, se separó el sedimento después de 12 horas y se secó en estufa a 125°C por 36 horas. El sólido seco se compactó en una matriz de acero, se trituró y tamizó para conformar partículas de 2.00 a 2.36 mm que se calcinaron a 1200°C durante cuatro horas.
4. PRUEBAS DE COMBUSTIÓN
El flujo de mezcla reactiva aire-gas natural de la Guajira (98% CH4, 1.4% N2, 0.24% CO2, 0.25% C2H6, balance C3 - C6) se varió entre 1.0 y 5.0 SLPM y su concentración entre 1.5 y 4.5% de CH4; las relaciones molares O2/CH4 variaron entre 4.0 y 12.0. Se estudió el efecto de la temperatura de precalentamiento de la mezcla de alimentación entre 450°C y 800°C sobre la conversión de metano, la formación de monóxido de carbono y la emisión de hidrocarburos sin quemar. Inicialmente se empacaron los reactores con carburo de silicio (SiC) como material inerte para determinar el efecto de los materiales de construcción del equipo sobre la reacción. El reactor de acero al carbón mostró actividad como promotor de la combustión a temperaturas superiores a 780°C, para tales condiciones en el lecho se alcanzó conversión completa. Sin embargo se presentaron dificultades para separar el efecto catalítico atribuible a los óxidos de hierro de la pared del tubo y al MgO. En el reactor cerámico de 1.5 cm de diámetro interno empacado con SiC se calentó una mezcla de 4.5 SLPM conteniendo 2.54% de metano desde 450°C hasta 850°C en intervalos de 25°C y no se detectó actividad alguna del lecho de SiC ni del material de construcción del reactor cerámico. Se encontró además que para las condiciones manejadas la temperatura predicha para iniciar la combustión con llama es alrededor de 780°C [2] pero experimentalmente no se observó combustión de metano.
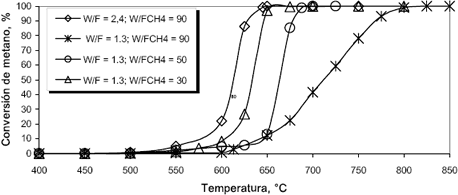
Para las pruebas de actividad, la parte inicial del reactor cerámico se empacó con carburo de silicio (135 mm), posteriormente se empacaron 40 mm del reactor con 6.11 g de MgO y la parte final del reactor (30 mm) con más carburo de silicio. La capacidad del reactor para promover la reacción se reportó como conversión de metano alcanzada en el lecho para diferentes flujos y concentraciones de mezcla en función de la temperatura. La figura 4 muestra la conversión de metano alcanzada a diferentes condiciones de operación en función de la temperatura de precalentamiento de la mezcla reactiva. Las pruebas de actividad se realizaron después de someter el catalizador a la mezcla reaccionante por cerca de 6h a 800°C. El sistema se enfrió a 400°C y se midió la concentración de los productos de reacción a la salida del lecho después de alcanzar una conversión constante con incrementos de temperatura de 50, 25 o 12.5°C según su variación.
Figura 4. Actividad catalítica del MgO para combustión de gas natural con oxigeno en exceso para diferentes relaciones W/F.
Figure 4. MgO catalytic activity in the lean natural gas combustion with different W/F relations.
Puede observarse que para relaciones peso de lecho flujo gaseoso W/F = 2.4 y W/FCH4 = 90 (flujo total y concentración de metano de 2570 mL/min y 2.65% v/v; O2/CH4 = 7.0) el MgO comienza a promover la reacción de combustión del gas natural a 500°C y se alcanza conversión total de CH4 a 650°C. Es importante resaltar que la combustión fue completa dado que no se detectó la presencia de CO. Para probar la capacidad del catalizador se aumentó el flujo global de gas de alimentación en un 80% para ver el efecto de la disminución del tiempo de contacto de los gases con el catalizador a W/F = 1.3 y W/FCH4 = 90 (flujo total y concentración de metano de 4570 mL/min y 1.50% v/v; O2/CH4 = 12.6). Bajo estas condiciones se inicia la reacción a 550°C, 50°C más que en el caso de W/F = 2.4 y W/FCH4 = 90, y la conversión completa de metano se alcanza cuando la temperatura de entrada al reactor es de 800°C, es decir, al aumentar el flujo y disminuir la concentración de metano se aumenta el punto de ignición de la mezcla; en este caso también la combustión mostró ser limpia sin la formación de monóxido de carbono.
El efecto de la concentración de gas natural en la alimentación se estudió a un flujo total constante de 4570 mL/min, correspondiente a W/F = 1.3. Las concentraciones de metano usadas fueron las correspondientes a W/FCH4 = 50 (flujo total 4570 mL/min y concentración de metano de 2.65% v/v; O2/CH4 = 7.0) y W/FCH4 = 30 (flujo total y concentración de metano de 4570 mL/min y 4.50% v/v; O2/CH4 = 4.0). Se observó que a medida que aumentó la concentración de gas natural en la alimentación, la temperatura de entrada necesaria para lograr una conversión completa de CH4 disminuyó desde 800°C hasta 675°C al cambiar la relación W/FCH4 de 90 a 30, siendo de 700°C para un W/FCH4 de 50. Esta disminución de la temperatura podría estar relacionada con la menor relación entre la cantidad de calor desprendido por la reacción y calor perdido hacia el ambiente a medida que se aumenta la cantidad de gas natural quemado en el lecho, pues la reacción de combustión no se da completamente sobre la superficie del catalizador sino que el catalizador hace las veces de iniciador o generador de radicales libres que continúan reaccionando en la fase gaseosa hasta alcanzar una conversión completa, es decir que se tiene una combustión homogénea soportada catalíticamente; ésto se evidenció con el hecho de que la temperatura de salida del lecho catalítico (T4) fue superior a la de entrada (T3) pero inferior a la temperatura de los gases a la salida del reactor (T5). Adicionalmente, dado que la zona final empacada con carburo de silicio es corta (25 mm) y la cantidad de calor liberado en ésta es grande, se puede asegurar que las velocidades de reacción son altas, características de reacciones en fase homogénea entre radicales libres y se esperaría que fuesen mayores que en el caso de la combustión con llama y por lo tanto más estable (Seo et. al., 2000). En ninguno de los casos estudiados se detectó la presencia de CO como producto de la combustión.
La estabilidad térmica del catalizador se evidenció a partir de los análisis de área superficial BET y Difracción de Rayos X (DRX), mediante los cuales se observó que no existieron variaciones significativas en cristalinidad ni área superficial. La composición superficial mostró un contenido importante de hierro y calcio segregados, los cuales podrían actuar como promotores importantes de la actividad del óxido de magnesio. La actividad predicha por el modelo a partir de la ecuación cinética de Berg y Järås (1994), en términos de la longitud de lecho necesaria para alcanzar la conversión total a unas condiciones dadas, es menor que la encontrada experimentalmente lo que puede atribuirse a la contribución de factores como la presencia de hierro y calcio, así mismo la incertidumbre inherente en la estimación de los parámetros efectivos de transporte y la presencia de reacciones rápidas en fase homogénea no tenidas en cuenta en el modelo.
5. CONCLUSIONESLa solución al modelo matemático mediante el método numérico y con la ayuda de MatlabTM permitió realizar análisis de sensibilidad respecto al flujo, composición, temperatura y características geométricas del sistema sobre el desempeño de catalizador y seleccionar las condiciones óptimas de diseño y operación del sistema. Con base en los resultados obtenidos en las pruebas de actividad del MgO para las condiciones bajo las cuales se trabajó, el material muestra un excelente comportamiento para promover la combustión completa de gas natural soportada catalíticamente de manera limpia sin producción de monóxido de carbono y a temperaturas inferiores a 1400°C, valor a partir del cual la velocidad de formación de NOx se hace importante. El catalizador preparado a partir de materias primas comerciales y baratas mostró alta estabilidad térmica puesto que el área superficial y cristalinidad de la muestra se conservaron después de la reacción. Los sistemas diseñados constituyen una herramienta valiosa para la determinación de propiedades de transporte y la enseñanza de los cursos de Ingeniería de las Reacciones dada la facilidad de realizar mediciones en lechos empacados reaccionantes y no reaccionantes con fases fluidas. Por la facilidad de montaje, economía y buen desempeño, el sistema desarrollado para la combustión de gas natural, se considera promisorio para su escalamiento a nivel de aplicaciones comerciales después de la realización de estudios cinéticos y de transporte más profundos.
AGRADECIMIENTOS
Los autores agradecen el apoyo financiero del Comité para el Desarrollo de la Investigación (CODI), a los integrantes de los grupos GIPIMME, Gas-URE, y PFA de la Universidad de Antioquia, por su asistencia técnica. Al Instituto de Investigaciones en Catálisis y Petroquímica (INCAPE), República Argentina.
NOMENCLATURA:
r y Z: direcciones radial y axial en el reactor, m.
Der: difusividad másica efectiva en dirección radial, m2/s
US, USE: velocidad superficial del gas en cualquier punto y en la entrada del reactor, m/s
RM: Velocidad neta de desaparición de metano, kmol/kgcat s
CM, CME: Concentración de metano en cualquier punto y en la entrada del reactor, kmol/m3
XM: Conversión molar de metano, fracción porcentual
rB: densidad global del lecho, kgcat/m3
ler: difusividad térmica efectiva en dirección radial, kJ/m.s.K
Cp: capacidad calorífica de la mezcla, kJ/kmol.K
T: Temperatura, K
(-DHM): Calor de combustión del metano, kJ/kmol
rg: densidad del gas, kg/m3; f: factor de fricción
dP: diámetro equivalente de la partícula, m
e: Porosidad o fracción de vacío del lecho
Re: número de Reynolds, Re = dp.G/m = dprg.US/m
Pe: número de Peclet, Pe = US.dp/Der
REFERENCIAS [ Links ]
[2]. HAYES, R. E.; KOLACZKOWSKI, S. T. Introduction to catalytic combustion, Amsterdam: Gordon and Breach Science Publishers, 1997. [ Links ]
[3]. ARAI, HIROMICHI; FUKUZAWA, HISASHI, Research and development on high temperature catalytic combustion, Catalysis Today, 26, 217-221, 1995. [ Links ]
[4]. SEO, Y. S.; CHO, S. J.; KANG, S. K.; SHIN, H. D. Experimental and numerical studies on combustion characteristics of a catalytically stabilized combustor, Catal. Today, 59, 75-86, 2000. [ Links ]
[5]. FANT, D. B.; JACKSON, G. S.; KARIM, H.; NEWBURRY, D. M.; DUTTA, P.; SMITH, K. O.; DIBBLE, R. W. Status of catalytic combustion R&D for the Department of Energy Advanced Turbine Systems Program, J. Eng. Gas Turbines Power. 122, 293-299, 2000. [ Links ]
[6]. BERG, M.; JÄRÅS, S. Catalytic combustion of methane over magnesium oxide, Applied catalysis A: general, 114, 227-241, 1994 [ Links ]
[7]. BERG, M.; JÄRÅS, Y S. High temperature stable magnesium catalyst for catalytic combustion of methane: a comparison with manganese-substututed barium hexaaluminate, Catal. Today, 26, 223-229, 1995. [ Links ]
[8]. GUNN, D. J., Axial and radial dispersion in fixed beds, Chem. Eng. Sci. 42, 363-370, 1987. [ Links ]
[9]. FOGLER, H. S., Elementos de ingeniería de las reacciones químicas. México: Pearson Educación, 2001. [ Links ]
[10]. NAUMAN, E. B., Chemical reactor design, optimization and scale up. USA: McGraw-Hill, 2002. [ Links ]
[11]. GOPALARATHNAM, C. D.; HOELSCHER, H. E.; LADDHA, G. S. Effective thermal conductivity in packed beds, A.I.C.H.E. Journal, 7, N°2, 249-253, 1961. [ Links ]
[12]. DE WASCH, A. P. Y G. F. FROMENT, Heat transfer in packed beds, Chem. Eng. Sci. 27, 567-576, 1972. [ Links ]
[13]. DIXON, A. G.; CRESSWELL, D. L. Theoretical prediction of effective heat transfer parameters in packed beds, A.I.C.H.E. Journal, 25, N°4, 663-676, 1979. [ Links ]
[14]. FROMENT, G. G.; BISCHOFF, K. B. Chemical Reactor Analysis and Design. USA: John Wiley & Sons. 1990. [ Links ]