Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.74 no.152 Medellín May/Aug. 2007
DISOLUCIÓN DE COBRE EN CIANURACIÓN CONVENCIONAL PROVENIENTE DE FERRITA CÚPRICA
COPPER DISSOLUTION FROM CUPRIC FERRITE IN CONVENTIONAL CYANIDATION
NÉSTOR R. ROJAS R.
Escuela de Metalurgia, Facultad de Ingeniería, Universidad Pedagógica y Tecnológica de Colombia – Tunja nerojasr@yahoo.com.br
M. OSWALDO BUSTAMANTE R.
I. M. CIMEX – Facultad d Minas, Universidad Nacional de Colombia – Sede Medellín, Medellín – Colombia mobustam@unal.edu.co
Recibido para revisar 26 de Marzo de 2006, Aceptado 26 de Septiembre de 2006, Versión final 30 de Mayo de 2007
RESUMEN: Se presentan los resultados de la cianuración, de un residuo proveniente de una lixiviación de una calcina oxidada de metal blanco con alto contenido de cobre (10,6 %) en la forma de ferrita cúprica, con tenores de oro y plata de 38,5 y 1085 g/Ton, respectivamente. Las extracciones de cobre en la cianuraciones son siempre más bajas que las reportadas en la literatura, pues bajo condiciones de extracción completa de oro, el cobre se disuelve tan sólo un 0,36 %, mientras que en las condiciones requeridas para una extracción del 60 % de la plata, se obtuvo una disolución cercana al 5 % de cobre. Es posible que la alta refractariedad del cobre en forma de ferrita cúprica sea la causa de la baja disolución de este metal en cianuro.
PALABRAS CLAVE: Cianuración, contaminación por cobre, ferrita cúprica.
ABSTRACT: This paper presents the principal results of the residue cyanidation from the lixiviation of a white metal oxidized calcine with high content of copper (10,6%) as cupric ferrite. The gold and silver grades of this residue are 38,5 and 1085 g/ton respectively. The copper extraction is lower than those reported on the literature. Under complete gold extraction conditions, the copper extraction is only 0,36% in contrast with 5% obtained from an extraction of 60% of silver. It is possible that the high refractority of copper, as a cupric ferrite, is the cause of the low dissolution of this metal in cyanide.
KEYWORDS: Cyanidation, copper contamination, cupric ferrite.
1. INTRODUCCIÓN
Dentro del desarrollo de nuevas alternativas para el tratamiento de concentrados y ejes de cobre, surge un proceso para el tratamiento de minerales sulfurados de cobre, en donde las emisiones de SO2 y de partículas tóxicas se minimizan substancialmente, mediante la tostación en un lecho fluidizado a 750 – 820 °C de metal blanco de cobre producido en un horno de fusión convencional, para generar una calcina que contiene esencialmente óxido cúprico (CuO), hematita (Fe2O3) y ferrita cúprica (CuOFe2O3).
La calcina es lixiviada en medio sulfato disolviendo el óxido de cobre, seguido de electro-obtención del cobre contenido en la solución. Actualmente, el residuo de lixiviación, que está compuesto principalmente de hematita y ferrita de cobre; así como de los metales nobles (oro y plata), es recirculada al horno de fusión donde la ferrita se descompone formando mate de cobre y los metales preciosos se concentran [9].
Una estrategia para la extracción de oro y plata de este residuo, es el empleo de la cianuración garantizado por su bajo costo y aceptable eficiencia [7]. Sin embargo, se tiene evidencia que la extracción de los metales preciosos mediante cianuración directa, puede convertirse en un proceso complejo como resultado del alto consumo de cianuro reaccionando con el cobre, cuando éste se encuentra a concentraciones mayores al 0,5 % en fases oxidadas de cobre y/o mayor al 1,0 % en fases sulfuradas de cobre [1–5].
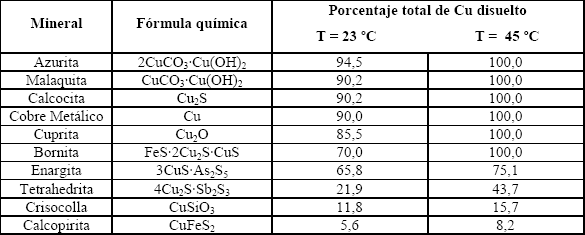
Los minerales oxidados de cobre (azurita, malaquita y cuprita), los sulfuros calcocina y bornita (sulfuros de fácil oxidación), y el cobre metálico, se solubilizan bajo condiciones normales de cianuración, causando un exceso de consumo de cianuro, por la posibilidad de que el cobre sea acomplejado por el cianuro mediante la formación de Cu(CN)2-, Cu(CN)43- y Cu(CN)32-, siendo el este último el complejo más común [1].
En la Tabla 1 se indica la solubilidad de diferentes especies minerales de cobre para muestras sometidas a lixiviación en soluciones cercanas al 0,1 % de NaCN [5].
Tabla 1. Solubilidad de minerales de Cu en soluciones ~0,1 % de NaCN (tomada de Marsden y Ian, 1992)
Table 1. Cooper mineral solubility in ~0,1 % de NaCN solutions (after de Marsden and Ian, 1992 )
Por último, dado que los residuos de lixviación de la calcina presentan cobre principalmente en forma de ferrita cúprica (CuOFe2O3), se evaluó el efecto de la presencia de esta fase en el proceso de cianuración de oro y plata, dado que este proceso se visualiza como una alternativa importante que apoya la sostenibilidad de la minería de cobre.
2. ESTUDIO EXPERIMENTAL
2.1. Caracterización del Material
El material sometido a cianuración es un residuo sólido que proviene de una lixiviación de cobre en medio sulfato, con altos tenores de ferrita de cobre, oro y plata (ver figura 1 y tablas 2 y 3).
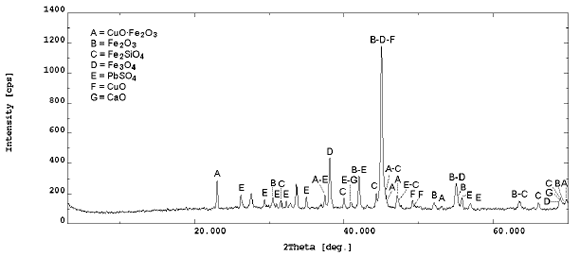
Figura 1. Difracción de RX del residuo
Figure 1. RX difraction of the residue
Tabla 2. Análisis químico del residuo.
Table 2. Chemical composition of the residue

Tabla 3. Análisis cuantitativo del grano Figura 3.
Table 3. Cuantitative analysis of grain Figure 3.
El análisis granulométrico del residuo se muestra en la Figura 2, y se puede observar que todo el material tiene un tamaño menor a 300 micras.
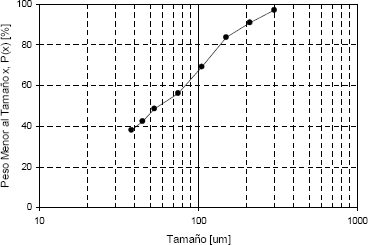
Figura 2. Distribución granulométrica presentada del residuo.
Figure 2. Particles size distribution of the residue
El análisis químico de este material se presenta en la Tabla 2 donde se observa la importante cantidad de cobre y metales preciosos que posee el residuo.
La difracción de rayos X (ver figura 2), muestra que la ferrita cúprica y la fayalita (Fe2SiO4) son las fases mayoritarias, con cantidades apreciables de óxidos de hierro; como hematina (Fe2O3) y magnetita (Fe3O4).
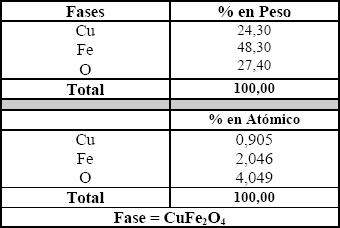
La determinación de las fases presentes se complementó con un análisis por microsonda electrónica. De acuerdo a la figura 3, se corrobora la presencia de ferrita cúprica.

Figura 3. a. Imagen composicional BEI de ferrita cúprica. b Imagen topográfica SEI de ferrita cúprica
Figure 3. a. Compositional BEI image of the cupric ferrite. b. Topographical SEI image of the cupric ferrite
La Tabla 3 muestra un análisis cuantitativo hecho con la microsonda del grano de la Figura 3 y confirma que ésta partícula es de ferrita cúprica.
2.2. Procedimiento Experimental
Se emplearon reactivos de calidad analítica tales como; KCN como lixiviante y AgNO3 para determinar la concentración de cianuro libre. Se utilizó agua destilada en las pruebas para evitar la presencia de iones extraños durante la cianuración.
Cada prueba se realizó con pulpas de 20 % en sólidos. La reacción se realizaba sobre una plancha calefactora, para el control de la temperatura. Se agitaba a una velocidad constante de 300 r.p.m, y el ajuste del pH se realizó mediante la adición de NaOH. La temperatura se determinó para cada prueba, y por último se le agregaba la cantidad de cianuro fijada para el estudio. El reactor se mantenía abierto al ambiente.
Durante la lixiviación se corregía la solución con respecto al pH y a la concentración de cianuro. El potencial de cianuro libre se determinaba titulando con nitrato de plata y el cianuro consumido era adicionado para mantener la concentración constante durante toda la experiencia.
Al finalizar el tiempo establecido para la prueba, la solución de lixiviación recuperada se analizaba por espectrometría de absorción atómica (AAS) para cuantificare tenores de oro, plata y cobre.
3. RESULTADOS Y DISCUSIÓN
Se estudió el efecto del tiempo de lixiviación, la concentración de cianuro, la temperatura de trabajo, el consumo de KCN y además se realizaron pruebas de disolución de ferrita cúprica sintética en condiciones extremas comparadas con la cianuración normal.
3.2.Efecto de la Concentración de Cianuro
En la Figura 4 se observa la relación directa que existe entre la concentración de cianuro y la disolución del cobre presente en el residuo.
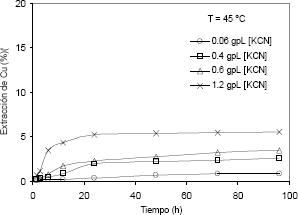
Figura 4. Efecto de la concentración de KCN sobre la extracción de cobre con tiempo (T = 45 °C y pH entre 10,5 y 11).
Figure 4. The effect of the concentration of KCN on the copper extraction with time (T = 45°C and pH between 10,5 – 11).
En la lixiviación con muy baja concentración de cianuro (0,06 g/l de KCN), se observa muy poca disolución de cobre, ya que después de 96 horas de lixiviación, la disolución llega solamente a un 0,87 % de Cu. Sin embargo, con una concentración 20 veces mayor que la anterior (1,2 g/l), la disolución de cobre aumenta a valores de 5,26 % a las 24 horas y se mantiene casi constante durante las siguientes 72 horas, pues solamente aumenta hasta 5,37 %.
En la Figura 5 se muestra el comportamiento de los tres metales en la cianuración, la extracción del cobre se mantiene en valores bajos, hasta 5,26 % para una concentración de KCN alta. Además se observa la influencia negativa que experimenta la disolución del oro a medida que aumenta la concentración de cianuro, pues su extracción disminuye desde 95,07 % para 0,06 g/l de KCN hasta 68,29 % para 1,2 g/l de KCN. Al contrario de lo que ocurre con el oro, la extracción de la plata aumenta desde 0,25 % hasta 28,84 %, para 0,06 g/l de KCN y 1,2 g/l de KCN, respectivamente.
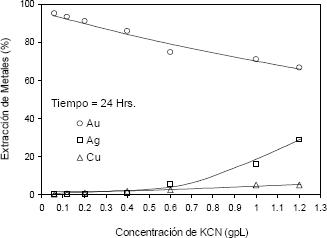
Figura 5. Extracción de metales vs concentración de KCN (pH =10,5, T = 45 ºC y t= 24 horas).
Figure 5. Metal extraction vs KCN concentration (pH = 10,5, T = 45°C and time of 24 hours)
3.2.1. Efecto de la Temperatura
En la Figura 6 se observa la influencia limitada que ejerce la temperatura del sistema en la disolución del cobre con extracciones de 1,77, 1,87 y 2,49 %, para 25, 45 y 65 °C, respectivamente. Es importante destacar que las extracciones alcanzadas para el cobre se encuentran en un intervalo de disolución muy inferior con respecto a los trabajos reportados en la literatura [3,4].
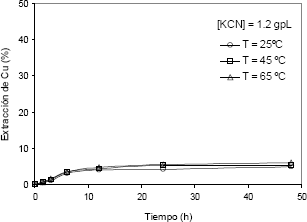
Figura 6. Extracción de cobre vs. tiempo, con tres diferentes valores de T (KCN de 1,2 g/l , pH entre 10,5 y 11)
Figure 6. Copper extraction vs time for three temperatures (1,2 g/l of KCN and pH between 10,5 and 11)
3.3.Consumo de Cianuro
En la Figura 7 se observa una extracción importante de oro y plata para un tiempo de 24 horas, luego del cual la disolución no es muy relevante. Este comportamiento se refleja igualmente en el consumo de KCN, pues en este mismo tiempo de lixiviación el consumo de reactivo fue de 15,25 kg/ton (77,8 % del consumo total), mientras que para toda la prueba fue 19,60 kg/ton.
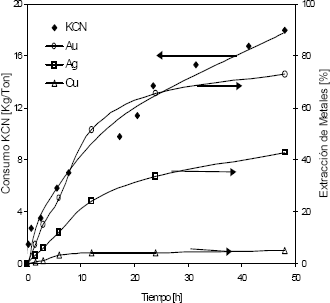
Figura 7. Consumo de cianuro y extracción de metales vs. tiempo (T = 25 ºC, solución de 1,2 g/l de KCN y pH entre 10,5 y 11)
Figure 7. KCN consumption and metal extraction vs. time (T = 25°C, KCN concentration 1,2 g/l and pH between 10,5-11)
En todas las pruebas realizadas la lixiviación del cobre se mantuvo con valores muy bajos de disolución. La respuesta de este metal en el presente sistema de cianuración, es contraria al comportamiento del cobre que reporta toda la literatura [3,4], para el tratamiento de minerales con compuestos cupríferos que contienen metales preciosos, los cuales en el proceso de cianuración llegan incluso a una disolución total de cobre.
Sin embargo, en este caso virtualmente todo el cobre presente en el residuo corresponde a cobre asociado a la ferrita cúprica, lo cual permite indicar que el cobre de la ferrita cúprica es altamente refractario a la disolución con cianuro.
3.4. Cianuración de Ferrita Cúprica
En la Figura 8 se observa claramente la baja disolución de hierro y cobre presentas en la ferrita cúprica en soluciones de cianuro alcalinas, en condiciones extremas para este tipo de lixiviación.
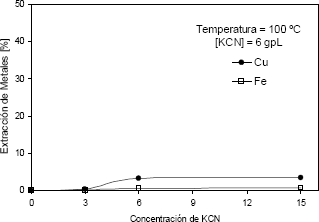
Figura 8. Extracción de Fe y Cu vs. del tiempo de lixiviación, (T = 100 °C, pH de 11,5 y 6 g/l de KCN)
Figure 8. Fe and Cu extraction vs. leaching time (T = 100°C, 6 g/l of KCN and pH = 11,5)
El cobre disuelto en un tiempo de 15 horas fue 3,53 %, mientras que la cantidad de hierro fue solamente un 0,8 %. Por lo tanto, el cobre disuelto lixiviado del residuo de lixiviación es probable que no provenga del cobre que forma la ferrita cúprica, sino que provenga de otros compuestos minoritarios tales como sulfuros de cobre, los cuales se observaron en las pruebas de DRX y microsonda.
4. CONCLUSIONES
Aunque el cobre presente se encuentra en el residuo con un valor promedio de 10,6 %, los valores de extracción obtenidos son más bajos que los reportados en la literatura, en todos los casos. En condiciones para una extracción completa de oro, el cobre se disuelve solamente en un 0,36 %, mientras que en las condiciones requeridas para una extracción del 60 % de la plata, el cobre alcanzó una disolución cercana al 5 %.
La muy baja disolución de cobre en la cianuración realizada en este estudio, se puede atribuir a la alta refractariedad del cobre presente en forma de ferrita cúprica.
El aumento de la temperatura en el sistema de lixiviación es un factor que no altera de forma importante la disolución del cobre dentro del proceso de cianuración, cuando el cobre se encuentre en la forma de ferrita cúprica.
Los valores calculados para el consumo de cianuro, dan niveles 25 % más bajos comparados con los valores reportados en la literatura correspondiente al tratamiento de minerales cupríferos que contienen metales nobles. Este poco consumo de cianuro se debe en gran medida a la baja solubilidad del cobre presente en el residuo.
REFERENCIAS [ Links ] [2]














