Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.74 no.152 Medellín May/Aug. 2007
MEDIDA DE LA BASICIDAD Y POTENCIAL DE OXÍGENO DEL SISTEMA ACERO 1020- SAL 80%V2O5-20%Na2SO4- GAS 1%SO2-99%O2 A 700ºC
BASICITY MEASUREMENT AND OXYGEN POTENTIAL OF 1020 STEEL- 80%V2O5-20%Na2SO4 SALT- 1%SO2-99%O2 GAS AT 700ºC
CUSTODIO VÁSQUEZ
Grupo de Investigaciones en Corrosión, Universidad Industrial de Santander, custodio@uis.edu.co
DARÍO PEÑA
Grupo de Investigaciones en Corrosión, Universidad Industrial de Santander, dtpena@uis.edu.co
Recibido para revisar 02 de Mayo de 2006, aceptado 26 de Septiembre de 2006, versión final 12 de Octubre de 2006
RESUMEN: Se construyeron dos electrodos de referencia para calcular la actividad de oxígeno y de sodio en un sistema compuesto por una sal de 80% V2O5-20% Na2SO4 en peso, una atmósfera de 1%SO2-99%O2 y los aceros AISI304H, 9Cr–1Mo modificado (T91) y 2¼Cr–1Mo (T22) a una temperatura de 700ºC, Los resultados se superpusieron en el diagrama de estabilidad Na-V-S-O a 700°C, indicando que la especie predominante en el fundido fue el NaVO3. Se comprobó que el mecanismo que rige la corrosión en caliente para estos materiales fue el Fluxing.
PALABRAS CLAVE: Fluxing, Sal fundida, T22, T 91, 304H, Basicidad.
ABSTRACT: Two reference electrodes to calculate oxygen and sodium activity were built to be used in an electrochemical system which was conformed by a molten salt of 80% V2O5-20% Na2SO4 in weight, 1%SO2-99%O2 oxidizing atmosphere and AISI 304H, 9Cr-1Mo modified steel and 2 1/4Cr-1Mo at 700°C. Results were superimposed in a stability diagrams of Na-V-S-O at the same temperature, indicating that the NaVO3 was the compound predominating in a molten system. The fluxing mechanism was corroborated for the hot corrosion of these materials.
KEYWORDS: Fluxing, Molten salt, 304H, T22, P91, Basicity.
1. INTRODUCCIÓN
Los materiales metálicos pueden sufrir corrosión acelerada a alta temperatura cuando están en contacto con una película de sal fundida en un ambiente oxidante. Este tipo de corrosión ocurre en los sobrecalentadores y recalentadores de los hornos y se debe a la formación de cenizas durante los procesos de combustión.
Las cenizas tienen una alta concentración de compuestos de vanadio, sodio y azufre, principalmente como complejos de Na2SO4.V2O5 y mezclas de sodio - vanadio. La corrosión de estos sistemas de combustión, es el principal obstáculo en la eficiencia térmica de las plantas que queman combustibles fósiles. Durante la combustión del carbón o del aceite combustible, la mayoría de los compuestos inorgánicos no volátiles forman cenizas, las cuales están compuestas de mezclas de compuestos inorgánicos oxidados, de bajo punto de fusión[1,2,3].
Las impurezas más agresivas son el vanadio y el azufre; el vanadio del combustible se transforma durante el proceso de combustión en V2O5 y el azufre en la ceniza está en forma de sulfatos alcalinos. Esta clase de compuestos (Na2SO4 y V2O5) forman un sistema binario que sufre una reacción eutéctica a temperatura relativamente baja (menor de 600ºC), la cual causa fusión, formando una capa estable de electrolito sobre la superficie del metal. Los compuestos de vanadio formados son muy corrosivos y estables bajo condiciones normales de operación en las calderas.
El ataque corrosivo se acelera cuando los componentes del sistema alcanzan las temperaturas de fusión del depósito salino; el cual ejerce una acción fundente sobre el óxido protector, deteriorándolo por disolución y favoreciendo el transporte de especies oxidantes hacia el metal y de iones metálicos hacia la sal, iniciando así la etapa de propagación o ataque acelerado[4].
Con base en la expectativa de que la solubilidad del complejo de óxidos exhibe solutos con acidez y basicidad individual y con concentraciones dependientes de la basicidad del fundido y tal vez de la presión parcial de oxígeno (PO2), Rapp y Goto[5] propusieron un gradiente de solubilidad negativo como un criterio general para la continuidad del ataque por corrosión en caliente.
La Figura 1 muestra un esquema de este mecanismo de disolución o fluxing, donde se observa que en la interfaz metal-óxido se presenta el desprendimiento de los iones metálicos y su consecuente formación de huecos de electrones. Esto hace que en la interfaz óxido-sal, el desprendimiento y la disolución de la capa protectora sea acelerada, y a medida que avanza hacia el seno de la película de sal fundida, y en cercanía de la interfaz sal-gas, este óxido reprecipita como un óxido poroso no protector. En consecuencia el gradiente de solubilidad del metal es negativo [6].
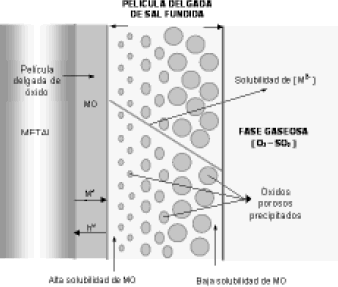
Figura 1. Mecanismo de precipitación del óxido y sus compuestos en la sal fundida.
Figure 1. Mechanism of oxide precipitation and its compounds in a molten salt.
Las reacciones de flujo de la sal incluyen el flujo básico, en el cual el óxido reacciona con el Na2O y se disuelve en la sal como especies aniónicas, y el flujo ácido, en el cual el óxido reacciona con el SO3 y se disuelve como una especie catiónica.
Flujo básico
La teoría propone que la película de óxido protector se disuelve en la sal en el sitio de reacción y el óxido se precipita en algún otro sitio donde la solubilidad local es más baja. La velocidad de oxidación de un metal que sufre corrosión en caliente puede explicar mejor este mecanismo; la Figura 2 muestra esquemáticamente la secuencia de reacción.
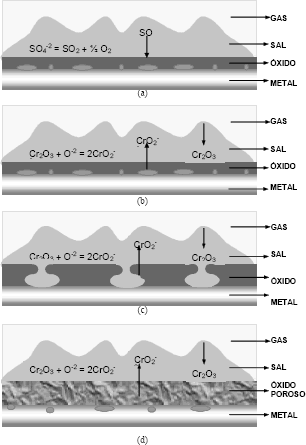
Figura 2. Esquema representativo de un metal afectado por corrosión de sales fundidas a alta temperatura.
Figure 2. Description of metal affected by molten salt corrosion at high temperatures.
Durante el calentamiento, sobre la superficie metálica, se forma una capa delgada de Cr2O3, la cual se cubre por el Na2SO4 mientras éste se funde. La formación continua del óxido disminuye rápidamente la presión parcial del oxígeno en la sal y el potencial del azufre se incrementa promoviendo el transporte a través del óxido y la formación de sulfuros en la interfaz metal-escama, como se describe en la Figura 2a. La fuente de SO2 es la disociación del sulfato [7]:
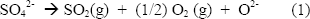
El probable mecanismo es el transporte de moléculas de SO2 a través de los defectos de la capa, tales como microgrietas. La fuente de SO2 es la disociación del ión sulfato de acuerdo a la ecuación 1; como se puede ver, a medida que el SO2 y el O2 son consumidos, la actividad del ión óxido en la sal se incrementa para mantener el equilibrio, provocando que la sal sea más básica.
El incremento en la basicidad será más alto en las áreas donde se forman los sulfuros, es decir, donde el SO2 se consume más rápidamente, y en esas regiones la capa de Cr2O3 reaccionará para formar iones cromato solubles en el fundido, como lo indica la Figura 2B, los cuales difunden hacia la interfaz sal-gas, donde la concentración del ión óxido es baja, reprecipitando como Cr2O3[6].
La disolución del óxido permite que la sal penetre y se difunda a lo largo de la interfaz óxido-metal levantando y quebrando la capa; este rompimiento del óxido, también permite la penetración del oxígeno que actúa como oxidante de los sulfuros, de ese modo se libera azufre que posteriormente penetra en el metal. La Figura 2c muestra este fenómeno.
La regeneración de este proceso produce un óxido de Cr2O3 poroso, similar a una colmena, permitiendo la difusión del azufre y posteriormente la del oxígeno a lo largo de los límites de grano del metal, ver Figura 2d. De esta manera las condiciones establecidas para el flujo básico del Cr2O3 están dadas por la reacción:
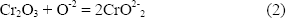
formando iones cromato en la sal fundida, los cuales migran a través de la capa de sal hacia los sitios de potencial de oxígeno más alto, esto es, sitios cercanos a la interfaz sal-gas donde precipitan como Cr2O3, liberando iones oxígeno de acuerdo a:
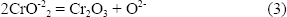
El alto potencial de oxígeno en esta posición hace que la reacción (1) se reverse de tal manera que la actividad del ión óxido o Na2O, llegue a ser demasiado baja para soportar la existencia de los iones complejos.
Flujo ácido
El flujo ácido puede ser subdividido en flujo ácido inducido por la aleación, en el cual, las condiciones de acidez en la sal son determinadas por la disolución de las especies desde la aleación, las cuales reaccionan con el Na2O, y en flujo ácido inducido por el gas, en el cual las condiciones de acidez son establecidas por la interacción con la fase gaseosa[8].
El flujo ácido debido a la aleación, generalmente resulta de la disolución de los óxidos metálicos en el Na2SO4 fundido, es decir, molibdatos, tungstanatos y vanadatos, disminuyendo la concentración del ión óxido en la sal fundida y haciendo que la sal sea mucho más ácida para que de esta forma ocurra la disolución de los óxidos en la sal, por disociación. Después de un período corto de incubación, ocurre una ganancia rápida en peso y de manera acelerada. La capa de óxido formada sobre la superficie durante la reacción es muy porosa y gruesa, con una textura en forma estratificada, que se desprende cuando se enfría a temperatura ambiente.
El ataque ácido inducido por el gas, ocurre cuando la atmósfera contiene presiones parciales de SO3 relativamente altas; bajo estas condiciones, resulta un fundido de baja actividad de Na2O o de ión óxido. Esta forma de corrosión en caliente predomina a bajas temperaturas, entre 600 y
Los diagramas termodinámicos de estabilidad de fases se usan comúnmente para el trazado de un mapa del estado de equilibrio y interpretar la formación de varios productos de corrosión. En estos diagramas la ordenada, log PO2, representa el potencial oxidante, y la abcisa, - log aNa2O, es el parámetro de basicidad para la sal fundida Na2SO4 puro, para la cual se aplica el siguiente equilibrio ácido-base:
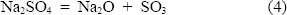
Para las medidas de polarización electroquímica, se usa una celda con tres electrodos, dos de los cuales son sensores de electrolito sólido como electrodos de referencia ión específico: Electrodo de zirconia y electrodo de sílice fundida.
Electrodo de zirconia [10]:
Para medir la actividad del oxígeno se utilizó un electrodo de zirconio, ver figura 3b, compuesto por un tubo de zirconia estabilizada con itrio (Y2O3), cerrado por su extremo, con un alambre de platino en contacto con el tubo en el extremo cerrado, esta descrito por:
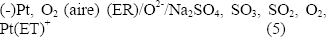
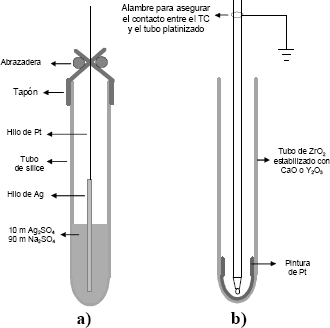
Figura 3. Electrodos de referencia: a) Sensor de sodio, b) Sensor de oxígeno.
Figure 3. Reference electrodes: a) Sodium sensor, b) Oxygen sensor.
La reacción global de celda es:
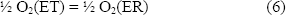
La ecuación de Nernst para la reacción anterior es:
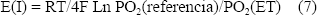
Electrodo de sílice fundida [11]:
La actividad de sodio en el fundido puede ser medida con un electrodo de SiO2 fundido. La celda (Figura 3a), constituida por un alambre de plata inmerso en una solución 0.1Ag2SO4 - 0.9Na2SO4, contenido en un tubo cerrado conductor de Na+ (mullita), se describe por medio de la siguiente representación:
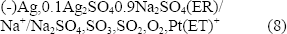
La reacción de media celda es:
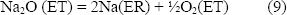
El tubo puede ser de sílice o de mullita, pero se comporta mejor el de sílice fundida, es más estable en Na2SO4 ácido y en la solución salina ácida Na2SO4 – NaVO3. La ecuación de Nernst para la reacción anterior es:
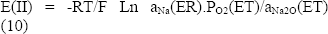
2. METODOLOGÍA EXPERIMENTAL
Se diseñó un horno circular montado verticalmente, con tapa en la parte superior, cuya longitud de calentamiento fue de

Figura 4. Horno-Celda electroquímica para estudios de corrosión en caliente.
Figure 4. Furnace with electrochemical cell for hot corrosion studies.
Cabe anotar que este horno tiene un sistema de refrigeración en la tapa para evitar recalentamientos en los electrodos utilizados como referencia[12].
Las aleaciones utilizadas fueron el acero inoxidable austenítico AISI304H y los aceros inoxidables ferríticos 9Cr – 1 Mo modificado (T91) y 2¼Cr – 1Mo (T22). Las probetas se maquinaron a dimensiones de 9x9x3 mm y se pulieron hasta lija 600. Los bordes de las muestras se suavizaron para asegurar una distribución homogénea del óxido sobre la superficie y evitar la generación de corrosión localizada.
Las micrografías de los aceros se muestran en la figura 5. Los electrodos de referencia de zirconio y Sílice fundida se fabricaron tal y como se mostró en la Figura 3 y su arreglo final se observa en la figura 6.

Figura 5. Microestructuras de los aceros en estado normalizado. a) T91, b) AISI 304H, c) T22.
Figure 5. Microestructures of normalized steels: a) T91, b) AISI 304H, c) T22.
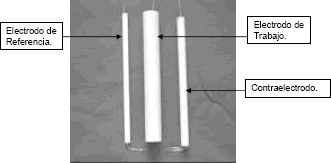
Figura 6. Electrodos de trabajo, referencia y Contraelectrodo.
Figure 6. Electrodes: working, referente and counterelectrode.
Los electrodos de referencia fueron calibrados con respecto a otros electrodos idénticos, cada par de electrodos fue sumergido en un mismo electrolito, donde la diferencia de potencial entre ellos, no debe ser mayor a 3 mV. La diferencia de potencial registrada para cada par de electrodos de referencia fue de 0.43 mV. y de 0.52 mV., respectivamente.
Todos los ensayos se realizaron en un potenciostato GAMRY, el cual se calibró bajo norma ASTM – G5.
La calibración de la celda electroquímica, consistió en el diseño, adecuación y puesta en funcionamiento de los accesorios que se requerían para el desarrollo de cada ensayo: tapa del reactor, termopozo, con su respectiva termocupla, sistema de enfriamiento de la tapa, sistema de entrada y salida de gas, electrodo de trabajo, electrodo de referencia y contraelectrodo.
El horno se llevó a 700ºC, una vez alcanzada esta temperatura, se tomó como el tiempo cero y se inició el monitoreo con los sensores de oxígeno y sodio durante 70 minutos.
3. RESULTADOS
Para la determinación del log PO2 y el -log aNa2O se utilizaron las siguientes ecuaciones a 700ºC:
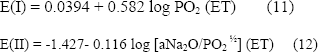
Las diferencias de potencial para cada una de las aleaciones entre un electrodo de platino y los electrodos de zirconia y sílice fundida para el sistema 80% V2O5-20%Na2SO4, en un ambiente gaseoso 1%SO2-99%O2 a la temperatura de
Tabla 1. Valores de las diferencias de potencial para el acero AISI304H utilizando los sensores de oxígeno y sodio a 700ºC.
Table 1. Values of differences of potential for steel AISI304H using the oxygen and sodium sensors at 700ºC.

Tabla 2. Valores de las diferencias de potencial para el acero T91 utilizando los sensores de oxígeno y sodio a
Table 2. Values of differences of potential for steel T91 using the oxygen and sodium sensors at 700ºC.
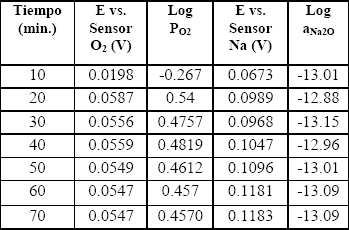
Tabla 3. Valores de las diferencias de potencial para el acero T22 utilizando los sensores de oxígeno y sodio a
Table 3. Values of differences of potential for steel T22 using the oxygen and sodium sensors at
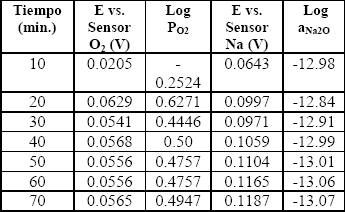
Los valores de la actividad del oxígeno presentan una tendencia a la disminución, para los tres aceros, durante los primeros 70 minutos después de alcanzada la temperatura de
En las figuras 7, 8 y 9 se muestra la química de la sal utilizada superpuesta sobre el diagrama de estabilidad de fases para el sistema Na – S – V – O, identificando la especie dominante para el vanadio, como el NaVO3 a través de la reacción. Los diagrmas fueron realizados a
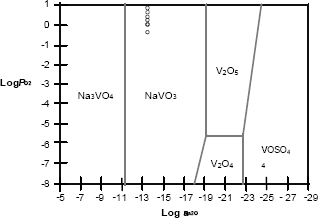
Figura 7. Diagrama de estabilidad de fases para el acero AISI304H.
Figure 7. Stability Diagram of phases for Steel AISI304H.
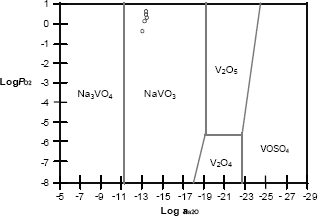
Figura 8. Diagrama de estabilidad de fases para el acero T91.
Figure 8. Stability Diagram of phases for Steel T91.
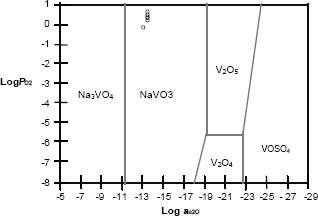
Figura 9. Diagrama de estabilidad de fases para el acero T91.
Figure 9. Stability Diagram of phases for Steel T22.
Este compuesto de sodio vanadio se identificó para las tres aleaciones objeto de estudio.
En las figuras 10 y 11 se presentan los difractógramas para dos muestras de sal, después de realizar el ensayo para los aceros AISI304H y T22 a
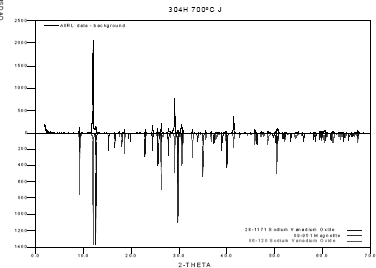
Figura 10. Difracción de rayos X para la sal, 80%V2O5 – 20%Na2SO4, en contacto con el acero AISI304H.
Figure 10. DRX for 80%V2O5 – 20%Na2SO4 salt in contact with Steel AISI304H.
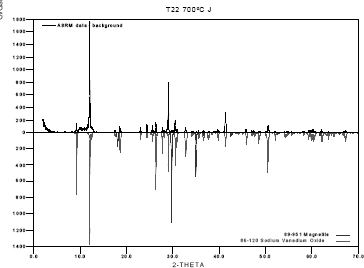
Figura 11. Difracción de rayos X para la sal, 80%V2O5 – 20%Na2SO4, en contacto con el acero T22.
Figure 11. DRX for 80%V2O5 – 20%Na2SO4 salt in contact with Steel T22.
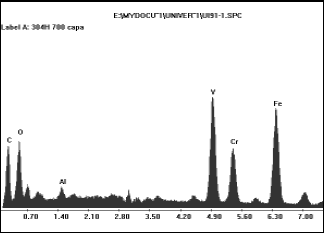
Figura 12. Difracción de rayos X para la capa de oxido formada sobre la superficie metálica de un acero AISI304H a
Figure 12. DRX for oxide layer formed on metallic surface of AISI304H at 700ºC and 3 hours.
De acuerdo con lo anterior, se comprueba la teoría de fluxing, expuesta por Rapp[13] relacionada con la disolución de la capa de óxido en la sal fundida y la posterior reprecipitación del óxido, dando lugar a una capa porosa.
4. CONCLUSIONES
La basicidad del fundido fue aproximadamente constante durante la primera hora de reacción después de haber alcanzado la temperatura de
La disolución de la capa de óxido y posterior reprecipitación de la misma lleva a la formación de una capa de óxido espesa porosa, que contiene óxidos y sal, cambiando parcialmente la conductividad iónica a conductividad electrónica.
El mecanismo de corrosión por sales fundidas consiste posiblemente, de acuerdo con los resultados de este trabajo, la disolución y posterior reprecipitación de los óxidos Fe2O3 y Cr2O3, los cuales por efecto sinergístico conllevan a una velocidad de corrosión muy alta.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Profesor Clemente Retamoso Rodríguez (QEPD) y a los Ingenieros José L. Tristancho y Huber Anaya, al Grupo de Investigaciones en Corrosión de la Universidad Industrial de Santander, a ECOPETROL-ICP, por su valioso aporte científico, y a COLCIENCIAS, por la financiación del Proyecto Evaluación de la corrosión en caliente en aleaciones, generada por productos de combustión, utilizando métodos electroquímicos, Código 1102-06-12471.
BIBLIOGRAFÍA [ Links ] [2]














