Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.75 no.154 Medellín Jan./Mar. 2008
CARACTERIZACIÓN MINERALÓGICA DE LOS PRODUCTOS DE OXIDACIÓN DEL SISTEMA PIRITA-ESFALERITA POR BACTERIAS NATIVAS OXIDANTES DE Fe
MINERALOGICAL CHARACTERIZATION OF OXIDATION PRODUCTOS IN A PYRITE-SPHALERITE SYSTEM USING INDIGENOUS Fe OXIDIZING BACTERIA
DIONI MABEL ZAPATA AGUIRRE
Grupo de Mineralogía Aplicada, Facultad de Minas, Universidad Nacional de Colombia, Sede Medellín
DIANA MARCELA OSSA HENAO
Universidad Estadual de Campinas, UNICAMP, Brasil
MARCO ANTONIO MÁRQUEZ GODOY
Laboratorio de Biomineralogía, Universidad Nacional de Colombia, Sede Medellín, mmarquez@unalmed.edu.co
Recibido para revisar Marzo 16 de 2007, aceptado Septiembre 09 de 2007, versión final Septiembre 16 de 2007
RESUMEN: La biooxidación de esfalerita y pirita fue evaluada a nivel de shaker utilizando microorganismos acidófilos compatibles con Acidithiobacillus ferrooxidans, a diferentes porcentajes de pulpa y temperatura de 35ºC. Análisis por SEM evidenciaron morfologías y mecanismos de oxidación diferentes para los dos sulfuros. La esfalerita presenta una capa de azufre elemental que bordea núcleos remanentes, los cuales a su vez muestran golfos de corrosión, evidenciando la actividad oxidante del medio. Las capas de azufre muestran morfologías típicas de precipitación a partir de soluciones generadas por la lixiviación de los sulfuros presentes. De otro lado, en la pirita la oxidación se ve reflejada en los golfos y pits de corrosión, sin que se observen películas de azufre. Además del azufre elemental, el principal producto generado durante el proceso fue jarosita. La secuencia de formación de estas fases, así como la oxidación preferencial de la esfalerita sobre la pirita fueron evidenciadas.
PALABRAS CLAVE: Biolixiviación de Zn, biooxidación de esfalerita, mineralogía de procesos, Acidithiobacillus ferrooxidans
ABSTRACT: A biooxidation study of sphalerite and pyrite concentrates was evaluated in a shaker experiments using an acidofile native strain, compatible with Acidithiobacillus ferrooxidans. The experiments were done to 35°C, using different proportions of pulp. Scanning electron microscopy (SEM) analysis showing grain morphologies that make evident different mechanisms of oxidation for both sulfides. After oxidation, the sphalerite looks an elemental sulphur layer, with core residues displaying embayment corrosion, indicating an active oxidizer environment. The sulphur layers showing concentrically banding, indicating several pulses of deposition. On the other hand, pyrite crystals displayed embayments and pits of corrosion, without sulphur layers. The principal products of the oxidations of both sulfides were, besides elemental sulphur, jarosite and another iron sulphate. The sequential formation of this mineral phases and the preferential oxidation of sphalerite more than pyrite was made evident.
KEYWORDS: Zn biolixiviation, sphalerite biooxidation, process mineralogy, Acidithiobacillus ferrooxidans
1. INTRODUCCIÓN
Los procesos de biooxidación y biolixiviación de sulfuros son actualmente utilizados para el pretratamiento de menas refractarias de oro, así como para la recuperación de metales de interés económico como Cu, U, Co y Zn [1]. La biolixiviación de Zn, utilizando microorganismos acidófilos, ha sido ampliamente estudiada, sin embargo, es evidente que aun no existe un acuerdo sobre los mecanismos de biooxidación de la esfalerita durante el proceso de biolixiviación del Zn, ni una teoría aceptada que explique dicho proceso [2]. Para el sector minero es importante, tanto desde el punto de vista económico como ambiental el conocimiento de las diferentes fases que se forman durante estos procesos y entender la posible influencia que tienen los productos insolubles formados en la superficie, tales como azufre elemental, sobre la velocidad de disolución, ya que se podrían desarrollar modelos más completos y eficientes de cinéticas de disolución de sulfuros [3] y mejorar en gran parte el diseño y operación de plantas de lixiviación bacteriana [4]. El principal objetivo de esta publicación es analizar los productos formados durante el proceso de biooxidación del sistema pirita-esfalerita y examinar las diferencias en la cinética del proceso y en la actividad de las bacterias, desde el punto de vista de los cambios en la morfología, texturas y composición química de los productos finales, al someter a las bacterias a un proceso de adaptación con diferentes porcentajes de pulpa.
2. MATERIALES Y MÉTODOS
El concentrado de esfalerita y pirita utilizado para el proceso de biooxidación, fue tomado de la parte alta del distrito minero de Marmato (Colombia). Este concentrado se obtuvo por medio de una separación manual y fue molido a un tamaño de partícula pasante malla 150 (Tyler).
Fueron utilizadas cepas nativas oxidantes de hierro, compatibles con el género Acidithiobacillus ferrooxidans, las cuales fueron aisladas dentro del desarrollo del proyecto de investigación Colciencias-UN Recuperación de Zn mediante lixiviación bacteriana de esfalerita proveniente de los residuos de la explotación aurífera en el distrito minero de Marmato, Caldas. Los experimentos de biooxidación fueron llevados a cabo en erlenmeyers de 500ml, utilizando un volumen final de 100ml, conteniendo un 10% (v/v) de inóculo y 5ml de sulfato ferroso al 30% en un medio 9K.
Estos ensayos fueron realizados como parte del proceso progresivo de adaptación de las bacterias a este tipo de minerales, el cual inició con un porcentaje de pulpa de 2.5% y se llevó a cabo por un tiempo de 16 días. Posteriormente los microorganismos fueron llevados a un medio con 5% de pulpa durante un tiempo de 45 días y finalmente se llevaron a un porcentaje de pulpa del 8% durante 55 días. En cada una de las condiciones las proporciones de esfalerita y pirita fueron 1:1. Las muestras se incubaron a 35°C, a una agitación constante de 180 +/- 10 rpm.
Periódicamente se hizo un monitoreo de la cinética del proceso mediante las medidas de pH, Eh y concentración de Zn en solución (resultados no mostrados). Al final de cada proceso se filtró la solución para recuperar los sólidos residuales, para así analizarlas posteriormente por medio de microscopía electrónica de barrido (SEM), modo de observación BSE (electrones retroproyectados). Para los análisis con SEM/EDX, se elaboraron secciones pulidas de las muestras, las cuales fueron metalizadas con grafito y analizadas microquímicamente utilizando un detector EDX, con un voltaje de aceleración de 25kV y un tiempo de colecta de 120 segundos.
3. RESULTADOS Y DISCUSIÓN
Con base en las observaciones de secciones delgadas pulidas, mediante el uso de microscopio de luz plana polarizada, modo de operación luz reflejada, se pudo constatar que en los concentrados la esfalerita y la pirita se presentaron como constituyentes mayores (>95%), acompañadas por proporciones menores de otros sulfuros como calcopirita, galena y tetraedrita, así como trazas de arsenopirita y pirrotita. Los cristales de esfalerita presentaron finas inclusiones de calcopirita, principalmente en forma de pequeñas gotículas (< 60μm), mostrando una textura disease, así como finas lamelas de exsolución; adicionalmente fue posible observar finas inclusiones de galena y en menor proporción de tetraedrita, como inclusiones de cristales anedrales y algunas veces en forma de lamelas. Dentro de los minerales de ganga detectó como componente mayor cuarzo, además de microclina, plagioclasa y esporádicamente calcita, rutilo y clorita.
A partir de los análisis microquímicos, se pudo constatar que el Fe en la esfalerita varía entre 6 y 12Wt%. El contenido de Cd varió entre 0.4At% y 0.65At%, mientras que el Mn mostró proporciones máximas de 1.8At%. Algunos análisis microquímicos en pirita evidenciaron la
presencia de contenidos de As en solución sólida (0.77At%), mientras que la galena se caracterizó por presentar cantidades considerables de plata en su estructura, variando entre 5 y 16Wt%.
Por medio de los análisis realizados con SEM/EDX se puedo ver que los productos de la oxidación bacteriana para los tres porcentajes de pulpa utilizados es similar, siendo principalmente jarosita, azufre elemental y sulfato de hierro, estando las principales diferencias marcadas por la proporción relativa entre las fases presentes, su morfología y texturas.
En las muestras con 2.5% de pulpa se pudo observar la presencia de pequeños granos de jarosita aislados (Figura 1a), siendo evidente en algunas partes que éstos empiezan a unirse para formar aglomerados; también se observó la formación de jarosita de hábito acicular (Figura 1a) y aglomerados de sulfato de hierro (Figura 1b).

Figura 1. a) Jarosita (Ja) con hábito acicular así como en forma de pequeños agregados aislados. b) Aglomerado de sulfatos de hierro (Sulf) y cristales de pirita (Py) sin reaccionar.
Figure 1. a) Jarosite (Ja) with acicular habits and small agglomerates. b) Iron sulfate agglomerates (Sulf) and pyrite crystals (Py) without reaction.
La esfalerita típicamente se presenta rodeada por una capa de azufre elemental, la cual llega a alcanzar hasta 100µm, muchas veces recubierta a su vez por una película más fina de sulfato de hierro como se puede observar en la Figura 2a. De otro lado, los cristales de pirita sólo se encuentran en ocasiones rodeados por una delgada capa (~1µm) de sulfato de hierro (Figura 2b), siendo que en ocasiones fue posible observar que algunos granos muestran un bajo grado de oxidación, evidenciado por la presencia de golfos de corrosión.
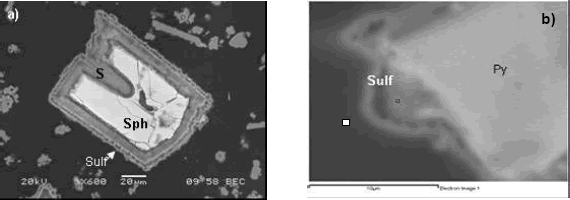
Figura 2. a) Imagen SEM/BSE mostrando núcleo de esfalerita (Sph) oxidada con golfos de corrosión, rodeada por una capa de S elemental, recubierta a su vez por una película de sulfato de hierro (Sulf) hacia el borde más externo. b) Cristal de pirita (Py) rodeado por una capa delgada de sulfato de hierro (Sulf).
Figure 2. SEM/BSE image. Sulfur layer (S) and iron sulphate (Sulf) around sphalerite nuclei oxidized. b) Pyrite crystal (Py) with a thin layer of iron sulphate (Sulf) around.
En los ensayos utilizando 5% y 8%, las muestras biooxidadas presentaron características similares, encontrándose una proporción de jarosita y sulfato de hierro mucho mayor, en comparación con la muestra a 2,5% de pulpa, así como aglomerados de tamaños mayores, lo cual se considera una consecuencia lógica si se tiene en cuenta que el porcentaje de sustrato disponible para lixiviar es mayor, al igual que el tiempo de residencia, además de un tiempo de adaptación mayor para las bacterias, traduciéndose esto en una mayor eficiencia en el proceso.
Igualmente, las capas de azufre elemental formadas alrededor de los cristales de esfalerita se presentaron en mayores espesores, mostrando texturas claras que evidenciaron un proceso de precipitación (Figura 3), las cuales al parecer fueron generadas en varios pulsos de depositación, evidenciados por su textura frecuentemente bandeada (Figura 3b). De otro lado, en estas muestras se observaron relaciones de intercrecimiento que muestran claramente una depositación de la jarosita posterior a la formación de las capas de azufre (Figura 4), donde los granos de esfalerita con películas de S0 se observan aglomerados por masas de jarosita.
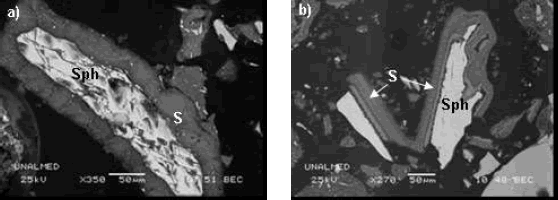
Figura 3. a) y b) Capas de azufre mostrando texturas de depositación concéntrica y en varios eventos (bandeadas).
Figure 3. Sulfur layers showing concentric textures.

Figura 4. Cristales de esfalerita con una capa de azufre elemental (S0), aglomerados por precipitados de jarosita, indicando una secuencia deposicional.
Figure 4. Sphalerite crystals with sulfur layer around and enveloped by jarosite precipitates.
En general las imágenes muestran una oxidación activa y preferencial de la esfalerita en relación a la pirita, pues esta última siempre se encontró en mayores proporciones al final del proceso, mostrando golfos de corrosión que indican una oxidación inicial de este sulfuro, situación que era de esperarse, pues en una mezcla de diferentes sulfuros en donde se forman pares galvánicos, las bacterias preferencialmente oxidarán aquellos de menor potencial de electrodo, siendo este el caso de la esfalerita para este sistema [5]. De otro lado, se observaron algunos granos de pirita con películas finas de azufre elemental y sulfato de hierro (Figura 1b), lo cual también podría estar influyen como inhibidor de su oxidación. La formación de capas de azufre elemental durante el proceso de oxidación de la esfalerita ha sido reportada por varios autores [6,7,2] señalando que su presencia tiene gran influencia en la cinética del proceso de lixiviación del Zn.
Para este caso, las muestras con 55 días de oxidación aún presentaron núcleos de esfalerita sin reaccionar, evidenciando una inhibición en el proceso atribuible a este tipo de productos. Datos sobre concentración de Zn en solución analizados para estos ensayos (resultados no mostrados) muestran que a pesar de la presencia del azufre elemental, se alcanzaron concentraciones de hasta 50.000ppm Zn en solución, lo que puede sugerir que, aun en presencia de estas películas, se puede estar dando difusión del hierro férrico en solución hacia la superficie de la esfalerita, oxidándola.
Aunque estas capas son relativamente gruesas, las imágenes en SEM muestran que éstas suelen ser porosas y en algunos casos no envuelven totalmente los cristales de esfalerita, dejando algunas partes expuestas al medio lixiviante (Figura 3b). De otro lado, aunque A. ferrooxidans tiene la habilidad de disolver azufre elemental, la velocidad de disolución y precipitación del azufre es más grande que la disolución, además de que su afinidad para oxidar compuestos reducidos de azufre, es menor, por lo que una combinación con microorganismos especializados en la oxidación este tipo de compuestos, tales como Acidithiobacillus thiooxidans, podría mejorar la cinética al eliminar estas capas de azufre.
Deveci et al. [8] también atribuyó la disminución de la velocidad de lixiviación de Zn a la abundante precipitación de hierro férrico en la forma de jarosita dentro del sistema, lo cual podría llevar a la finalización del proceso de lixiviación al formarse una capa protectora sobre la superficie del mineral; sin embargo, en este trabajo se observó que la formación de jarosita se dio principalmente como agregados y no formando capas sobre la superficie de la esfalerita.
4. CONCLUSIONES
Durante el proceso de biooxidación del sistema esfalerita-pirita y a partir de las observaciones microscópicas de los productos de oxidación se evidenció la formación de capas de azufre elemental alrededor de los granos de esfalerita, capas que presentan una textura frecuentemente bandeada, evidenciando una depositación posiblemente en varios eventos. A pesar de la presencia de estas películas, se alcanzaron concentraciones de hasta 50.000ppm Zn en solución, lo que sugiere que, aun en presencia de éstas, se está dando difusión del hierro férrico en solución hacia la superficie de la esfalerita. En general las imágenes muestran una oxidación activa y preferencial de la esfalerita en relación a la pirita, pues esta última siempre se encontró en mayores proporciones al final del proceso y su oxidación se ve reflejada en los golfos y pits de corrosión, sin que se observen películas de azufre a su alrededor.
Las relaciones de intercrecimiento muestran claramente una depositación de la jarosita posterior a la formación de las capas de azufre, donde los granos de esfalerita con películas de S0 se observan rodeadas por masas de jarosita.
Con el fin de mejorar la cinética del proceso es importante establecer el tiempo y condiciones bajo las cuales productos como el azufre elemental y la jarosita empiezan a depositarse sobre la superficie de la esfalerita, para que éste sea removido y evitar la inhibición de la lixiviación de Zn.
Para esto, se deben controlar parámetros como la acidez del medio, con el fin de privilegiar la precipitación de jarosita hacia el final del proceso, permitiendo altas concentraciones de Fe3+ en solución, el cual es bien conocido como el principal agente oxidante en este tipo de procesos, y evitar la formación de películas de precipitados sobre los minerales a ser oxidados.
5. AGRADECIMIENTOS
COLCIENCIAS y su Programa Nacional de Biotecnología por su apoyo incondicional a la investigación y la financiación de este proyecto. A los laboratorios de Microscopía Avanzada y Biomineralogía de la Universidad Nacional de Colombia-Sede Medellín. Al municipio de Marmato, especialmente a los propietarios y trabajadores de las minas San Antonio, El Patacón, El Corozo y La Ochoa, por su apoyo incondicional.
REFERENCIAS
[1] RAWLINGS, D. Characteristics and adaptability of iron- and sulfur-oxidizing microorganisms used for the recovery of metals from minerals and their concentrates. Microbial Cell Factories, 4 (13), 112-135. 2005. [ Links ]
[2] RODRÍGUEZ, Y., BALLESTER, A., BLÁZQUEZ, M. L., GONZÁLEZ, F., and MUÑOZ, J. A. New information on the sphalerite bioleaching mechanism at low and high temperature. Hydrometallurgy 71, 57–66. 2003. [ Links ]
[3] MCGUIRE, M., EDWARDS, K., BANFIELD, J., and HAMERS, R. Kinetics, surface chemistry, and structural evolution of microbially mediated sulfide mineral dissolution. Geochemica et Cosmochimica Acta 65(8), 1243-1258. 2001. [ Links ]
[4] WEISENER, C., SMART, R., and GERSON, A. Kinetics and mechanisms of the leaching of low Fe sphalerite. Geochimica et Cosmochimica Acta 67(5), 823-830. 2003. [ Links ]
[5] KARAVAIKO, G., ROSSI, G., AGATE, A. D., GROUDEV, S. N. ANDA AVAKYAN. Z. Biogeotechnology of metals Manual. Centre for international projects. Moscow. 1988. [ Links ]
[6] SHI, S AND FANG, Z. Bioleaching of marmatite flotation concentrate by Acidithiobacillus ferrooxidans. Hydrometallurgy 75 (1-4), 1-10. 2004. [ Links ]
[7] GARCÍA, O., BIGHAM, J. and TUOVINEN O. Sphalerite oxidation by Thiobacillus ferrooxidans and Thiobacillus thiooxidans. Can. J. Microbiol. 41, 578-584. 1995. [ Links ]
[8] DEVECI, H., AKCIL, A., and ALP, I. Bioleaching of complex zinc sulphides using mesophilic and thermophilic bacteria: comparative importance of pH and iron. Hydrometallurgy 73, 293–303. 2004. [ Links ]














