Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
DYNA
versión impresa ISSN 0012-7353versión On-line ISSN 2346-2183
Dyna rev.fac.nac.minas v.75 n.154 Medellín ene./mar. 2008
PRODUCCIÓN BIOLÓGICA DE HIDRÓGENO: UNA APROXIMACIÓN AL ESTADO DEL ARTE
BIOLOGICAL PRODUCTION OF HYDROGEN: A LITERATURE SURVEY
ANDREA BEDOYA
Estudiante Ingeniería Biológica, Universidad Nacional de Colombia, Sede Medellín, abedoya@unal.edu.co
JUAN CAMILO CASTRILLÓN
Estudiante Ingeniería Biológica, Universidad Nacional de Colombia, Sede Medellín, jccastr0@unal.edu.co
JUAN ESTEBAN RAMÍREZ
Estudiante Ingeniería Biológica, Universidad Nacional de Colombia, Sede Medellín, jeramir3@unal.edu.co
JUAN ESTEBAN VÁSQUEZ
Estudiante Ingeniería Biológica, Universidad Nacional de Colombia, Sede Medellín, jevasque@unal.edu.co
MARIO ARIAS ZABALA
Profesor Asociado, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Medellín, marioari@unal.ed.co
Recibido para revisar Julio 27 de 2007, aceptado Octubre 29 de 2007, versión final Noviembre 04 de 2007
RESUMEN: En este documento se presenta una revisión de información obtenida de la literatura sobre la producción de biohidrógeno, describiendo los fundamentos básicos de los diferentes sistemas de producción biológica, con especial énfasis en la fermentación oscura, la cual ha sido reportada como uno de los métodos más eficientes y viables de producción de hidrógeno a partir de materiales de desecho. Se describe el uso de diversos microorganismos y la manipulación de diferentes variables de proceso para obtener las condiciones que optimicen la producción de hidrógeno. Además, se hace un recuento de los métodos desarrollados para el mejoramiento de la producción y purificación del hidrógeno.
PALABRAS CLAVE: Biohidrógeno, Fermentación, Materiales de desecho, Metabolismo de hidrógeno.
ABSTRACT: This review compiles the information from many papers about the biohydrogen production. The basic fundamentals of different biological production systems are described. Special emphasis is given to the dark fermentation, reported as one of the more efficient and viable method of hydrogen production from waste materials. The use of diverse microorganisms and manipulation of some process variables are described to obtain the maximum hydrogen production. In addition, an account of the methods developed for the purification and improvement of production is presented.
KEYWORDS: Biohydrogen, Fermentation, Waste materials, Hydrogen metabolism.
1. INTRODUCCIÓN
Las necesidades energéticas mundiales crecen exponencialmente; sin embargo, las reservas actuales de combustibles fósiles se agotan vertiginosamente, lo que ha llevado a explorar nuevas fuentes energéticas alternativas y renovables.
Además, un tema inquietante a nivel mundial es la creciente contaminación ambiental que está estrechamente ligada con la utilización de hidrocarburos que causan gran parte del calentamiento global por acumulación de CO2 en la atmósfera y gases como nitruros, sulfuros y material particulado que deterioran la salud y los ecosistemas. Debido a esto, en los últimos años se ha volcado la atención al hidrógeno, por ser un combustible limpio y renovable, el cual posee un alto rendimiento energético (122 KJ/g, 2.75 veces más alto que los combustibles hidro-carbonados), siendo el agua el único producto resultante [Han y Shin, 2004; Claasen y otros, 2005; Kapdan y Kargi, 2006]. La demanda de hidrógeno no es exclusiva como fuente de energía, ya que es ampliamente utilizado en las industrias química, de alimentos y en la producción de derivados electrónicos, entre otros, lo que genera una creciente necesidad de producir hidrógeno de una manera sostenible y económicamente viable. Se ha reportado una demanda de más de 50 millones de toneladas anuales [Kapdan y Kargi, 2006], con un crecimiento de más del 10 % anual.
Los métodos de producción actuales no son lo suficientemente eficientes y económicos para suplir las necesidades mundiales de hidrógeno. La obtención convencional se caracteriza por los altos costos energéticos del proceso; entre estos métodos están: oxidación parcial no catalítica de combustibles, vapor reformante de metano, procesos de membrana, oxidación selectiva de metano, deshidrogenación oxidativa y procesos electroquímicos [Dolgykh y otros, 2006; Ni y otros, 2006]. Sin embargo, los anteriores métodos no son los únicos; en los últimos años se ha planteado una novedosa forma de obtener hidrógeno, la cual es conocida como tecnología verde y no es más que su producción biológica, resultante de la conversión de compuestos por diversas especies celulares. Esta biotecnología incluye: biofotólisis directa, biofotólisis indirecta, reacción de intercambio gaseoso (water-shift-reaction), fermentación oscura y foto-fermentación [Reith y otros, 2003; Kovács y otros, 2004].
El objetivo del presente documento es describir los adelantos en la producción biológica de hidrógeno a partir de diversas fuentes de sustratos, inóculos, pretratamientos, modos y condiciones de operación del bioproceso, así como describir las principales perspectivas metodológicas para el mejoramiento de su producción.
2. BIOQUÍMICA DE LA PRODUCCIÓN DE BIOHIDRÓGENO
El entendimiento de los fundamentos moleculares de la producción de hidrógeno es fundamental para su investigación aplicada. La producción biológica de hidrógeno se debe principalmente a la presencia en las células de enzimas como la hidrogenasa y la nitrogenasa.
La hidrogenasa está ampliamente distribuida en los microorganismos anaeróbicos. Ésta tiene diversos orígenes filogenéticos y produce el hidrógeno tanto irreversible como reversiblemente, dependiendo de las condiciones medioambientales en las que se encuentre, siendo reversible sólo en condiciones de anaerobiosis estricta [Vignais y otros, 2006].Esta enzima se ha clasificado en tres grupos principales: Fe-hidrogenasa, Ni-Fe-hidrogenasa e hidrogenasa libre de metales [Franchi y otros, 2004; Dutta y otros, 2005; Gutekunst y otros, 2006]. La Fe-hidrogenasa, una de las más conocidas, tiene como función remover los equivalentes (H+) excesivos en los anaerobios estrictos y puede ser inhibida por la presencia de oxígeno o por altas concentraciones de su producto hidrógeno. Se sabe que la reacción catalizada por la hidrogenasa tiene la forma:
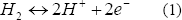
La nitrogenasa está presente en gran cantidad de microorganismos fijadores de nitrógeno, puede producir hidrógeno en una reacción irreversible de forma continua (Ec. (2)), incluso con saturación de producto (atmósfera al 100% H2). Esta enzima es empleada para reducir el N2 a NH3; sin embargo, cuando hay ausencia de N2, reduce los H+ a hidrógeno consumiendo 4 moles de ATP. Se ha encontrado que además del N2, el O2 y el NH4+ pueden inhibirla [Kovács y otros, 2004; Kovács y otros, 2006].
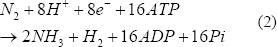
Se han realizado numerosos estudios a nivel molecular con estas enzimas para el mejoramiento de la producción de hidrógeno. Además, se han llevado a cabo estudios estequiométricos en diversos microorganismos, con el fin de aclarar las vías metabólicas utilizadas en la producción de hidrógeno. Es común el estudio en especies del género Clostridium para determinar los rendimientos máximos teóricos de la conversión de glucosa en hidrógeno en condiciones anaerobias.
En la Figura 1 se muestran dos de las posibles rutas metabólicas del hidrógeno para Clostridium butyricum. Una de estas rutas es el rompimiento del piruvato en CO2 y H2, el cual es catalizado por la enzima piruvato ferredoxin- óxido-reductasa. En esta ruta una parte de los electrones es transferida a protones para producir hidrógeno y el resto a NAD+ para generar NADH2; luego este NADH2, y el generado en la glucólisis, es usado en la segunda ruta para producir hidrógeno por medio de la hidrogenasa [Chen y otros, 2006].
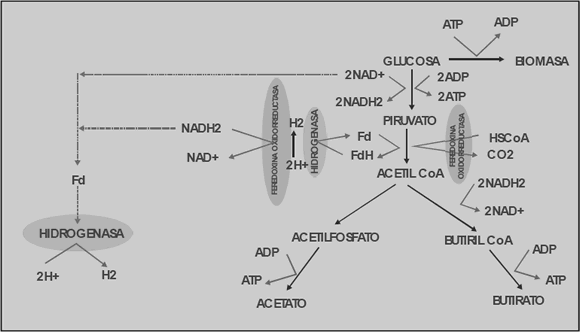
Figura 1. Ruta metabólica del hidrógeno en Clostridium butyricum [Chen y otros, 2006]
Figure 1. Clostridium butyricum hydrogen metabolic pathway [Chen et al., 2006]
Considerando la Figura 1, y realizando un análisis estequiométrico, se llega a lo siguiente:
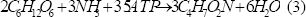
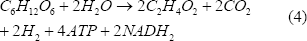
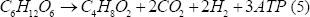
Las ecuaciones (3), (4) y (5) representan la formación de biomasa, acetato y butirato, respectivamente. Este tipo de estudios han demostrado que la vía del acetato permite un mayor rendimiento de hidrógeno que la del butirato, y se ha encontrado que potenciar esta ruta metabólica mejora considerablemente su producción [Chen y otros, 2006].
También se han hecho estudios sobre Klebsiella pneumonia, un microorganismo anaerobio facultativo capaz de producir hidrógeno en cantidades significativas involucrando en su metabolismo tanto la hidrogenasa como la nitrogenasa. Las posibles rutas metabólicas para la producción de hidrógeno en Klebsiella pneumoniae a partir de glucosa se pueden observar en la Figura 2. En estas rutas el rompimiento del acetil-CoA es catalizado por dos enzimas llamadas piruvato-formiato-liasa y piruvato-deshidrogenasa. En la primera ruta, una parte del piruvato, catalizado por la enzima piruvato formato-liasa, produce ácido fórmico; luego la enzima formiato-hidrogenoliasa rompe este ácido para producir hidrógeno. En la segunda ruta, los electrones generados en el rompimiento del piruvato catalizado por la piruvato deshidrogenasa son transferidos a la ferredoxina y luego a H+ para generar hidrógeno por medio de la hidrogenasa y el resto de los electrones son transferidos a NAD+ para producir NADH2. En la última ruta, una porción del NADH2 es transferido a la nitrogenasa para generar hidrógeno y el resto es oxidado por el oxígeno para sintetizar ATP a través de la cadena respiratoria [Chen y otros, 2006].
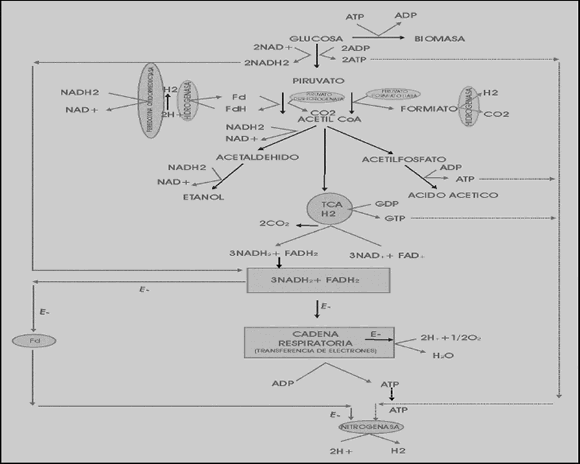
Figura 2. Ruta metabólica de Klebsiella pneumoniae a partir de glucosa [Chen y otros, 2006]
Figure 2. Klebsiella pneumoniae metabolic pathway from glucose [Chen et al., 2006]
El análisis estequiométrico muestra:
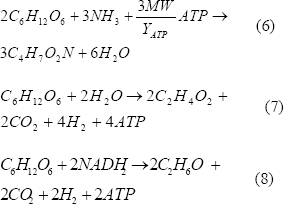
Las ecuaciones (6), (7) y (8) representan la formación de biomasa, acetato y etanol, respectivamente.
Algunos estudios en ingeniería metabólica han trabajado en estas vías, especialmente sobre la hidrogenasa, con el fin de direccionar y optimizar el flujo de equivalentes (H+) reducidos para la producción de hidrógeno. Sin embargo, se requiere un mayor entendimiento de las rutas metabólicas y de su regulación para incrementar la eficiencia de estas enzimas. Algunos autores han mostrado enzimas de microorganismos mutantes con rendimientos mejores que los de las especies silvestres [Kondo y otros, 2002; Kruse y otros, 2005; Kovács y otros, 2006; Vignais y otros, 2006].
3. MÉTODOS PARA LA PRODUCCIÓN DE BIOHIDRÓGENO
3.1 Biofotólisis directa
Éste es un proceso de producción de hidrógeno y oxígeno fotosintéticamente a partir de agua y luz solar (Ec. 9). En él se usan algunos microorganismos que constituyen las algas verdes, las cuales requieren de un tiempo de incubación anaeróbica en oscuridad para inducir la síntesis o la actividad de enzimas involucradas en el metabolismo del hidrógeno, como las hidrogenasas reversibles e irreversibles [Daday y otros, 1977; Melis y Happet, 2001; Weissman y Benemann, 1977]. Éstas canalizan la producción de dos protones (2H+) a hidrógeno gaseoso (H2) mediante la siguiente reacción [Jorquera y otros, 2003; Levin y otros, 2004]:
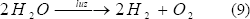
Las hidrogenasas hacen parte de una maquinaria genética y enzimática en el transporte de electrones para generar hidrógeno y producir ATP durante la fotosíntesis. Teniendo en cuenta que la hidrogenasa en este proceso no es tolerante al oxígeno y que el proceso genera los dos gases en forma simultánea (hidrógeno y oxígeno), no es viable a lo largo del tiempo, sino se hacen ciertas modificaciones. Una de estas posibles modificaciones es una separación tempo-espacial, donde primero el CO2 es fijado en sustratos ricos en hidrógeno durante la fotosíntesis normal y luego se incuba el alga anaeróbicamente con luz, produciéndose hidrógeno gaseoso. Lo anterior se debe realizar teniendo en cuenta que la incubación del alga se tiene que hacer en un medio libre de nutrientes que contengan azufre, para evitar la producción de oxígeno por parte del fotosistema II, pues la ausencia de este elemento impide la formación de este complejo enzimático [Jorquera y otros, 2003]. Estos estudios se han hecho principalmente con Chlamydomonas reinhardtii [Zhang y Melis 2002; Levin y otros, 2004].
3.2 Biofotólisis indirecta
Se lleva a cabo por cianobacterias y algas verde-azules, donde a partir del proceso fotosintético el CO2 es fijado a sustratos ricos en hidrógeno endógeno generando luego hidrógeno molecular cuando estos microorganismos se incuban en condiciones anaerobias [Dutta y otros, 2005].
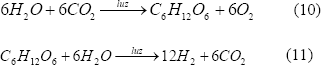
En el proceso se requiere un sistema de cultivo inicial para la fotosíntesis normal y otro sistema aparte para la generación de hidrógeno [Kovács y otros, 2006]. Las cianobacterias poseen varias enzimas involucradas directamente en el metabolismo del hidrógeno. La más importante, la nitrogenasa, cataliza la producción de hidrógeno en el proceso de fijación del nitrógeno. Otra enzima es la hidrogenasa captadora, la cual oxida el hidrógeno que sintetiza la nitrogenasa y, por último, están las hidrogenasas bidireccionales que tienen la habilidad de oxidar y sintetizar hidrógeno.
La producción de hidrógeno por cianobacterias ha sido estudiada por cerca de tres décadas y se ha revelado que la eficiente fotoconversión de agua en hidrógeno es influenciada por muchos factores, siendo la intensidad de luz el más importante. Las tasas de producción de hidrógeno son muy variadas y dependen de las especies de cianobacterias involucradas y de las condiciones del proceso; sin embargo el interés en este proceso ha decaído debido a las bajas tasas de producción encontradas de 13μL/mg(peso seco/h) [Jeffries y otros, 1978]. Además existen desventajas en la producción de hidrógeno con cianobacterias, que se deben fundamentalmente a que es necesario remover el O2 producido, pues éste actúa también como inhibidor de la nitrogenasa y la hidrogenasa [Kapdan y Kargi, 2006].
3.3 Fotofermentación
En este proceso se utilizan bacterias púrpuras no sulfurosas que producen hidrógeno, catalizado por la nitrogenasa bajo condiciones deficientes en N2, usando luz y compuestos reducidos, como ácidos orgánicos, que muchas veces están contenidos en sustancias de desecho.
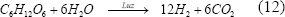
En este proceso también interviene la hidrogenasa captadora de hidrógeno, la cual compite por el hidrógeno disponible en el medio, reduciendo la actividad de la nitrogenasa al quedar sin sustrato. Uno de los parámetros que más afectan la fotofermentación es la intensidad de luz, pues un incremento en ésta se ha visto que afecta de forma simultánea la velocidad de producción y el rendimiento del hidrógeno [Hillmer y Gest, 1977; Reith y otros, 2003; Kapdan y Kargi, 2006].
Se ha visto que las tasas de producción de hidrógeno son más altas cuando las células son inmovilizadas que cuando están suspendidas en la fase líquida [Levin y otros, 2004]. Son diversos los tipos de biorreactores desarrollados (foto-biorreactores) en este sistema. Se han evaluado configuraciones tubulares, de panel de platos y de columna de burbujeo, obteniéndose diferentes resultados en la producción de hidrógeno, debido a las diferencias en la agitación e intensidad de la luz, parámetros cruciales para este método de producción [Reith y otros, 2003; Kapdan y Kargi, 2006].
La mayoría de los procesos utilizados en fotofermentación se han llevado a cabo con microorganismos del género Rhodobacter en lotes (algunas veces con inmovilización celular) y con menor frecuencia en continuo [Zurrer y Bachofen, 1979; Kapdan y Kargi, 2006]. Entre los resultados reportados más destacables de tasas de producción de hidrógeno por este microorganismo están 0,009 L/L*h y 0,008 L/L*h a un pH de 5 y una temperatura de 35 °C [Eroglu y otros, 2006].
3.4 Reacción de intercambio gaseoso (Water gas shift reaction)
Ciertas bacterias fotoheterotróficas, dentro de la superfamilia Rhodospirillaceae, pueden crecer en oscuridad usando CO como única fuente de carbono para generar ATP, con la liberación de H2 y CO2 [Levin y otros, 2004].
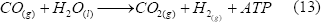
En estos microorganismos, la producción de hidrógeno es mediada por reacciones enzimáticas, las cuales se dan a temperaturas y presiones bajas (ambientales). La enzima que se encarga de atrapar el CO y oxidarlo es la óxido-reductasa-CO-deshidrogenasa (CODH), y es parte de un complejo enzimático unido a la membrana [Levin y otros, 2004]. Este proceso puede ser muy prometedor al poder utilizar gases que contengan CO, para removerlo y producir hidrógeno. Se han hecho algunas propuestas para el diseño de biorreactores que permitan este proceso [Wolfrum y Watt, 2001]. Sin embargo, aún se debe mejorar la transferencia de masa que es una de las limitaciones del mismo.
3.5 Fermentación oscura
La producción de hidrógeno por este método está dada por bacterias anaeróbicas que crecen en oscuridad y usan sustratos ricos en carbo-hidratos. Los subproductos de la fermentación lo constituyen los ácidos acético (máximo teórico de 4 mol H2/mol glucosa) y butírico (máximo teórico de 3.4 mol H2/mol glucosa), con lo que los rendimientos prácticos de hidrógeno en la fermentación oscura están alrededor de 2 mol H2/mol glucosa [Levin y otros, 2004].
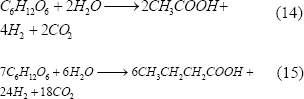
Las fermentaciones se llevan a cabo a diferentes temperaturas, desde mesófilas (25- 40ºC), hasta termófilas (> 50ºC) [Zhang y otros, 2003; Lin y Chang, 2004], produciéndose biogás que contiene H2, CO2, CO, H2S y, en alguno casos, CH4. Las especies bacterianas que producen hidrógeno por este sistema, y que son más conocidas, son las que corresponden a los géneros Enterobacter, Bacillus y Clostridium [Reith y otros, 2003; Levin y otros, 2004].
La producción de hidrógeno por estas bacterias depende de condiciones del proceso como pH, tiempo de retención hidráulica (HRT) y presión parcial del gas. La formación de los productos obedece a las condiciones ambientales en las cuales los microorganismos crecen. Productos como etanol, butanol y lactato, contienen hidrógeno que todavía no se ha liberado; así, para maximizar la cantidad de hidrógeno, el metabolismo de la bacteria debe enfocarse hacia la producción de ácidos grasos volátiles (VFA) [Chen y otros, 2005; Lee y otros, 2006; Lin y Chen, 2006].
3.5.1 Microorganismos e inóculos
La producción de biohidrógeno por fermentación oscura se puede llevar a cabo tanto con cultivos puros, con gran variedad de cepas de microorganismos, como con cultivos mixtos que por lo general provienen de productos de desecho. Ambos tipos de cultivos sirven como inóculos para la fermentación
3.5.1.1 Cultivos puros
Con respecto a los cultivos con cepas puras de microorganismos, se tienen referenciados algunos géneros y especies de bacterias muy estudiadas (Tablas 1 y 2). Dentro de los microorganismos anaerobios estrictos, los cuales son muy sensibles a la presencia de oxígeno, se encuentra el género Clostridium, además de bacterias del rumen, termófilos y metanógenos. El género Clostridium ha sido uno de los más estudiados, tanto en cultivo por lotes (Tabla 1) como en continuo (en menor proporción) y por lotes alimentados (Tabla 2), utilizando glucosa; pero se ha visto que existen especies que son capaces de utilizar otros carbohidratos simples como xilosa, arabinosa, galactosa, celobiosa, sacarosa y fructosa, lo que sugiere que se pueden utilizar sustratos pretratados más complejos como almidón, celulosa y hemicelulosa (Tabla 2). Este género muestra tener un rendimiento de alrededor de 2 moles H2/mol glucosa que, con respecto a otros microorganismos, ha sido uno de los mejores; además produce una mezcla de subproductos en la fermentación como ácidos acético y butírico, y algunos alcoholes, que son los subproductos principales del metabolismo del hidrógeno. Bacterias del rumen, como Ruminococcus albus, producen el hidrógeno junto con otros subproductos no derivados del metabolismo del hidrógeno propiamente, pero hacen falta más estudios sobre éstos. Muchos termófilos e hipertermófilos, como los de los géneros Spirocheta, Anaerocellum, Caldicellulosiruptor, Clostridium, Dictyoglomus, Fervidobacterium, Thermoanaerobacter y Thermotoga, producen hidrógeno a partir de sustratos celulolíticos, algunos de ellos con una eficiencia mayor al 80% del valor teórico (4mol H2/mol glucosa), pero presentan la desventaja de tener un bajo consumo de glucosa y bajas densidades celulares en los cultivos [Reith y otros, 2003]. Aunque se sabe que los metanógenos consumen hidrógeno para producir metano, bajo condiciones de inhibición de producción de éste, se ha reportado producción de H2 y CO2 a partir de CO y H2O por una cepa de Methanosarcina barkeri, en una modificación del proceso de reacción de intercambio gaseoso [Reith y otros, 2003].
Tabla 1. Procesos por lotes para fermentación oscura usando cultivos puros
Table 1. Batch processes in dark fermentation using pure cultures
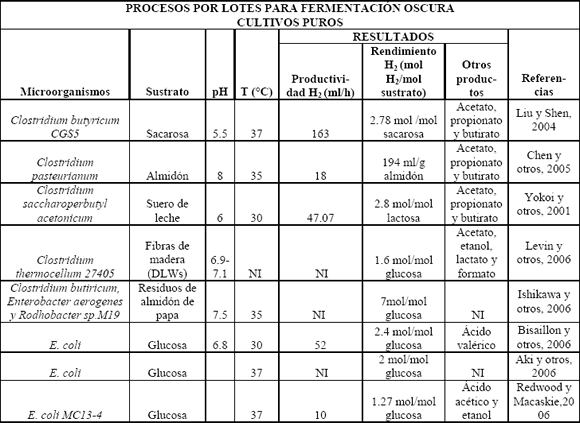
Tabla 2. Procesos en continuo para fermentación oscura usando cultivos puros
Table 2. Continuous and fed batch processes in dark fermentation using pure cultures
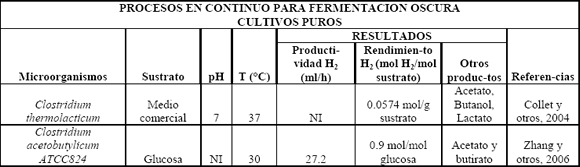
Con respecto a los anaerobios facultativos, que presentan resistencia a la presencia de oxígeno y por lo tanto tienen la ventaja de consumir el oxígeno rápidamente en los biorreactores garantizando anaerobiosis, están Enterobacter, E. coli y Citrobacter. A pesar que las bacterias del género Enterobacter no presentan una inhibición a altas presiones de hidrógeno, generalmente tienen rendimientos más bajos que Clostridium, pues se producen otros subproductos propios del metabolismo del hidrógeno como el lactato, aunque se han desarrollado mutantes para bloquear estos metabolitos no deseados y mejorar la producción. Con E. coli se ha demostrado la producción de hidrógeno a partir de formiato en anaerobiosis debido a su actividad formiato-hidrógeno-liasa y Citrobacter produce hidrógeno por reacción de intercambio gaseoso [Reith y otros, 2003]. Se han reportado ratas de producción de biohidrógeno para Clostridium y Enterobacter de 23 a 58 mmol H2/l h [Reith y otros, 2003].
3.5.1.2 Cultivos mixtos
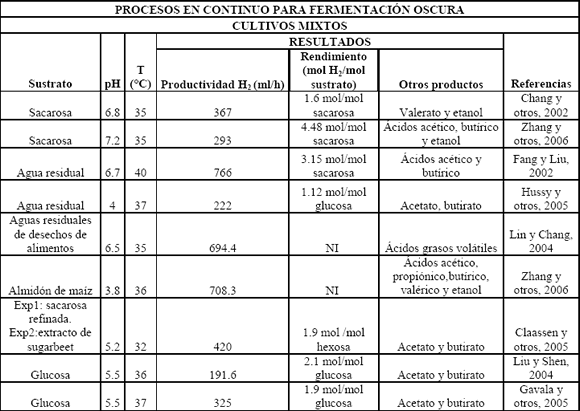
Se ha podido aislar microflora de cultivos mixtos de varias fuentes de desecho como compost, lodos y suelos. Esta microflora a menudo contiene bacterias no deseadas para la producción de hidrógeno como son los metanógenos, los cuales consumen el hidrógeno producido y lo convierten a metano. Generalmente se utilizan pretratamientos con calor y/o pHs extremos para enriquecer la microflora, los cuales inhiben la actividad de los consumidores de hidrógeno, mientras las bacterias esporuladas, que por lo general son del género Clostridium, sobreviven; otros de los métodos utilizados en el enriquecimiento de microflora productora de hidrógeno son aireación, inhibición de metanógenos por ácido 2-bromoetanosulfónico (BESA) y yodopropano [Zhu y Béland, 2006]. Cuando se trabaja en continuo, la presencia de metanógenos en el cultivo se puede controlar aumentando los tiempos de retención hidráulica (HRT) para promover el lavado celular (wash out) de metanógenos, que tienen una tasa de crecimiento baja, y seleccionar las bacterias que producen hidrógeno. Una de las ventajas del uso industrial de los cultivos mixtos, con respecto a los cultivos puros, es que estos últimos son más sensibles a la contaminación de bacterias consumidoras de hidrógeno. Se ha reportado la utilización de cultivos mixtos con lodos activados, lodos digeridos anaeróbicamente, compost de desechos, sedimentos de lagos y suelos de cultivos agrícolas; algunos de éstos por lotes y en continuo, mostrando rendimientos cercanos a 2 moles H2/mol glucosa (Tablas 3 y 4), demostrando la presencia dominante de Clostridium en los cultivos enriquecidos por tratamientos o acondicionamiento de estos inóculos [Lin y Chang, 2004; Zhang y otros, 2006; Eroglu y otros, 2006; Vijayaraghavan y otros, 2006]. Las fermentaciones de hidrógeno por cultivos mixtos muestran tener ratas de producción alrededor de 30-50 mmolH2/l h [Reith y otros, 2003].
Tabla 3. Procesos por lotes para fermentación oscura usando cultivos mixtos
Table 3. Batch processes in dark fermentation using mixed cultures
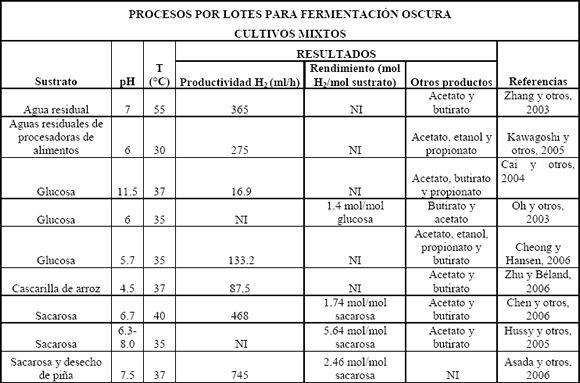
Tabla 4. Procesos en continuo para fermentación oscura usando cultivos mixtos
Table 4. Continuous processes in dark fermentation using mixed cultures
3.5.2 Sustratos y pretratamientos
Para que la producción de biohidrógeno sea un proceso sostenible, los sustratos utilizados deben cumplir ciertos criterios. Los sustratos deben ser producidos a partir de recursos renovables, estar disponibles en suficiente cantidad y/o concentración para que la fermentación ocurra de forma eficiente y se produzca hidrógeno de una forma energéticamente favorable (biohidrógeno como fuente de energía renovable), y que los pretratamientos sean mínimos y de bajo costo. Los carbohidratos son los sustratos preferidos como fuente de carbono; la glucosa y la sacarosa han sido los sustratos fermentables más estudiados a escala de laboratorio, aunque también se han utilizado otros como la maltosa, lactosa, galactosa, manosa y xilosa [Lin y otros, 2006; Lin y Cheng, 2006; Das y Kotay, 2007; Ogino y otros, 2005]. Aunque los sustratos puros han sido ampliamente estudiados, las investigaciones más recientes se enfocan en la utilización de desechos, como sustratos aptos para un proceso sostenible. El rango de los sustratos orgánicos que se podrían usar es tan amplio como el rango de microorganismos utilizados en la producción de hidrógeno por vía fermentativa. Existe gran variedad de sustratos provenientes de recursos renovables como los azúcares contenidos en productos agrícolas como maíz, arroz, trigo, sorgo o material ligno-celulósico de la biomasa. Aunque algunas bacterias del género Clostridium contenidas en cultivos mixtos han presentado actividades celulolíticas, no se han encontrado bacterias que produzcan hidrógeno a partir de materiales celulósico y hemicelulósico crudos [Fang y Liu, 2002; Hawkes y otros, 2002; Van Ginkel y Logan, 2005; Redwood y Macaskie, 2006; Fan y otros, 2006; Sung y otros, 2003].
3.5.2.1 Sustratos de material de desecho
Existe gran variedad de desechos que contienen los sustratos aptos para la producción de biohidrógeno. Los azúcares simples como glucosa, lactosa y sacarosa están presentes en muchos efluentes industriales y también pueden ser obtenidos a partir de desechos agrícolas. Se pueden encontrar grandes contenidos de almidón y celulosa en desechos agroindustriales. Los desechos de las industrias de alimentos poseen gran contenido de carbohidratos en forma de azúcares simples, almidón y celulosa que pueden ser utilizados en la producción de biohidrógeno. Estos desechos sólidos contienen cantidades de carbohidratos y proteínas que varían en concentración y de esta manera deben ser ajustados para obtener las condiciones óptimas del bioproceso. Así mismo, como las aguas residuales de estas industrias procesadoras de alimentos son ricas en carbohidratos, también pueden ser utilizadas; se han usado aguas residuales de productos lecheros, restos de la industria de la oliva, desechos de panadería, melazas y cervecería [Yokoi y otros, 2001; Kádár y otros, 2003; Bálint y otros, 2005; Claassen y otros, 2005; Van Ginkel y otros, 2005; Vijayaraghavan y otros, 2006; Kapdan y Kargi, 2006; Fang y Zhang, 2006; Levin y otros, 2006; Fan y otros, 2006; Ginkel y otros, 2005a; Ginkel y otros, 2005b; Oh y Logan, 2005].
Lodos de plantas de tratamiento, que contienen gran cantidad de carbohidratos y proteínas, se usan tradicionalmente para la producción de metano [Kapdan y Kargi, 2006], pero se ha encontrado que con pretratamientos pueden ser utilizadas como sustratos para la producción de biohidrógeno, teniendo en cuenta los debidos cuidados en cuanto a esterilidad.
3.5.2.2 Pretratamientos del sustrato
Cuando se utilizan sustratos de naturaleza compleja, su capacidad de ser biodegradables disminuye. Para aumentar la biodegradabilidad, y por tanto la calidad de estos sustratos, se tienen que someter a ciertos procesos de pretratamiento. Generalmente se aplican procesos térmicos (temperaturas de ebullición por ciertos periodos de tiempo), químicos (tratamiento con ácidos y bases a pHs extremos) o enzimáticos, para hidrolizar el almidón y la celulosa y dejar el medio con carbohidratos libres para la fermentación. Debido a que gran parte de estos residuos están constituidos por material lignocelulósico y que éste promete ser uno de los sustratos utilizados en el futuro, se debe someter a pretratamientos más enérgicos. Mientras la celulosa y la hemicelulosa pueden someterse a pretratamientos más suaves y luego utilizarlas en la fermentación, la degradación de la lignina inhibe el crecimiento microbiano. Así, se deben desarrollar procesos de pretratamiento que puedan ser útiles para obtener sustratos más fácilmente fermentables y que no causen efectos dañinos en el proceso.
Los pretratamientos de las aguas residuales industriales ricas en compuestos orgánicos consisten en la eliminación de ciertos componentes indeseables, así como en la desnaturalización de proteínas y sustancias orgánicas complejas, dilución de la carga orgánica, regulación del pH y adición de ciertos componentes necesarios para llevar a cabo el proceso fermentativo [Kapdan y Kargi, 2006; Hawkes y otros, 2007].
3.5.3 Requerimientos nutricionales
Se debe tener cuidado con los requerimientos de nutrientes inorgánicos para una producción óptima de biohidrógeno a partir de sustratos que contienen carbohidratos. Así como el nitrógeno y el fósforo son muy importantes en la producción de hidrógeno, el azufre y el hierro son componentes esenciales en la producción de las hidrogenasas, las cuales son las encargadas de generar el hidrógeno. Se ha visto también que la limitación de hierro en el medio promueve la formación de metabolitos no asociados al metabolismo del hidrógeno, obteniéndose menor producción de hidrógeno. Según esto, se deben determinar las cantidades necesarias de nutrientes inorgánicos y de otros elementos traza para lograr una eficiente producción de hidrógeno a diferentes condiciones; por ejemplo, a diferentes concentraciones de sustrato, donde el fósforo y el hierro deben estar presentes a niveles tales que no lleguen a ser limitantes [Bisaillon y otros, 2006; Hawkes y otros, 2007].
3.5.4 Condiciones de operación del proceso
Los distintos parámetros y condiciones de operación (principalmente pH, HRT, presión parcial de hidrógeno y CO2, subproductos, temperatura, concentración inicial de sustrato, edad y volumen del inóculo, etc.) deben ser controlados durante el proceso de fermentación oscura, pues éstos pueden afectar directamente la eficiencia de producción, el contenido del biogás, el tipo de ácidos producidos y la rata específica de producción de hidrógeno. Cuando se trabaja con cultivos mixtos, un descontrol en uno de estos parámetros podría afectar el metabolismo de la microflora productora de hidrógeno o cambiar las comunidades de microorganismos presentes en al proceso y, por tanto, alterar los subproductos de la fermentación. Como ya se ha dicho, los ácidos acético y butírico son los subproductos que están directamente relacionados con la producción de hidrógeno y por lo tanto el rendimiento de hidrógeno es mucho mayor cuando éstos se obtienen en alto porcentaje. Por esta razón, para maximizar el rendimiento de hidrógeno, se deben buscar las condiciones óptimas para direccionar el metabolismo de las bacterias hacia la producción de ácidos grasos volátiles (VFA), específicamente acetato y butirato, y fuera de la producción de alcoholes (como etanol y butanol) y ácidos reducidos (como el lactato) que contienen hidrógeno que todavía no ha sido liberado como gas [Kawagoshi y otros, 2005, Wang y otros, 2007]. Entre algunas de las condiciones de operación más importantes están la temperatura, concentración inicial de sustrato, edad y volumen del inóculo.
3.5.5 Tipos de operación
La producción de biohidrógeno por fermentación oscura se puede llevar a cabo en modos de operación por lotes, continuo o lotes alimentados (Tablas 1, 2, 3, 4). Los procesos por lotes, se han llevado a cabo más en el laboratorio para investigar los requerimientos nutricionales y obtener rendimientos cuando se tienen sustratos particulares. Estos procesos se han realizado a volúmenes de no más de 4L con agitación magnética o en shakers. Quizás uno de los usos principales en la producción de hidrógeno de los procesos por lotes, cuando se tienen cultivos mixtos, es el acondicionamiento del inóculo antes de la fermentación, pues esto permite efectuar el proceso de germinación de esporas de las bacterias productoras de hidrógeno y así evitar un posible lavado de células en un proceso continuo. Además, este tiempo de adaptación por lotes permite disminuir la fase lag del micro-organismo, haciendo que cuando se llegue a realizar la fermentación, éste empiece a crecer y producir hidrógeno rápidamente.
Las bacterias del género Clostridium, reportadas como una de las mejores productoras de hidrógeno, han sido usadas en procesos por lotes a gran escala para producir solventes como acetona, butanol y etanol; para la producción de hidrógeno, un proceso continuo es más atractivo, pues el modo por lotes involucra mayores tiempos de fermentación y no se garantizan condiciones de estado estacionario, que se pueden alcanzar con un proceso en continuo, que son de gran importancia para una óptima producción de hidrógeno [Oh y otros, 2003; Redwood y Macaskie, 2006; Asada y otros, 2006].
Los procesos por lotes alimentados no han sido muy utilizados; los pocos estudios que se han hecho, han sido para evaluar condiciones de germinación de bacterias esporuladas, un proceso que necesita de nutrientes específicos como aminoácidos para que se pueda llevar a cabo, pero no son muy recomendables, pues se ha visto que la interrupción en la alimentación por un periodo de 6 h puede llevar a las bacterias a esporular de nuevo de una forma irreversible y por esto se recomienda un suplemento de nutrientes continuo.
Aunque todavía no se tiene un proceso continuo económicamente factible, en los últimos años se han hecho algunos cambios para optimizarlos. Se ha investigado mucho en fermentación oscura en continuo con microflora mesofílica y termofílica. Esta última podría ser apropiada si el proceso se acopla a otro que esté asociado a una generación de calor, cuya energía sea aprovechable para el proceso termofílico; de lo contrario esta operación es una opción menos favorable técnica y económicamente hablando.
En un proceso continuo es factible, y mucho más fácil, controlar el pH, HRT, presión parcial de hidrógeno y CO2 y los subproductos del proceso, que, como ya se había mencionado, son condiciones determinantes a la hora de optimizar la producción.
3.5.4.2 Efecto del pH, HRT y de la presión parcial de los gases en un proceso continuo
Con el fin de disminuir el consumo del hidrógeno por parte de bacterias metanógenas, se usan condiciones especiales en la fermentación, como bajos pHs y cortos tiempos de retención hidráulica (HRT).
En cuanto al pH, la producción se da en un amplio rango, encontrándose que a pHs menores de 4.0 y mayores de 12.0 se inhibe por completo la producción de hidrógeno. Los rangos de producción varían entre 6.0 y 6.8 con rendimientos aceptables para la fermentación con cultivos mixtos (Cai y otros, 2004).
Se ha encontrado también que a un pH inicial controlado de 6.0, la producción de hidrógeno es más eficiente que si no se controla, cambiando el patrón de fermentación al pasar de producir ácido acético y butírico a sólo ácido butírico y, luego de algún tiempo, a ácido láctico, lo que sugiere un cambio en la comunidad bacteriana [Oh y otros, 2002; Liu y Shen, 2004; Ferchichi y otros, 2005; Kawagoshi y otros, 2005]. De esta manera, la producción de hidrógeno y ácidos acético y butírico como principales subproductos es más conveniente a pHe menores o iguales a 6.0 que a pHs más neutros, en los cuales se encuentran subproductos no asociados al metabolismo del hidrógeno.
En la fermentación es necesario evitar que se incremente la proporción de ácidos acético y butírico no disociados (el incremento ocurre cuando el pH cae a sus pKa de 4.74 y 4.81, respectivamente), pues éstos pueden pasar a través de la membrana de las bacterias, causando un colapso en el gradiente de pH de ésta y la bacteria produciría solventes no deseados y quizás esporule o muera [Oh y otros, 2002; Hawkes y otros, 2007].
El tiempo de retención hidráulica (HRT) puede afectar considerablemente las fermentaciones en continuo, siendo el uso de cortos tiempos de retención lo más ventajoso, al lavar las bacterias productoras de metano; éstos también reducen el tamaño del reactor y, así, el costo del proceso. Se ha concluido que el HRT presenta una selección hidrodinámica de las poblaciones de cultivos mixtos, estabilizándolas por el lavado de bacterias productoras de propionato a un HRT de 6 h [Hawkes y otros, 2002; Zhang y otros, 2006].
La presión parcial de hidrógeno en la fase líquida es uno de los factores claves que afectan la producción de hidrógeno, pues si ésta es alta afecta directamente las reacciones metabólicas de la fermentación. Así, se debe controlar la presión parcial de hidrógeno controlando parámetros que la afectan como la agitación, la concentración de sustrato, la purga con gases inertes (teniendo en cuenta que no se baje mucho la concentración de hidrógeno en el biogás) y la extracción del biogás a través de membranas [Oh y otros, 2002; Hawkes y otros, 2002; Hawkes y otros, 2007].
3.5.4.3 Tipos de reactores
La configuración de biorreactor más utilizada para la producción de biohidrógeno por fermentación, es el reactor continuo de tanque agitado (CSTR) [Yang y otros, 2006]. También existen otros tipos de biorreactores que actualmente operan, la mayoría basados en los procesos de digestión anaeróbica para producir metano. En la producción de biohidrógeno, los reactores deben retener las bacterias productoras para obtener una mayor capacidad catalítica de éstas y permitir grandes tasas de carga orgánica, lo que a su vez permite llegar a altas tasas volumétricas de producción de hidrógeno, sin dejar de lado que se debe evitar la retención de bacterias metanógenas o productoras de propionato.
Se han utilizado reactores biológicos secuenciales (SBR) en los cuales los micro-organismos son retenidos por un periodo de inmovilización y se han encontrado tasas volumétricas y específicas de producción de hidrógeno similares a las encontradas en CSTRs.
Los métodos para retener la biomasa en los reactores incluyen la inmovilización en matrices de etilén-vinil-acetato (EVA), celulosa, capas de alginato-polivinil-acetato, carbón activado y alginato de calcio, aprovechando la formación de biopelículas en estos soportes [Wu y otros, 2005; Wu y otros, 2006]. También se ha retenido la biomasa con membranas, pero no se recomienda como una buena opción, pues los biorreactores de membrana poseen grandes costos de operación. Otras de las configuraciones que también han sido utilizadas son reactor de lecho fluidizado (FBR), de lecho empacado (PBR) y anaeróbico bafleado de tres compartimentos (ABR) [Chang y otros, 2007; Lee y otros, 2006; Wang y otros, 2006].
La retención de bacterias para producir hidrógeno puede incrementar la biomasa y las ratas de carga orgánica, además de presentar ventajas en la creación de ambientes locales anaeróbicos que favorecen el proceso. Las principales configuraciones de biorreactores de lecho empacado con biomasa inmovilizada, generalmente cultivos mixtos libres de metanógenos, son el reactor de lecho ascendente anaerobio (UASB) y el reactor de cargador inducido granular (CIGSB) (Tabla 4) [Wolfrum y Weaver, 2000; Chang y Lin 2004; Lee y otros, 2004; Gavala y otros, 2006].
4. SEPARACIÓN Y ANÁLISIS DEL HIDRÓGENO
La producción de biohidrógeno implica su separación de una mezcla de gases (biogás) producida por el microorganismo, el cual no es apto para ser utilizado directamente, debido a que la concentración de hidrógeno en esta mezcla no es lo suficientemente alta y los otros gases producidos en el proceso, como el CO2, impiden su utilización en aplicaciones como las celdas de combustible. De esta forma, las mejoras en la separación del gas contribuirán de forma directa a aplicaciones económicamente viables del biohidrógeno [Claassen y otros, 2005; Búcsu y otros, 2006].
La remoción continua del hidrógeno es de suma importancia para un modo de operación en continuo, pues su acumulación, y la de otros gases producidos en el proceso de fermentación oscura, generalmente reduce la tasa de producción debido al aumento de la presión parcial de estos gases. Al incrementar la concentración de hidrógeno en la mezcla, su síntesis decae. Además pueden suceder cambios metabólicos en la comunidad bacteriana y producirse sustratos reducidos (no deseables como el propionato). La concentración de CO2 también puede afectar la tasa de producción de hidrógeno; a partir de éste, en un cultivo mixto, las células pueden producir otros metabolitos, cuyas reacciones pueden competir con el requerimiento de NADH necesario para una buena producción de biohidrógeno [Levin y otros, 2004].
Otros gases (CH4, H2S, NH3), producto de la fermentación, también deben ser separados para obtener hidrógeno con una pureza mayor al 99%. Además, se debe tener en cuenta que la purga con gases inertes, como el nitrógeno y el argón, para garantizar anaerobiosis, afecta el proceso de separación [Horváth y otros, 2004; Levin y otros, 2004; Bélafi y otros, 2006].
Existen varios métodos de remoción y purificación selectiva de hidrógeno usando tecnologías de membranas solas o combinadas con otros métodos. El proceso más usado es la separación de gas, donde se maneja una presión conducida por membranas, pudiendo separarse la mezcla de gases con membranas porosas o no porosas, basándose en la permeabilidad y selectividad de los gases. La separación de hidrógeno ha sido un proceso conducido a altas temperaturas y por lo tanto se han utilizado membranas termo-resistentes de materiales muy costosos. La separación de biohidrógeno no requiere altas temperaturas, pudiéndose utilizar membranas de polímeros menos termoestables y por tanto más baratas [Bélafi y otros, 2006].
A 25ºC se han utilizado membranas no porosas de polímeros que tienen gran permeabilidad por el hidrógeno y selectividad en mezclas hidrógeno-nitrógeno a esta temperatura [Horváth y otros, 2004]. En las membranas porosas la permeabilidad de los gases se ve influenciada sólo por los pesos moleculares y la separación se determina por la relación entre éstos [Bélafi y otros, 2006].
Existen muchos estudios sobre la separación de hidrógeno, pero con respecto a las técnicas usadas en biohidrógeno poco se ha publicado. Se han usado membranas de silicona para la separación del biohidrógeno de la fase líquida enfocándose principalmente en la separación hidrógeno-CO2 [Levin y otros, 2004, Bélafi y otros, 2006].
5. MEJORAMIENTO DE LA PRODUCCIÓN
Los principales sistemas de producción de biohidrógeno (fotólisis directa e indirecta, foto-fermentación y fermentación oscura) actualmente están bajo intensa investigación con el fin de desarrollar métodos que mejoren tanto las tasas de producción de H2 como sus rendimientos. Por ejemplo, se ha reportado el mejoramiento de la producción de H2 con la utilización de un mutante por radiación UV de Rhodobacter sphaeroides. Esta mutación hizo reducir el contenido de carotenoides debido a que este tipo de pigmentación está presente en exceso en la célula limitando la incidencia de la luz en el sistema fotosintético y haciendo que la producción en una cepa silvestre de Rhodobacter sphaeroides sea menor que en la cepa mutante [Kondo y otros, 2002].
El mejoramiento genético de algunos micro-organismos, realizando cambios o mutaciones en las enzimas involucradas que las hace más resistentes a los inhibidores como el oxígeno, eliminando las hidrogenasas captadoras de hidrógeno e incrementando los niveles de actividad de la hidrogenasa bidireccional, han demostrado mejoras en los rendimientos y la producción de hidrógeno [Franchi y otros, 2004; Kruse y otros, 2005; Vignais y otros, 2006].
La integración de dos de los procesos más productivos, la fermentación oscura y la fotofermentación, con el fin de aprovechar al máximo las fuentes de carbono presentes en el sustrato, hacen más eficiente el proceso de producción de biohidrógeno [Nath y Das, 2004]. Esta integración permite primero la degradación de los carbohidratos hasta ácidos orgánicos implicando una producción de hidrógeno, y luego estos ácidos orgánicos son utilizados en un reactor en serie conectado al anterior en el cual los microorganismos fotofermentadores transforman estos ácidos en presencia de luz a hidrógeno y CO2 [Eroglu y otros, 2006; Redwood y Macaskie, 2006].
Finalmente, la optimización de condiciones de cultivo tales como la intensidad de la luz, pH, temperatura, contenido de nutrientes, mantenimiento de una baja presión parcial, eliminación de microorganismos competidores y el diseño de nuevos biorreactores, podrán contribuir al incremento en la producción de H2.
6. CONCLUSIONES
La producción de una fuente de energía limpia y la utilización de materiales de desecho hacen del biohidrógeno una novedosa y prometedora alternativa a las demandas energéticas que aumentan cada día en el mundo. Los distintos sistemas biológicos de producción de hidrógeno ofrecen ventajas, pero sin duda la fermentación oscura es una de las alternativas más atractivas por trabajar con un amplio rango de micro-organismos y sustratos renovables, y poder llevarse a cabo en procesos continuos, donde es posible controlar condiciones de operación como pH, HRT y presión parcial de gases, entre otras, permitiendo optimizar el proceso de producción de hidrógeno. Cambios en las rutas metabólicas de los microorganismos y el acoplamiento de diferentes métodos de producción, como fermentación oscura y fotofermentación, han mejorado los resultados de los procesos convencionales. Los métodos de separación y purificación del producto final (biohidrógeno) juegan un papel muy importante y se han utilizado tecnologías de membrana que se basan en la permeabilidad y selectividad de los gases a separar.
7. AGRADECIMIENTOS
Al curso de Fermentaciones Industriales por sus aportes y disponibilidad. A la Universidad Nacional de Colombia, Sede Medellín, y a todos los que hicieron posible este documento.
REFERENCIAS
[1] AKI H., YAMAMOTO SH., KONDO J., MAEDA T., YAMAGUCHI H., MURATA A., AND ISHIID I. Fuel cells and energy networks of electricity, heat, and hydrogen in residential areas. International Journal of Hydrogen Energy. Vol. 31, 967–980. 2006. [ Links ]
[2] ASADA Y., TOKUMOTO M., AIHARA Y., OKU M., ISHIMI K., AKAYAMA T., MIYAKE J., TOMIYAMA M., KOHNO H. Hydrogen production by co-cultures of Lactobacillus and a photosynthetic bacterium, Rhodobacter sphaeroides RV. International Journal of Hydrogen Energy. Vol. 31, 1509-1513. 2006. [ Links ]
[3] BÁLINT B., BAGI Z., TÓTH A., RÁKHELY G., PEREI K., KOVÁCS K. Utilization of keratin-containing biowaste to produce biohydrogen. Applied Microbiology Biotechnology. Vol. 69, 404–410. 2005. [ Links ]
[4] BÉLAFI-BAKÓ K., BÚCSÚ D., PIENTKA Z., BÁLINT B., HERBEL Z., KOVÁCS K., AND WESSLING M. Integration of biohydrogen fermentation and gas separation processes to recover and enrich hydrogen. International Journal of Hydrogen Energy. Vol. 31, 1490–1495. 2006. [ Links ]
[5] BISAILLON A., TURCOT J., AND HALLENBECK P. The effect of nutrient limitation on hydrogen production by batch cultures of Escherichia coli. International Journal of Hydrogen Energy. Vol. 31, 1504-1508. 2006. [ Links ]
[6] BÚCSÚ D., PIENTKA Z., KOVÁCS S., AND BÉLAFI-BAKÓ K. Biohydrogen recovery and purification by gas separation method. Desalination. Vol., 200, 227-229. 2006. [ Links ]
[7] CAI M., LIU J., AND WEI Y. Enhanced biohydrogen production from sewage sludge with alkaline pretreatment. Enviromental Science and Technology. No. 38, 3195- 3202, 2004. [ Links ]
[8] CHANG J-S., LEE K-S., AND LIN P-J. Biohydrogen production with fixed-bed bioreactors. International Journal of Hydrogen Energy. Vol. 27, 1167–1174. 2002. [ Links ]
[9] CHANG F-Y., LIN CH-Y. Biohydrogen production using an up-flow anaerobic sludge blanket reactor. International Journal of Hydrogen Energy. Vol. 29, 33-39. 2004. [ Links ]
[10] CHANG J-S., WU K-J., AND CHANG C-F. Simultaneous production of biohydrogen and bioethanol with fluidized-bed and packed-bed bioreactors containing immobilized anaerobic sludge. Process Biochemistry (en prensa). 2007. [ Links ]
[11] CHEN X., SUN Y., XIU Z., LI X., ZHANG D. Stoichiometric analysis of biological hydrogen production by fermentative bacteria. International Journal of Hydrogen Energy. Vol. 31, 539-549. 2006. [ Links ]
[12] CHEN W-M., TSENG Z-J., LEE K-S., AND CHANG J-S. Fermentative hydrogen production with Clostridium butyricum CGS5 isolated from anaerobic sewage sludge. International Journal of Hydrogen Energy. Vol. 30, 1063-1070. 2005. [ Links ]
[13] CHEONG D-Y., AND HANSEN C. Acidogenesis characteristics of natural, mixed anaerobes converting carbohydrate-rich synthetic wastewater to hydrogen. Process Biochemistry. Vol. 41, 1736-1745. 2006. [ Links ]
[14] CLAASSEN P., LIER B., CONTRERAS A., SIJTSMA W., STAMS J., VRIES S., WEUSTHUIS R. Utilization of biomass for the supply of energy carriers. Applied Microbiology Biotechnology. Vol. 52, 741-755. 2005. [ Links ]
[15] COLLET CH., ADLER N., SCHWITZGUEBEL J-P, AND PERINGER P. Hydrogen production by Clostridium thermolacticum during continuous fermentation of lactose. International Journal of Hydrogen Energy. 29, 1479– 1485, 2004. [ Links ]
[16] DADAY A., PLATZ R., AND SMITH G. Anaerobic and aerobic hydrogen gas formation by the blue-green alga Anabaena cylindrica. Applied and Environmental Microbiology. 34(5), 478-483. 1977. [ Links ]
[17] DAS D., AND KOTAY S. Microbial hydrogen production with Bacillus coagulans IIT-BT S1 isolated from anaerobic sewage sludge. Bioresource Technology. Vol. 98, 1183–1190. 2007. [ Links ]
[18] DOLGYKH L., STOLYARCHUK I., DEYNEGA I. , AND STRIZHAK P. The use of industrial dehydrogenation catalysts for hydrogen production from bioethanol. International Journal of Hydrogen Energy. Vol. 31, 1607– 610. 2006. [ Links ]
[19] DUTTA D., DE D., CHAUDURI, S AND BHATTACHARYA S. Hydrogen production by Cyanobacteria. Review. Microbial Cell Factories. 4:36. 2005. http//www.microbialcell-factories.com/content/4/1/36. [ Links ]
[20] EROGLU E., GÜNDÜZ U., YÜCEL M., TÜRKER L.,.AND EROGLU I. Photobiological hydrogen production by using olive mill wastewater as a sole substrate source. International Journal of Hydrogen Energy. Vol. 29, 163-171. 2004. [ Links ]
[21] EROGLU E., EROGLU I., GÜNDÜZ U., TÜRKER L., AND YÜCEL M. Biological hydrogen production from olive mill wastewater with two-stage processes. International Journal of Hydrogen Energy. Vol. 31, 1527-1535. 2006. [ Links ]
[22] FAN Y-T., ZHANG Y-H, ZHANG S-F., HOU H-W., AND REN B-Z. Efficient conversion of wheat straw wastes into biohydrogen gas by cow dung compost. Bioresource Technology. Vol. 97, 500-505. 2006. [ Links ]
[23] FANG H., AND LIU H. Effect of pH on hydrogen production from glucose by a mixed culture. Bioresource Technology. Vol. 82, 87-93. 2002. [ Links ]
[24] FANG H., LI CH., AND ZHANG T. Acidophilic biohydrogen production from rice slurry. International Journal of Hydrogen Energy. Vol. 31, 683–692. 2006. [ Links ]
[25] FERCHICHI M., CRABBE E., GIL G-H., HINTZ W., ALMADIDY A. Influence of initial pH on hydrogen production from cheese whey. Journal of Biotechnology. Vol. 120, 402-409. 2005. [ Links ]
[26] FRANCHI E., TOSI C., SCOLLA G., PENNA G., RODRIGUEZ F. AND, PEDRONI M. Metabolically engineered Rhodobacter sphaeroides RV strains for improved biohydrogen photoproduction combined with disposal of food wastes. Marine Biotechnology. 6, 552-565, 2004. [ Links ]
[27] GAVALA H., SKIADAS I. , AHRING B. Biological hydrogen production in suspended and attached growth anaerobic reactor systems. International Journal of Hydrogen Energy. Vol. 31, 1164-1175. 2006. [ Links ]
[28] GINKEL S., VAN W., AND LOGAN B. Increased biological hydrogen production with reduced organic loading. Water Research. Vol. 39, 3819-3826. 2005a. [ Links ]
[29] GINKEL S., VAN W., OH S-E., AND LOGAN B. Biohydrogen gas production from food processing and domestic wastewaters. International Journal of Hydrogen Energy. Vol. 30, 1535-1542. 2005b. [ Links ]
[30] GUTEKUNST K., HOFFMANN, D. LOMMER M., EGERT M., SUZUKI I, SCHULZ-FRIEDRICH R., AND APPEL J. Metal dependence and intracellular regulation of the bidirectional NiFe-hydrogenase in Synechocystis sp. PCC 6803. International Journal of Hydrogen Energy. Vol. 31, 1452–1459. 2006. [ Links ]
[31] HAN S-K., AND SHIN H-S. Biohydrogen production by anaerobic fermentation of food waste. International Journal of Hydrogen Energy. Vol. 29, 569-577. 2004. [ Links ]
[32] HAWKES F., DINSDALE R., HAWKES D., AND HUSSY I. Sustainable fermentative hydrogen production: challenges for process optimisation. International Journal of Hydrogen Energy. Vol. 27, 1339-1347. 2002. [ Links ]
[33] HAWKES F., HUSSY I., KYAZZE G., DINSDALE R., AND HAWKES D. Continuous dark fermentative hydrogen production by mesophilic microflora: Principles and progress. International Journal of Hydrogen Energy. Vol. 32, 172-174. 2007. [ Links ]
[34] HILLMER P., AND GEST H. H2 metabolism in the photosynthetic bacterium Rhodopseudomonas capsulata: H2 production by growing cultures. Journal of Bacteriology. 129 (2), 724-731. 1977. [ Links ]
[35] HORVÁTH R., OROSZ T., BÁLINT B., WESSLING M., KOOPS G., KAPANTAIDAKIS G., AND BÉLAFI-BAKÓ K. Application of gas separation to recover biohydrogen produced by Thiocapsa roseopersicina. Desalination. Vol. 163, 261–265. 2004. [ Links ]
[36] HUSSY I., HAWKES F., DINSDALE R., AND HAWKES D. Continuous fermentative hydrogen production from sucrose and sugarbeet. International Journal of Hydrogen Energy. Vol. 30, 471-483. 2005. [ Links ]
[37] ISHIKAWA M., YAMAMURA S., TAKAMURA Y., SODE K., TAMIYA E., AND TOMIYAMA M. Development of a compact high-density microbial hydrogen reactor for portable bio-fuel cell system. International Journal of Hydrogen Energy. Vol. 31, 1484–1489. 2006. [ Links ]
[38] JEFFRIES T., TIMOURIAN H., AND WARD R. Hydrogen production by Anabaena cylindrica: Effects of varying ammonium and ferric ions, pH, and light. Applied and Environmental Microbiology. 35 (4), 704-710. 1978. [ Links ]
[39] JORQUERA O., HERNÁNDEZ J. Y HERRERA L. Producción biofotolítica de hidrógeno. Departamento de Ingeniería Química; Facultad de Ciencias Físicas y Matemáticas, Universidad de Chile. Disponible:http://cabierta.uchile.cl/revista/16/articulos/pdf/paper5.pdf. 2003. [ Links ]
[40] KÁDÁR Z., VRIJE T., BUDDE M., SZENGYEL Z., RÉCZEY K., CLAASSEN P. Hydrogen production from paper sludge hydrolysate. Applied Biochemistry and Biotechnology. Vol. 108, 105-108. 2003. [ Links ]
[41] KAPDAN I., AND KARGI F. Bio-hydrogen production from waste materials. Review. Enzyme and Microbial Technology. Vol. 38, 569-582. 2006. [ Links ]
[42] KAWAGOSHI Y., HINO N., FUJIMOTO A., NAKAO M., FUJITA Y., SUGIMURA S., AND FURUKAWA K. Effect of inoculum conditioning on hydrogen fermentation and pH effect on bacterial community relevant to hydrogen production. Journal of Bioscience and Bioengineering. 100(5), 524-530. 2005. [ Links ]
[43] KONDO T., ARAKAWA M., HIRAI T., WAKAYAMA T. HARA M., AND MIYAKE J. Enhancement of hydrogen production by a photosynthetic bacterium mutant with reduced pigment. Journal of Bioscience and Bioengineering. 93(2), 145-150, 2002. [ Links ]
[44] KOVÁCS K. , KOVÁCS A., MAROTI G., BAGI Z., CSANA G., PEREKATALIN I., BALINT B., BALOGH J., FULOP A., MESZAROS L., TOTH A., DAVID R., LATINOVICS D., VARGA A., AND RAKHELY G. Improvement of biohydrogen production and intensification of biogas formation. Reviews in Environmental Science & Biotechnology. Vol. 3, 321–330. 2004. [ Links ]
[45] KOVÁCS K., MARÓTI, G., AND RÁKHELY. G. A novel approach for biohydrogen production. International Journal of Hydrogen Energy. Vol. 31, 1460-1468. 2006. [ Links ]
[46] KRUSE O., RUPPRECHT J., BADER K., THOMAS-HALL S., SCHENK P., FINAZZI G. AND HANKAMER B. Improved photobiological H2 production in engineering green algal cells. Journal of Biological Chemistry. Vol. 280. No. 40, 34170-34177. 2005. [ Links ]
[47] LEE K-S., LO Y-S., LO Y-Ch., LIN P-J., AND CHANG J-S. Operation strategies for biohydrogen production with a high-rate anaerobic granular sludge bed bioreactor. Enzyme and Microbial Technology. 35, 605–612. 2004. [ Links ]
[48] LEE K-S., LIN P-J., AND CHANG J-S. Temperature effects on biohydrogen production in a granular sludge bed induced by activated carbon carriers. International Journal of Hydrogen Energy. Vol. 31, 465-472. 2006. [ Links ]
[49] LEE K., LO Y., LIN P., CHANG J. Improving biohydrogen production in a carrier-induced granular sludge bed by altering physical configuration and agitation pattern of the bioreactor. International Journal of Hydrogen Energy. Vol. 31, 2076-2087. 2006. [ Links ]
[50] LEVIN D. B., SLAM R. I., CICEK N. and SPARLING R. Hydrogen production by Clostridium thermocellum 27405 from cellulosic biomass substrates. International Journal of Hydrogen Energy. Vol. 31, 1496–1503. 2006. [ Links ]
[51] LEVIN D., PITT L., AND LOVE M. Biohydrogen production: prospects and limitations to practical application. International Journal of Hydrogen Energy. Vol. 29, 173-185. 2004. [ Links ]
[52] LIN CH.-Y., AND CHANG R.-CH. Fermentative hydrogen production at ambient temperature. International Journal of Hydrogen Energy. Vol. 29, 715-720. 2004. [ Links ]
[53] LIN CH.-Y., AND CHEN H-P. Sulfate effect on fermentative hydrogen production using anaerobic mixed microflora. International Journal of Hydrogen Energy. Vol. 31, 953-960. 2006. [ Links ]
[54] LIN CH-Y., LEE CH-Y., TSENG I., AND SHIAO I. Biohydrogen production from sucrose using base-enriched anaerobic mixed microflora. Process Biochemistry. Vol. 41, 915-919. 2006. [ Links ]
[55] LIN CH-Y., CHENG CH-H. Fermentative hydrogen production from xylose using anaerobic mixed microflora. International Journal of Hydrogen Energy. Vol. 31, 832-840. 2006. [ Links ]
[56] LIU G., AND SHEN J. Effects of culture and medium conditions on hydrogen production from starch using anaerobic bacteria. Journal of Bioscience and Bioengineering. 98(4), 251-256. 2004. [ Links ]
[57] MELIS A., AND HAPPE T. Hydrogen production. Green algae as source of energy. Plant Physiology. Vol. 127, 740-748. 2001. [ Links ]
[58] NATH K., AND DAS D. Improvement of fermentative hydrogen production: various approaches. Applied Microbiology and Biotechnology. Vol. 65, 520–529. 2004. [ Links ]
[59] NI M., LEUNG M., SUMATHY K., AND LEUNG D. Potential of renewable hydrogen production for energy supply in Hong Kong. International Journal of Hydrogen Energy. Vol. 31, 1401–1412. 2006. [ Links ]
[60] OGINO H., MIURA T., ISHIMI K, SEKI M., AND YOSHIDA, H. Hydrogen production from glucose by anaerobes. Biotechnology Progress. 21, 1786-1788. 2005. [ Links ]
[61] OH Y-K., SEOL E-H., KIM J., PARK S. Fermentative biohydrogen production by a new chemoheterotrophic bacterium Citrobacter sp. Y19. International Journal of Hydrogen Energy. Vol. 28, 1353-1359. 2003. [ Links ]
[62] OH Y-K., SEOL E-H., LEE E., PARK S. Fermentative hydrogen production by a new chemoheterotrophic bacterium Rhodopseudomonas palustris P4. International Journal of Hydrogen Energy. Vol. 27, 1373-1379. 2002. [ Links ]
[63] OH S., AND LOGAN B. Hydrogen and electricity production from a food processing wastewater using fermentation and microbial fuel cell technologies. Water Research. Vol. 39, 4673-4682. 2005. [ Links ]
[64] REDWOOD M., AND MACASKIE L. A two-stage, two-organism process for biohydrogen from glucose. International Journal of Hydrogen Energy. Vol. 31, 1514-1521. 2006. [ Links ]
[65] REITH J., WIJFFELS R., AND BARTEN H. Edit. Bio-methane & Bio-hydrogen status and perspectives of biological methane and hydrogen production. Dutch Biological Hydrogen Foundation. 2003. [ Links ]
[66] SUNG SH., BAZYLINSKI, D., AND RASKIN L. Biohydrogen production from renewable organic wastes. Hydrogen, Fuel Cells, and Infrastructure Technologies. FY 2003 Progress Report. 2003. [ Links ]
[67] VAN GINKEL S., OH S-E., AND LOGAN B. Biohydrogen gas production from food processing and domestic wastewaters. International Journal of Hydrogen Energy. Vol. 30, 1535–1542. 2005. [ Links ]
[68] VAN GINKEL S., AND LOGAN B. Increased biological hydrogen production with reduced organic loading. Water Research. Vol. 39, 3819-3826. 2005. [ Links ]
[69] VIGNAIS, P., MAGNIN J-P., AND WILLISON, J. Increasing biohydrogen production by metabolic engineering. Vol. 31, 1478 – 1483. 2006. [ Links ]
[70] VIJAYARAGHAVAN K., AHMAD D., KHAIRIL M. Biohydrogen generation from jackfruit peel using anaerobic contact filter. International Journal of Hydrogen Energy. 31, 569-579. 2006. [ Links ]
[71] VIJAYARAGHAVAN K., AHMAD D., KHAIRIL M., NAEMMAH H., NAEMMAH, H. Isolation of hydrogen generating microflora from cow dung for seeding anaerobic digester. International Journal of Hydrogen Energy. Vol. 31, 708-720. 2006. [ Links ]
[72] WANG L., ZHOU Q., AND LI F. Avoiding propionic acid accumulation in the anaerobic process for biohydrogen production. Biomass and Bioenergy. Vol. 30, 177-182. 2006. [ Links ]
[73] WANG Y., MU Y., AND YU H-Q. Comparative performance of two upflow anaerobic biohydrogen-producing reactor seeded with different sludge. International Journal of Hydrogen. Vol. 32, 1050-1058. 2007. [ Links ]
[74] WEISSMAN J. AND BENEMANN J. Hydrogen production by nitrogen-starved cultures of Anabaena cylindrica. Applied and Environmental Microbiology. 39 (1), 123-131. 1977. [ Links ]
[75] WOLFRUM E., AND WEAVER P. Bioreactor development for biological hydrogen production. Proceedings of the 2000 DOE Hydrogen Program Review. 2000. [ Links ]
[76] WOLFRUM E., AND WATT A. Bioreactor design studies for a novel hydrogen-producing bacterium. Proceedings of the 2001 DOE Hydrogen Program Review. 2001. [ Links ]
[77] WU S-Y., LIN CH-N., CHANG J-S., AND CHANG J-S. Biohydrogen production with anaerobic immobilized by ethylene-vinyl acetate copolymer. International Journal of Hydrogen Energy. Vol. 30, 1375-1381. 2005. [ Links ]
[78] WU K-J., AND CHANG J-S. Batch and continuous fermentative production of hydrogen with anaerobic sludge entrapped in a composite polymeric matrix. Process Biochemistry. Vol. 42. No. 2, 279-284. 2007. [ Links ]
[79] YANG H., SHAO P., LU T., SHEN J., WANG D., XU Z., AND YUAN X. Continuous bio-hydrogen production from citric acid wastewater via facultative anaerobic bacteria. International Journal of Hydrogen Energy. Vol. 31, 1306-1313. 2006. [ Links ]
[80] YOKOI H., SAITSU A., UCHIDA H., HIROSE J., HAYASHI S., AND TAKASAKY Y. Microbial hydrogen production from sweet potato starch residue. Journal of Bioscience and Bioengineering. 91 (1), 58-63. 2001. [ Links ]
[81] ZHANG H., BRUNS M., AND LOGAN B. Biological hydrogen production by Clostridium acetobutylicum in an unsaturated flow reactor. Water Research. Vol. 40, 728-734. 2006. [ Links ]
[82] ZHANG T., LIU H., AND FANG H. Biohydrogen production from starch in wastewater under thermophilic condition. Journal of Environmental Management. Vol. 69, 149-156. 2003. [ Links ]
[83] ZHANG L., AND MELIS A. Probing green algal hydrogen production. Phil. Trans. R. Soc. Lond. B. Vol. 357, 1499–1509. 2002. [ Links ]
[84] ZHANG Z-P., SHOW K-Y., TAY J-H., LIANG D., LEE D.-J., JIANG W-J. Effect of hydraulic retention time on biohydrogen production and anaerobic microbial community. Process Biochemistry. Vol. 41, 2118-2123. 2006. [ Links ]
[85] ZHU H., AND BÉLAND M. Evaluation of alternative methods of preparing hydrogen producing seeds from digested wastewater sludge. International Journal of Hydrogen Energy. Vol. 31, 1980–1988. 2006. [ Links ]
[86] ZURRER H., AND BACHOFEN R. Hydrogen production by the photosynthetic bacterium Rhodospirillum rubrum. Applied and Environmental Microbiology. 37 (5), 789-793. 1979. [ Links ]














