Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.75 no.156 Medellín Sep./Dic. 2008
BaTiO3 OBTENIDO POR EL MÉTODO DE COPRECIPITACIÓN
BaTiO3 OBTAINED BY COPRECIPITATION METHOD
CLAUDIA FERNÁNDEZ PERDOMO
Grupo CYTEMAC, Departamento de física, Universidad del Cauca, cpfernandez@unicauca.edu.co
EDISON RIVERA FIGUEROA
Grupo CYTEMAC, Departamento de física, Universidad del Cauca, edrivera@unicauca.edu.co
JORGE RODRIGUEZ PAEZ
Grupo CYTEMAC, Departamento de física, Universidad del Cauca, jnpaez@unicauca.edu.co
Recibido para revisar Octubre 10 de 2007, aceptado Febrero 25 de 2008, versión final Marzo 12 de 2008
RESUMEN: El titanato de bario (BaTiO3) es un material con propiedades ferroeléctricas muy importantes. Normalmente se obtiene a través de la mezcla de óxidos, TiO2 y BaCO3, obteniéndose partículas grandes y requiriendo altas temperaturas para su síntesis. En este trabajo se utilizó el método de coprecipitación para obtener BaTiO3, con un tamaño de partícula manométrico, y a una temperatura de síntesis más baja. Para ello se determinaron los parámetros más adecuados de síntesis: pH, concentración de los precursores y temperatura. La materia prima obtenida se caracterizó utilizando ATD/TG, DRX, FTIR y MET.
PALABRAS CLAVE: BaTiO3; Caracterización; Coprecipitación; Síntesis.
ABSTRACT: The barium titanate (BaTiO3) is a material with very important ferroelectrics properties. It is usually obtained through the mixture of oxides, TiO2 and BaCO3, this method gives big particles and it requires high temperatures for the synthesis of this compound. In this work, we used the coprecipitación method to obtain BaTiO3 with a smaller particle size and a low temperature of synthesis.
The most appropriate parameters for the synthesis, pH, concentration precursors and temperature, were determined. The ceramics powders were characterized with ATD/TG, DRX, FTIR and MET.
KEYWORDS: BaTiO3; Characterization; Coprecipitación; Synthesis.
1. INTRODUCCIÓN
El titanato de bario, BaTiO3, es hasta la fecha el material ferroeléctrico más investigado. Es extremadamente interesante, desde el punto de vista del estado sólido, debido a que su estructura es más simple que la de cualquier otro ferroeléctrico conocido. Entre las propiedades más sobresalientes que presenta el BaTiO3 se pueden destacar su estabilidad tanto química como mecánica, sus propiedades ferroeléctricas a temperatura ambiente y su fácil sintetizado considerando su uso como cerámica policristalina [1].
El BaTiO3 es ampliamente usado en la fabricación de dispositivos piezoeléctricos, elementos electro-ópticos, capacitores cerámicos y resistores PTC. Es conocido que los cerámicos de BaTiO3 presentan una alta constante dieléctrica y exhiben interesantes propiedades semiconductoras cuando ellos son modificados utilizando aditivos adecuados [2].
El método clásico de síntesis de los polvos cerámicos de BaTiO3 exige mezclar y tratar térmicamente carbonato de bario (BaCO3) y óxido de titanio (TiO2). El proceso implica una serie de etapas que impiden alcanzar el grado de pureza y homogeneidad que requieren muchas de las aplicaciones tecnológicas actuales. Para obtener el BaTiO3, por el método convencional, se promueve la reacción en estado sólido entre el BaCO3 y el TiO2. El BaCO3 es un compuesto muy estable y su descomposición térmica, en presencia de TiO2, comienza a temperaturas del orden de 700 °C. De igual forma, el hecho de que la reacción se produzca por difusión de Ba+2 requiere de altas temperaturas, por encima de 1000 °C y tiempos de reacción largos para la obtención del BaTiO3, lo que lleva a la aparición de segundas fases cristalinas remanentes [3].
Otros métodos utilizados para la síntesis del BaTiO3 son: síntesis por vía húmeda como las rutas de oxalato y citrato [4], método sol-gel [4] y síntesis hidrotermal [4], principalmente.
En este trabajo se determinaron los parámetros más adecuados para sintetizar del BaTiO3 utilizando el método de coprecipitación. Los polvos obtenidos se caracterizaron empleando espectroscopía infrarroja (FTIR), difracción de rayos X (DRX), análisis térmico (ATD/TG) y microscopía electrónica de transmisión, (MET).
2. PROCEDIMIENTO EXPERIMENTAL
2.1 Síntesis de polvos cerámicos de BaTiO3Para la obtención de titanato de bario, mediante el método de coprecipitación, se estudió el efecto tanto de la concentración del soluto como del solvente sobre las características finales del producto obtenido. Para ello se tomaron soluciones 0.1, 0.2, 0.3 y 0.5 N de acido nítrico (HNO3 Fisher, 69,7%), en 200 mL de agua destilada, y acetato de bario Ba(CH3COO)2 Aldrich,99%) al 0.06, 0.1 y 0.2 M.
Para garantizar la homogeneidad en el sistema se suspendió dióxido de titanio (TiO2 Aldrich, 99%) en agua acidulada y para garantizar una adecuada dispersión del solido se sometió la mezcla a una agitación continua de 200 r.p.m.; luego se disolvió Ba(CH3COO)2. Posteriormente, se adicionó el precipitante (NH4OH J.T. Baker, 29,6%) a una velocidad de 0.05 ml cada 20 segundos. El sistema se llevó hasta el pH de interés, el cual fue determinado previamente mediante las curvas de valoración potenciométrica, grafica de la variación del pH en función del volumen adicionado de precipitante. El monitoreo del pH, durante la adición del precipitante, fue realizado utilizando el Titrino SM 702 marca Metrohn, con electrodo de vidrio.
Para eliminar gran parte del solvente de la suspensión obtenida se usó el rotaevaporador R-124/Buchi. Luego, el polvo húmedo obtenido se calentó a 60 °C utilizando una plancha, durante 24 horas, para dar por terminado el proceso de secado. El sólido resultante se macero, en un mortero de ágata, obteniéndose así un polvo de color blanco, bastante higroscópico, con textura fina.
Adicionalmente se estudio el efecto de los tratamientos térmicos sobre las características fisicoquímicos del polvo cerámico final.
2.2 Caracterización de los polvos cerámicos obtenidos
Para conocer los grupos funcionales presentes en los polvos cerámicos sintetizados, a diferentes valores de pH y diferentes tratamientos térmicos, se utilizo Espectroscopía Infrarroja (FTIR); para ello se empleó el espectrofotómetro Nicolet Modelo IR200.
Se realizó análisis térmico diferencial y térmico gravitacional (ATD\TG) a los sólidos sintetizados para conocer los principales eventos fisicoquímicos que ocurren al someter los polvos a tratamientos térmicos.
Para determinar las fases cristalinas presentes en los polvos cerámicos de interés, con y sin tratamiento térmico, se empleo la técnica de Difracción de Rayos X (DRX); el equipo empleado para tal fin fue el difractómetro marca Philips PW1710, utilizando la radiación Kα del Cu (λ=1.54 Å) en un rango de barrido entre 10° y 70° (2θ), y a una velocidad de 0.04 °s-1. Por último, se utilizó el Microscopio Electrónico de Transmisión (MET), Jeol JEM-1200 EX, para conocer la morfología y el tamaño de partícula de los polvos cerámicos sinterizados.
3. RESULTADOS Y DISCUSIÓN
3.1 Valoración potenciométrica
La curva de valoración potenciométrica de la figura 1 se obtuvo para una disolución 0.5 N de HNO3, y 0.06M de Ba(CH3COO)2, al adicionarle el precipitante (NH4OH). En ella se presentan 3 regiones bien definidas si se considera la variación de la pendiente de la curva. Como se observa, la región 1 se mantiene casi constante lo que indica que el sistema consume una gran cantidad de OH-, mientras que las regiones 2 y 3 muestran un cambio más significativo en los valores del pH.
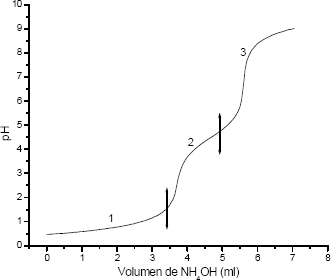
Figura 1. Curva de valoración potenciométrica para el sistema BaTiO3 0,06 Molar 0.5 Normal
Figure 1. Potenciometric valuation curve for the BaTiO3 0,06 Molar 0.5 Normal system
En la solución, al adicionar el HNO3, ocurre la siguiente reacción:
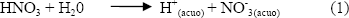
Es a este sistema al que se adiciona el TiO2 para obtener la suspensión de este óxido; se observa que al adicionar el óxido el pH del sistema no varía.
Al agregar el acetato de bario se pueden favorecer la formación de nitrato de barrio y acido acético tal como se indica en la siguiente reacción:
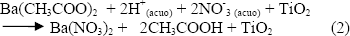
reacciones que hacen evidente que el intercambio de ligando NO-3 con el CH3COO- es muy eficiente.
En la región 1, de la figura 1, la variación del pH no es muy notoria, es una zona prácticamente plana bastante grande, que debe representar principalmente la neutralización del acido por el precipitante adicionado, produciéndose nitrato de amonio:
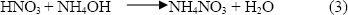
Entre pH 1.5 y 4.5, los posibles compuestos presentes en el sistema son: Ba(NO3)(OH), (CH3COO–OH)Ba2, NH4CH3COO así como Ba(NO3)2, CH3COOH y NH4NO3.
Finalmente, entre pH 4.5 y 9, se deben formar compuestos que son estables a estas condiciones del sistema.
Por otro lado, dado que el catión Ba es grande y tiene una carga de 2+, las reacciones de hidrólisis y condensación no ocurren en la disolución [5] y solo sería posible la formación de pares iónicos.
Para determinar el efecto de la concentración, tanto del precursor como del solvente, se obtuvieron las curvas de valoración potenciométrica indicadas en las figuras 2 y 3, respectivamente.
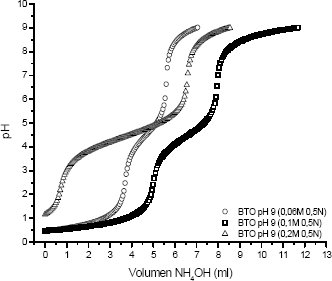
Figura 2. Curvas de valoración potenciométrica para BTO 0,5N con diferentes concentraciones de Ba(CH3COO)2
Figure 2. Potenciometric valuation curves for BTO 0,5N with different concentrations of Ba(CH3COO)2
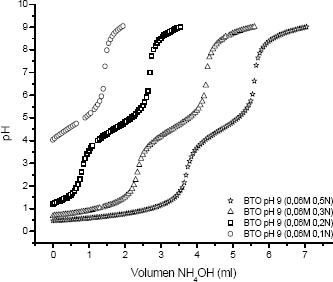
Figura 3. Curvas de valoración potenciométrica para el sistema BTO 0,06 M con diferentes concentraciones de HNO3
Figure 3. Potenciometric valuation curves for the BTO 0,06 M system with different concentrations of HNO3
Al variar la concentración del precursor, la curva de valoración potenciométrica cambia en la región 1 debido a la naturaleza básica del catión bario, lo que hace que el sistema requiera una menor cantidad de precipitante para neutralizar el acido, figura 2. Además, una alta concentración de acetato de bario genera una gran cantidad de ion acetato que neutraliza los H+ presentes en el sistema.
Para diferentes concentraciones de ácido, manteniendo la misma cantidad del precursor, se observa que la región 1 y 2 son fuertemente afectas, figura 3.
Entre mayor la concentración de HNO3 se evidencia un mayor desarrollo de las principales reacciones que ocurren en el sistema, entre ellas una buena disolución y adecuada disociación del Ba(CH3COO)2.
3.2 Caracterización de la fase sólida de las suspensiones
Tanto el efecto del pH como el de la temperatura, sobre los sólidos obtenidos, se determinaron utilizando FTIR, ATD/TG, DRX y MET.
3.3 Efecto del pH
La evolución de los grupos funcionales se estableció utilizando muestras obtenidas a diferentes valores de pH: 1.5, 4.5 y 9, valores que son representativos en la curva de la figura 1.
3.3.1 Espectroscopia Infrarroja con transformada de Fourier (FTIR)
Los espectros IR correspondientes a muestras sólidas obtenidas a diferentes valores de pH, para una concentración 0.06 M 0.5 N, se indican en la figura 4.
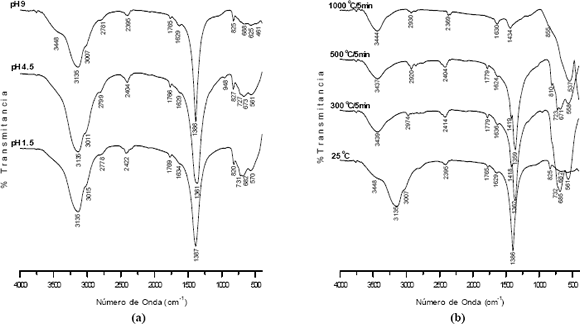
Figura 4. Espectros FTIR de muestras sólidas obtenidas a diferentes valores de pH (a), y tratadas a diferentes temperaturas (b), del sistema BTO 0,06 M de precursor y 0,5 N de HNO3
Figure 4. FTIR spectra of solid samples obtained to different values from pH (a), and treated to different temperatures (b), for BTO 0,06 M of precursor and 0,5 N of HNO3 system
En los espectros de la figura 4 (a) son evidentes las bandas a 3448 y 1630 cm-1 correspondientes a ν(OH) y al modo de flexión del grupo H-O-H del agua[6], la ubicada a 3135 cm-1 del NH+4 [7], la del grupo –OH asociado al carboxilo, 2422 cm-1[6], la banda a 1769 cm-1 correspondiente al NO-3 libre[7], las ubicadas a 1387, 820 y 731 cm-1 que dan información sobre un complejo NO-3 unidentado, flexión del OH y al modo ν (COO) [7] y las bandas a 682 y 570 cm-1 asociadas al TiO2 tipo anatasa que aún no ha reaccionado [8]. Se nota que a pH bajos se incrementa la presencia de grupos funcionales a bajo número de onda donde estarían los modos vibracionales M–O y M–OH con (M = Ti, Ba), los cuales son importantes a la hora de la conformación de nuestro compuesto de interés.
3.4 Efecto de la temperatura
3.4.1 Análisis térmico
La figura 5 muestra las curvas de ATD/TG correspondiente a la muestra BTO obtenida a pH 9 con una concentración 0.06 M de precursor y 0.5 N de HNO3. Al realizar el tratamiento térmico se nota que los picos endotérmicos de la curva de ATD, entre 50 y 200°C, deben corresponder a la pérdida de agua por parte de la muestra, tanto adsorbida como de cristalización, así como del amonio presente. Los picos endotérmicos, entre 250 y 280 °C, deben corresponder al proceso de fundido del NH4NO3 que posteriormente se volatiliza tal como lo indica la gran pérdida de peso que presenta la muestra alrededor de 250 °C. Los dos picos endotérmicos alrededor de 600 °C deben corresponder a la descomposición del Ba(NO3)2 y a la reacción del Ba2+ con el Ti4+ para producir el BaTiO3, por lo tanto es de esperar que por encima de los 600 °C ya exista titanato de bario en la muestra.
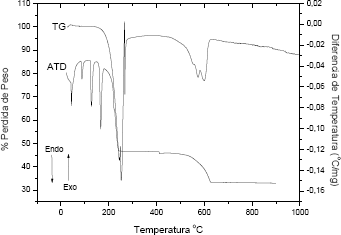
Figura 5. Curvas de ATD/TG para el sistema BTO con 0,06 M de precursor y 0,5 N de HNO3, sintetizado a pH 9
Figure 5. ATD/TG curves for the BTO system with 0,06 M of precursor and 0,5 N of HNO3, synthesized to pH 9
La figura 4(b) muestra los espectros FTIR de muestras del sistema BTO, obtenido a pH 9 con una concentración 0.06 M de precursor y 0.5 N de HNO3, sometidas a diferentes tratamientos térmicos. Se nota que a 300 y 500 °C, la banda a 1386 cm-1 se divide para dar lugar a las bandas a 1362 y 1418 cm-1 las cuales corresponden a los dos modos de tensión de un complejo de carbonato unidentado[7].
La principal característica de estos espectros es la banda intensa entre 558 y 685 cm-1 que corresponde a las vibraciones de tensión en el octaedro TiO6 [8]. Por otro lado, a 1000 °C, se observa una banda más intensa a bajas frecuencias, centrada en 537 cm-1, y que es característica del BaTiO3 [8].
Teniendo en cuenta los resultados de ATD/TG, se decidió tratar una muestra a 750 oC/2h para conocer qué otras fases podrían estar presentes en ella. En su espectro de FTIR, figura 6, se aprecian las bandas a 1442 y 856 cm-1 asociadas al grupo CO-3 unidentado[7]. La banda mas intensa a bajo número de onda, 546 cm-1, corresponde al BaTiO3[8].
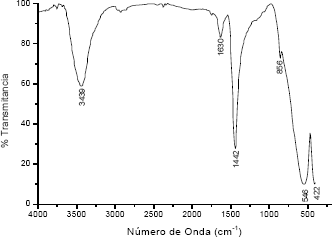
Figura 6. Espectro FTIR de la muestra BTO 0,06M 0,5N pH 9 tratada a 750 °C/2h
Figure 6. FTIR spectra of BTO 0,06 M - 0,5 N pH 9 sample treated to 750 °C/2h
3.4.2 Difracción de Rayos X (DRX)
En la figura 7 se muestran los difractogramas de rayos x correspondientes a muestras sólidas del sistema BTO 0.06 M- 0.5 N, sintetizados a pH 9, y tratados térmicamente a diferentes temperaturas. Ellos indican que las principales fases cristalinas presentes en las muestras son: Ba(NO3)2 (PDF 76-1376), NH4NO3 (PDF 83-0524) y TiO2 anatasa (PDF 84-1286), tanto para la muestra sin tratamiento térmico como para las tratadas a 300 y 500 °C por 5min. Se observa que tanto la fase de nitrato de bario como la de titanio, fase anatasa, no aparecen a altas temperaturas; la muestra tratada a 1000 °C, por 5min, presenta como única fase cristalina el BaTiO3 (PDF 75-0212).
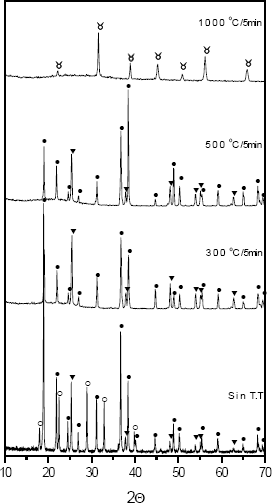
Figura 7. Difractogramas de rayos x correspondientes a tratamientos térmicos de muestras sólidas del sistema BTO 0,06 M - 0,5 N, sintetizado a pH 9, y tratados térmicamente a diferentes temperaturas. [● Ba (NO3)2, ○ NH4NO3, ▲ TiO2 anatasa,  BaTiO3]
BaTiO3]
Figure 7. XRD pattern corresponding to heat treatments of solid samples of BTO 0,06 M - 0,5 N system, synthesized to pH 9, and treated thermally to different temperatures [● Ba (NO3)2, ○ NH4NO3, ▲ TiO2 anatasa,  BaTiO3]
BaTiO3]
La principal fase cristalina presente en la muestra tratada térmicamente a 750 oC/2h, figura 8, es el BaTiO3 (PDF 75-0212); además existe BaCO3 en fase Witherite (PDF 71-2394). Este resultado reitera la tendencia que tiene el bario a formar compuestos con el CO-3.
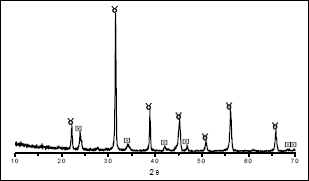
Figura 8. Difractograma de rayos X de una muestra BTO 0,06M - 0,5N, sintetizada a pH 9 y tratada termicamente a 750 oC/2h [ BaTiO3,
BaTiO3,  BaCO3]
BaCO3]
Figure 8. XRD pattern of a sample BTO 0,06 M - 0,5 N, synthesized to pH 9 and treated thermally to 750 oC/2h [ BaTiO3,
BaTiO3,  BaCO3]
BaCO3]
3.4.3 Microscopía electrónica de transmisión. (MET)
La figura 9 muestra las micrografías obtenidas con MET del polvo cerámico sintetizado del sistema BTO 0,06 M-0,5 N a pH 9. Como se puede observar, por debajo de 500 °C la muestra presenta partículas de naturaleza esferoidal y tamaño nanométrico (<200 nm), figuras 9 (a) y (b), mientras que por encima de los 500 °C se observan, además, partículas con una morfología tipo tablón y una gran cantidad de agregados que indican que la sinterización de las nanopartículas está bastante avanzada a 1000 °C, figura 9 (c).
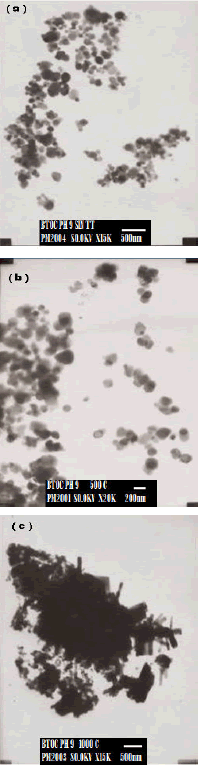
Figura 9. Micrografías MET de la muestra BTO 0,06 M - 0,5 N pH 9: (a) Sin tratamiento térmico, (b) 500 °C, (c) 1000 °C
Figure 9. MET Micrographs of BTO 0,06 M - 0,5 N pH 9 sample: (a) Without heat treatment, (b) 500 °C, (c) 1000 °C
4. CONCLUSIONES
Tomando como base los resultados del anterior trabajo podemos concluir que: El método de coprecipitación permite obtener polvos cerámicos con una fase cristalina única de BaTiO3 tratando la muestra a 1000 °C por 5 minutos. El tamaño de partícula para esta muestra es nanométrica (<200 nm). Es evidente que a partir de 650 °C, de acuerdo a las curva de ATD/TG, debe existir como fase cristalina mayoritaria BaTiO3.
Las condiciones más adecuadas para realizar la síntesis del BaTiO3 son: pH 9, con una concentración 0,06 M de Ba(CH3COO)2 y 0,5 N de HNO3, las cuales se establecieron a partir de las curvas de valoración .
Los principales compuestos que se formaron, al adicionar el precipitante, fueron: Ba (NO3)2 y NH4NO3. Con la formación del nitrato de bario se hizo evidente la gran eficiencia en el intercambio del ligando NO-3 por el CH3COO-, en la esfera de coordinación del Ba2+.
5. AGRADECIMIENTOS
Este trabajo fue financiado por el proyecto COLCIENCIAS código 1103-14-17900. Agradecimiento especial a la VRI de la Universidad del Cauca por la administración de los recursos del proyecto.
REFERENCIAS
[1] SHIRANE, J. Ferroelectric Crystals. Dover Edition, 1993. [ Links ]
[2] BRZOZOWSKI, E., CASTRO, M.S. Síntesis of barium titanate improved by modifications in the kinetics of the solid state reaction. J. Eur. Ceram. Soc, Vol. 20 2347-2351, 2000. [ Links ]
[3] RODRÍGUEZ, M. S. Síntesis y caracterización de nanopartículas de titanato de bario, BaTiO3, [Trabajo de grado], Universidad del Cauca, 2004. [ Links ]
[4] PRADEEP P. P., SUBAS H. R. Low-temperature synthesis and processing of electronic materials in the BaO-TiO2 system, Review, J. Mater. Sci, Vol. 25 1169-1183, 1990. [ Links ]
[5] JOLIVET J. Metal oxide chemistry and synthesis. Jhon. Wiley & Sons, LTD, 2000. [ Links ]
[6] SOCRATES, G. Infrared characteristics group frequencies. Jhon. Wiley & Sons, LTD, 1994. [ Links ]
[7] NAKAMOTO, K. Infrared and Raman spectra of inorganic and coordination compounds. Part B. 5th edition, 1997. [ Links ]
[8] BLANCO, L.M., FOURLARIS, G., RAND F., RILEY, L. F. Characterization of barium titanate powders: barium carbonate identification. J. Am. Ceram. Soc, Vol 82 1777-1786, 1999. [ Links ]














