Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.72 no.157 Medellín Jan./Apr. 2009
ASPECTOS INGENIERILES DEL CULTIVO IN VITRO DE CÉLULAS VEGETALES PARA LA PRODUCCIÓN DE METABOLITOS SECUNDARIOS
ENGINEERING ASPECTS OF THE IN VITRO PLANT CELL CULTURE FOR THE PRODUCTION OF SECONDARY METABOLITES
MARIO ARIAS
Grupo de Biotecnología Industrial, Universidad Nacional de Colombia, Sede Medellín, marioari@unalmed.edu.co
ANA AGUIRRE
Grupo de Biotecnología Industrial, Universidad Nacional de Colombia, Sede Medellín, amaguir@unalmed.edu.co
MÓNICA ANGARITA
Grupo de Biotecnología Industrial, Universidad Nacional de Colombia, Sede Medellín, mjangari@unalmed.edu.co
CAROLINA MONTOYA
Grupo de Biotecnología Industrial, Universidad Nacional de Colombia, Sede Medellín, cmontoy0@unalmed.edu.co
JUAN RESTREPO
Grupo de Biotecnología Industrial, Universidad Nacional de Colombia, Sede Medellín, jmrestr1@unalmed.edu.co
Recibido para revisar enero 24 de 2008, aceptado abril 16 de 2008, versión final mayo 16 de 2008
RESUMEN: Las plantas son una fuente importante de metabolitos que han sido usados como medicamentos, pesticidas, saborizantes y fragancias. Con el fin de producir estos compuestos sin necesidad de cultivar la planta completa, se ha propuesto la tecnología de cultivo de sus células in vitro (callos, suspensiones y órganos). En este trabajo se abordan diferentes aspectos ingenieriles del cultivo de células vegetales concernientes a la producción de metabolitos secundarios.
PALABRAS CLAVE: Cultivo de células vegetales, metabolitos secundarios, escalado, modelamiento, inmovilización.
ABSTRACT: Plants are an important source of metabolites that have been used as medicines, pesticides, flavors and fragrances. In order to obtain those compounds without growing the whole plant, the in vitro culture technology (callus, suspensions and organs) has been proposed. In this work, some engineering aspects of the plant cell culture concerning the production of secondary metabolites are discussed.
KEYWORDS: Plant cell culture, secondary metabolites, scale up, modeling, immobilization.
1. INTRODUCCIÓN
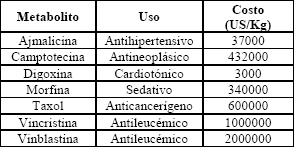
Las plantas han sido reconocidas históricamente como fuente de un amplio rango de compuestos utilizados como medicamentos, pesticidas, saborizantes y fragancias, entre otros (Tabla 1). Tradicionalmente éstos se han obtenido por extracción química, pero este procedimiento es difícil debido a las bajas concentraciones de muchos de estos compuestos en las plantas [1].
Tabla 1. Metabolitos de importancia farmacéutica [2]
Table 1. Metabolites with pharmaceutical importance [2]
El cultivo de células vegetales ha surgido como una alternativa para la obtención de metabolitos de interés, en especial cuando las plantas son silvestres, requieren largos periodos de cultivo, tienen rendimientos de metabolitos secundarios bajos o no se cuenta con procesos de síntesis química. En este sistema, la producción es independiente de factores externos como disponibilidad de tierra, clima y condiciones geopolíticas; además es posible controlar las condiciones de cultivo, alcanzando mayor rendimiento y calidad.
Sin embargo, para lograr la aplicación industrial de esta estrategia es necesario resolver algunos problemas como baja productividad, crecimiento lento e inestabilidad genética [3].
En un país megadiverso como Colombia, resulta pertinente la aplicación de este tipo de tecnologías para utilizar de manera productiva estos recursos que además, gracias a las condiciones climáticas, permanecen disponibles durante todo el año; sin embargo, no es suficiente contar con el material biológico, siendo necesario desarrollar e implementar la infraestructura adecuada para lograr procesos productivos no sólo a escalas de laboratorio sino industrial. En este trabajo se revisan algunos de los aspectos ingenieriles asociados con el cultivo de células vegetales para la producción de metabolitos secundarios, con el fin de introducir esta tecnología como una estrategia para la utilización de la biodiversidad colombiana.
2. CLASES DE CULTIVO IN VITRO
Existen fundamentalmente tres formas de realizar cultivos in vitro: células en suspensión, células inmovilizadas o como tejidos u órganos. La clase de cultivo afecta, entre otras cosas, el crecimiento celular, la formación de producto, su purificación y el tipo de biorreactor que puede ser utilizado.
2.1 Cultivo en suspensión
En las suspensiones, las células individuales se distribuyen en forma homogénea a través del medio de cultivo y por estar rodeadas del mismo, se facilita la transferencia de nutrientes y oxígeno hacia el citoplasma. Este tipo de cultivo presenta la ventaja de permitir el control relativamente sencillo de variables como temperatura, pH y oxígeno disuelto; sin embargo, pueden verse modificadas algunas características de las células presentes en las plantas como su diferenciación y la comunicación intercelular [4], lo que implica en muchos casos la disminución en la producción de metabolitos secundarios, pues se ha reportado que en algunas especies la síntesis de ciertos metabolitos requiere la coexistencia de diferentes tipos celulares o la compartimentalización intracelular [5].
Las suspensiones celulares finas están constituidas principalmente por células meristemáticas indiferenciadas, más débiles e inestables en comparación con su estado en el ambiente natural (6) pero con respecto a los cultivos de células diferenciadas (raíces y brotes), presentan las ventajas de poder ser cultivadas a mayores concentraciones celulares y a mayores velocidades de crecimiento [5].
En el cultivo en suspensión el estado que más se aproxima a las condiciones naturales es la fase estacionaria, en la que diversos autores han reportado un cierto grado de diferenciación [7], observándose que la acumulación de metabolitos secundarios se presenta principalmente durante este periodo; sin embargo, en caso de metabolitos asociados al crecimiento, su acumulación puede ser proporcional a la producción de biomasa y se ha observado durante la fase exponencial en ciertas líneas celulares, tales son los casos de la producción de betalaínas, carotenoides y azadiractina [7, 8, 9].
Las células vegetales en suspensión tienden a formar agregados de manera natural ya que al dividirse no se separan adecuadamente, lo cual puede afectar la producción de metabolitos secundarios, probablemente por el estrés nutricional, especialmente de oxígeno, que es causado por la limitación a la transferencia de masa en los agregados y por la diferenciación celular dentro de los mismos; además el aumento de las interacciones intercelulares puede facilitar el intercambio de señales y metabolitos, necesarios en la síntesis de algunos metabolitos particulares [5,10,11,12].
En la actualidad se conocen pocos procesos industriales para la producción de metabolitos secundarios utilizando esta estrategia de cultivo; algunos de los procesos exitosos han sido la obtención de paclitaxel, una droga anticancerígena obtenida de suspensiones celulares de especies del género Taxus por la empresa Alemana Phyton hasta volúmenes de 75000 litros; la obtención de shikonina por suspensiones celulares de Lithospermum erythrorhizon y berberina a partir de suspensiones de Coptis japonica por la empresa japonesa Mitsui Petrochemical Industries Ltd. y finalmente la obtención de extractos de la planta Panax ginseng en reactores de hasta 25000 litros por la empresa japonesa Nitto Denko Corporation.
2.2 Cultivo de células inmovilizadas
Ésta es una alternativa que ha mostrado en muchos casos la estimulación del metabolismo secundario, debido probablemente a una tasa de crecimiento más lenta que favorece un mayor flujo de nutrientes y energía hacia este metabolismo, un mayor contacto célula-célula y un mayor grado de diferenciación, haciendo que el ambiente físico-químico sea más parecido al de la planta [4, 7, 9, 13, 14, 15]. Las células inmovilizadas presentan una mayor limitación a la transferencia de masa, debido a la resistencia aportada por el soporte; además, se ha reportado la inducción de cambios morfológicos y fisiológicos, que pueden estimular no sólo la producción, sino también la liberación de metabolitos secundarios al medio, posiblemente por la permeabilización de la membrana celular [9, 14, 16].
La utilización de sistemas con células inmovilizadas presenta la ventaja de mantener retenido el biocatalizador, permitiendo su reutilización y la operación del proceso de manera continua, usando altas tasas de dilución sin que ocurra lavado celular. Adicionalmente, cuando el metabolito es liberado por la célula al medio, se ven simplificados los procesos de purificación de los metabolitos de interés, reduciendo el costo del proceso [3, 6, 13, 14].
La matriz de inmovilización provee una mayor protección a las células, impidiendo que éstas tengan contacto directo con el fluido y con dispositivos mecánicos dentro del reactor, reduciendo de esta forma el estrés de corte al que son sometidas y por tanto manteniendo la actividad catalítica por más tiempo, a altas tasas de aireación y agitación [4, 13, 14]. La productividad puede incrementarse mediante el mantenimiento de altas densidades celulares, la inducción de la liberación del producto y la eliminación de la fase de crecimiento, que en el caso de células vegetales representa gran parte del tiempo del proceso (6,13). Sin embargo, debe tenerse en cuenta que la viabilidad de las células puede verse comprometida, que el metabolito de interés no debe estar asociado a la fase de crecimiento y debe liberarse al medio, ya que es indispensable inhibir la división celular para evitar el rompimiento del soporte [2,14] y éste no debe ser destruido en el proceso de purificación [6,13].
Los métodos físicos de inmovilización son los más usados en el cultivo de células vegetales (Tabla 2) ya que tienden a modificar menos la capacidad biosintética de las células debido a que no involucran uniones covalentes con los soportes [2,4,6,13,15]. Dentro de estos métodos se ha usado fundamentalmente el atrapamiento en gel [16] o en espuma [17].
Tabla 2. Algunos sistemas de inmovilización utilizados en el cultivo de células vegetales
Table 2. Several immobilization systems used in plant cell culture
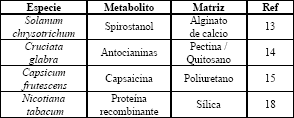
Recientemente se ha comenzado a explorar la posibilidad de usar soportes inorgánicos (derivados de sílice); este tipo de soportes es más resistente al estrés mecánico y no es sensible al crecimiento celular [18]. En la actualidad no existen procesos industriales en los que se usen células inmovilizadas para la producción de metabolitos secundarios.
2.1 Cultivo de órganos
La producción de ciertos metabolitos está asociada a células muy especializadas o a la interacción de células en la planta, que en algunos casos pueden ser de diferentes tipos celulares [5]; en estos casos resulta útil cultivar el órgano o tejido completo [6]. Existen dos tipos de órganos que usualmente son cultivados para la producción de metabolitos secundarios: raíces y brotes; éstos se caracterizan por tener un patrón metabólico muy similar al de los órganos en la planta y pueden o no estar transformados genéticamente; en el caso de células no trasformadas el tejido se obtiene a partir de un explante y la diferenciación se logra utilizando una combinación apropiada de hormonas; los órganos transformados se obtienen utilizando Agrobacterium rizhogenes, en el caso de raíces, o Agrobacterium tumefaciens en el caso de brotes [4,7,19,20,21,22,23,24,25].
Los órganos transformados tienen varias ventajas con respecto a los órganos sin transformar y a los cultivos en suspensión, ya que requieren medios más simples sin reguladores de crecimiento, mantienen la estabilidad genética y la producción del metabolito de interés por más tiempo, crecen rápidamente acumulando metabolitos secundarios durante la fase de crecimiento y se pueden cultivar a altas densidades de biomasa [7,26]. Sin embargo, es importante tener en cuenta las limitaciones a la transferencia de oxígeno y nutrientes dentro de los órganos, por lo que es necesario optimizar las operaciones de transferencia de masa para evitar la necrosis [4,7], aspectos importantes en el escalado de los procesos [27].
Se ha encontrado que los requerimientos de oxígeno para raíces transformadas son similares a los de los cultivos de tejidos de células de mamífero; sin embargo los tejidos vegetales son más porosos, permitiendo la transferencia de oxígeno por convección dentro de los tejidos, por lo que los efectos convectivos en la transferencia de masa cobran gran importancia en este tipo de cultivo [27].
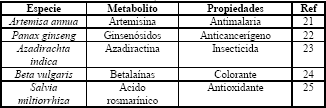
Las ventajas de este sistema de cultivo han hecho común su utilización (Tabla 3). Algunos casos exitosos que han sido llevados hasta niveles de producción industrial son la obtención de camptothecina y podofilotoxina por la compañía alemana ROOTec, la cual solucionó los problemas de transferencia de masa asociados con el escalado a través del diseño de un sistema de biorreactores modulares (LCMB) que escala el proceso incrementando el número de unidades de fermentación en lugar del volumen [28]
Tabla 3. Especies vegetales cultivadas como raíces para la producción de metabolitos secundarios
Table 3. Plant species growth as roots for the production of secondary metabolites
3. ASPECTOS INGENIERILES
Las técnicas, metodologías y reactores para el cultivo de células vegetales en suspensión se han desarrollado a partir de la adaptación de procesos con células microbianas; sin embargo, es importante tener en cuenta las características inherentes a las células vegetales: alcanzan diámetros de hasta 150 µm, forman agregados de manera natural de hasta pocos milímetros y en ocasiones pueden sufrir procesos de diferenciación, lo que implica la heterogeneidad del cultivo [5], tienen un tiempo de duplicación de entre 20 y 100 horas, así como una velocidad de consumo de oxígeno de aproximadamente 10-1 mmol/lh [29].
3.1 Agregación
Las células vegetales, como ya se ha mencionado, tienen una tendencia natural a formar agregados cuando son cultivadas en suspensión; este hecho es de gran importancia pues puede afectar tanto las características metabólicas del cultivo como la reología de los caldos; esta última variable es influenciada por el tamaño de los agregados y por la forma de los mismos, observándose que agregados esféricos resultan en caldos Newtonianos mientras que células elongadas resultan en comportamientos no Newtonianos [30]. Otro factor que es importante considerar cuando se presenta el fenómeno de agregación es la heterogeneidad del sistema, pues al interior de los agregados se presentan gradientes de transferencia de masa y variaciones en las condiciones de iluminación con respecto a las células de la periferia [31].
3.2 Agitación y estrés hidrodinámico
La agitación es una operación física que aumenta la homogeneidad del medio de cultivo, disminuyendo los gradientes de concentración y temperatura, evitando la sedimentación de las células (11,32) y controlando el tamaño de los agregados celulares (32). La agitación, al igual que la aireación, genera fuerzas hidrodinámicas sobre las células en suspensión, lo que se traduce en una respuesta metabólica que depende del tiempo, la intensidad de la exposición y las características fisiológicas de estas células [29,11,32]. En los procesos de agitación es posible mantener constante la velocidad del impulsor o el tiempo de mezcla. Se ha encontrado que tiempos de mezcla elevados afectan el crecimiento debido a la formación de zonas muertas dentro del reactor que presentan una mayor limitación a la transferencia de oxígeno, mientras que tiempos de mezcla pequeños favorecen el incremento de la densidad celular debido a una mayor homogenización del medio de cultivo [11].
Una forma de entender los efectos de estrés hidrodinámico sobre los cultivos es a través de la teoría de Kolmogorov, según la cual durante la agitación se forman remolinos de diferentes tamaños; los mayores extraen energía del flujo principal, mientras que los más pequeños interactúan directamente con las células, haciéndolas rotar y en ocasiones causando daños a la pared celular cuando remolinos con rotaciones contrarias y tamaños menores al de la célula entran en contacto con ésta simultáneamente. Según la teoría de Kolmogorov, los remolinos más grandes son inestables y tienden a disgregarse en remolinos más pequeños, hasta que la escala del remolino o eddy es tan pequeña que el número de Reynolds de los mismos no es suficientemente grande como para que persista la inestabilidad y su energía cinética es disipada térmicamente. Esta teoría permite calcular el tamaño del remolino más pequeño que se produce bajo las condiciones del fluido y la velocidad de agitación aplicada [33,34], lo que permite evitar la formación de remolinos que puedan afectar el cultivo [35].
Existen diferentes estudios que muestran que las células vegetales en suspensión presentan sensibilidad al estrés de corte [12], lo cual usualmente se ha relacionado con su tendencia a formar agregados, la existencia de paredes celulares rígidas, la presencia de vacuolas [35,36] y con su gran tamaño de entre 20 a 150 μm que puede coincidir con los valores de la microescala de Kolmogorov, que en estudios conducidos con Catharanthus roseus en reactores de tanque agitado ha mostrado estar alrededor de 58 μm [31]. Sin embargo, es importante destacar que esta susceptibilidad no es un hecho generalizado, encontrándose diferentes reportes de líneas celulares resistentes o que se han hecho resistentes, a través del subcultivo repetido, en condiciones de estrés de corte elevadas [37,38].
Un hecho importante relacionado con la sensibilidad al estrés de corte en cultivos celulares, es que el aumento de la viscosidad en el medio tiene un efecto de protección contra las fuerzas de cizalla, pues un incremento en ésta disminuye las condiciones de turbulencia [35,39]. En células vegetales se ha demostrado que en ciertas líneas celulares una respuesta subletal al estrés de corte es la secreción de glicoproteínas, las cuales incrementan la viscosidad del medio de cultivo [39,40]. Adicionalmente, se ha explorado el efecto de la adición de suplementos viscosos al medio de cultivo, encontrándose efectos favorables en la producción de antocianinas por Vitis vinifera [12].
Los cultivos de células vegetales usualmente presentan un comportamiento no-Newtoniano, determinado por las altas densidades celulares, la agregación y la morfología de las células, así como por la secreción de polisacáridos, fenómenos que suelen incrementar la viscosidad de los caldos, generando mayores requerimientos de agitación [29, 30,39].
3.3 Aireación y transferencia de oxígeno
La composición y concentración de ciertos compuestos gaseosos (oxígeno, dióxido de carbono y etileno, entre otros) en el medio de cultivo, es determinante en el crecimiento celular y la síntesis de metabolitos secundarios [41,42]; estas concentraciones dependen de varios factores, como la temperatura, la presión, el flujo de aireación y la composición de los gases de alimentación. El papel de la aireación en un cultivo celular puede entonces entenderse desde tres perspectivas: en primer lugar se encarga de suplementar el oxígeno necesario, en segundo lugar incrementa la homogenización del medio de cultivo y finalmente es responsable de la desorción de metabolitos volátiles como el CO2 y el etileno [40,41,42,43]. De este modo es fundamental en el diseño de un biorreactor hacer consideraciones referentes tanto a los requerimientos de oxígeno del cultivo, como a la necesidad de mantener los metabolitos volátiles en las concentraciones que estimulan la síntesis de metabolitos secundarios.
El oxígeno favorece el crecimiento celular hasta cierto valor de concentración, después del cual tiene efectos inhibitorios debido al estrés oxidativo; sin embargo, en algunos casos este efecto ha favorecido la acumulación de metabolitos secundarios [41,42]. El requerimiento de oxígeno de las células vegetales es del orden de 10-1 mmol/lh [44], siendo menor que el de las células microbianas que tienen velocidades de consumo de hasta 103 mmol/lh).
La optimización de la transferencia de oxígeno puede lograrse incrementando la velocidad de agitación, la tasa de aireación o su concentración en el aire suministrado; sin embargo, las dos primeras estrategias presentan algunas desventajas ya que se aumenta el consumo de potencia [29,42,45], se genera mayor estrés de corte sobre las células [12], se puede presentar la formación de espuma y puede darse el arrastre de compuestos volátiles importantes en el metabolismo secundario [29,42,45]. De otro lado, el incremento de la concentración de oxígeno en la corriente de entrada implica un aumento en los costos de operación, lo que debe considerarse en caso de seleccionar esta estrategia para la aplicación industrial.
Tanto el etileno como el dióxido de carbono pueden actuar como hormonas necesarias para estimular la producción de metabolitos secundarios [41,46]. Con el fin de mantener su concentración en el medio de cultivo se ha empleado la re-inyección de aire exhausto con la corriente de entrada [47], así como el suministro de estos compuestos puros mezclados con aire (46).
3.4 Diseño del biorreactor
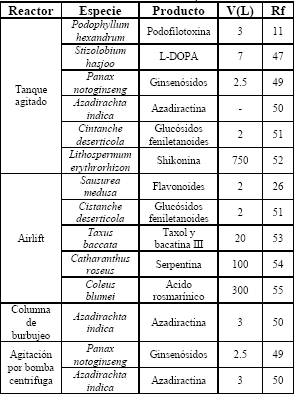
Los biorreactores para el cultivo de células vegetales se diseñan usualmente mediante adaptaciones y modificaciones de fermentadores convencionales (Tabla 4), teniendo en cuenta características de este tipo de sistemas como la sensibilidad al estrés de corte, la dificultad para mantener la homogeneidad de la suspensión y los requerimientos de transferencia de masa [29,47].
Tabla 4. Algunos biorreactores utilizados en el cultivo de células vegetales
Table 4. Several bioreactors used in plant cell culture
El biorreactor de tanque agitado (STR) ha sido comúnmente utilizado; sin embargo, es importante destacar que es de difícil escalado y presenta alto riesgo de contaminación por la presencia de partes móviles; además, cuando éste es empleado debe de garantizarse tanto la homogeneidad de la suspensión como una buena dispersión del gas en el líquido [44]. El estudio del desempeño de diferentes tipos de agitadores ha mostrado que las turbinas de paleta inclinada con flujo axial ofrecen importantes ventajas en sistemas en los que la agitación está limitada por la resistencia al estrés de corte de las células; otro tipo de impulsores como las turbinas de disco con paleta curvada y también podrían ofrecer algunas ventajas [44].
También se han usado biorreactores de agitación neumática como columnas de burbujeo, reactores airlift y reactores con agitación con bombas centrífugas. Los primeros son de fácil escalado y generan poco estrés de corte; sin embargo no proporcionan el grado de homogeneización necesario. Los segundos son una buena alternativa pues suministran una mezcla adecuada, generan poco estrés de corte [29] y presentan bajos requerimientos de energía [3], aunque pueden generar zonas muertas de alta densidad celular. Los terceros fueron diseñados basándose en la geometría de los tanques agitados, sustituyendo el agitador por una bomba centrífuga; este tipo de reactores realiza un buen mezclado sin comprometer la viabilidad celular y ha sido ensayado con éxito en varias especies vegetales [48, 49,50]. Los biorreactores de tambor rotatorio representan una alternativa novedosa, pues proporcionan una homogeneización adecuada con un bajo estrés de corte y un menor requerimiento energético. Además presentan una elevada relación área/volumen, lo que los hace atractivos como foto-biorreactores [3,4].
Cuando se trabaja con células inmovilizadas, se utilizan biorreactores de membrana o de lecho empacado que permiten tener mayor cantidad de células por unidad de volumen; sin embargo presentan limitaciones difusionales para la transferencia de masa y para el suministro y remoción de gases [3].
3.5 Modelamiento del proceso
El crecimiento celular puede describirse mediante modelos que, dependiendo de cómo consideran la población y la estructura de la célula, pueden ser segregados o no segregados y estructurados o no estructurados. Los modelos segregados consideran la heterogeneidad de la población, distinguiendo entre diferentes tipos celulares, mientras que los no segregados, consideran que la población es completamente uniforme. En los modelos estructurados, se consideran los eventos intracelulares específicos, mientras los no estructurados definen a la biomasa como una variable simple de composición constante, asumiendo crecimiento balanceado.
Debido a la complejidad del proceso, pocos sistemas de células vegetales en suspensión han sido modelados; sin embargo es posible encontrar la aplicación de algunos modelos en la literatura [3]. Por ejemplo, en cultivos de Carthamus tinctorius se utilizó un modelo estructurado compartimentalizado para describir la cinética de crecimiento y la producción de vitamina E [56]; en cultivos de Eschscholzia californica el crecimiento celular fue descrito y predicho empleando un modelo segregado [57]; en suspensiones de Taxus chinensis el consumo de sustrato, el crecimiento, la respiración celular y la producción de placlitaxel se describieron mediante un modelo estructurado [58] y en cultivos de Azadirachta indica el crecimiento, el consumo de nutrientes y la producción de azadiractina fueron descritos haciendo uso de un modelo no estructurado y no segregado [9].
3.6 Escalado
Actualmente existen pocos procesos de obtención de metabolitos secundarios por cultivo de células vegetales a nivel industrial, debido principalmente a la baja productividad, la inestabilidad de las líneas celulares y a los problemas concernientes al escalado [4,48]. El escalado del cultivo de células vegetales presenta tres complicaciones principales: la sensibilidad al estrés de corte, el suministro de oxígeno y la remoción de compuestos volátiles con la aireación [6,48]. Varios estudios muestran que dichos parámetros afectan el cultivo de manera especie-específica e inclusive dependiendo de la línea celular que es empleada. Por ejemplo, en cultivos de Taxus chinensis y Stizolobium hassjoo se ha demostrado la importancia de la presencia de compuestos volátiles sobre el crecimiento y la producción de metabolitos secundarios al cambiar de escala [48,47], y en suspensiones de Podophyllum hexandrum se concluyó que el estrés de corte era un factor determinante en la disminución de la viabilidad celular y por tanto de la productividad en el cambio de escala [11].
En el escalado de estos procesos es importante implementar estrategias que permitan disminuir las diferencias entre las dos escalas, como el desarrollo de métodos de agitación que generen un menor estrés de corte, la implementación de sistemas de aireación forzada que suministren el oxígeno necesario y la recirculación de parte del aire exhausto o la inyección de compuestos volátiles en la aireación, para mantener la composición de la fase gaseosa constante [11,48, 47].
4. EXTRACCIÓN Y PURIFICACIÓN
La purificación es la etapa final del proceso y determina un alto porcentaje del valor del producto. Este proceso puede dividirse en las siguientes etapas: remoción del material particulado, concentración de la solución y separación del componente de interés. La primera se realiza generalmente empleando métodos de centrifugación, filtración o decantación; la segunda hace uso de técnicas no selectivas de separación como ultrafiltración, precipitación, extracción líquido-líquido o absorción, y en la tercera se captura el producto por métodos selectivos como la cromatografía, que permite alcanzar altos niveles de pureza y mantener la actividad biológica del compuesto [3].
4.1 Extracción con solvente
Después de tener una solución libre de material particulado, se puede realizar una extracción con solvente; éste generalmente es un compuesto orgánico en el cual es soluble el metabolito de interés. El solvente adecuado para realizar la extracción es aquél que permite, empleando la menor cantidad, obtener el mayor grado de pureza del producto [59,60]. Ya que la extracción con solvente puede dejar impurezas, usualmente se realiza una segunda extracción con otro solvente {61]. En ocasiones es conveniente combinar los métodos tradicionales de extracción con otras técnicas que permiten aumentar la solubilidad del metabolito y la velocidad de transferencia de masa [62]; algunas de estas técnicas son: extracción Soxhlet, reflujo caliente [63], microondas y ultrasonido [64], el cual es ampliamente utilizado en la liberación de compuestos intracelulares al medio de cultivo ya que aumenta la penetración del solvente y permeabiliza la pared celular.
4.2 Extracción in situ
Las células diferenciadas poseen sitios especializados para síntesis y almacenamiento de los metabolitos secundarios, además de contar con sistemas de encapsulación de sustancias citotóxicas. En ocasiones el proceso de desdiferenciación en el cultivo causa la pérdida de estas características, pudiendo causar la disminución en el rendimiento del producto [65]. Por esta razón la incorporación de un paso de extracción durante la fermentación ha demostrado aumentar la productividad, pues dirige el equilibrio hacia la formación de productos, los protege de degradación y también se puede aplicar para remover metabolitos que causen inhibición. Se han implementado principalmente dos estrategias: la primera se conoce como sistema solvente-medio, que puede ser aplicada mediante la adición directa del solvente al biorreactor o recirculando el medio a un tanque externo donde entra en contacto con el solvente [3]. mientras la segunda utiliza una sustancia secuestradora que se incorpora en el biorreactor, como el carbón activado, arcillas activadas o el polietilenglicol, que remueven selectivamente los productos de interés [65].
4.3 Permeabilización
Muchos metabolitos secundarios se acumulan intracelularmente, lo cual es desventajoso si se requiere utilizar continuamente o reutilizar la biomasa; además eleva los costos de purificación y disminuye la producción (inhibición feedback). Es posible lograr que éstos se secreten al medio, mediante procesos químicos o físicos; los primeros hacen uso de surfactantes y solventes, pero en ocasiones causan una deformación permanente de la membrana celular [66]. Los segundos involucran la aplicación de choques térmicos, ultrasonido, electroporación, cambio del pH externo, alta presión e inmovilización, causando generalmente cambios en la membrana sólo durante el tiempo de aplicación [67].
5. CONCLUSIONES Y PERSPECTIVAS
En los últimos 50 años hemos asistido al desarrollo de la tecnología del cultivo de tejidos vegetales in vitro para la producción de metabolitos secundarios; sin embargo la aplicación industrial de esta tecnología ha resultado problemática debido a las características de las células vegetales; aun así en la actualidad ya hay varios procesos que utilizan esta estrategia; dadas las ventajas que ofrece, es probable que en los próximos años numerosos procesos para la obtención de estos productos utilizando este sistema aparezcan en el mercado como resultado de la investigación que se lleva a cabo en el área. Nuestro país tiene la necesidad de adentrarse en este campo con el fin de aprovechar racionalmente su biodiversidad, aunque a la fecha son pocos los grupos que trabajan en el área.
REFERENCIAS
[1] RASKIN I, RIBNICKY D, KOMARNYTSKY S, ILIC N, POULEV A, BORISJUK N ET AL. Plants and human health in the twenty-first century. Trends in Biotechnology. 2002; 20(12):522-531. [ Links ]
[2] RAMACHANDRA S, RAVISHANKAR G. Plant cell cultures: Chemical factories of secondary metabolites. Biotechnology Advances. 2002; 20(2):101-153. [ Links ]
[3] SAJC L, GRUBISIC D, VUNJAK-NOVAKOVIC G. Bioreactors for plant engineering: an outlook for further research. Biochemical Engineering Journal. 2000; 4(2): 89-99. [ Links ]
[4] SCHLATMANN J, HOOPEN H, HEIJNEN J. Large-scale production of secondary metabolites by plant cell cultures. En: DiCosmo F, Misawa M, Editores. Plant cell culture secondary metabolism: toward industrial application. New Cork: CRS Press; 1996. p.11-52. [ Links ]
[5] TREJO-TAPIA, RODRÍGUEZ-MONROY. La agregación celular en la producción de metabolitos secundarios en cultivos vegetales in-vitro. Interciencia. 2007; 32(10):669-674. [ Links ]
[6] YEOMAN M; YEOMAN C. Manipulating secondary metabolism in cultured plant cells. New Phytologist. 1996; 134 (4):553-569. [ Links ]
[7] BOUGARD F, GRAVOT A, MILESI S, GONTIER E. Production of secondary metabolites: a historical perspective. Plant Science. 2001; 161(5): 839-851. [ Links ]
[8] PRAKASH G, SRIVASTAVA A. Modeling of azadirachtin production by Azadirachta indica and its use for feed forward optimization studies. Biochemical Engineering Journal. 2006; 29(1-2):62-68. [ Links ]
[9] PRAKASH G, SRIVASTAVA A. Statistical media optimization for cell growth and azadirachtin production in Azadirachta indica (A. Jyss) suspension cultures. Process Biochemistry. 2005; 40(12): 3795-3800. [ Links ]
[10] EDAHIRO JI, SKI M. Phenylpropanoid metabolite supports cell aggregate formation in strawberry cell suspension culture. Journal of Bioscience and Bioengineering. 2006; 102(1):8-13. [ Links ]
[11] CHATTOPADHYAY S, SRIVASTAVA A, BHOJWANI S, BISARIA V. Production of podophyllotoxin by plant cell cultures of Podophyllum hexandrum in bioreactor. Journal of Bioscience and Bioengineering. 2002; 93(2):215-220. [ Links ]
[12] HONDA H, HIRAODA K, NAGAMORI E, OMOTE M, KATO Y ET AL. Enhanced anthocyanin production from grape callus in air lift type bioreactor using viscous additive supplemented medium. Journal of Bioscience and Bioengineering. 2002; 94 (2):135-139. [ Links ]
[13] CHARLET S, GILLET F, VILLAREAL ML, BARBOTIN JN, FLINIAUX MA, NAVA JE. Immobilization of Solanum chrysotrichum plant cells within Ca-alginate gel beads to produce an antimycotic spirostanol saponin. Plant Physiology Biochemistry. 2000; 38(11): 875-880. [ Links ]
[14] DÖRNENBURG H. Evaluation of immobilization effects on metabolic activities and productivity in plant cell processes. Process Biochemistry. 2004; 39(11):1369-1375. [ Links ]
[15] LINDSEY K, YEOMAN MM, BLACK GM, MAVITUNA F. A novel method for the immobilization and culture of plant cells. Febs. Letters. 1983; 155(1):143-149. [ Links ]
[16] GILLET F, ROISIN C, FLINIAUX M, JACQUIN-DUBREUIL A, BARBOTIN J, NAVA-SAUCEDO J. Immobilization of Nicotiana tabacum plant cell suspensions within calcium alginate gel beads for the production of enhanced amounts of scopolin. Enzyme and Microbial Technology. 2000; 26(2):229-234. [ Links ]
[17] HU ZD, YUAN YJ. Fuzzy growth kinetics of immobilized Catharanthus roseus cells in polyurethane foams. Chemical Engineering Science. 1995; 50(20):3297-3301. [ Links ]
[18] PERULLINI M; RIVERO MM; JOBBÁGY M; MENTABERRY A; BILMES SA. Plant cell proliferation inside and inorganic host. Journal of Biotechnology. 2007; 127(3):542-548. [ Links ]
[19] RAY S; JHA S. Withanolide synthesis in cultures of Withania somnifera transformed with Agrobacterium tumefaciens. Plant Science. 1999; 146(1):1-7. [ Links ]
[20] MAHAGAMASEKERA M; DORAN P. Intergereric co-culture genetically transformed organs for the production of scopolamine. Phytochemistry. 1998; 47(1):17-25. [ Links ]
[21] PATULUN W, LUEALON W, DE-EKNAMKUL W, TANALA H, SHOYAMa Y. Improvement of artemisin production by chitosan in hairy root cultures of Artemisia annua L. Biotechnology Letters. 2007; 29(7):1143-1146. [ Links ]
[22] YU KW, MURTHY HN, HAHN EJ, PAEK KY. Ginsenoside production by hairy root cultures of Panax ginseng: influence of temperature and light quality. Biochemical Engineering Journal. 2005; 23(1):53-56 [ Links ]
[23] SATDIVE RK, FULZELE DP, EAPEN S. Enhanced production of azadirachtin by hairy root cultures of Azadirachta indica A. Juss by elicitation and media optimization. Journal of Biotechnology. 2007; 128(2):281-289. [ Links ]
[24] PAVLOV A, BLEY T. Betalains biosynthesis by Beta vulgaris L. hairy root culture in a temporary immersion cultivation system. Process Biochemistry. 2006; 41(4):848-852. [ Links ]
[25] YAN Q, SHI M, JANET NG, WU JY. Elicitor-induced rosmarinic acid accumulation and secondary metabolism enzyme activities in Salvia miltiorrhiza hairy roots. Plant Science. 2006; 170(4):853-858. [ Links ]
[26] GIRI A; LAKSHMI M. Transgenic hairy roots: recent trends and applications. Biotechnology Advances. 2000; 18(1): 1-22. [ Links ]
[27] MARTIN Y; VERMETE P. Bioreactors for tissue mass culture: design, characterization, and recent advances. Biomaterials. 2005; 26(35):7481-7503. [ Links ]
[28] GUILLON S, TRÉMOUILLAUX-GUILLER J, PATI PK, RIDEAU M, GANTET P. Hairy root research : recent scenario and exciting prospects. Current Opinion in Plant Biology. 2006; 9(3):341-346. [ Links ]
[29] KIERAN P, MACLOUGHLIN P, MALONE D. Plant cell suspensions cultures: some engineering considerations. Journal of Biotechnology. 1997; 59(1): 39-52. [ Links ]
[30] TREJO-TAPIA G, JIMÉNEZ-APARICIO A, VILLAREAL L, RODRÍGUEZ-MONROY M. Broth rheology and morphological analysis of Solanum chrysotrichum cultivated in a stirred tank. Biotechnology Letters. 2001; 23(23):1943-1946. [ Links ]
[31] KEßLER M, HOOPEN H, FURUSAKI S. The effect of the aggregate size on the production of ajmalicine and tryptamine in Catharanthus roseus suspension culture. Enzyme and Microbial Technology. 1999; 24(5):308-315. [ Links ]
[32] ZHONG JJ, PAN ZW, WANG ZY, WU J, CHEN F, TAGAKI M, ET AL Effect of mixing time on taxoid production using suspension cultures of Taxus chinensis in a centrifugal impeller bioreactor. Journal of Bioscience and Bioengineering. 2002; 94(3):244-250. [ Links ]
[33] VANT RIET K, TRAMPER H. Basic Bioreactor Design. Marcel Dekker, INC (NY) 1991. [ Links ]
[34] DORAN P. Bioprocess Engineering Principles. 1st Ed. Great Britain . Academic Press. 1995. [ Links ]
[35] JOSHI JB, ELIAS CB, PATOLE MS. Role of hydrodynamic shear in cultivation of animal, plant and microbial cells. The Chemical Engineering Journal. 1996; 62(2):121-141. [ Links ]
[36] HUA J, ERICKSON E, YIIN TY, GLASGOW L. A review of the effects of shear and interfacial phenomena on cell viability. Critical Reviews in biotechnology. 1993; 13(4):305-328. [ Links ]
[37] DRAPEAU D, BLANCH H W, WILKE C R. Growth kinetics of. Dioscorea deltoidea and Catharanthus roseus in batch culture. Biotechnology and Bioengineering 1986. 28(10):1555–1563. [ Links ]
[38] WAGNER F, VOGELMANN H; EN BARZ W, REINHARD E, ZENK M (editores). Plant tissue culture and its biotechnological applications, Springer, Berlin, 1977, p.245. [ Links ]
[39] RODRÍGUEZ-MONROY M; GALINDO E. Broth rheology, growth and metabolite production of Beta vulgaris suspension culture: a comparative study between cultures grown in shake flask and in a stirred tank. Enzyme and Microbial Technology. 1999; 24(10):687-693. [ Links ]
[40] JUÁREZ-SÁNCHEZ M, JIMÉNEZ-APARICIO A, GUTIERREZ-LÓPEZ G, TREJO-TAPIA G, RODRÍGUEZ-MONROY M. Broth rheology of Beta vulgaris cultures growing in an air lift bioreactor. Biochemical Engineering Journal. 2002; 12(1):37-41. [ Links ]
[41] LEE-PARSONS C, SHULER M. Sparge gas composition affects biomass and ajmalicine production from immobilized cell cultures of Catharanthus roseus. Enzyme and Microbial Technology. 2005; 37(4):424-434. [ Links ]
[42] TRUNG N, MURTHY HN, YU K, JEONG CS, HAHN EJ, PAEK KY. Effect of oxygen supply on cell growth and saponin production in bioreactor cultures of Panax ginseng. Journal of Plant Physiology. 2006; 163(12):1337-1341. [ Links ]
[43] HUANG SY, CHOU CJ. Effect of gaseous composition on cell growth and secondary metabolite production in suspension culture of Stizolobium hassjoo cells. Bioprocess Engineering. 2000; 23(6):585-593. [ Links ]
[44] DORAN P. Design of mixing systems for plant cell suspensions in stirred reactors. Biotechnology Progress. 1999; 15(3):319-335. [ Links ]
[45] HAN J, ZHONG JJ. Effects of oxygen partial pressure on cell growth and ginsenoside and polysaccharide production in high density cell cultures of Panax notoginseng. Enzyme and Microbial Technology. 2003; 32(3):498-503. [ Links ]
[46] JEONG CS, CJAKRABARTY D, HAHN, LEE HL, PAEK KY. Effects of oxygen, carbon dioxide and ethylene on growth and bioactive compound production in bioreactor culture of ginseng adventitious roots. Biochemical Engineering Journal. 2006; 27(3):252-263. [ Links ]
[47] HUANG SY, SHEN YW, CHAN HS. Development of a bioreactor operation strategy for L-DOPA production using Stizolobium hassjoo suspension culture. Enzyme and Microbial Technology. 2002; 30(6): 779-791. [ Links ]
[48] PAN ZW, WANG HQ, ZHONG JJ. Scale-up study on suspension cultures of Taxus chinensis cells for production of taxane diterpene. Enzyme and Microbial Technology. 2000; 27(9): 714-723. [ Links ]
[49] ZHONG JJ, CHEN F, HU WW. High density cultivation of Panax notoginseng cells in stirred bioreactors for the production of ginseng biomass and ginseng saponin. Process Biochemistry. 1999; 35(5): 491-496. [ Links ]
[50] PRAKASH G, SRIVASTAVA AK. Azadirachtin production in stirred tank reactors by Azadirachta indica suspension culture. Process Biochemistry. 2007; 42(1): 93-97. [ Links ]
[51] OUYANG J, WANG XD, ZHAO B, WANG YC. Improved production of phenylethanoid glycosides by Cistanche deserticola cells cultured in an internal loop airlift bioreactor with sifter riser. Enzyme and Mycrobial Technology. 2005; 36(7): 982-988. [ Links ]
[52] TABATA M, FUJITA Y. Production of shikonin by plant cell cultures. En: Zaitlin M, Day P, Hollaender A, Editores. Biotechnology in Plant Science. Orlando. Academic Press; 1985. p. 207-223. [ Links ]
[53] NAVIA-OSORIO A, GARDEN H, CUSIDO R, PALAZON J, ALFERMANN A, PIÑOL M. Taxol and Baccatin III production in suspension cultures of Taxus baccata and Taxus wallichiana in an air-lift bioreactor. Journal of Plant Physiology. 2002; 159(1):97-102. [ Links ]
[54] SMART NJ, FOWLER MW. Effect of aeration on large scale culture of plant cells. Biotechnology Letters. 1981; 3(4):171–176. [ Links ]
[55] ROSEVEAR A. Putting a bit of color into the subject. Trends in Biotechnology. 1984; 2:145–146. [ Links ]
[56] TAKEDA T, TAKEUCHI Y, SEKI M, FURUSAKI S, Matsuoka H. Kinetic analysis of cell growth and vitamin E production in plant cell culture of Carthamus tinctorius using a structured model. Biochemical Engineering Journal. 1998; 1(3):233-242. [ Links ]
[57] SIROIS J, PERRIER M, ARCHAMBAULT J. Development of a two-step segregated model for the optimization of plant cell growth. Control Engineering Practice. 2000; 8(7) 813-820. [ Links ]
[58] LI C, YUAN YJ, WU JC, HU ZD. A structured kinetic model for suspension cultures of Taxus chinensis var. mairei induced by an oligosaccharide from Fusarium oxysporum. Biotechnology Letters. 2003; 25(16): 1335-1343. [ Links ]
[59] KIM JH. Prepurification of paclitaxel by micelle and precipitation. Process Biochemistry. 2004; 39(11):1567-1571. [ Links ]
[60] TREYBAL R. Operaciones de transferencia de masa. 2a Ed. México. McGraw-Hill. 1988. [ Links ]
[61] PYO S, PARK H, SONG B, HAN B, KIM J. A large-scale purification of paclitaxel from cell cultures of Taxus chinensis. Process Biochemistry. 2004; 39(12):1985–1991. [ Links ]
[62] VONGSANGNAK W, GUA J, CHAUVATCHARIN S, ZHONG J. Towards efficient extraction of notoginseng saponins from cultured cells of Panax notoginseng. Biochemical Engineering Journal. 2004; 18(2):115–120. [ Links ]
[63] PONGNARAVANE B, GOTO M, SASAKI M, ANEKPANKUL T, PAVASANT P, SHOTIPRUK A. Extraction of anthraquinones from roots of Morinda citrifolia by pressurized hot water: Antioxidant activity of extracts. Journal of Supercritical Fluids. 2006; 37(3):390-396. [ Links ]
[64] HEMWIMOL S, PAVASANT P, SHOTIPRUK A. Ultrasound-assisted extraction of anthraquinones from roots of Morinda citrifolia. Ultrasonics Sonochemistry. 2006; 13(6):543-548. [ Links ]
[65] DÖRNENBURG H, KNORR D. Strategies for the improvement of secondary metabolite production in plant cell cultures. Enzyme Microbial Technology. 1995; 17(8): 674-684. [ Links ]
[66] BASSETTI L, HAGENDOORN M, TRAMPER J. Surfactant-induced non-lethal release of anthraquinones from suspension cultures of Morinda citrifolia. Journal of Biotechnology. 1995; 39(2):149-155. [ Links ]
[67] THIMMARAJU R, BHAGYALAKSHMI N, NARAYAN M, RAVISHANKAR G. Kinetics of pigment release from hairy root cultures of Beta vulgaris under the influence of pH, sonication, temperature and oxygen stress. Process Biochemistry. 2003; 38(7):1069-1076. [ Links ]














