Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.72 no.157 Medellín Jan./Apr. 2009
ALGUNOS CONCEPTOS SOBRE NITRURO DE TITANIO Y EL CARBURO DE TITANIO
SOME CONCEPTS ABOUT TITANIUM NITRIDE AND TITANIUM CARBIDE
ELISABETH RESTREPO PARRA
Grupo de Desarrollo de Nuevos Materiales, Universidad Nacional de Colombia, Sede Manizales, erestrepop@unal.edu.co
PEDRO JOSE ARANGO ARANGO
Departamento de Física y Química, Universidad Nacional de Colombia, Sede Manizales, erestrepop@unal.edu.co
SIMEÓN CASANOVA TRUJILLO
Departamento de Matemáticas y estadística, Universidad Nacional de Colombia, Sede Manizales, scasanova@unal.edu.co
Recibido para revisar abril 15 2008, aceptado mayo 22 de 2008, versión final noviembre 29 de 2008
RESUMEN: En este artículo se presentan algunas características estructurales y químicas de materiales utilizados comúnmente en aplicaciones industriales como nitruro de titanio (TiN) y carburo de titanio (TiC). El análisis inicial se llevó a cabo a partir de los diagramas de fase del TiN y el TiC. En ellos se observan propiedades importantes como punto de fusión, punto de evaporación, polimorfismo y solubilidad entre otros. La comprensión de estos diagramas de fase lleva a un mejor entendimiento de las características de estos materiales. Por otro lado se hizo una evaluación de los enlaces químicos que resultan en la formación de las moléculas del TiN y TiC, teniendo en cuenta que en estos compuestos se presenta una combinación de enlaces iónico, covalente y metálico, lo que les otorga excelentes propiedades eléctricas mecánicas y tribológicas. Además, se consideró la hibridación que se produce para conseguir compuestos estables.
PALABRAS CLAVE: fases, temperatura, enlaces moleculares, hibridación.
ABSTRACT: In this work a sumary of structural and chemical characteristics of materials commonly employed in industrial applications such as TiN and TiC was realized. The analysis was realized from the phase diagrams of TiN and TiC. This materials present, important characteristics such as melting point, boiling point, polymorphism and solubility among others, are observed. These phase diagrams carry to a best understanding to the material properties. On the other hand, an analysis of chemical bonds that result in the TiN and TiC molecules formation, having into a count that they present ionic, covalent and metallic molecular combination bonds was carried out. Moreover, the hybridization that is produced in order to get stable compounds was considered.
KEYWORDS: Phases, temperature, molecular bonds, hybridization.
1. INTRODUCCIÓN
El titanio es un elemento de transición como el circonio, vanadio, cromo, niobio, molibdeno, entre otros, cuya estructura electrónica presenta
una capa d incompleta [1, 2]. Dicha estructura electrónica permite que el titanio forme soluciones sólidas con muchos elementos sustitucionales como el carbón y el nitrógeno, con un factor de tamaño hasta del 20% [3, 4].
Desde un primer momento, el titanio ha sido catalogado como un metal ligero, a pesar de que su densidad es de 4.51 gr/cm3, que es casi el doble de la del aluminio, debido a su excelente relación entre resistencia mecánica y densidad [5]. TiN y TiC son materiales similares que tienen alta dureza, buena resistencia al desgaste con un alto punto de fusión y buena resistencia química [6]. Además, se consideran materiales industrialmente importantes y tienen un gran número de aplicaciones en herramientas de corte y piezas de maquinaria, especialmente en forma de recubrimientos [7-11].
Las primeras publicaciones para mejorar el desempeño de recubrimientos de TiN producidos por PVD para herramientas de corte aparecieron en los 80s [12]. En la última década ha habido un crecimiento en la aceptación del desempeño benéfico del TiN para la industria de la manufactura, siendo ampliamente empleado por empresas tales como Teer Coatings Ltd, BryCoat y Irwin Industrial tools entre otras [13-15].
La siguiente generación de los recubrimientos PVD importantes, después de los recubrimientos de TiN, son los recubrimientos de TiC [16-20], TiCN [21-24], TiAlN [25-30] y TiAlVN [31, 32]. Estos materiales han llegado rápidamente a tener gran importancia comercial en los mercados de Australia, Europa, Norteamérica y Asia [33]. El desempeño superior del recubrimiento de TiCN sobre los recubrimientos de TiN en herramientas de corte se debe al bajo coeficiente de fricción y a un más alto coeficiente de transferencia de calor [12, 34, 35]. Probablemente la razón por la cual, los recubrimientos de TiCN no han emergido lo suficiente como un recubrimiento importante PVD se debe a las dificultades en el procesamiento, el control de la estequiometría, el esfuerzo residual y la escogencia del gas hidrocarburo portador apropiado, que en ocasiones es metano y en otras acetileno [36].
Los materiales en estado sólido existen en muchas formas diferentes o fases. El número de tales fases puede ser grande incluso para sustancias puras, por ejemplo el hielo puede existir en varias fases sólidas y un metal tan importante como el hierro presenta hasta cuatro fases sólidas. En los sistemas que presentan más de una especie química el número de fases puede ser aún mayor [37]. Con frecuencia, aún en sistemas comerciales importantes, no se tiene la disponibilidad de datos que cubra completamente todo el rango de concentraciones y temperaturas. En vista del hecho de que las propiedades de los materiales dependen significativamente de la naturaleza, número, cantidad, y forma de las posibles fases que se presentan y pueden cambiar por alteraciones en dichas cantidades, es vital, para cualquier aplicación, conocer las condiciones bajo las cuales cualquier sistema dado puede existir en sus varias formas posibles [38, 39].
A través de los años se ha acumulado gran cantidad de información de un gran número de sistemas; para registrar tal enorme cantidad de datos se acostumbra graficar el número y composición (e indirectamente las cantidades) de fases presentes como función de la temperatura, la presión y sobre todo la composición. Estas gráficas se denominan diagramas de fase, diagramas de constitución o diagramas de equilibrio. Este último nombre se deriva del hecho de que tales diagramas permiten mostrar la mayoría de las fases estables que se encuentran bajo condiciones de equilibrio [38, 40].
El término condiciones de equilibrio requiere cierta elaboración. Estrictamente hablando el estado de equilibrio de un sistema es aquel en el cual las propiedades de dicho sistema no cambian con el tiempo, a menos que se ejerza una restricción. En este último sentido, restricción significa normalmente una alteración de la temperatura, la presión o la composición, pero puede también referirse a la aplicación de fuerzas mecánicas, eléctricas, magnéticas, etc [41]. En la práctica, sin embargo, la definición de equilibrio se modifica teniendo en cuenta las velocidades relativas de los posibles procesos que puedan introducirse en un sistema por cambios en la temperatura, la composición o la presión. Frecuentemente un sistema es importante sólo para ciertos valores de presión, temperatura y composición; en tales casos las reacciones al interior de los sistemas pueden proceder a velocidades que son: i) tan lentas que producen cambios despreciables en las propiedades para períodos de tiempo lo suficientemente considerables. ii) tan rápidas que llegan al equilibrio en menos tiempo que el que se puede registrar de manera práctica y iii) una magnitud intermedia.
Tanto en la determinación como en el uso de los diagramas de fase se ha hecho un acercamiento fundamentalmente empírico, aunque en general ellos poseen una fuerte base termodinámica. En principio, al menos los diagramas de equilibrio, pueden calcularse por relaciones termodinámicas [42]. En la práctica, sin embargo, sólo se recurre a sustituciones relativamente simples fundamentalmente debido a que no solo la teoría exacta para casos generales es bastante compleja, sino que además muchos de los datos termodinámicos necesarios no se encuentran disponibles. Otros acercamientos posibles son: i) estudios desde un punto de vista puramente químico, con lo cual se involucrarían algunos sistemas que no son de interés. ii) una visión puramente matemática, haciendo uso de un lenguaje y simbolismos que no se manejan normalmente en ingeniería. iii) estudio geométrico y/o aproximación fenomenológica a los diagramas de fase sin casi ninguna discusión termodinámica [39].
La mayoría de los diagramas de fase han sido construidos según condiciones de equilibrio (aunque los cambios de fases se pueden observar tanto con el aumento como con la disminución de la temperatura, normalmente los diagramas de fases se realizan en condiciones de enfriamiento lento), siendo utilizadas por ingenieros y científicos para entender y predecir muchos aspectos del comportamiento de los materiales. Los diagramas de fases más comunes involucran temperatura versus composición. La información que se puede obtener de los diagramas de fase permite: 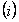 conocer que fases están presentes a diferentes composiciones y temperaturas bajo condiciones de enfriamiento lento (equilibrio).
conocer que fases están presentes a diferentes composiciones y temperaturas bajo condiciones de enfriamiento lento (equilibrio). 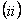 Determinar la solubilidad en el estado sólido y en el equilibrio de un elemento (o compuesto) dentro de otro.
Determinar la solubilidad en el estado sólido y en el equilibrio de un elemento (o compuesto) dentro de otro. 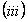 Hallar la temperatura a la cual una aleación enfriada bajo condiciones de equilibrio comienza a solidificar y la temperatura a la cual ocurre la solidificación,
Hallar la temperatura a la cual una aleación enfriada bajo condiciones de equilibrio comienza a solidificar y la temperatura a la cual ocurre la solidificación, 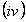 Conocer la temperatura a la cual comienzan a fundirse en diferentes fases [43].
Conocer la temperatura a la cual comienzan a fundirse en diferentes fases [43].
Por otro lado, el estudio de los enlaces que se forman en un compuesto permite determinar muchas de sus propiedades. La forma como dos elementos se enlazan depende de consideraciones tales como electronegatividad y tamaño del átomo así mismo como de su valencia electrónica. Estas características que gobiernan su estructura y su estequiometría [44]. Un enlace es una fuerza de atracción que mantiene juntos los átomos de una molécula o de un cristal. Estos se caracterizan especialmente por su longitud y su energía. La naturaleza del enlace es una función de la configuración electrónica de los elementos constituyentes, el tipo de orbítales disponibles y la polaridad del enlace. En el caso del TiN y TiC estos enlaces son una combinación iónico, covalente, metálico [45]. El enlace metálico se forma entre los iones metal – metal (para este caso Ti-Ti), y depende fuertemente del punto de fusión y del grupo al que pertenece el metal. Es así como para el caso de Ti, por pertenecer al grupo IV de la tabla periódica, el punto de fusión del nitruro y del carburo es mayor que el del Ti. Además, los enlaces metálicos para elementos del grupo IV son débiles, mientras que los enlaces Ti-C y Ti-N son fuertes, contrario a lo que sucede con los metales del grupo V, en los que los enlaces metal-metal son fuertes y los enlaces del metal con el carbón o con el nitrógeno son débiles. Ahora bien, debido a que el carbón y el nitrógeno son mucho mas electronegativos que el titanio, se favores la formación de un alto porcentaje de enlaces iónicos del tipo Ti-N y Ti-C. la porción de enlace covalente de estos materiales se debe esencialmente a la superposición de los orbitales p del carbono y del nitrógeno, con los orbitales d del titanio [6, 46]. El tema de los enlaces se analizara con mayor profundidad más adelante. [6]
En este trabajo se presenta un análisis de los diagramas de fases del TiN y TiC, analizando puntos críticos de las transiciones de fases y los diferentes compuestos que se pueden presentar además de las estructuras cristalinas de dichas fases. Por otro lado, se realiza un estudio de los enlaces que se forman en cada uno de los compuestos relacionados en este documento, que fundamentan sus propiedades físicas especiales y que les otorgan las diversas aplicaciones industriales.
2. DIAGRAMAS DE FASES
2.1 Sistema Ti-N
En la figura 1(a) se presenta el diagrama de fase del sistema Ti-N y el las figuras 1(b) y 1(c) se muestran las combinaciones liquido-solido y sólido-sólido respectivamente. Las fases sólidas en equilibrio de este sistema son: 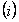 la solución sólida terminal hcp, a-Ti,
la solución sólida terminal hcp, a-Ti, 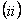 la solución sólida terminal bcc, b-Ti,
la solución sólida terminal bcc, b-Ti, 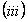 el nitruro tetragonal Ti2N,
el nitruro tetragonal Ti2N, 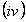 el nitruro fcc, d-TiN,
el nitruro fcc, d-TiN, 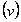 el nitruro bct (bulk centered tetragonal) d'-TiN [47, 48]. Los dos primeros están clasificados dentro del grupo de cerámicos intersticiales, puesto que los átomos de nitrógeno se encuentran en bajo porcentaje y se acomodan en los intersticios o espacios libres dentro de la estructura de este metal [36, 38]. La figura 2 presenta cada una de las estructuras antes mencionadas. Las soluciones sólidas a-Ti y b-Ti, tienen un amplio rango de composiciones. El nitrógeno disuelto existe en un rango estable para a-Ti por encima de la temperatura de transformación alotrópica b-Ti
el nitruro bct (bulk centered tetragonal) d'-TiN [47, 48]. Los dos primeros están clasificados dentro del grupo de cerámicos intersticiales, puesto que los átomos de nitrógeno se encuentran en bajo porcentaje y se acomodan en los intersticios o espacios libres dentro de la estructura de este metal [36, 38]. La figura 2 presenta cada una de las estructuras antes mencionadas. Las soluciones sólidas a-Ti y b-Ti, tienen un amplio rango de composiciones. El nitrógeno disuelto existe en un rango estable para a-Ti por encima de la temperatura de transformación alotrópica b-Ti 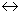 a-Ti, a 882 °C, hasta un máximo en 2350 °C, correspondiente al peritéctico L+ a-Ti
a-Ti, a 882 °C, hasta un máximo en 2350 °C, correspondiente al peritéctico L+ a-Ti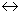 d-TiN muy por encima del peritéctico L+ b-Ti
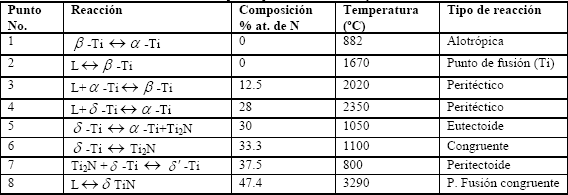
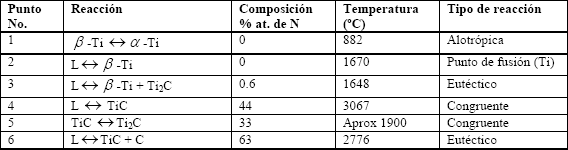
d-TiN muy por encima del peritéctico L+ b-Ti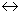 a-Ti, y el punto de fusión de la fase b-Ti a 1670°C. El campo de la fase a-Ti está limitado en su lado rico en Ti desde 882°C hasta 2020°C por una región de combinación en equilibrio con la fase b-Ti, y desde 2020°C hasta 2350°C por la línea del solidus. En su lado rico en nitrógeno, el rango de la fase a-Ti se limita por las composiciones en equilibrio con Ti2N, en 1050 °C hasta el peritéctico en 2350 °C. Los límites ricos en Ti de la fase a-Ti se interceptan en el punto de equilibrio a-Ti+TiN+ Ti2N, que se describe en el diagrama como un eutectoide a 1050 °C. La tabla 1 presenta algunos puntos importantes en el diagrama de fases del TiN.
a-Ti, y el punto de fusión de la fase b-Ti a 1670°C. El campo de la fase a-Ti está limitado en su lado rico en Ti desde 882°C hasta 2020°C por una región de combinación en equilibrio con la fase b-Ti, y desde 2020°C hasta 2350°C por la línea del solidus. En su lado rico en nitrógeno, el rango de la fase a-Ti se limita por las composiciones en equilibrio con Ti2N, en 1050 °C hasta el peritéctico en 2350 °C. Los límites ricos en Ti de la fase a-Ti se interceptan en el punto de equilibrio a-Ti+TiN+ Ti2N, que se describe en el diagrama como un eutectoide a 1050 °C. La tabla 1 presenta algunos puntos importantes en el diagrama de fases del TiN.
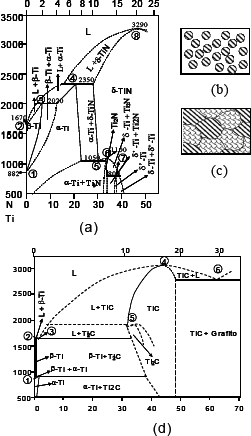
Figura 1. (a) Diagrama de fases del sistema TiN [47, 48]. (b) Mezcla de fases liquida y sólida (c) Mezcla de dos fases sólidas (d) Diagrama de fases del sistema Ti-C [49, 50]
Figure 1. Phase diagram of the Ti-N system [47, 48]. (b) Mixture of solid and liquid phases (c) Mixture of two solid phases. (d) Phase diagram of the Ti-C system [49, 50]
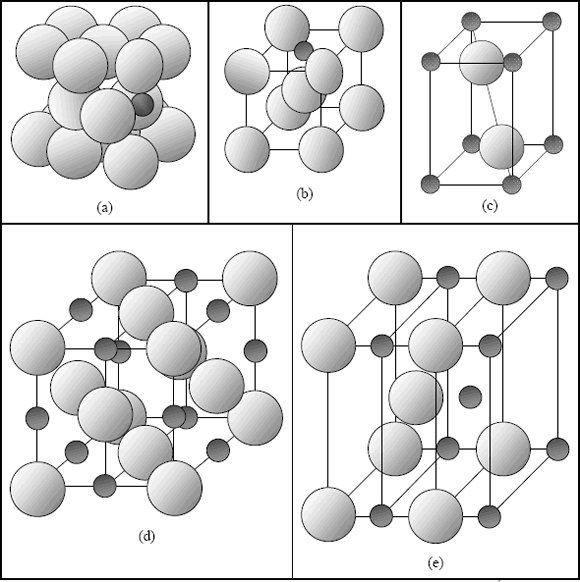
Figura 2. Diferentes estructuras del sistema Ti-N. a) a-Ti, b) b-Ti, c) Ti2N, d) d-TiN e) d'-TiN [47]
Figure 2. Different structures of the Ti-N system. a) a-Ti, b) b-Ti, c) Ti2N, d) d-TiN e) d'-TiN [47]
Tabla 1. Puntos especiales en el sistema Ti-N
Table 1. Special points in the Ti-N system
El nitrógeno disuelto (intersticial) también existe en la fase b-Ti por encima del punto de fusión del Ti, hasta un pico en el peritéctico a 2020 °C. Su campo está limitado en el lado rico en Ti desde 1670°C hasta 2020 °C por su solidus y en lado rico en N desde 882 °C hasta 2020 °C por su combinación en equilibrio con a-Ti. Las fases estables de la mezcla Ti-N son: a-Ti, b-Ti, d-TiN. El Ti2N es estable sólo en estrecho rango de composiciones y se transforma congruentemente a 1100°C en d-TiN. Los límites del campo del Ti2N por el lado rico en N están a una composición en equilibrio con d-Ti, por debajo del eutectoide en 1050 °C; otros límites ricos en Ti o en N están en equilibrio con la fase d-TiN. La fase del d'-TiN, también con un estrecho rango de composiciones, cambia en el peritectoide a 800 °C. La fase d-TiN existe estable sobre un extenso rango de composiciones y temperaturas hasta el punto congruente de la temperatura de fusión, aproximadamente en 3290 °C.
El límite rico en N, por encima del 50%, no ha sido determinado como se puede ver en la figura con las líneas punteadas. Pero en el lado rico en Ti, el campo de la fase está limitado por el solidus, por encima del peritéctico en equilibrio en 2350 °C, y para composiciones en equilibrio con la fase a-Ti entre 2350 °C y 1050 °C.
2.2 Sistema Ti-C
En la figura 1(d) se presenta el diagrama de fases del TiC. El sistema condensado Ti-C se ha caracterizado por tener un porcentaje atómico de carbón de 0 a 70%. Además de las soluciones b-Ti (bcc) y a-Ti (hcp), existe un carburo en equilibrio, TiC con la misma estructura de la fase d-TiN, en un rango de porcentajes atómicos homogéneos entre 32% y 48.8% C [49]. Este sistema también tiene otra forma denominada Ti2C, en la misma región, en el cual, las vacancias están ordenadas sobre la sub-red del carbón [6].
Diferentes investigadores realizaron diagramas de fases para este material. El sistema Ti-C presenta la misma transformación alotrópica a 882 ºC mostrada en el sistema Ti-N a 0% de porcentaje atómico de carbón. Las soluciones sólidas b-Ti y a-Ti se presentan a contenido de carbón muy bajos, comparados con el sistema Ti-N.
Aún no se ha encontrado un límite exacto de equilibrio entre las fases TiC y Ti2C, por lo que las líneas punteadas están truncadas. Se presenta además una transformación L TiC+C (grafito) en 2776 ºC con una composición eutéctica de 63%. En la tabla 2 se muestran algunos puntos especiales del sistema Ti-C [50].
TiC+C (grafito) en 2776 ºC con una composición eutéctica de 63%. En la tabla 2 se muestran algunos puntos especiales del sistema Ti-C [50].
Tabla 2. Puntos especiales en el sistema Ti-C
Table 2. Special points in the Ti-C system
3. ENLACES QUIMICOS
TiN y TiC se consideran como materiales refractarios, es decir, tienen alto punto de fusión y son químicamente estables a altas temperaturas [51]. Sus estructuras intersticiales permiten la combinación de enlaces iónicos covalente y metálico, y por tal razón combinan las propiedades físicas de los cerámicos y las propiedades eléctricas de los metales, como es el caso de alta dureza y alta conductividad térmica [6, 52].
3.1 Nitruro de Titanio
Las características y las propiedades del nitruro de titanio indican que este material es más que una simple solución de átomos de nitrógeno dentro de la red del metal de transición. Se ha observado una gran diferencia entre el nitruro de titanio y el material huésped (titanio), indicándose la presencia de enlaces titanio – nitrógeno, sin la aparición de enlaces nitrógeno – nitrógeno [53]. En general se ha reportado que el enlace de estos dos materiales es una combinación de tres tipos de enlaces [6, 52]: (i) el enlace iónico que resulta de la transferencia de electrones de titanio hacia el nitrógeno, ya que este último tiene una electronegatividad más alta (la electronegatividad del N es 3.04 y la electronegatividad del Ti es 1.54 [6]). (ii) el enlace metálico, con una densidad finita de estados en el nivel de energía de Fermi, (iii) El enlace covalente se presenta en mayor proporción y se genera por la superposición entre los estados d del titanio y los estados p del nitrógeno, con alguna interacción metal –metal [6].
El nitrógeno organiza sus electrones de valencia con una configuración 2s22p12p12p1 mientas que el titanio forma una configuración 4s13d13d13d1. Los orbítales p del nitrógeno forman enlaces covalentes con el titanio tanto de tipo s comop.
Cuando los electrones gastan la mayoría de su tiempo en la región que se encuentra directamente entre los dos núcleos, la superposición de la nube de electrones de los dos átomos constituyentes del enlace se denomina s, ya que se parece a un orbital del tipo s del átomo de hidrógeno (que presenta una nube de electrones dentro de una esfera). Los electrones que se encuentran al otro lado (diferente a la región intermedia de los núcleos), se dice que se encuentran anti-enlazados y a estos orbítales se les denomina s*.
La energía del enlace s es menor que la de los orbítales que lo componen y que la energía del anti-enlace s*, que tiene mayor energía incluso que los orbítales que lo forman. Cuando se produce un enlace covalente en el que se comparten electrones, existe una superposición entre las funciones de ondas propias de cada uno de de ellos.
Cuando esta superposición es tal que se forma una interferencia constructiva entre las funciones de onda, se produce un enlace s, pero cuando dicha superposición forma una interferencia destructiva, se obtiene un anti-enlace s* [55]. La superposición de los orbítales d del titanio en forma de enlaces 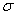 producen un cierto grado de interacción del tipo Ti-Ti. La figura 3 muestra los enlaces covalentes formados en el sistema Ti-N, para el plano (100) del d-TiN. Figura 3(a) muestra el enlace s entre los orbitales p del nitrógeno y d del titanio. Figura 3(b) presenta el enlace p entre los orbitales p del nitrógeno y d del titanio y figura 3(c) esquematiza el enlace s entre los orbitales d del titanio. La transferencia de electrones del titanio hacia el nitrógeno se produce debido a que el nitrógeno tiene mayor electronegatividad que el titanio, los electrones involucrados en los enlaces, pasan más tiempo cerca de la coraza del átomo de nitrógeno que del titanio, como se muestra en la figura 4. Teniendo en cuenta que el nitrógeno tiene valencia 5 y el titanio valencia 4, se tienen 9 electrones para formar los enlaces. Los elementos buscan llenar su último nivel de energía, para estar en equilibrio y por esta razón se forman los compuestos [56]. En el caso del TiN, se tiene un electrón de valencia, que viene a formar un enlace metálico, como se muestra en la figura 5. Un enlace metálico se presenta en un material cuando se tiene un conjunto de iones, que en este caso son de TiN+, que se consideran prácticamente inmóviles, y los electrones de valencia, que están débilmente enlazados, forman una nube, que está moviéndose continuamente. La figura 6 muestra un esquema simplificado de bandas para el TiN.
producen un cierto grado de interacción del tipo Ti-Ti. La figura 3 muestra los enlaces covalentes formados en el sistema Ti-N, para el plano (100) del d-TiN. Figura 3(a) muestra el enlace s entre los orbitales p del nitrógeno y d del titanio. Figura 3(b) presenta el enlace p entre los orbitales p del nitrógeno y d del titanio y figura 3(c) esquematiza el enlace s entre los orbitales d del titanio. La transferencia de electrones del titanio hacia el nitrógeno se produce debido a que el nitrógeno tiene mayor electronegatividad que el titanio, los electrones involucrados en los enlaces, pasan más tiempo cerca de la coraza del átomo de nitrógeno que del titanio, como se muestra en la figura 4. Teniendo en cuenta que el nitrógeno tiene valencia 5 y el titanio valencia 4, se tienen 9 electrones para formar los enlaces. Los elementos buscan llenar su último nivel de energía, para estar en equilibrio y por esta razón se forman los compuestos [56]. En el caso del TiN, se tiene un electrón de valencia, que viene a formar un enlace metálico, como se muestra en la figura 5. Un enlace metálico se presenta en un material cuando se tiene un conjunto de iones, que en este caso son de TiN+, que se consideran prácticamente inmóviles, y los electrones de valencia, que están débilmente enlazados, forman una nube, que está moviéndose continuamente. La figura 6 muestra un esquema simplificado de bandas para el TiN.
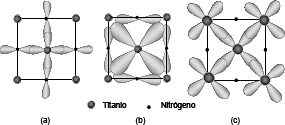
Figura 3. Enlaces covalentes formados en el sistema Ti-N, para el plano (100) del d-TiN (a) Enlace s (b) Enlace p. (c) Enlace s [6, 54]
Figure 3. covalent bonds formed in the Ti-N system, for the plane (100) of d-TiN (a) s bond. (b) p bonds. (c) s bonds [6, 54]
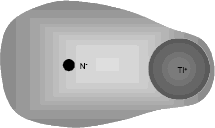
Figura 4. Formación del enlace iónico entre el titanio y el nitrógeno. La nube de electrones permanece más tiempo cerca del nitrógeno
Figure 4. Formation of ionic bonds between titanium and nitrogen. The electron cloud is maintained much time close to the nitrogen
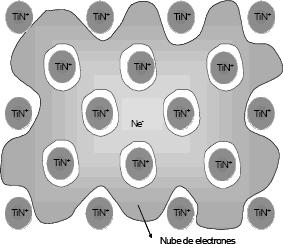
Figura 5. Enlace metálico del TiN. Fondo de iones inmóviles dentro de una nube de electrones
Figure 5. Metallic bond of TiN. Background of unmovable ions into a cloud of electrons
Como ya habíamos especificado, este material tiene 9N electrones de valencia dentro del sólido. El número total de orbítales que tiene el compuesto es 10 (por el titanio 1 y 5 correspondientes a los niveles s y d, por el nitrógeno 1 y 3 correspondientes a los niveles s y p). Cada orbital está ocupado por dos electrones con espines opuestos. La banda de valencia que contiene 8N electrones tiene 4N orbítales, quedando totalmente llena. Por otro lado, en la banda de conducción se tienen los 6N orbítales restantes que son ocupados solamente por 1N electrones, dejándola semi-vacía [56].
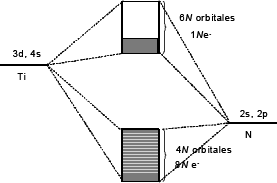
Figura 6. Esquema simplificado de bandas de energía del TiN
Figure 6. Simplified scheme of bands of energy for TiN
3. 2 Carburo de Titanio
El caso de los enlaces entre el titanio y el carbón es similar al caso del titanio y el nitrógeno. Hasta el momento no se ha podido establecer exactamente como se enlazan estos átomos para formar el TiC. El titanio y el carbón se relacionan en virtud de sus posiciones en la tabla periódica; el carbón ocupa el grupo principal y el titanio, la misma posición en las series de transición. Cada uno tiene cuatro electrones de valencia, pero cuando ellos se combinan para formar enlaces, ellos alcanzan diferentes resultados [6]. En el átomo de carbón sucede hibridación. La configuración 1s22s22p2 del átomo de carbón en el estado base no tiene en cuenta los diferentes tipos de enlaces encontrados en la molécula de carbón o en otros compuestos como carburos e hidrocarburos entre otros. Para estudiar estos enlaces, la configuración del estado base debe ser alterada a un estado con cuatro electrones, cada uno en un orbital separado y cada uno con su espín desacoplado de los otros electrones. Esta alteración ocurre como resultado de la formación de orbítales atómicos híbridos. La hibridación puede tomar alguna de las tres siguientes formas, cada una con su propia distribución de enlaces en el espacio: sp3, sp2 y sp. En las estructuras de los carburos la mayoría de los enlaces ocurren con una configuración sp3 que se describirá a continuación.
En la configuración híbrida sp3 el arreglo de los electrones en el nivel L de los átomos en el estado base se modifica cuando uno de los electrones del orbital 2s es promovido hacia un orbital de mayor energía 2p. Estos nuevos orbítales se denominan híbridos, ya que son la combinación de los orbítales 2s y 2p. En el titanio, el nivel d está parcialmente lleno.
Las características estructurales y las propiedades del TiC reflejan un cambio obvio en los enlaces atómicos a diferencia del metal puro. Algunas de estas diferencias son: (i) los carburos son duros y frágiles, mientras que el titanio es maleable y muy dúctil. (ii) el TiC tiene una alta energía de enlace, superior a la del titanio (iii) el punto de fusión del TiC es más alto que el del Ti. Los átomos de carbón dentro del TiC se consideran como átomos aislados que se incrustan dentro de la red cristalina del Ti, sin que exista esencialmente enlaces carbón – carbón, ya que la distancia entre ellos es muy grande como para que exista una interacción atómica significante.
La totalidad del esquema de los enlaces se limita por lo tanto a la interacción metal – metal y metal – carbón, que se combinan en tres tipos de enlaces iónico, covalente y metálico, los cuales se comportan de manera similar a los descritos anteriormente para el TiN. Para obtener una representación de la estructura del TiC es necesario realizar un estudio de la estructura electrónica de bandas y de densidad de estados. La electronegatividad del carbón es mucho mayor que la del titanio, por lo tanto el enlace iónico resulta de la transferencia de electrones del uno al otro, generando una interacción electrostática. Se ha establecido que la transferencia de carga del titanio hacia el carbón es de aproximadamente medio electrón, resultando en la formación de dos iones Ti+ y C- [6]. De acuerdo por la regla propuesta por Pauling [58], el porcentaje de contribución del enlace iónico se puede calcular por la ecuación , siendo 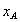 y
y /../../../SciELO/serial/dyna/v76n157/img/a21027.gif" v:shapes="_x0000_i1036"> son las electronegastividades de los átomos
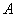 y
y 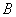 del compuesto. Para el caso del Ti y C, las electronegatividades son 1. 54 y 2.55 respectivamente, resultando en un porcentaje de enlace iónico Ti-C menor del 30%. Se puede concluir entonces, que para el caso Ti-C, el enlace covalente es dominante [59].
del compuesto. Para el caso del Ti y C, las electronegatividades son 1. 54 y 2.55 respectivamente, resultando en un porcentaje de enlace iónico Ti-C menor del 30%. Se puede concluir entonces, que para el caso Ti-C, el enlace covalente es dominante [59].
Los enlaces covalentes se producen entre Ti-C y Ti-Ti resultando principalmente de la interacción entre los orbítales 2sp del carbón y los 3d del titanio. Con el fin de formar el TiC, las bandas sp de los átomos de carbón se hibridizan con las bandas d del átomo metálico [60], Es decir que se forma una banda d2sp3 debido a la hibridación, ya que el agrupamiento típico octaédrico de los átomos metálicos centrados en el carbón tiene seis enlaces con las seis esquinas del octaedro, favoreciéndose así la formación de enlaces Ti-C. La figura 7 muestra estos enlaces en el octaedro. El carácter metálico de los enlaces se debe a la interacción Ti – Ti, produciendo una densidad de estados y energía de Fermi finitas y una apreciable densidad de electrones en la celda unidad. Como resultado, algunas propiedades tales como conductividad térmica y conductividad eléctrica tienen fuertes características metálicas. Aunque en el sistema del TiC se tienen ocho electrones de valencia, que harían pensar que la banda de valencia está completamente llena y la banda de conducción totalmente vacía, el hecho de que se produzca hibridación entre los diferentes orbítales atómicos de los dos átomos que lo componen, genera que estas bandas se traslapen, generando estados vacíos dentro de las bandas que permiten la conducción eléctrica y por lo tanto el carácter metálico [61]. En la figura 8 se presenta un esquema de esta situación.
Figura 7. Agrupamiento típico octaédrico de los átomos de titanio centrados en el carbón [6, 57]
Figure 7. Typical octahedrical grouping of the Ti atoms centered in the carbon [6, 57]
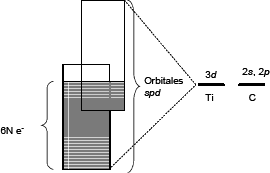
Figura 8. Esquema simplificado de bandas energía del TiC
Figure 8. Simplified scheme of bands of energy for TiC
4. CONCLUSIONES
El nitruro de titanio (TiN) y el carburo de titanio (TiC) se clasifican entre los nitruros y carburos de metales de transición. Estos materiales tienen propiedades especiales gracias a que son polimorfos y se pueden conseguir en diferentes fases de acuerdo a la concentración entre Ti/N y Ti/C.
El TiN y TiC son materiales que tienen una combinación de tres tipos de enlaces: enlace iónico que resulta de la transferencia de electrones de titanio hacia el nitrógeno o el carbón, debido a la diferencia de electronegatividad entre ellos; el enlace metálico, con una densidad finita de estados en el nivel de energía de Fermi, y el de mayor porcentaje, el enlace covalente, entre los estados d del titanio y los estados p del nitrógeno y sp del carbón, con alguna interacción metal –metal.
5. AGRADECIMIENTOS
Los autores agradecen A la Universidad Nacional de Colombia Sede Manizales por su apoyo para la realización de este artículo, a través de la División para el apoyo a la investigación, (DIMA), bajo el proyecto aprobado bajo la resolución No. CFCA030 del 2 de marzo de 2006.
REFERENCIAS
[1] LÉVY F., P. HONES, P.E. SCHMID, R. SANJINÉS, M. DISERENS, C. WIEMER, Surf. Coat. Technol. 120–121 (1999) 284–290. [ Links ]
[2] RESTREPO-PARRA E., S. AMAYA-RONCANCIO, C.M. BEDOYA-HINCAPIE, J.C. RIAÑO-ROJAS, Superlattices and Microstructures, 43 (2008) 559-563. [ Links ]
[3] GALASSO F. S., Structure and Properties of Inorganic Solids, Pergamon Press, New York (1970) [ Links ]
[4] KISLY P. S., The Chemical Bond Strength and the Hardness of High Melting Point Compounds, in Science of Hard Materials, Institute of Physics Conf. Series No. 75, Adam Hilger Ltd., Bristol, UK (1984). [ Links ]
[5] WELSH G., R. BOYER, E. W. COLLINS, Material properties Handbook: Titanium alloys, (Ohio-USA, Ed. ASM, 1994). [ Links ]
[6] PIERSON H. O. Handbook of refractory carbides and nitrides, (USA, Ed. Noyes Publications, 1996). [ Links ]
[7] SHIEU F.S., L.H. CHENG, Y.C. SUNG, J.H. HUANG, G.P. YU, Thin Solid Films 334 (1998) 125-132. [ Links ]
[8] LECLAIR P., G.P. BERERA, J.S. MOODERA, Thin Solid Films 376 (2000) 9-15 [ Links ]
[9] HUBER P., D. MANOVA, S. MÄNDL, B. RAUSCHENBACH, Surf. Coat. Technol., 174-175 (2003) 1243-1247. [ Links ]
[10] XIAO S., C. P. LUNGU, O. TAKAI, Thin Solid Films 334 (1998) 173-177 [ Links ]
[11] RADHAKRISHNAN G., P.M. ADAMS, D.M. SPECKMAN, Thin Solid Films 358 (2000) 131-138. [ Links ]
[12] WEI CHEHUNG, JEN FIN LIN, TSAE-HWA JIANG, CHI-FONG AI, Thin Solid Films 381 (2001)104-118. [ Links ]
[13] TEER, coatings ltda – www.teercoatings.co.uk [citado 10de septiembre de 2008].
[14] BRYCOAT – Advanced Metallurgical Coatings – http://www.brycoat.com [citado 10de septiembre de 2008]. [ Links ]
[15] IRWIN, Industrial tools - http://www.irwin.com [citado 10de septiembre de 2008]. [ Links ]
[16] KATIPELLI L. R., A. AGARWAL, N. B. DAHOTRE, Mater. Sci. Eng. A289 (2000) 34–40. [ Links ]
[17] SHI B., W. J. MENG, L. E. REHN AND P. M. BALDO, App. Phys. Letters, 81 (2002) 352-354. [ Links ]
[18] MENGA W.J., R.C. TITTSWORTHB, L.E. REHN, Thin Solid Films 377-378 (2000) 222-232. [ Links ]
[19] RADHAKRISHNAN G., P.M. ADAMS, D.M. SPECKMAN, Thin Solid Films 358 (2000) 131-138. [ Links ]
[20] WANG J, WEN-ZHI LI, HENG-DE LI, Thin Solid Films 382 (2001) 190-193. [ Links ]
[21] KARLSSONA L., U, L. HULTMAN, J.-E. SUNDGREN, Thin Solid Films 371 (2000) 167-177. [ Links ]
[22] ZUKERMAN I., A. RAVEH, Y. LANDAU, R. WEISS, R. SHNECK, Y. SHNEOR, H. KALMAN, J.E. KLEMBERG-SAPHIEHA, L. MARTINUUNO, Surf. Coat. Technol. 201 (2007) 6171-6175. [ Links ]
[23] CHENG Y., CHENG, Y.F. ZHENG, Surf. Coat. Technol., Volume 201 (2007) 4909-4912. [ Links ]
[24] LIU Z.-J., P. LEICHT, Y.-X. LIU, Z.-K. LIU, Surf. Coat. Technol. 201 (2006) 2818-2821. [ Links ]
[25] ACQUAVIVA S., E. DANNA, L. ELIA, M. FERNÁNDEZ, G. LEGGIERI, A. LUCHES, M. MARTINO, P. MENGUCCI, A. ZOCCO, Thin Solid Films 379 (2000) 45-49. [ Links ]
[26] IKEDA SH., S. GILLES, B. CHENEVIER, Thin Solid Films 315 (1998) 257–262. [ Links ]
[27] CHENGA Y.H., B. K. TAYA, S. P. LAUA, X. SHIA, H. C. CHUA, Thin Solid Films 379 (2000) 76-82. [ Links ]
[28] KIMURA A., T. MURAKAMI, K. YAMADA, T. SUZUKI, Thin Solid Films 382 (2001) 101-105. [ Links ]
[29] LIU X., C. JOHNSON, CH. LI, J. XU, C. CROSS, Internat. J. Hydrogen Energy, 33 (2008) 189-196. [ Links ]
[30] QUESADA F., A MARIÑO, E. RESTREPO, Surf. Coat. Technol. 201 (2006) 2925-2929. [ Links ]
[31] BRADBURY S. R., D. B. LEWIS, P. M. ARCHER, W. AHMED, Surf. Coat. Technol., 91 (1997) 192-199. [ Links ]
[32] WARD L. P., K. N. STRAFFORD, C. SUBRAMANIAN, T. P. WILKS, J. Mater. Proc. Technol., 56 (1996) 375-384. [ Links ]
[33] MUELLER TH., A. GEBESHUBER, R. KULLMER, CH. LUGMAIR, S. PERLOT, M. STOIBER, MTAEC9, 38 (2004) 353. [ Links ]
[34] REBELO DE FIGUEIREDO M., J. NEIDHARDT, R. KAINDL, A. REITER, R. TESSADRI, C. MITTERER, Wear, 265 (2008) 525-532. [ Links ]
[35] ZUKERMAN I., A. RAVEH, Y. LANDAU, R. WEISS, R. SHNECK, Y. SHNEOR, H. KALMAN, J.E. KLEMBERG-SAPHIEHA, L. MARTINU, Surf. Coat. Technol., 201 (2007) 6171-6175. [ Links ]
[36] KARLSSON L., L. HULTMAN, J.-E. SUNDGREN, Thin Solid Films 371 (2000) 167-177. [ Links ]
[37] KODENTSOV G. F. BASTIN, F. J. J. VAN LOO, J. Alloys Compounds, 320 (2001) 207-217. [ Links ]
[38] SMITH W. F., Fundamentos de la ciencia e ingeniería de materiales, (España, Ed. McGraw-Hill, 1998) [ Links ]
[39] SHACKELFORD J. F., Introducción a la ciencia de materiales para ingenieros, (España, Prentice –Hall, 1998) [ Links ]
[40] ZHAO J.-C., Methods for Phase Diagram Determination (Elsevier Ltda 2007), Shortcut URL to this page: http://www.sciencedirect.com/science/book/9780080446295. [citado 15 de septiembre de 2008]. [ Links ]
[41] LENGAUER W., P. ETTMAYER, J. Alloys Compounds, 178 (1992)205-209. [ Links ]
[42] ZHANG P., X. ZHANG, J. Computational Phys., 227 (2008) 5859-5870. [ Links ]
[43] STANLEY H. E., Introduction to phase transitions and critical phenomena, (USA, Ed. Oxford University Press, 1971). [ Links ]
[44] TUPPEN S.J., M.R. BACHE, W.E. VOICE, Internat. J. Fatigue, 27 (2005) 651-658. [ Links ]
[45] DEVIA A., V. BENAVIDES, E. RESTREPO, D.F. ARIAS, R. OSPINA, Vacuum, 81 (2006) 378-384. [ Links ]
[46] YOUTSOS A. G., M. KIRIAKOPOULOS, TH. TIMKE, Theoret. Appl. Fracture Mech., 31 (1999) 47-59. [ Links ]
[47] WOLFF L., G. BASTIN, H. HEIJLIGERS, Solid State Ionics, 16 (1985) 105-112. [ Links ]
[48] HOHMUTH A., B. RAUSCHENBACH, Mater. Sci. Eng., 69 (1985) 489-49 [ Links ]
[49] TEYSSANDIER F., M. DUCARROIR, C. BERNARD, Calphad 8 (1984) 233-242. [ Links ]
[50] KAUFMAN L., H. NESOR, Calphad, 2 (1978) 295-318. [ Links ]
[51] LUGSCHEIRDER E.A., O. KNOTEK, H. ZIMMERMANN, S. HELLMANN. Surf. Coat. Technol., 116-119 (1999) 239-243. [ Links ]
[52] BERTÓTI I., Surf. Coat. Technol., 151-152 (2002) 194-203. [ Links ]
[53] VAZ F., J. FERREIRA, E. RIBEIRO, L. REBOUTA, S. LANCEROS-MÉNDEZ, J. A. MENDES, E. ALVES, PH. GOUDEAU, J. P. RIVIÈRE, F. RIBEIRO, I. MOUTINHO, K. PISCHOW, J. DE RIJK, Surf. Coat. Technol., 191 (2005),317-323. [ Links ]
[54] DASA T., S. DEBB, A. MOOKERJEE, Physica B 367 (2005) 6–18 [ Links ]
[55] LEVINE I. N., Quantum chemestry, (USA, Ed. Prentice Hall, 1983). [ Links ]
[56] SONG B. J. Phys.: Condens. Matter 10 (1998) 9443-9454 [ Links ]
[57] ZHANG Q., STEVEN P. LEWIS, Chem. Phys. Letters 372 (2003) 836–841 [ Links ]
[58] SIVASUBRAMANIAN K., J. Nuclear Mat. 341 (2005) 90-92. [ Links ]
[59] ZHANG Y., J.LI, L. ZHOU, S XIANG, Solid State Comun, 121 (2002) 411-416. [ Links ]
[60] ZAOUI A., S. KACIMI, B. BOUHAFS, A. ROULA, Physica B 358 (2005) 63–71 [ Links ]
[61] LIA J.-Q., Y.-F. ZHANG, SH.-CH. XIANG, Y.-N. CHIU, J. Molecular Structure (Theochem) 530 (2000) 209–216. [ Links ]














