Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.72 no.158 Medellín May/Aug. 2009
SÍNTESIS Y EVALUACIÓN DE FERRITA DE NÍQUEL OBTENIDA POR MECANOSÍNTESIS Y SU COMPARACIÓN CON FERRITA DE MANGANESO
NICKEL FERRITE SYNTHESIS AND EVALUATION OBTAINED BY MECANOSÍNTESIS AND THEIR COMPARISON WITH MANGANESE FERRITE
FRANCISCO PRIETO
Universidad Autónoma del Estado de Hidalgo, Pachuca, Hidalgo, México, prietog@uaeh.edu.mx
ALBERTO GORDILLO
Universidad Autónoma del Estado de Hidalgo, Pachuca, Hidalgo, México
EURIDICE RIVERA
Universidad Autónoma del Estado de Hidalgo, Pachuca, Hidalgo, México
MARÍA A. MÉNDEZ
Universidad Autónoma del Estado de Hidalgo, Pachuca, Hidalgo, México
Recibido para revisar marzo 5 de 2008, aceptado julio 23 de 2008, versión final julio 7 de 2008
RESUMEN: El objetivo de este trabajo ha sido evaluar por comparación, las características de las ferritas de Ni y Mn, que han sido obtenidas partiendo de sus óxidos básicos por vía mecanosíntesis. El proceso se llevó a cabo a temperatura ambiente, en vacío; como medio de molienda esferas de acero de 3 mm de diámetro y frascos cilíndricos de 50 cm3 de capacidad, del mismo material; relación en peso de bolas/polvos de 10:1. El tiempo máximo del proceso fue de 12 horas. Fueron evaluadas por DRX, EAA, FTIR, MEB y se les midió permeabilidad magnética, distribución y tamaños de partículas. La obtención de estas ferritas por vía mecanosíntesis resulta efectiva pero no de mayores purezas, ni homogeneidades que las obtenidas por vía hidroquímica. El tiempo más eficiente del proceso oscila entre las 7-10 horas de molienda, ligeramente menor para la ferrita de manganeso. Se obtiene mayor fracción molar (0,90) en la ferrita de manganeso con relación a la de níquel; no resultaron significativamente homogéneas. En valores de permeabilidad magnética fue superior la ferrita de manganeso al igual que en tamaños de partículas.
PALABRAS CLAVE: Mecanoquímica, Fases, Ferritas, Permeabilidad Magnética.
ABSTRACT: The objective of this work has been to evaluate by comparison, the characteristics of Mn and Ni ferrites that have been obtained starting of their basic oxides by via mechanosynthesis. The process was carried out to room temperature, in vacuum; like milling means steel spheres of 3 mm of diameter and cylindrical bottles of 50 cm3 of capacity of the same material; relation in weight of ball/dusts of 10:1. The maximum time of the process was of 12 hours. They were evaluated by XRD, AAS, FTIR, SEM and magnetic permeability and distribution and sizes of particles. The obtaining of this ferrites by via mecanosíntesis is effective but not from greater purities or homogeneities than the obtained by hydrochemical way. The most efficient time of the process it oscillates between the 7-10 hours of milling, slightly smaller for the manganese ferrite. Greater molar fraction is obtained (0,90) in the manganese ferrite in relation to the one of nickel; they were not significantly homogenous. In values of magnetic permeability the manganese ferrite was superior like in sizes of particles.
KEYWORDS: Mechanochemistry, Phases, Ferrites, Magnetic Permeability.
1. INTRODUCCIÓN
Las ferritas para la elaboración y fabricación de los llamados imanes dulces en su mayoría se reporta que son obtenidas por procesos hidroquímicos. Conseguir la producción de ferritas de algunos metales como el níquel y manganeso por vía mecanosíntesis, constituyen un nuevo reto en el campo de nuevos materiales con aplicaciones prácticas. El objetivo de este trabajo fue evaluar por comparación, las características de las ferritas de Ni y Mn, que son obtenidas a partir de sus óxidos básicos, en grado reactivo y por vía mecanosíntesis. Algunos compuestos cerámicos pueden ser ferromagnéticos [1-4], así algunos óxidos mezclados, la ferrita de manganeso, MnFe2O4 y la ferrita de bario BaFe11O17. Los spines desapareados de los iones giran, dando lugar a momentos de dipolos magnéticos que interaccionan con los iones vecinos del oxígeno con un mecanismo de intercambio [1]. Las paredes del dominio se mueven fácilmente en las ferritas cerámicas, denominadas suaves, tales como MnFe2O4, NiFe2O4, BaFe11O17 y a-Fe2O3, que se utilizan en transformadores y cintas magnéticas. En la ferrita del bario, las vueltas se traban firmemente a un eje hexagonal, haciéndola útil como imán permanente [3]. Las ferritas son también materiales ferromagnéticos, compuestos por hierro y otros metales [4].
Las ferritas, compuestos de fórmula general MeFe2O4 (Me metal divalente), son cuerpos ferrimagnéticos de estructuras del tipo espinelas. Esto es así en la magnetita (FeFe2O4 ó Fe3O4 ó FeO.Fe2O3); sin embargo, la pirrotita (Fe1-xS), la ilmenita (FeTiO3), la maghemita (g-Fe2O3), etc., son ferromagnéticas [5], por lo que un campo exterior débil puede reorganizar las subredes. La estructura general de las espinelas se indica por una formulación del tipo A+2B+32O4, donde A representa los elementos que ocupan posiciones tetraédricas y B las posiciones octaédricas. En la celda unidad se pueden distinguir 32 átomos de oxígeno, 64 posiciones tetraédricas y 32 octaédricas. Por la distribución de cationes A+2 y B+3 en los intersticios tetraédricos y octaédricos, de la aglomeración compacta cúbica y de los oxígenos, las espinelas pueden dividirse en normales, inversas y mixtas [6].
En una espinela normal se tienen 8 átomos en posiciones A (tetraédrica) y 16 átomos en posiciones B (octaédrica); en una espinela inversa, habrá 8 átomos B en posiciones tetraédrica y 8 átomos de A y 8 de B en posiciones octaédrica. En el caso de la espinela inversa de la magnetita, que puede escribirse como Fe+3(t)[Fe+2Fe+3](o)O4; los átomos de oxígeno forman un retículo cúbico centrado en las caras. Óxidos con estructuras de espinelas presentan bajas áreas específicas, buena cristalinidad y estequiometrías controladas si se sintetizan a elevadas temperaturas, mientras que a bajas temperaturas los compuestos son mal cristalizados, no estequiométricos, hidratados y de áreas más elevadas [7]. En trabajos recientes han obtenido manganitas y manganitas dopadas con calcio [8] empleando los procesos de mecanosíntesis; en estos casos partiendo de los óxidos metálicos han llegado a obtener compuestos con estequiometrías tipo Ca1/3La2/3MnO3. Estos procesos de mecanosíntesis, han sido también llamados procesos mecanoquímicos [4]; al igual que cualquier reacción en estado sólido, deben cumplir leyes fisicoquímicas y principios termodinámicos, por lo cual deben ser estrictamente controlados para evitar presencia de fases no deseadas o fluidos no requeridos.
En este sentido, los aspectos cinéticos de las reacciones mecanoquímicas, no obedecen a un modelo específico que pueda considerarse como guía. Una activación mecánica en una mezcla de polvos (óxidos metálicos en este caso) involucra una serie de cambios e interacciones químicas, dependiendo de las condiciones físico-mecánicas. Un primer cambio lo constituye la mezcla o contacto sucesivo de interacción química de las superficies de contacto durante un período de activación. Los cristales que conforman los sólidos se fragmentan continuamente y aumentan así las superficies de contactos, dando inicio a reacciones derivadas de estos contactos. Le continúan procesos de deformaciones plásticas y agrupamiento de partículas diferentes que originan reacciones encadenadas y nuevos agregados; los nuevos productos formados dan origen a un reordenamiento estructural que conlleva a una nueva fase o estatus de cristalinidad, diferente a los productos de origen. Todas las etapas que se suceden, tendrán obligatoriamente un tiempo, de duración que dependerá entre otros aspectos de los factores energéticos y mecánicos [4].
Un método para la obtención de ferritas de Ni y de Mn [2], puede ser la vía de la mecanosíntesis. En este sentido es probable que se logren obtener productos más puros, si se compara con los métodos de obtención por vía hidroquímica, por cuanto en estos últimos se presentan interferencias de los reactivos que participan en las etapas de precipitación. Otros autores han reportado también la síntesis de ferritas de níquel y zinc mediante reacciones de combustión y sinterización [9]. En este trabajo los autores parten de las sales de hierro, níquel y zinc en forma de nitratos como precursores; utilizan además la urea como agente reductor. Reportan composiciones del tipo Ni1-xZnxFe2O4 pero en estos casos por DRX, señalan la presencia de las fases de los óxidos precursores a-Fe2O3, NiO y ZnO. Recientemente ha sido demostrada la eficacia de la técnica por molienda en molinos de bola de gran energía, para la obtención de ferritas nanoestructuradas por mecanosíntesis y por la activación mecánica del MnO y su mezcla con α-Fe2O3 [2, 10], según la reacción:
MnO +α-Fe2O3 = MnFe2O4 ( 1 )
2. MATERIALES Y MÉTODOS
2.1 Proceso De Mecanosíntesis
Se utilizaron los óxidos de Fe3+, Mn2+ y Ni2+ grado reactivo y alta pureza (Bayer). El proceso de mecanosíntesis se llevó a cabo en un molino SPEX 8000D a temperatura ambiente y en atmósfera de vacío, empleando como medio de molienda, esferas de acero de 3 mm de diámetro y frascos cilíndricos de este mismo material de 50 cm3 de capacidad, siguiendo el procedimiento utilizado en trabajos reportados recientemente [8]. Se utilizó una relación en peso de bolas de acero/peso de polvos de óxidos metálicos con valor de 10:1. El tiempo máximo del proceso de mecanosíntesis fue de 12 horas de molienda, tiempo con el cual se garantiza según algunos autores la formación del producto que se sintetiza [8, 11]. Sin embargo, posteriormente se aplicaron tiempos mayores (25, 35 y 50 horas) con la finalidad de observar si existían cambios en los productos (aparición de otras fases por DRX). Las tapas de los cilindros de acero fueron modificadas colocándoles válvulas herméticas en las juntas y un anillo en la base, que permitió hacer un vacío de aproximadamente 1 mbar en el interior del cilindro durante los tiempos de molienda. Este vacío permite estimar una máxima presión parcial de oxígeno en el interior del cilindro aproximadamente de 0.2 mbar; en estas condiciones se estima que no será posible que ocurran procesos de oxidación de las especies presentes. El proceso de transformación de fases en el tiempo se llevó a cabo con seguimiento mediante análisis de rayos X. La mecanosíntesis se llevó a cabo llenando el cilindro con 2.0000 g ± 0,0004g de la mezcla estequiométrica de los óxidos promotores en cada caso y para cada uno de los tiempos de molienda previstos y colocando las bolas de acero en relación 10:1.
2.2 Análisis De Los Sólidos Obtenidos
Las ferritas fueron evaluadas por difracción de rayos X (DRX) en un difractómetro PHILIPS, modelo PW-1710-BASED, con fuente de radiación CuKa, l=0,15406 nm, filtro y portamuestra de aluminio, tensión del generador y corriente de 40 KV y 30 mA, respectivamente, con barridos de ángulos (2q) de 5 a 700 con integrador de señales acoplado [2, 3, 8]. La identificación cualitativa de las fases fue realizada por comparación, usando la base de datos PDF-2 [12]. El análisis cuantitativo fue realizado sobre la base de los refinamientos del método propuesto por Rietveld [13, 14], utilizando el programa FULLPROF [15] y el software MAUD [16, 17] el cual fue aplicado en su modo profile-matching con los datos reales de difracción de rayos X obtenidos con la radiación de CuKa. Este programa posibilitó la realización del análisis cuantitativo sin usar datos estructurales para cada una de las fases. Todos los parámetros que van a ser refinados para cada fase son llevados a este programa de un modelo estructural [14, 17, 18]. También permite el refinamiento de varias fases de forma simultánea.
Los sólidos formados fueron sometidos a evaluación de permeabilidad magnética, la cual se realizó con una bobina (100 vueltas) de hilo de cobre; 31,7 mm de largo y 16,7 mm de ancho (Figura 1). Este dispositivo mide el voltaje inducido que es directamente proporcional al valor de la inducción magnética provocada por la muestra (L). Después de medir la inducción del voltaje en la celda vacía (L0), los sólidos se colocan en tubos de ensayos de vidrio de 100 mm de largo y 8 mm de diámetro interior, se compactan adecuadamente y se tapan con algodón [2, 3]. Se colocan en el interior de la bobina cada uno de los tubos conteniendo las muestras de ferritas, y se medirá la inducción magnética provocada por la muestra (L). Los resultados de las mediciones se procesarán usando la formula siguiente:
mrel = 1 + C(L - L0). 104/n.p.b2 (2)
donde:
mrel: permeabilidad magnética relativa; L: inducción magnética en la muestra, mH; L0: inducción magnética en el vacío, mH; n: número de vueltas del hilo de cobre en la bobina; C: largo del enrollado en la bobina; b: diámetro interior de los tubos de vidrio donde se colocó la muestra.
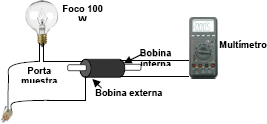
Figura 1. Dispositivo aproximado para las mediciones de permeabilidad magnética en muestras de ferritas a obtener [2, 3]
Figure 1. Device approximated for the measurements of magnetic permeability in ferrite samples to obtain [2, 3]
Los contenidos de hierro, manganeso y níquel en las muestras sintetizadas, fueron medidos por análisis espectrofotométrico de absorción atómica (EAA) en un equipo Perkin Elmer, modelo ANALYST 100, con llama acetileno-aire, flujo de aire de 0.8-1.1 L/min y flujo de acetileno de 0.8 a 1.2 L/min. Se realizó una curva de calibrado y mediante el programa FIT-2 con ajuste de regresión lineal se obtuvo valores de r2=0.9981, r2=0.9943 y r2=0.9916 para Fe, Mn y Ni, respectivamente. En pesadas de 0.20 g se sometieron previamente a una digestión en horno de microonda modelo Marx 5X en vasos de teflón; para ello se adicionaron a cada muestra, en cada vaso, 5 ml de HNO3 concentrado y se sometió a presión y temperatura según programación del horno. Las muestras digestadas se aforaron en matraces a 50mL con agua desionizada y se reservaron para los análisis de los metales. Se analizó además, la distribución y tamaño de partículas de los sólidos obtenidos a diferentes horas de molienda. Se preparó una suspensión de estos sólidos en agua desionizada en proporción 1:50 (m/v) y se llevaron a un analizador de tamaño de partículas por difracción de rayos láser LS 13-320 [2]. Se utilizó el módulo universal para líquidos donde se analizan partículas en suspensión. No se utilizó el módulo para micro líquido por cuanto las propiedades magnéticas de las partículas no lo permiten.
Adicionalmente se realizaron mediciones de tamaños de partículas en el equipo Zeta-Sizer Modelo 3000HSA, de la firma Malrvern, en suspensiones de los polvos de ferritas en agua desionizada, con el objeto de poder medir probables tamaños de partículas nanométricos. Este instrumento permite realizar mediciones de tamaños desde 0.002 µm hasta 5 µm, a diferencia del LS 13-320 que permite medir desde 0.4 µm hasta 2000 µm.
La región del infrarrojo (IR) comprendida entre 1200–200 cm-1 abarca las zonas denominadas IR medio (4000-660 cm-1) e IR lejano (660-50 cm-1). Esta técnica permite detectar la presencia, en el material analizado, de enlaces metálicos con el oxígeno en la estructura conseguida. En este estudio se trabajó con un espectrómetro FTIR MAGNA-IRTM de la marca NICOLET, modelo 550, con óptica de Yoduro de Cesio. Las muestras fueron preparadas en tabletas de CsI al 1:200. El barrido se realizó entre 1200 y 200 cm-1. El estudio morfológico de las muestras se llevó a cabo es un Microscopio Electrónico de Barrido JEOL JSM-820. Se trabajó a 20 KV, a la misma distancia (Wd = 39 mm) y con aumentos de X350.
3. RESULTADOS Y DISCUSIÓN
3.1 Identificación De Fases
La figura 2 muestra los espectros de DRX de los polvos de ferritas de níquel; se presentan de forma secuenciadas en base a los distintos tiempos de molienda. Así mismo, en el eje de ordenadas se representan los valores de intensidades relativas en unidades arbitrarias (a.u.). Se observa que a tiempo 0 h, inicio de los experimentos, solo se aprecian en las mezclas, las fases de a-Fe2O3 [carta de difracción 33-664] y NiO [carta de difracción 44-1159] [12], de manera similar a lo indicado por Prieto y colaboradores en la síntesis de una ferrita de manganeso por este mismos procedimiento [2].
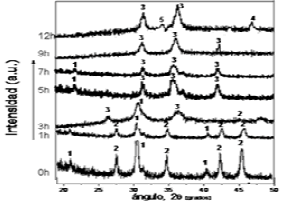
Figura 2. Difractogramas de las ferritas de níquel a diferentes tiempos de molienda y a partir de una mezcla estequiométrica de NiO–Fe2O3 (1:1% mol). Fases: 1) Fe2O3, 2) NiO, 3) NiFe2O4, 4) (Fe2O3)x(NiO)1−x y 5) Fé
Figure 2. Diphractograms of ferrites of nickel to different times from milling and from a stoichiometric mixture of NiO-Fe2Ò3 (1:1% mol). Phases: 1) Fe2Ò3, 2) NiO, 3) NiFe2Ò4, 4) (Fe2Ò3)x(NiO)1-x and 5) Fe
A partir de las 7 h, tiempo que se corresponde con el requerido según Sánchez y colaboradores [8] para que se aprecie la fase principal y que en estos casos se corresponden a las espinelas cúbicas de MnFe2O4 [carta de difracción 10-319] y NiFe2O4 [carta de difracción 11-3390] [12], se observan en la figura 2 y en [2], éstas como fases mayoritarias, igualmente se aprecia la presencia de las fases anteriores. En la figura 2 se muestra que a partir de las 9 horas ya aparecen las espinelas como fases únicas presentes (aparentemente, en cada caso) y a partir de este tiempo, comienzan a formarse nuevas fases que se pueden considerar como una mezcla de (Fe2O3)x(NiO)1−x, un óxido mezclado de níquel y hierro que pudiera tener una estructura del tipo wustita [carta de difracción 77-2356] [12]; de manera análoga esto fue observado para el caso de la ferrita de manganeso [2]. En los trabajos de Albani y colaboradores [19] reportan haber identificado una ferrita del tipo cuaternaria con la presencia de Mn(II) y Mn(III), con fórmula (MnII0.39FeIII0.61)[MnII0.31MnIII0.53FeIII1.15]O4.0, y la composición obtenida fue asociada con la contaminación por oxígeno durante el proceso de molienda. Sin embargo para la ferrita de manganeso se apreció por Prieto y colaboradores [2] presencia de Fe2+ en la fase tipo wustita. Por otra parte, en este trabajo, al igual que lo reportado en [2], se aplicó un control cuidadoso del sistema que ha permitido evitar la contaminación por oxígeno en los frascos de reacción.
Después de 9 h de molienda comienza a aparecer el Fe metálico y cuando alcanza un alto nivel de concentración (a las 12 horas de molienda), pueden llegar a ocurrir reacciones químicas indeseadas en las interfaces de las partículas. De acuerdo con esto, es posible que la ferrita formada, reaccione con el Fe metálico que va apareciendo y llegue a dar origen a una descomposición progresiva que pueda ocurrir en las interfaces de Fe/ferrita. El hierro metálico en presencia de la ferrita aparentemente puede propiciar un nuevo proceso mecanoquímico a prolongados tiempos; pudiera ser este el caso que a tiempos de molienda de 12 h y más, podrían ocurrir reacciones del tipo:
XNiFe2O4 + 2Fe ® 2(FeO)x+1(NiO)1−x + (3X-2)NiO + 0.5(X-1)O2 (3)
Se pone de manifiesto la posibilidad de la oxidación del Fe metálico que aparece y la descomposición de la ferrita de níquel, lo que está acorde con lo indicado por algunos autores [2, 20]. La presencia de la fase del Fe metálico [carta de difracción 6-696] [12], continuó apreciándose y permaneció durante el proceso de molienda a mayores tiempos.
3.2 Análisis Cuantitativo De Fases
Los resultados de los análisis de composición química realizados por absorción atómica (AA), permiten apreciar un aumento significativo de la relación molar de Fe/Mn (hasta 2.59), tomado de trabajos anteriores [2] y Fe/Ni (hasta 1.36), que sus máximos los alcanza a las 7 h de molienda, y posteriormente, comienzan a disminuir ambas relaciones (ver tabla 1a y 1b, respectivamente). El resultado indica la existencia de una contaminación en ambos casos, debida al hierro proveniente de las bolas de acero, pero también a la presencia de las fases de (FeO)x(MnO)1−x y (Fe2O3)x(NiO)1−x y la de los óxidos precursores.
Tabla 1a. Resultados de análisis por absorción atómica de Fe y Mn (tomado de [2]) a diferentes tiempos de molienda en horas (h), relación [Fe]/[Mn]
Table 1a. Results of analysis by atomic absorption of Fe and Mn (referente [2]) to different times from milling in hours (h), relation [ Fe]/[Mn]
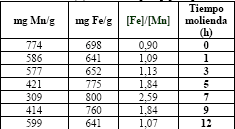
Tabla 1b. Resultados de análisis por absorción atómica de Fe y Ni a diferentes tiempos de molienda en horas (h), relación [Fe]/[Ni]
Table 1b. Results of analysis by atomic absorption of Faith and Nor to different times from milling in hours (h), relation [ Fe]/[Ni ]
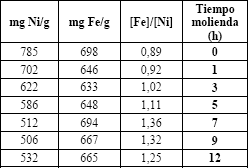
De estos resultados, así como de la permanencia de las fases de los óxidos promotores (a-Fe2O3, MnO y NiO) y que no se aprecian mayores formaciones de las espinela que se sintetizan, se infiere que la ferrita Ni es de mayor dureza o resistencia mecánica que la ferrita de Mn. En este sentido algunos autores han reportado que los incrementos en la dureza y su resistencia cumplen en sentido general, con los principios generales de endurecimiento por solución sólida [21]. Este autor ha señalado que un orden aproximado de incremento de dureza y resistencia en algunos materiales como las ferritas blandas, puede ser: ferrita de Cr, de Wo, de V, de Mo, de Ni, de Mn y de Si. La figura 3a y 3b muestra el análisis de las fases, luego del proceso de refinamiento en las muestras de ferrita de manganeso y de níquel, respectivamente.
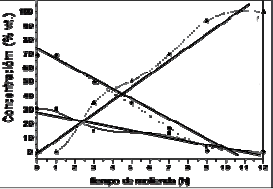
Figura 3a. Variación de la concentración porcentual (% wt) del proceso de mecanosíntesis contra tiempo de molienda en la ferrita de manganeso
Figure 3a. Variation of the percentage concentration (% wt) in the process of mechanosynthesis against time of milling in the manganese ferrite
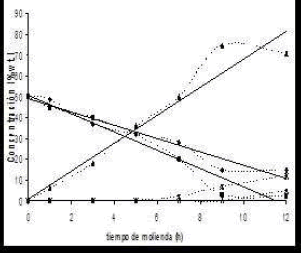
Figura 3b. Variación de la concentración porcentual (% wt) del proceso de mecanosíntesis contra tiempo de molienda en la ferrita de níquel
Figure 3b. Variation of the percentage concentration (% wt) of the process of mechanosynthesis against time of milling in the nickel ferrite
Está en correspondencia con lo que se aprecia en la figura 2 donde se observan que las fases de los promotores no desaparecen sino que permanecen presentes durante todo el tiempo del proceso (incluso a mayores tiempos de molienda). Los resultados permiten confirmar de manera semicuantitativa, que las reacciones de síntesis se completan después de 9-10 horas de molienda. Así mismo, se puede confirmar que las cinéticas de ambos procesos de mecanosíntesis, muestran una dependencia casi lineal entre el tiempo y la concentración de los óxidos precursores.
Para la formación de la fase NiFe2O4 se encontró una regresión lineal en el tiempo de R2 = 0,9422 (ligeramente menor que en el caso anterior) y cuya ecuación fue:
y = 6.7343x + 0.9761 (4)
Por su parte, la disminución de los precursores se comportó, para a-Fe2O3 con una regresión de R2 = 0.9463 y su ecuación fue:
y = -3.2053x + 49.228 (5)
y para el NiO una regresión R2 = 0.9557 y su ecuación:
y = -4.398x + 50.675 (6)
Las tablas 2a y 2b muestran los parámetros que resultaron de los procesos para las diferentes horas de molienda. Las fracciones molares de las fases de los productos, obtenidos por los cálculos a partir del análisis por el método de Rietveld y en función de los diferentes tiempos de molienda, indican que las fracciones de MnFe2O4 y NiFe2O4 aumentan a expensas de que las fracciones de los óxidos promotores a-Fe2O3, MnO y del NiO disminuyen, pero sólo de manera parcial, en las etapas de molienda tempranas, alcanzando sus valores máximos (92% y 78%, respectivamente), aproximadamente entre las 9-10 h de molienda.
Tabla 2a. Parámetros principales para la red, obtenidos por DRX y el método Rietveld para MnO, Fe2O3, MnFe2O4, MnxFe1−xO y Fe (tomado de [2])
Table 2a. Main parameters for the network, obtained by DRX and the Rietveld method for MnO, Fe2Ò3, MnFe2Ò4, MnxFe1-xO and Fe (reference [2])
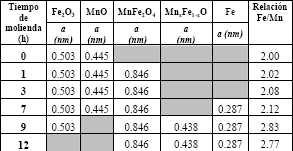
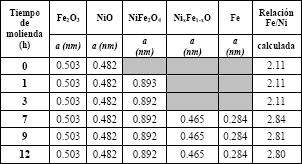
Tabla 2b. Parámetros principales para la red, obtenidos por DRX y el método Rietveld para NiO, Fe2O3, NiFe2O4, NixFe1−xO y Fe
Table 2b. Main parameters for the network, obtained by DRX and the Rietveld method for NiO, Fe2Ò3, NiFe2Ò4, NixFe1-xO and Fe
Así por ejemplo para la formación de la fase MnFe2O4 se encontró [2] una regresión lineal en el tiempo de R2 = 0,9641 y cuya ecuación fue:
y = 8,9887x + 1,2028 (7)
Por su parte, la disminución de los precursores se comportó, para Fe2O3 con una regresión de R2 = 0.9573 y su ecuación fue:
y = -6,4005x + 68,831 (8)
y para el MnO una regresión R2 = 0.9355 y su ecuación:
y = -2,6209x + 29,996 (9)
La velocidad de formación de la ferrita de manganeso fue de 0.090 g/h (pendiente de la ecuación 7), en la medida en que la velocidad de disminución de los precursores de -0.064 g/h para el Fe2O3 y -0.026 g/h para el MnO. Los signos negativos indican velocidad de disminución o desaparición de las fases. La suma de las pendientes negativas se corresponde con el valor de la pendiente de formación. Para el caso de la ferrita de níquel fue de 0.067 g/h (pendiente de la ecuación 4). Esto puede estar asociado a la mayor dureza del NiO comparada con la de MnO, según señala Torres [21]. Esto puede explicar que el proceso de reacción en estado sólido sea un poco más demorado.
Por otra parte se puede apreciar también que la sumatoria de las pendientes negativas de los óxidos precursores, que indican que los mismos van desapareciendo a expensas de la formación de NiFe2O4, no corresponde al valor positivo de la pendiente de formación de la espinela (la diferencia es de 0.87 unidades). Esto corrobora que en la síntesis de la espinela de níquel quedan parte de dichos óxidos sin reaccionar.
Al evaluar las relaciones Fe/Mn y Fe/Ni (ver tablas 2a y 2b) calculadas por el método Rietveld (MR) y compararlas con las encontradas a partir de los resultados de absorción atómica (AA) (ver tablas 1a y 1b), se puede corroborar en la figura 4, la correlación entre estos dos métodos.
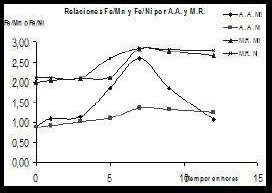
Figura 4. Correspondencia de los valores encontrados de las relaciones Fe/Mn y Fe/Ni en las ferritas a diferentes tiempos de molienda por los métodos analíticos de absorción atómica (AA) y el método de cálculo de Rietveld (MR)
Figure 4. Correspondence of the found values of the relations Fe/Mn and Fe/Ni in ferrites to different times from milling by the analytical methods of atomic absorption (AA) and the method of calculation of Rietveld (MR)
Se demuestra la mayor relación Fe/Mn o Fe/Ni para las 7 h de molienda y que esta relación disminuye a mayores tiempos en ambas ferritas. Después de 7 h, el contenido de las fases de espinelas sintéticas de MnFe2O4 y NiFe2O4 disminuyen por debajo de 60 % y en ese mismo tiempo, comienzan a aparecer las fases de hierro metálico en concentraciones entre 10-15%.
La fase de Fe comienza a hacerse detectable a partir de las 9 h de molienda en ambas ferritas, llegando a su máximo a las 12 h. Por otro lado es significativo señalar que a partir de las 7 h y en adelante, se alcanzan los mayores valores de relaciones molares Fe/Ni, pero no presentan cambios significativos como lo es en la relación Fe/Mn para la ferrita de manganeso.
De acuerdo a los resultados se puede inferir que en el presente trabajo, se logrado sintetizar la ferrita de manganeso al término de 7-9 horas promedio de molienda, con la probable presencia de impurezas de fases tales como (FeO)x(MnO)1-x y hierro metálico de acuerdo con la ecuación 10:
2Fe2O3 + 2MnO ® 1.58MnFe2O4 + (FeO)0.58(MnO)0.42 + 0.26Fe (10)
Para la ferrita de níquel se puede definir que se ha obtenido la espinela, con las impurezas que se indican en la ecuación 11:
2Fe2O3 + 1.9NiO®1.55NiFe2O4 + 0,58(Fe2O3)0.31(NiO)0.69 + 0.04Fe + 0.25Fe2O3 (11)
De la ecuación 11, la relación 2:1,9 de Fe2O3:NiO, permite corroborar, que aunque se calcularon los pesos iniciales para una relación estequiométrica exacta, queda una fracción del óxido de hierro precursor, que no llega a completar la reacción; no así en el caso de la ferrita de Mn (ecuación 10). El valor de 1,55 moles de la espinela de níquel formada, corroboran igualmente el 0,78 de fracción molar que se alcanzó como máximo, en tanto el valor de 1,58 moles de la espinela de manganeso corroboran el 0,90 de fracción molar obtenida.
3.3 Análisis de la Permeabilidad Magnética
La Figura 5 muestra los valores de las permeabilidades magnéticas de las ferritas de manganeso y níquel obtenidas. Se aprecia una cierta permeabilidad magnética que inicia y se ve incrementada en la medida en que comienza la aparición de las fases de espinelas y justamente a partir de las 7-9 h de molienda, alcanzan sus máximos respectivos, aunque mucho más bajo que para una magnetita pura (96.0 kHz).
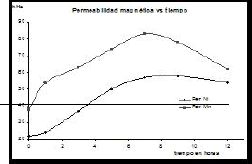
Figura 5. Variación de la permeabilidad magnética de las ferritas de manganeso y de níquel, contra tiempos de molienda
Figure 5. Variation of the magnetic permeability of ferrites of manganese and nickel, against times of milling
Destacan en la figura 5 los valores correspondientes a los tiempos de molienda de 5 y 12 h, con valores mayores de 50 kHz, coincide con los resultados de mayor porcentaje de fracción molar de las ferritas MnFe2O4 y NiFe2O4 obtenidas, lo que permite corroborar que el tiempo de 9 h de molienda puede ser considerado como tiempo óptimo para el proceso que rinde la mayor proporción de estas ferritas.
Se lograron obtener valores de permeabilidades magnéticas para las ferritas de manganeso desde 40.0 hasta 83.3 kHz. Estos resultados permiten compararlas con la magnetita (Fe3O4) con un valor de permeabilidad magnética de 96.0 kHz, esto se corresponde desde un 40.6 % hasta un 86.8 % de similitud en esta propiedad. Para las ferritas de níquel los valores alcanzados fueron desde 26.0 hasta 58.1 kHz. Comparados con los de la magnetita (Fe3O4) pura, los valores obtenidos son del orden del 27.1 % al 60.5 % de similitud
3.4 Análisis Del Tamaño De Partículas
Los tamaños de partículas de las ferritas de manganeso y de níquel, se aprecian en las tablas 3a y 3b, donde se observa las variaciones con el tiempo de molienda. En el inicio del proceso los tamaños promedios corresponden aproximadamente a los valores esperados como promedios para la mezcla de los óxidos MnO, NiO y a-Fe2O3, según el caso. Después de las 3 h de molienda se observa un incremento del tamaño promedio de las partículas que está asociado a la presencia de las fases de las espinelas que comienzan a formarse y a aparecer como nuevas fases, sumándose a los tamaños promedios anteriores.
Tabla 3a. Tamaños de partículas de las ferritas de manganeso sintetizadas a diferentes tiempos. Tamaños promedios, valores de partículas menores de 0.45mm y variabilidad
Table 3a. Sizes of particles of synthesized ferrites of manganese to different times. So large averages, values of smaller particles of 0.45mm and variability
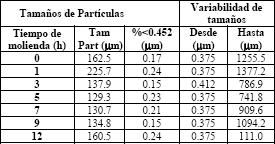
Tabla 3b. Tamaños de partículas de las ferritas de níquel sintetizadas a diferentes tiempos. Tamaños promedios, valores de partículas menores de 0.45mm y variabilidad
Table 3b. Sizes of particles of synthesized ferrites of nickel to different times. So large averages, values of smaller particles of 0.45mm and variability
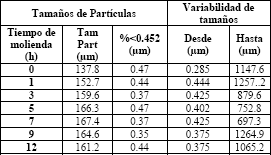
Los tamaños continúan incrementando de manera ligera con los tiempos prolongados de molienda. Las dimensiones promedios de las partículas incrementan hasta llegar a las 7 h de molienda donde se alcanza el mayor tamaño promedio así como la menor variabilidad de éstos (mejor homogeneidad en general). Posteriormente los tamaños promedios no presentan variaciones importantes, sin embargo si se aprecian mayores variabilidades entre mínimos y máximos, es decir, mayores variabilidades.
Resulta interesante observar como entre las 5 y 9 horas del proceso de molienda, el tamaño promedio permanece con poca variación para ambas ferritas (132 ± 2 µm para la ferrita de manganeso y 166 ± 2 µm para la ferrita de níquel); esto se puede asociar a que durante este tiempo la fase mayoritaria que corresponde a la estructura de espinela de la ferrita en cuestión no varía demasiado (entre 70 y 90% de fracción molar), posteriormente esta fase tiende a disminuir ligeramente. Sin embargo de las tablas resaltan que los tamaños promedios entre 5-9 h alcanzan los valores mínimos para las ferritas de Mn y máximos para las ferritas de Ni. Esto puede corresponder con los discutido acerca de que esta última es de mayor dureza.
Los tamaños de partículas en suspensiones coloidales de los polvos de ferritas de manganeso y níquel en agua desionizada, de tamaños nanométricos, arrojó los resultados que se muestran en la figura 6. El análisis del tamaño medio de partícula nanométricas, también permite corroborar una disminución del tamaño de las mismas, al incrementar el tiempo de molienda hasta llegar a un tamaño nanométrico promedio de 540 nm y 825 nm que se alcanza entre las 3 primeras horas de molienda y hasta las 7 horas del proceso, para las ferritas de Mn y Ni, respectivamente. Al incrementar el tiempo, incrementa de nueva cuenta el tamaño, asociado a la aglomeración de estas partículas.
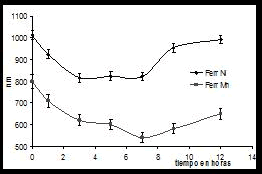
Figura 6. Efecto del tiempo de molienda sobre el tamaño medio nanométrico de partículas en ambas ferritas
Figure 6. Effect of the time of milling on so large nanométrico particle means in both ferrites
3.5 Análisis De Las Ferritas Por FTIR
Las figuras 7a y 7b muestran los resultados de las evaluaciones realizadas por espectroscopía por FTIR en las ferritas, de manganeso y níquel respectivamemnte, donde se destacan solamente en la región de interés (200-1200 cm-1), las señales de las vibraciones de los enlaces Me-O, entre otras.
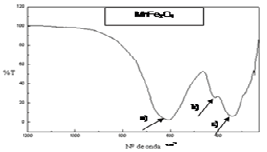
Figura 7a. Espectro de FTIR para la ferrita de manganeso sintetizada
Figure 7a. Spectrum of FTIR for the synthesized manganese ferrite
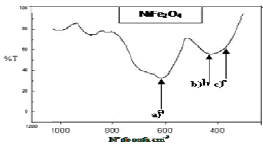
Figura 7b. Espectro de FTIR para la ferrita de níquel sintetizada
Figure 7a. Spectrum of FTIR for the synthesized nickel ferrite
Como se ha discutido anteriormente, en la estructura de espinela inversa de la magnetita y en este caso, en la ferrita de manganeso que se sintetiza, es sustituido el ión Fe2+ de la posición octaédrica que aparecería en una magnetita, por el ión Mn2+, de esta forma se distinguen de manera análoga en la ferrita de níquel, las diferencias de las vibraciones de los enlaces para la zona entre 200 y 700 cm-1 (deconvolusión de las bandas). Se muestran las tres bandas características de las vibraciones: a) Metal en posición tetraédrica con oxígeno y metal en posición octaédrica, vibración de flexión, MT-O-MO (650-550 cm-1), ésta corresponde a la vibración Fe(III)T-O-Mn(II)O o Ni(II)O que se muestra en 610-620 cm-1, respectivamente; b) Vibración tensión metal-oxígeno, MO-O (»440 cm-1), ésta correspondería MnO-O y se encontró a 435 cm-1 y a NiO-O que se apreció a 455 cm-1 y c) Vibración metal-metal, MT-MO (350-400 cm-1), esta última sería la correspondiente a Fe(III)T-MnO o Fe(III)T-NiO.
Cabe destacar que esta última señal no se aprecia gráficamente en la ferrita de Ni ya que se muestra como un hombro que aparece a 365 cm-1. Se entiende que MT y MO se refieren igualmente al metal en posición tetraédrica y octaédrica respectivamente. Estos resultados son en cierta medida similares a los reportados por otros autores en caracterizaciones de ferritas obtenidas por vía hidroquímica [22, 23]. Las vibraciones observadas que corresponden al tipo MT-O-MO, para los metales divalentes como el Ni+2, aparecen a valores mayores de número de onda (620 cm-1) que en el caso del metal Mn2+ (596 cm-1), lo que está en correspondencia con el hecho de que los iones Ni+2 tienen mayor radio iónico que el Mn2+ y al irse incorporando a la estructura de espinela inversa en posiciones MO (octaédricas), requieren mayor energía. Para las vibraciones del tipo MO-O, también se apreció la señal del Ni+ 2 a 455 cm-1, comparada con 442 cm-1 para el Mn2+ y finalmente, acerca de las vibraciones del tipo MT-MO, que no fue bien apreciada, sólo se puede señalar que el hombro al que se le podría atribuir, se distinguió en 365 cm-1, comparado con la señal a 358 cm-1 para el Mn2+. Para la ferrita de níquel se observó además otro hombro (más pronunciado) alrededor de 700 cm-1, éste puede corresponder a una vibración Me-O, pero no perteneciente a la estructura de espinela inversa, sino a otra fase formada. Debe recordarse que en opinión de expertos y según algunos autores [24], la región del infrarrojo comprendida entre 200-1200 cm-1 constituye una especie de huella dactilar del compuesto.
3.6 Análisis Por Microscopía Electrónica De Barrido (MEB) De Las Ferritas
El análisis de las microfotografías que se observan en la figura 8 (a, b c y d) permite comparar las morfologías conseguidas para las ferritas de manganeso y en la figura 9 (a, b, c y d) las ferritas de níquel a diferentes tiempos de molienda y distinguir ciertas diferencias en las morfologías. En este caso se observan las morfologías al inicio (figuras 8a y 9a), que corresponde a los óxidos precursores de Mn, Ni y Fe; posteriormente las morfologías conseguidas a 3, 7 y 9 horas (figuras 8 y 9 b, c y d, respectivamente). Se aprecia que al inicio los tamaños de partículas corresponden a los polvos individuales y una mayor homogeneidad en la morfología de los precursores de la ferrita de níquel (figura 9a). A partir de la 3 h ya puede notarse el comienzo de formación de nuevas fases, tamaños mayores, hasta que van apareciendo como agregados a las 7 y 9 h de molienda.

Figura 8. Morfología de la ferrita de manganeso. a) Al inicio, solo la mezcla de los precursores; b) a 3 h de molienda; c) a 7 h de molienda; d) a 9 h de molienda, considerado tiempo óptimo
Figure 8. Morphology of the manganese ferrite. a) At the beginning, single the mixture of the precursors; b) to 3 milling h; c) to 7 milling h; d) to 9 h of milling, considered optimal time

Figura 9. Morfología de la ferrita de níquel. a) Al inicio, solo la mezcla de los precursores; b) a 3 h de molienda; c) a 7 h de molienda; d) a 9 h de molienda, considerado tiempo óptimo
Figure 9. Morphology of the nickel ferrite. a) At the beginning, single the mixture of the precursors; b) to 3 milling h; c) to 7 milling h; d) to 9 h of milling, considered optimal time
Este último tiempo corresponde a las fases mayoritarias de MnFe2O4 y NiFe2O4 y se puede observar que no existe una gran homogeneidad en ninguno de los casos. Se observan también a las 7 y 9 h, tamaños de partículas individuales muy pequeños (gránulos independientes), menores de 1-2 mm.
Esto corrobora que los gránulos así obtenidos son más heterogéneos que en el caso de las ferritas obtenidas por vía hidroquímica, por lo tanto no resultan puros como se pretendía y corrobora lo señalado por algunos autores [9] que indican haber obtenido por mecanosíntesis, impurezas de los precursores.
4. CONCLUSIONES
La obtención de ferritas de manganeso y níquel por vía mecanosíntesis resulta efectiva pero resultan ser de baja pureza y poca homogeneidad si se compararan con las obtenidas por vía hidroquímica y que reportan Prieto (1997) y Barrado y colaboradores (2002). Persiste la presencia de otras fases correspondientes a los precursores, mismas que no llegan a desaparecer con el tiempo de molienda. El tiempo de síntesis más eficiente del proceso oscila entre las 7-10 horas de molienda, al parecer ligeramente menor para la ferrita de manganeso. Se obtiene mayor fracción molar en ésta con relación a la ferrita de níquel; así mismo, no resultan significativamente homogéneas. En valores de permeabilidad magnética resulta superior la ferrita de manganeso al igual que en tamaños de partículas.
REFERENCIAS
[1] SONI, P. R. Mechanical Alloying: Fundamentals and applications. Cambridge International Science Publishing. Ed. Pear Tree Press Ltd. Stevenage. England. 6-24. (2001). [ Links ]
[2] PRIETO, F.; SÁNCHEZ, F. J.; MÉNDEZ, M. A.; GARCÍA, G.; GORDILLO, J. A. Boletín de la Sociedad Geológica Mexicana. Tomo 59, 1, 125 (2007). [ Links ]
[3] PRIETO, F. Depuración de aguas residuales mediante formación de ferritas in situ. Diseño y optimización de un reactor a escala piloto, Evaluación de ferritas Tesis doctoral. Facultad de Ciencias, Universidad de Valladolid, España, 67, (1997). [ Links ]
[4] AVVAKUMOV, E.; SENNA, M.; KOSOVA, N. Soft mechanochemical synthesis: A basic for new chemical technologies. Kluwer Academic Publishers, New Yoyrk, London, Moscow. Ed. Hingham. USA , 48–73. (2002). [ Links ]
[5] CARMICHAEL R.S. Practical Handbook of Physical properties of rocks and minerals, Section IV, 303–334, (1984). [ Links ]
[6] GUTIÉRREZ E. Óxidos Mixtos. En: Química Inorgánica Ed. Reverté, Barcelona, España. 729–738, (1985). [ Links ]
[7] GAUTIER, J. L. Boletín de Química de los Materiales, Santiago de Chile, 27, 2, 35, (2006). [ Links ]
[8] SÁNCHEZ F., COREÑO O., BOLARÍN A.M. Y HINOJOSA M. Rev. Soc. Quím. México. 3, 49, (2005). [ Links ]
[9] COSTA, A. C.; MORELLI, M. R.; KIMINAMI, R. H. Cerámica, 49, 3, 11, (2003). [ Links ]
[10] ALBANI, C., G. ENNAS, A. LA BARBERA, G. MARONGIU, F. PADELLA, F. VARSANO. International Journal Hydrogen Energy, 30, 13, 1407, (2005). [ Links ]
[11] MATSUBARA E., OKUDA K., WASEDA Y. Y SAITO Y. J. Physical Sciences. 47, 10, 1023, (1992). [ Links ]
[12] PCPDF-WIN Power Diffraction Files. Version 2.01, November, ICPDS. ICDD. (1998). [ Links ]
[13] RIETVELD, H. Acta Crystallographica, 22, 151, (1967) [ Links ]
[14] YOUNG, R. The Rietveld Method, In: Chapter 2, The Early Days: a Retrospective View, Ed. Intitute Union of Crystalographyc, Oxford, University Press, New York. (1993). [ Links ]
[15] MADSEN, I., N.V.Y. SCARLETT, L.M.D. CRANSWICK, T. LWIN. Journal of Applied Crystallography, 34, 409, (2001). [ Links ]
[16] LUTTEROTTI, L.; MATTHIES, H.; WENK, R. MAUD: Material Analysis Using Diffraction: a user friendly Java program for Rietveld Texture Analysis and more (en línea), in Proceeding of the Twelfth International Conference on Textures of Materials (ICOTOM-12), Vol. 1, 1999, Version 1.993<
[17] ESTEVE, V. J. El Método Rietveld. Primera Edición. Editores Cano. Barcelona, España. 17–92, (2006). [ Links ]
[18] BONETTO, R.; ZALBA, P.; CONCONI, M.; MANASSERO, M. Revista Geológica de Chile 30, 1, 103, (2003). [ Links ]
[19] ALBANI, C., G. ENNAS, A. LA BARBERA, G. MARONGIU, F. PADELLA, F. VARSANO. International Journal Hydrogen Energy, 30, 13, 1407, (2005). [ Links ]
[20] BOTTA, P. M.; BERCOFF, P. G.; AGLIETTI, E. F.; BERTORELLO, R. G.; PORTO, J. M. Revista Matéria, 9, 2, 144, (2004). [ Links ]
[21] TORRES, G. Materiales metálicos. Tratamientos térmicos. Ed. TMD, Mechatronic Desing. (2001). Disponible en http://giovannitorres.20m.com.(consultado Octubre 2007). [ Links ]
[22] BARRADO, E.; PRIETO, F.; MEDINA, J.; LÓPEZ, J. L. J. Alloys Compd. 335(1-2):203, (2002). [ Links ]
[23] BARRADO, E.; RODRÍGUEZ, J. A.; PRIETO, F.; MEDINA, J. Journal of Non-Crystalline Solids. 351, 906, (2005). [ Links ]
[24] SKOOG D. A.; LEARY J. J. Análisis Instrumental, Ed. Mc Graw Hill, México, p. 135, (1994).














