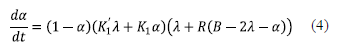Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.77 no.162 Medellín Apr./June 2010
CINÉTICA Y MECANISMO DE ENTRECRUZAMIENTO DE DIGLICIDIL ETER DE BISFENOL-A CON TRIMETILEN GLICOL di-p-AMINOBENZOATO
KINETIC AND MECHANISM OF DIGLYCIDYL ETHER OF BISPHENOL A AND TRIMETILEN GLICOL di-p-AMINOBENZOATE CROSSLINKING
FABIO AUGUSTO MESA RUEDA
Universidad Nacional de Colombia, Departamento de Ingeniería Química, Manizales. famesar@unal.edu.co
ALNEIRA CUÉLLAR BURGOS
Universidad Nacional de Colombia, Departamento de Ingeniería Química, Manizales. acuellarb@unal.edu.co
CARLOS VARGAS HERNÁNDEZ
Universidad Nacional de Colombia, Departamento de Física, Manizales. cvargash@unal.edu.co
JAIRO ERNESTO PERILLA PERILLA
Universidad Nacional de Colombia, Departamento de Ingeniería Química, Bogotá. jeperillap@unal.edu.co
Recibido para revisión 12 de diciembre de 2008, aceptado 17 de junio de 2009, versión final 07 de octubre de 2009
RESUMEN:Este trabajo presenta la cinética de entrecruzamiento de un sistema epóxico utilizando la titulación de grupos oxirano para determinar el porcentaje y la conversión de los mismos antes de los eventos de gelificación y vitrificación. El sistema que se usó para este estudio fue diglidicil éter de bisfenol A (DGEBA)/trimetilen glicol di-p-aminobenzoato (TMAB). El comportamiento de las curvas de conversión fue sigmoidal indicando que el sistema de entrecruzamiento reactivo tiene un efecto autocatalítico. Comparando los resultados experimentales con los datos teóricos se puede concluir que se obtuvo una expresión adecuada que representa la cinética de entrecruzamiento en estos sistemas.
PALABRAS CLAVE: diglicidil éter de bisfenol A, DGEBA, trimetilen glicol di-p-aminobenzoato, TMAB, polimeros termofijos, mecanismo de curado, cinética de entrecruzamiento.
ABSTRACT: Autocatalytic cure kinetics for a crosslinking epoxy system was studied by manual titration of oxirane groups for the quantitative determination of the percent epoxide content and epoxide conversion before significant effect of gelification and vitrification events. The system used in this study was the diglycidyl ether of bisphenol A(DGEBA)/trimetilen glicol di-p-aminobenzoate (TMAB). The shape of the conversion curves was sigmoid, and this meant that DGEBA/TMAB system underwent an autocatalytic cure reaction. From the comparison between theoretical prediction and experimental data, it was found that the autocatalytic expression correctly represented to analyze the cure kinetics of these systems.
KEYWORDS: Diglycidyl ether of bisphenol-A, DGEBA, trimethylene glycol di-p-aminobenzoate, TMAB, thermosetting polymers, curing mechanism, crooslinking kinetic.
1. INTRODUCCIÓN
Los termofijos se encuentran dentro de la clasificación dada a los materiales poliméricos, como respuesta a su comportamiento en función de la temperatura y se caracterizan estructuralmente por el elevado grado de reticulación o entrecruzamiento de las macromoléculas compuesta por unidades repetitivas con enlaces covalentes; estos materiales tienden a degradarse ante un calentamiento progresivo sin llegar a ser líquidos [1, 2]. Algunos polímeros que se encuentran en esta clasificación son las resinas epóxicas, fenólicas, poliéster insaturado, poliuretanos, acrilatos, urea-formaldehido, entre otras.
Los sistemas epoxi/amina (EA) para la producción de resinas epóxicas entrecruzadas son materiales ampliamente usados como recubrimientos, adhesivos, matrices compuestas (con fibras sintéticas y/o naturales), entre otros, para la industria aeroespacial, transporte, electrónica, laminados, encapsulación, etc. [3]. La redes de los polímeros termofijos, en particular las resinas epóxicas, se forman por reacción química entre monómeros, donde al menos uno de ellos tiene tres o más grupos reactivos por molécula (funcionalidad mayor o igual a tres) [4].
Dentro de los monómeros epóxicos (oligómeros epóxicos o resinas epóxicas) comerciales más usados se encuentran las de Diglicidil Éter de Bisfenol A (DGEBA), Diglicidil Éter de Bisfenol F (DGEBF), Novolac, Triglicidil para-amino fenol (TGAP) y Tetra diglicidil-4-4’-diamino difenil metano (TGDDM). Este tipo de monómeros pueden reaccionar con más de 50 tipos de agentes de entrecruzamiento por un mecanismo catiónico o aniónico con el anillo epoxi(oxirano ó α-epoxi ó 1,2-epoxi ó epóxico) [3]. Algunos de los agentes de entrecruzamiento más usados son bases de Lewis, aminas primarias, aminas secundarias, aminas terciarias, amidas, ácidos orgánicos e inorgánicos, anhídridos, etc.
Específicamente se analizará cinéticamente el sistema conformado por un oligómero epóxico líquido tipo Diglicidil Éter de Bisfenol A (DGEBA) y como agente de entrecruzamiento se usará la diamina aromática trimetilen glicol di-p-aminobenzoato (TMAB). El DGEBA es considerado industrialmente como un material de propósito general por sus aplicaciones en adhesivos de alto rendimiento, moldeo de piezas por vaciado, formulación de recubrimientos en carrocerías de automóviles, formulación de recubrimientos para envases, recubrimiento de estructuras en ambientes corrosivos (p.ej. medio ambiente marino ó químico), formulación de pinturas por fotocurado, entre otras [5]. Por otra parte, el TMAB es usado como agente de curado en resinas epóxicas, elastómeros de poliuretano, y provee en la formulación excelentes propiedades mecánicas y químicas, estabilidad hidrolítica, buen desempeño en altas temperaturas y suministra resistencia química a hidrocarburos, solventes, contaminantes y ozono; además de ser un producto industrialmente seguro aprobado por la FDA en los Estados Unidos[6].
2. SISTEMA REACTIVO EPOXI/DIAMINA (EA) UTILIZADO.
Para el análisis del sistema EA, se escogió la resina epóxica líquida DER-331 tipo DGEBA de la casa Dow Chemical Inc. suministrada por la empresa Andercol S.A. (Medellín, Colombia). Para la verificación del peso equivalente epoxi se utilizó la norma ASTM D1652-97 [7], obteniendo un valor promedio de 190.77 g/eq que se encuentra dentro del intervalo ofrecido por el proveedor. Algunas propiedades características y la estructura de este oligómero se muestran en la tabla 1 y figura 1.
Tabla 1. Propiedades del Oligómero Epóxico[5].
Table 1. Epoxide Oligomer Properties.

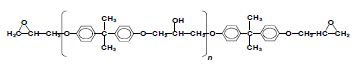
Figura 1. Estructura química del oligómero epóxico
Figure 1. Chemical Structure of epoxy oligomer.
El agente de entrecruzamiento TMAB es una diamina aromática de Air Products and Chemicals y se conoce comercialmente con el nombre de Versalink-740M. Algunas propiedades y la estructura de este monómero se muestran en la tabla 2 y la figura 2.
Tabla 2. Propiedades del Agente de Entrecruzamiento
Table 2. Crosslinking agent properties


Figura 2. Estructura química del agente de entrecruzamiento
Figure 2. Chemical structure of crooslinking agent
3. MODELO CINÉTICO.
El mecanismo de curado entre la resina epóxica y la amina primaria ocurre básicamente por un ataque nucleofílico [3] sobre el carbón terminal del anillo, con la conversión del anillo epóxico en un grupo hidroxílico. Previamente se forma un complejo donor-aceptor entre el anillo epóxico y un grupo hidroxílico suministrado por la resina epóxica, impurezas, catalizador, entre otros. El ataque nucleofílico necesita una asistencia electrofílica que es dada por el complejo donor-aceptor. Un grupo amínico primario puede reaccionar sucesivamente con dos grupos oxirano debido a los dos hidrógenos activos de la amina, pasando de una amina primaria a una amina secundaria y terciaria. Por otra parte, los grupos hidroxílicos pueden intervenir formando una reacción de eterificación con otro grupo epóxico debido a temperaturas altas (>150°C) y exceso de grupos epoxi, conversiones altas y por el efecto competitivo entre aminas secundarias de gran impedimento estérico con los grupos epóxicos [4]. La figura 3 (a-f) representa el mecanismo de reacción y tiene en cuenta las siguientes consideraciones [8]:
a) Evaporación de los reactivos, especialmente si el agente de entrecruzamiento es una amina de bajo peso molecular.
b) Incluye la relación entre las constantes cinéticas de la amina secundaria y de la amina primaria (relaciones 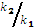 y/o
y/o  ). Se han reportado valores para esta relación desde 0.1 hasta 1.0 [9, 10, 11] que depende del sistema estudiado en particular y de la temperatura.
). Se han reportado valores para esta relación desde 0.1 hasta 1.0 [9, 10, 11] que depende del sistema estudiado en particular y de la temperatura.
c) La posibilidad que ocurra la reacción de eterificación depende de la relación estequiométrica entre resina epóxica y amina, de la temperatura y de la basicidad de la amina [3]. Generalmente la eterificación se promueve por altas temperaturas de curado y por exceso de resina epóxica que entraría a competir con la reacción entre los grupos oxiranos y la amina secundaria [4].
d) No se tiene en cuenta reacciones de homopolimerización que solo ocurren en presencia de catalizadores básicos ó ácidos de Lewis [3] o por impurezas presentes en el medio.
e) Los grupos hidroxilo generados en la reacción, actúan como medio de autocatalización suministrando hidrógenos activos [3].

Figura 3. Mecanismo de reacción EA
Figure 3. Reaction mechanism EA
Donde A1, A2, A3 y E corresponden a la amina primaria, secundaria, terciaria y resina epóxica respectivamente. El término CAT corresponde al afecto catalítico dado por la concentración d
e grupos hidroxilo (OH-) generados en aminas secundarias y terciarias que actúan como promotores de la reacción con la formación del complejo donor-aceptor explicado anteriormente. La ecuación 1 representa las velocidades de reacción para A1, E y CAT (OH) con base en el mecanismo sugerido:

La ecuación 2 tiene en cuenta el balance de masa a partir del mecanismo de reacción para la amina y para la resina epóxica.

Donde [A1]0, [A1]evap, [A1], [A2] y [A3] son la concentración inicial de amina primaria, amina primaria evaporada, amina primaria, amina secundaria y amina terciaria respectivamente.
Por otra parte, [E]0, [E]evap y [E] corresponden la concentración inicial de grupos oxirano o epóxicos, grupos oxirano evaporados y epoxi a cualquier tiempo respectivamente. La ecuación 3 es una simplificación de la velocidad de reacción en términos del balance de masa (ecuación 2), la conversión α  , reducción de constantes y asumiendo que las relaciones
, reducción de constantes y asumiendo que las relaciones 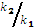 y
y  son independientes de la ruta de reacción catalítica ó no catalítica. Es decir,
son independientes de la ruta de reacción catalítica ó no catalítica. Es decir, 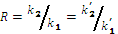 .
.

Es de resaltar que de acuerdo al mecanismo de reacción, la relación R es constante con la conversión y se podría simplificar bajo los siguientes criterios:
- Para resinas epóxicas y diaminas de alto peso molecular, la evaporación no existe o es despreciable.
- Si se tiene una relación estequiométrica entre resina epóxica a diamina.
Se han reportado valores de R entre 0.5 y 1 [12, 13, 14, 10] y menores o iguales a 0.5 [12, 8, 15, 16, 17]. Si R>1/2 implicaría que los hidrógenos de la amina secundaria son más reactivos que los hidrógenos de la amina primaria. Simplemente por efectos estéricos, este caso es menos probable. La ecuación 6 incluye la suposición de mayor reactividad (al menos el doble) entre los hidrógenos amínicos de la amina primaria en comparación a la amina secundaria.

Esta última ecuación es similar a una derivación del modelo generalizado de Kamal [18, 19] en la ecuación 7, para el entrecruzamiento de sistemas epoxi/diamina.

Donde los coeficientes m y n son parámetros ajustables a partir de resultados experimentales.
4. DETERMINACIÓN DE LAS CONSTANTES CINÉTICAS.
Para relaciones estequiométricas de resina epóxica y diamina, se reportan conversiones (α) hasta de 0.577 [20, 21], situación en la cual se llega al punto de gel. A partir de este punto puede proseguir el proceso de curado, pero inicia un predominio de fenómeno difusional en el sistema.
Varias técnicas son usadas para caracterizar la extensión del curado en los polímeros termofijos, de igual forma para los fenómenos de gelación y de vitrificación. Dentro de estas técnicas se encuentran: análisis térmico, espectroscopia, cromatografía, reología y medidas dieléctricas [22, 23, 24, 25, 26, 27, 28].
De igual forma hay varios métodos por titulación que han sido desarrollados para medir, algunas veces selectivamente, la cantidad de grupos epóxicos [7, 29], amina primaria, amina secundaria y amina terciaria [30, 31]. Estos procedimientos consumen más tiempo y tienen la limitante de llevarse a cabo en conversiones cercanas al punto de gel, básicamente por las limitaciones de disolución de monómeros y polímeros.
Para la determinación de la cinética y de los parámetros se utilizó la norma estándar ASTM-1652 [7] para cuantificar el contenido de grupos epóxicos y por lo tanto la conversión. La reacción fue en masa utilizando una relación 1:1 de grupos epóxicos a hidrógenos amínicos activos a 140°C, 150°C y 160°C. Se retiraban muestras a diferentes tiempos para determinar el contenido de grupos epóxicos de acuerdo al procedimiento reportado en la norma ASTM-1652. La figura 4 muestra los resultados experimentales de conversión en función del tiempo y de la temperatura del sistema. Se aprecia que a pesar de las limitaciones de esta técnica se puede llegar a conversiones cercanas al 80%.

Figura 4. Conversión de grupos epóxicos en función del tiempo usando ASTM-1652
Figure 4. Epoxide groups conversion in function of time using ASTM-1652.
Las ecuaciones 8 y 9 son una reorganización del Modelo Propuesto (MP) en este trabajo (ecuación 6) y el Modelo de Kamal (MK) referenciado en la ecuación 7.

De acuerdo a MP (ecuación 8), si se grafica el término del lado izquierdo de la ecuación vs. α se obtiene una línea recta cuya pendiente es  y el intercepto es
y el intercepto es  . Si se comparan las ecuaciones 6 y 7, es factible proponer que el orden global de la reacción es 3 (m+n=3) y bajo ese criterio se podrían ajustar los parámetros m, n,
. Si se comparan las ecuaciones 6 y 7, es factible proponer que el orden global de la reacción es 3 (m+n=3) y bajo ese criterio se podrían ajustar los parámetros m, n,  y
y  en el modelo de Kamal, y las constantes cinéticas de acuerdo a una expresión tipo Arrhenius.
en el modelo de Kamal, y las constantes cinéticas de acuerdo a una expresión tipo Arrhenius.
Las figuras 5 y 6 muestran los resultados obtenidos a partir de los datos experimentales y cuya linealización permite obtener las constantes cinéticas  y
y  a cada temperatura.
a cada temperatura.

Figura 5. Linealización de modelo MK.
Figure 5. Linearization MK model.

Figura 6. Linealización de modelo MP.
Figure 6. Linearization MP model.
Las figuras 7 y 8 muestran el ajuste de las constantes cinéticas en función de la temperatura para una expresión tipo Arrhenius 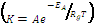 , donde A, EA, Rg y T son la constante de amortiguamiento, energía de activación, constante universal de los gases y temperatura absoluta respectivamente.
, donde A, EA, Rg y T son la constante de amortiguamiento, energía de activación, constante universal de los gases y temperatura absoluta respectivamente.

Figura 7. Constantes cinéticas de MK en función de la temperatura.
Figure 7. Kinetic constants of MK in function of temperature.

Figura 8. Constantes cinéticas de MP en función de la Temperatura.
Figure 8. Kinetic constants of MP in function of temperature.
La figura 9 muestra la dependencia lineal de los parámetros m (m=m0+m1T) y n (n=n0+n1T) en MK con la temperatura absoluta de entrecruzamiento y la tabla 3 resume los resultados obtenidos.
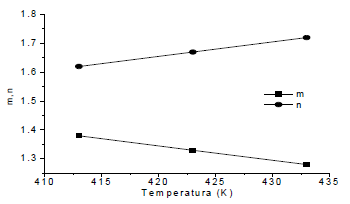
Figura 9. Parámetros m y n en función de la temperatura absoluta
Figure 9. m and n parameters in function of absolute temperature
Tabla 3. Resumen de parámetros cinéticos.
Table 3. Summary of kinetic parameters

Las figuras 10 y 11 muestran los datos experimentales de conversión de grupos epóxicos con el tiempo, comparados con el modelo MP y MK. De estos resultados se aprecia el alejamiento a partir de la conversión en el punto de gel para este sistema EA, que teóricamente es de αgel=0.577 [4].
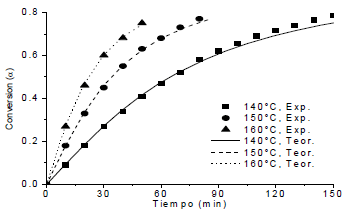
Figura 10. Comparación entre los datos experimentales y el modelo cinético MP
Figure 10. Comparation between experimental data and MP model.
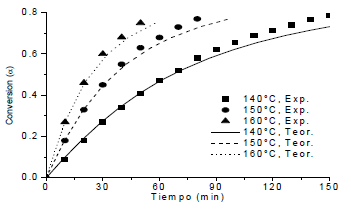
Figura 11. Comparación entre los datos experimentales y el modelo cinético MK.
Figure 11. Comparation between experimental data and MK model.
Eso se explica del hecho que a partir de este punto predomina una cinética donde el fenómeno difusional toma mayor relevancia por el incremento de la viscosidad y del grado de entrecruzamiento. En los dos modelos es necesario corregir las expresiones cinéticas con funciones que tengan en cuenta este efecto y para ello se necesitan de técnicas instrumentales que permitan la medición de la conversión por encima del punto de gel, sin limitaciones de solubilidad del sistema, tales como: calorimetría diferencial de barrido (DSC ó MDSC), espectroscopia infrarroja (FTIR, MIR, NIR), espectroscopia dieléctrica, reología, entre otros.
5. CONCLUSIONES.
A partir de seguimiento químico por titulación se puede determinar la concentración de grupos epóxicos y de conversión con el tiempo, y por lo tanto de la cinética de reacción para sistemas como el DGEBA/TMAB. Tiene la limitante dada por el aumento progresivo de la viscosidad debido al aumento en el peso molecular y el entrecruzamiento. Los datos obtenidos hasta el punto de gel, y un poco más allá, son fáciles de seguir a través de la norma ASTM-1652 dada la relativa solubilidad del polímero y monómeros en los solventes especificados por el procedimiento estándar. Después del punto de gel se hace necesario el uso de otras técnicas instrumentales que permitan medir el grado de entrecruzamiento y por lo tanto de la conversión sin las limitantes propias de la inmiscibilidad. De esta forma se puede obtener una función dentro de la cinética que tenga en cuenta el fenómeno difusional que se hace importante a partir de la gelificación y vitrificación. La aproximación con el modelo propuesto (MP) tiene mejores resultados por encima del punto de gel en comparación al modelo de Kamal (MK) para el sistema EA analizado. En próximos trabajos se utilizará la espectroscopia micro-Raman y la calorimetría diferencia de barrido (DSC) para determinar la conversión con el tiempo para esta clase de materiales poliméricos.
AGRADECIMIENTOS
Los Autores agradecen al Laboratorio de Polímeros y Materiales Compuestos y al Laboratorio de Bioproductos de la Universidad Nacional de Colombia sede Manizales, a las compañías Andercol (Medellín, Colombia), Emulsiones Químicas (Bogotá, Colombia) y Air Products (EE.UU) por las muestras de DGEBA y TMAB. El presente trabajo ha sido apoyado parcialmente por el proyecto Semilleros de Investigación de la Direcciones de Investigaciones (DIMA) de la Universidad Nacional de Colombia sede Manizales.
REFERENCIAS
[1] CARRAHER, CHARLES E. Polymer Chemistry, Marcel Dekker, 2003. [ Links ]
[2] ODIAN, GEORGE. Principles of Polymerization, Wyley-Interscience, 2004. [ Links ]
[3] LEE, HENRY. Handbook of Epoxy Resins, McGraw-Hill, 1967. [ Links ]
[4] PASCAULT, J. P.; SAUTEREAU, H; VERDU, JACQUES; WILLIAMS, R. J. J. Thermosetting Polymers, Marcel Dekker, 2002. [ Links ]
[5] DOW CHEMICAL, COMPANY. Epoxy Resin: Selection Guide, Catalog, 1998. [ Links ]
[6] AIR PRODUCTS AND CHEMICALS, INC. Versalink® 740M Diamine Curative For High-Performance Polyurethane Elastomers and Epoxies, Catalog, 2004. [ Links ]
[7] ASTM, INTERNATIONAL. ASTM D 1652-97: Standard Test Methods for Epoxy Content of Epoxy Resins, Catalog, 1997. [ Links ]
[8] PAZ-ABUÍN, SENÉN; PAZOS PELLIN, MERCEDES; PAZ-PAZOS, MARTA. Influence of the reactivity of amine hydrogens and the evaporation of monomers on the cure kinetics of epoxy-amine: kinetic questions. Polymer, 38, 3795-3804, 1997. [ Links ]
[9] KIEFER, J.; HEDRICK, J. L.; HILBORN, J. G. Macroporous Thermosets by Chemically Induced Phase Separation. Advances in Polymer Science, 147, 161-247, 1999. [ Links ]
[10] BONNET, A; PASCAULT, J. P.; SAUTEREAU, H; TAHA, M.; CAMBERLIN, Y. Epoxy-Diamine Thermoset/Thermoplastic Blends. 1. Rates of Reactions before and after Phase Separation. Macromolecules, 32, 8517-8523, 1999. [ Links ]
[11] BORRAJO, J.; RICCARDI, C. C.; WILLIAMS, R. J. J.; SIDDIQI, HUMAIRA MASSOD; DUMON, MICHEL; PASCAULT, J. P. Thermodynamic analysis of reaction-induced phase separation in epoxy-based polymer dispersed liquid crystals (PDLC). Polymer, 39, 845-853, 1998. [ Links ]
[12] VERCHERE, D.; SAUTEREAU, H; PASCAULT, J. P.; RICCARDI, C. C.; MOSCHIAR, S. M.; WILLIAMS, R. J. J. Buildup of Epoxycycloaliphatic Amine Networks. Kinetics, Vitrification, and Gelation. Macromolecules, 23, 725-731, 1990. [ Links ]
[13] GIRARD-REYDET, E.; RICCARDI, C. C.; SAUTEREAU, H; PASCAULT, J. P. Epoxy-Aromatic Diamine Kinetics. 2. Influence on Epoxy-Amine Network Formation. Macromolecules, 28, 7608-7611, 1995. [ Links ]
[14] GIRARD-REYDET, E.; RICCARDI, C. C.; SAUTEREAU, H; PASCAULT, J. P. Epoxy -Aromatic Diamine Kinetics. 1. Modeling and Influence of the Diamine Structure. Macromolecules, 28, 7599-7607, 1995. [ Links ]
[15] LÓPEZ-QUINTELA, ARTURO; PRENDES, PILAR; PAZOS PELLIN, MERCEDES; PAZ-PAZOS, MARTA; PAZ-ABUÍN, SENÉN. Cis/Trans Reactivity: Epoxy-Amine Systems. Macromolecules, 31, 4770-4776, 1998. [ Links ]
[16] PAZ-ABUÍN, SENÉN; LÓPEZ-QUINTELA, ARTURO; VARELA, MONTSE; PAZOS PELLIN, MERCEDES. Method for determination of the ratio of rate constants, secondary to primary amine, in epoxy-amine systems. Polymer, 38, 3117-3120, 1997. [ Links ]
[17] PROLONGO, S. G.; MIKES, F.; CABANELAS, J. C.; PAZ-ABUÍN, SENÉN; BASELGA, J. Diffusion control on the cure kinetics of DGEBA with ethylenediamines. Journal of Materrials Processsing Technology, 143-144, 546-550, 2003. [ Links ]
[18] COLE, K. C. A New Approach to Modeling the Cure Kinetics of Epoxy Amine Thermosetting Resins. 1. Mathematical Development. Macromolecules, 24, 3093-3097, 1991. [ Links ]
[19] COLE, K. C.; HECHLER, J. J.; NOEL, D. A New Approach to Modeling the Cure Kinetics of Epoxy Amine Thermosetting Resins. 2. Application to a Typical System Based on Bis[4-(diglycidylamino)phenyl]methane and Bis(4-aminophenyl) Sulfone. Macromolecules, 24, 3098-3110, 1991. [ Links ]
[20] WILLIAMS, R. J. J.; ROZENBERG, B. A.; PASCAULT, J. P. Reaction-Induced Phase Separation in Modified Thermosetting Polymers. Advances in Polymer Science, 128, 95-156, 1997. [ Links ]
[21] BONNAUD, L.; PASCAULT, J. P.; SAUTEREAU, H. Kinetic of a thermoplastic-modified epoxy-aromatic diamine formulation: modeling and influence of a trifunctional epoxy prepolymer. European Polymer Journal, 36, 1313-1321, 2000. [ Links ]
[22] CRAVER, CLARA D. and PROVDER, THEODORE. Polymer Characterization: Physical Property, Spectroscopy and Chromatographic Methods, American Chemical Society, 1990. [ Links ]
[23] STUART, BARBARA. Polymer Analysis, John Wiley & Sons, 2003. [ Links ]
[24] HATAKEYAMA, T. and QUINN, F. X. Thermal Anlalysis: Fundamentals and Applications to Polymer Science, John Wiley & Sons, 1999. [ Links ]
[25] WUNDERLICH, BERNHARD. Thermal Analysis of Polymeric Materials, Springer, 2005. [ Links ]
[26] HUNT, B. J. and JAMES, M. I. Polymer Characterisation, Chapman & Hall, 1993. [ Links ]
[27] SPELLS, S. J. Characterization of Solid Polymers: New Techniques and Developments, Chapman & Hall, 1994. [ Links ]
[28] BRADY, ROBERT F. Comprehensive Desk Reference of Polymer Characterization and Analysis, Oxford University Press, 2003. [ Links ]
[29] ASTM, INTERNATIONAL. ASTM D 1652-04: Standard Test Method for Epoxy Content of Epoxy Resins, Catalog, 2004. [ Links ]
[30] ASTM, INTERNATIONAL. ASTM D 2074-66: Total, Primary, Secondary, and Tertiary Amine Values of Fatty Amines by Alternative Indicator Method, Catalog, 1987. [ Links ]
[31] ASTM, INTERNATIONAL. ASTM D 2074-07: Standard Test Methods for Total, Primary, Secondary, and Tertiary Amine Values of Fatty Amines by Alternative Indicator Method, Catalog, 2007. [ Links ]