Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.77 no.162 Medellín Apr./June 2010
CRISTALES BIOGÉNICOS DE MAGNETOCOCOS DE LA REPRESA LA FE Y LAGO CALIMA (COLOMBIA)
BIOGENIC CRYSTALS OF MAGNETOCOCCUS FROM LA FE DAM AND CALIMA LAKE (COLOMBIA)
VIVIANA MORILLO
Grupo de Mineralogía Aplicada y Bioprocesos,Universidad Nacional de Colombia Sede Medellín. vkmorill@unalmed.edu.co
ALEJANDRO SALAZAR
Grupo de Mineralogía Aplicada y Bioprocesos,Universidad Nacional de Colombia Sede Medellín.
MARCO MÁRQUEZ
Grupo de Biomineralogía Aplicada. Universidad Nacional de Colombia Sede Medellín. mmarquez@unalmed.edu.co
ALVARO MORALES
Grupo de Física del Estado Sólido. Universidad de Antioquia, Medellín, Colombia. amoral@fisica.udea.edu.co
ULYSSES LINS
Instituto de Microbiología Profesor Paulo de Góes. Universidad Federal de Rio de Janeiro, Brasil. ulins@micro.ufrj.br
Recibido para revisar Enero 27 de 2009, aceptado 17 de junio de 2009, versión final 22 de junio de 2009
RESUMEN:Con el propósito de estudiar la morfología y composición de magnetosomas sintetizados intracelularmente por magnetococos encontrados en la represa La Fe y lago Calima - Colombia, se separaron bacterias magnetotácticas (MTBs) por inducción magnética. MTBs y sus magnetosomas se evaluaron mediante espectroscopía de energías dispersivas de rayos X (EDX) usando microscopía electrónica de transmisión (TEM) para determinar el tamaño y la morfología de los nanocristales. Los resultados muestran una alta similitud entre los magnetosomas de los magnetococos estudiados, presentando cristales de magnetita con morfología hexagonal prismática y una media de longitud de 83 y 87 nm para cristales de La Fe y Calima respectivamente. Por el tamaño y factor de forma, los cristales se clasificaron en el rango de monodominio magnético. Los datos obtenidos permiten evidenciar futuras aplicaciones para la magnetita biogénica, en biotecnología y medicina.
PALABRAS CLAVE: bacterias magnetotácticas, magnetita biogénica, monodominio, nanocristales, TEM/EDX.
ABSTRACT:In order to study the morphology and composition of magnetosomes synthesized by two magnetococcus found at La Fe Dam and Calima Lake - Colombia, magnetotactic bacteria (MTBs) were separated by magnetic induction. MTBs and their magnetosomes were evaluated by energy dispersive x-ray spectroscopy (EDX) using transmission electron microscopy (TEM) and the size and shape of the nanocrystals were determined. Results revealed a high similarity between the magnetococcus under study, showing magnetite crystals with hexagonal-prismatic morphology and average length of 83 and 87 nm for crystals from La Fe and Calima respectively. By the size and shape factor, crystals were classified in the single domain magnetic range. Results obtained allow seeing future applications for biogenic magnetite in biotechnology and medicine.
KEYWORDS: magnetotactic bacteria, biogenic magnetite, single domain, nanocrystals, TEM/EDX.
1. INTRODUCCIÓN
Los materiales magnéticos se vienen usando principalmente en la elaboración de ferrofluidos, siendo los óxidos de hierro los más empleados en tales fines, así, materiales como la magnetita se han empleado como micro o nanotransportadores con aplicaciones en medicina y biotecnología [1,2].
Para muchas de las aplicaciones biotecnológicas y médicas los cristales de magnetita deben tener tamaños nanométricos, los cuales son generalmente obtenidos por co-precipitación, resultando en una alta proporción de partículas superparamagnéticas y alta saturación de magnetización, con diámetros promedios de 10 nm [2].
Hace varias décadas se reportó que bacterias de hábitat acuático y con actividad magnetotáctica son capaces de sintetizar cristales de magnetita y/o greigita en el interior de la célula, los cuales son conocidos como magnetosomas [3,4,5]. Los magnetosomas sintetizados por la bacteria no sólo tienen un papel magnético, sino que al parecer pueden ser una forma de almacenamiento y captura de Fe, como reserva de aceptores o donadores de electrones [6].
Los nanocristales magnéticos sintetizados por las MTBs, tienen unas propiedades muy particulares, de interés tanto en el campo científico como en el industrial, como son tamaño, estructura cristalina organizada respecto a la versión sintetizada inorgánicamente, y pureza. Los cristales intracelulares reportados hasta el momento tienen como característica particular una biocapa, compuesta principalmente por lípidos y polisacáridos, que los recubre y ordena en cadenas lineales en la bacteria, permitiéndole orientarse en el campo geomagnético [3,7,8].
El conocimiento de los principios biológicos y químicos de biomineralización permitirá aprovecharlos para uso en el desarrollo de nanomateriales, puesto que las aplicaciones de minerales con magnetismo son un aporte significativo para la ciencia y la tecnología como medio para almacenamiento de datos en cintas, discos y burbujas magnéticas, en la medicina, para la inmovilización de sustancias bioactivas, elaboración de biosensores, transportadores de drogas especificas, agentes de contraste, entre otros [1,2].
2. METODOLOGÍA
2.1. Área de estudio y toma de muestras
Muestras con sedimento y agua para el aislamiento de MTBs fueron tomadas en la interfase agua/sedimento, a profundidades entre 160 - 310 cm en la represa La Fe, ubicada a 2156 m.s.n.m. al nororiente del departamento de Antioquia y en el lago Calima, ubicado a 1400 m.s.n.m. en el centro del departamento del Valle del Cauca, Colombia.
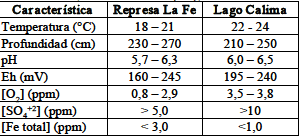
In situ se valoraron parámetros como temperatura, pH (pH-metro Handylab 1) y oxígeno disuelto (OD) (oxímetro Hanna HI 9143) en función de la profundidad de la interfase agua/sedimento. Una vez en el laboratorio, en los microcosmos obtenidos se hicieron mediciones de Eh (Eh-metro Hanna HI 3619), concentración de sulfatos (método turbidimétrico normalizado 4500 SO42-) y concentración de hierro (método de la fenantrolina 3500 Fe), según los métodos normalizados para el análisis de aguas [9]. Los ensayos fueron medidos en un espectrofotómetro GENESYST 10 UV de barrido. La tabla 1 muestra las características principales de las zonas de muestreo. Luego de los análisis, las muestras se incubaron en una zona oscura por 30 días a temperatura ambiente (25° C).
Tabla 1. Caracteristicas de los microcosmos para MTB tipo coco, encontrados en sitios de muestreo
Table 1. Characteristics of positive MTB microcosm type cocci, found in the sampling sites.
2.2. Colección de MTBs
Para aislar MTBs se utilizó la técnica descrita por Lins et al., (2003) [10] que consiste en un dispositivo de vidrio con un extremo terminado en capilar, el cual es sometido a un campo magnético. El dispositivo se llenó con una muestra de agua/sedimento y se sometió a un campo magnético uniforme de ~ 6 Gauss, generado por un solenoide. Luego de 30 minutos de exposición, se extrajo aproximadamente 1ml del líquido rico en MTBs retenido en el capilar del dispositivo, se depositó en un tubo eppendorf provisto de un imán de neodimio de 12,8 Gauss, para obtener un pellet de MTBs.
En un microscopio óptico OLYMPUS CX31 y con un aumento de 400X se estudió el tipo de movilidad celular y el tiempo en el que un concentrado de MTBs logra alcanzar el borde de una gota de 16mm.
2.3. Estudio de magnetosomas por TEM
Una gota del pellet de MTBs fue depositada en una malla de Cu de 200 Tyler, recubierta con Formvar. La gota se posicionó de forma tal que cubriera parcialmente la malla, usando un imán para dirigir las MTBs al borde de la gota en el centro de la malla. Las muestras se dejaron secar a temperatura ambiente y se observaron en un microscopio de transmisión marca Morgagni 268 T063/D791 operando a 80 kV y en uno marca Phillips, modelo Tecnai G2 operando a 200 kV.
Al microscopio se buscó la presencia de MTBs y magnetosomas. El análisis de energías dispersivas de rayos rayos X (EDX) de los cristales intracelulares se realizó en un microscopio de transmisión marca Jeol 1200 EX equipado con un accesorio Noran para análisis químicos y en uno marca Phillips, modelo Tecnai G2.Utilizando el software Origin Pro-Plus 6.2 se midió el ancho y el largo de los magnetosomas, tomando el largo del cristal según la dirección del eje de la cadena a través de la célula. Se analizaron 350 cristales en cada zona de estudio. Para contar la cantidad de cristales por célula se tomaron 50 magnetococos por zona de muestreo.
3. RESULTADOS Y DISCUSIÓN
Los resultados obtenidos por microscopía óptica muestran la presencia de bacterias magnetotácticas tipo coco y bacilo para la represa La Fe y únicamente cocos para el lago Calima, en concentraciones aproximadas de 106 MTBs/ml, luego de los 30 días de incubación. Los cocos observados en la represa la Fe presentaron una forma ligeramente ovalada, con tamaños promedios de 2.0 + 0,2 μm por 1,9 + 0,1 μm. Los cocos del lago Calima, aproximadamente esferoidales, mostraron un diámetro de 1,5 + 0,3 mm. Para la represa La Fe, la concentración de cocos y bacilos varió dependiendo del periodo de recolección de la muestras, concordando con lo encontrado por Simmons et al. (2004) [11], quienes reportaron que las poblaciones de microorganismos magnetotácticos variaron en forma, número y cantidad de magnetosomas en el interior de la célula, de acuerdo con la época del año de recolección y del ambiente climático, encontrando mayor concentración de cocos en invierno y concentraciones similares de cocos y bacilos en el verano.
3.1. Movimiento de los magnetococos
Los cocos magnetotácticos de las dos zonas de estudio mostraron un movimiento coordinado con trayectoria helicoidal junto con un movimiento de rotación alrededor de su propio eje. Una vez en el borde de la gota, los cocos mantuvieron el movimiento de rotación.
Las velocidades de nado de las dos muestras de MTBs fueron en promedio de 103 μm/s, con una velocidad mayor para los cocos de la represa La Fe (113 + 7 μm/s) que para los del lago Calima (93 + 8 μm/s). Los resultados aquí obtenidos son similares a los reportados por Thomas-Keprta et al. (2001) [12], quienes, bajo condiciones óxicas y en un campo magnético uniforme, encontraron que la velocidad de nado de las MTBs evaluadas fue de 105 mm/s en promedio. De otro lado, Silva et al. (2007) [13], quienes evaluaron la velocidad de nado de Candidatus Magnetoglobus multicellularis, encontraron que este agregado, en trayectoria libre, logró una velocidad de 90 + 20 mm/s. Estos datos y los resultados encontrados por TEM al evaluar la cantidad, morfología y disposición de los magnetosomas en cadena o agrupaciones en las células conllevan a concluir a priori que la morfología celular es el factor que determina la diferencia en la velocidad de nado entre los cocos de La Fe y los de Calima.
3.2. Estudio de magnetosomas por TEM
3.2.1. Morfología de los cristales biogénicos
Los magnetococos de La Fe presentaron cristales alongados, con morfología hexagonal prismática (fig. 1), mientras que los del lago Calima mostraron dos tipos de cristales, unos cocos con cristales de morfología octaédricos y otros con cristales de morfología alongada hexagonal prismática (fig. 2).
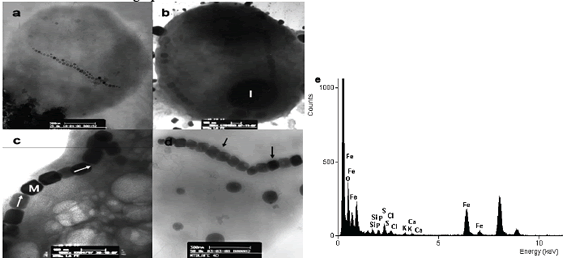
Figura 1. Magnetosomas de magnetococos de la represa La Fe. a) Coco magnetotáctico con dos cadenas de magnetosomas dispuestos a lo largo de la célula, obsérvese los extremos de la cadena con cristales de menor tamaño. b) Magnetococo con dos cadenas de magnetosomas ubicados en la periferia de la célula. c) y d) Magnetosomas con morfología elongada hexagonalprismática. e) Espectro de EDX del magnetosoma. Las flechas negras muestran la membrana del magnetosoma alrededor de los cristales. Las flechas en blanco muestran la forma de medición de la longitud de los cristales. I (inclusión), M (magnetosoma).
Figure 1. Magnetosomes of magnetococos from La Fe dam. a) Magnetococcus with two chains of magnetosomes arranged along the cell, note the ends of the chain with little crystals. b) Magnetococcus with two chains of magnetosomes located at the cell periphery. c) and d) Magnetosomes with elongated hexagonalprismatic morphology. e) EDX spectrum of magnetosomes. The black arrows show the magnetosomes membrane around the crystals. The white arrows show how the length of crystals were measured of the length of the crystals. I (inclusion), M (magnetosomes).
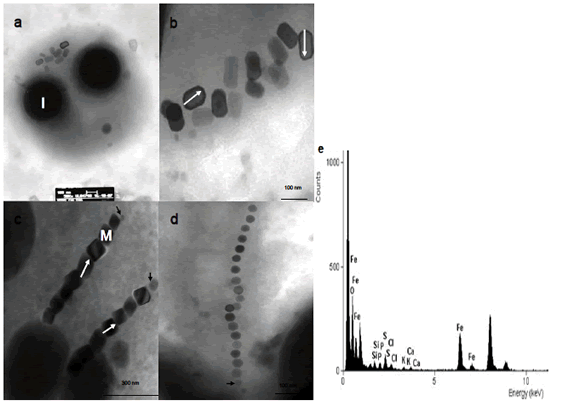
Figura 2. Magnetosomas de magnetococos del lago Calima. a) Coco magnetotáctico con magnetosomas agrupados entre 2 inclusiones de S. b), c) Magnetosomas elongados con morfología hexagonalprismática. c) Coco magnético con dos cadenas paralelas de magnetosomas. d) Magnetosomas cubooctaedrales en cadena. e) Espectro de EDX del magnetosoma. Las flechas negras muestran cristales en crecimiento al final de la cadena. Las flechas en blanco muestran la forma de medición de la longitud de los cristales. I (inclusión de azufre), M (magnetosoma).
Figure 2. Magnetosomes of magnetococcis from Calima Lake. a) Magnetococcus with clustered magnetosomes between 2 sulfur inclusions. b), c) Elongated magnetosomes with hexagonalprismatic morphology. c) Magnetoccus with two parallel chains of magnetosomes. d) Cubeoctaedral magnetosomes chain. e) EDX spectrum of magnetosomes. The black arrows show the magnetosomes membrane around the crystals. The white arrows show how the length of crystals were measured of the length of the crystals. I (inclusion), M (magnetosomes).
De acuerdo con estos resultados y lo expuesto por Mann et al. (1989) [14], quienes afirman que la morfología de los cristales varía dependiendo de la cepa bacteriana, presentándose cristales octaédricos en Magnetospirillum magnetotacticum MS-1 [15,16], cristales no equidimensionales (elongados), de formas hexagonales u octaédricas truncadas (en forma de bala, diente o punta de flecha) en la bacteria MV-1 [17], entre otras, es posible, con bases en este criterio, considerar que en el lago Calima existen dos cepas de cocos magnéticos diferentes, sin embargo es necesario comprobareste hecho por medio de métodos certeros como es el caso de las técnicas de biología molecular.
Otra característica, que vale la pena resaltar, es que en la mayoría de los magnetococos los cristales se observaron cerca de la pared celular (fig. 1c, 2a), lo que hace pensar que la membrana que rodea a los cristales (fig. 1d) podría ser una invaginación de la pared celular, tal como lo han demostrado varios autores a partir de análisis bioquímicos hechos a las membranas de los magnetosomas, mostrando la presencia de compuestos como la fosfatidiletanolamina y fosfatidilglicerol, comunes a otras membranas celulares, aunque sin la presencia de amidas ligadas a ácidos grasos, comunes en bacterias Gram - negativas, aunque con proteínas únicas de las membranas de los magnetosomas, que podrían suministrar un ambiente bioquímico propio para la biomineralización de magnetita [18,19,20].
En la represa La Fe se observó una alta proporción de cocos con cadenas dobles de magnetosomas (fig. 1a, 1b) y escasos con cadenas sencillas (fig. 1d). En el lago Calima se observaron MTBs con cadenas dobles y sencillas de magnetosomas (fig. 2c, 2d), pero ~ 80 % de los magnetococos aparecen con magnetosomas agrupados entre inclusiones bacterianas de azufre (fig. 2a, 2b). Esa disposición podría estar influyendo en la menor velocidad de nado de los magnetococos del lago Calima con respecto a los de la represa La Fe, en los que la disposición en cadena de los cristales aumentaría el momento dipolar magnético de la célula, permitiendo que la magnetotaxis se realice con mayor eficiencia a lo largo de la líneas de campo magnético [21]. Adicionalmente, la longitud de las cadenas de magnetosomas varió entre células de un mismo sitio de muestreo, con un promedio de 1,09 μ para los cocos de La Fe y 0,70 μ para los cocos que presentaron magnetosomas dispuestos en cadena del lago Calima.
Los análisis de EDX en los magnetosomas de los cocos de La Fe y Calima detectaron la presencia de Fe y O consistentes con la composición de una magnetita (fig. 1e, 2e). La presencia de pequeñas cantidades P, S, K, Ca y Mg, parecen corresponder a las inclusiones bacterianas próximas a los magnetosomas y al contenido citoplasmático y de la membrana celular de los cocos, confirmados por los EDX realizados a las inclusiones celulares (datos no mostrados), compatible con lo ya evidenciado por Cox et al. (2002) [22].
3.2.2. Cantidad de Cristales
Se observó una media de 16 + 3 cristales por coco magnetotáctico de la represa La Fe y 15 + 4 por coco del lago Calima, mostrando un promedio de magnetosomas similar para los cocos de los dos sitios de estudio. De otro lado, en los bacilos magnéticos de la represa La Fe, se observó una gran cantidad de magnetosomas (90 + 34). Resultados semejantes con gran número de cristales han sido reportados por Blakemore, (1982) [23] con un promedio de 22 magnetosomas por célula magnética para Aquaspirillum magnetotacticum cepa MS1, y Schüler y Frankel (1999) [24] y Schüler (2002) [25], con un promedio de 60 partículas magnéticas por célula para Magnetospirillum gryphiswaldense. A partir de estos resultados es posible concluir que, como ya se ha anotado por otros autores, el número de partículas magnéticas por célula depende principalmente de la especie de MTB y no de las condiciones de crecimiento o de la disponibilidad de nutrientes en el medio.
Teniendo en cuenta las cercanas similitudes entre los cristales de los cocos de las represas de La Fe y Calima, parece ser que la morfología y cantidad de cristales no influye ostensivamente en la velocidad de nado de las MTBs, ya que en los dos casos se tienen 16 + 3 cristales con morfología alongada hexagonal prismática y sin embargo se presentan diferencias en la velocidad de nado. Por ello se puede concluir que la diferencia en la velocidad de nado está influenciada en gran parte por la disposición de las partículas en el interior de la célula, siendo la disposición en cadena y no en agregados, la que favorece una mayor velocidad. Por otro lado, se puede concluir que la cantidad de cristales no influye de una forma directamente proporcional con la velocidad de nado, si se tiene en cuenta que en bacilos magnéticos de la represa La Fe (con 90 + 34 cristales por célula, datos no publicados), muestran una velocidad de nado menor que la observada para los cocos de ésta misma represa (con 16 + 3 cristales por célula).
3.2.3. Tamaño de los magnetosomas
Los magnetosomas de las MTBs de La Fe y Calima mostraron una amplia variedad en el tamaño de cristal, tanto longitudinal como transversalmente. En general, los cristales fueron más largos que anchos, con tan solo 8,23% de éstos más anchos que largos y 0,66% aproximadamente equidimensionales.
Longitud de los Cristales: Se mostró una amplia distribución de tamaños para los 2 concentrados celulares estudiados, que va desde 20 hasta 170 nm para los cristales de La Fe, con un promedio de 82,5 + 18,2 nm, y de 20 hasta 140 nm para cristales del lago Calima, con un promedio de 86,6 + 22,8 nm (fig. 3a). Es importante anotar además que, de una forma general los cristales de la represa de Calima se presentaron con longitudes mayores, siendo que la mayor proporción de éstos se presentó entre 80-100 nm, mientras que para la Fe la mayoría estuvo entre 70-80 nm (fig. 3a).
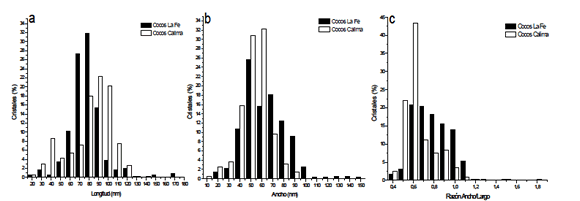
Figura 3. Porcentaje de Cristales de la represa La Fe y lago Calima Vs Tamaño de los cristales. a) Longitud. b) Ancho. c) Relación ancho/largo.
Figure 3. La Fe dam and Calima Lake crystal percentage Vs crystal size. a) Length. b) Width. c) width/length
Ancho de los Cristales: En la figura 3b se muestra la distribución de los cristales según el ancho. Los cocos de Calima presentan una distribución entre 10 - 90 nm con una media de 58,3 + 12,8 nm. Los magnetococos de La Fe mostraron una distribución amplia entre 20 - 150 nm, con una media de 68,5 + 19,5 nm.
Factor forma: Los resultados muestran que, en general, los cocos de la represa La Fe son más anchos, pero más cortos que los del lago Calima.
La dispersión de este factor para los magnetosomas del lago Calima está entre 0,4 y 1,8, mientras que para La Fe está entre 0,4 y 1,5, con una media de 0,7 y 0.84 para la Fe y Calima respectivamente (fig. 3c).
La estructura de dominios en las partículas magnéticas está determinada principalmente por el volumen de las mismas [26]. Así, cuando el tamaño de las partículas disminuye, el tamaño de los dominios y ancho de los límites se reducen, de modo que, por debajo de un tamaño crítico, la energía debida a los límites de los dominios es mayor que la energía magnetostática debida a una magnetización uniforme, por lo que la partícula adopta una estructura de monodominio [27].
Los resultados obtenidos al comparar los tamaños de los magnetosomas en las MTBs tipo coco de las dos zonas de estudio concuerdan con las descripciones realizadas de magnetosomas en otros estudios que reportan cristales de magnetosomas de aproximadamente 35 - 140 nm de longitud [17,21,22,28,29]. Dicho tamaño clasifica a los cristales como magnetos biogénicos de dominio único (SD) con momentos dipolares permanentes [30], permitiendo que la partícula maximice su eficiencia como un transportador magnético [21].
Al representar las dimensiones de los cristales magnéticos intracelulares de las MTBs cocoidales de La Fe y Calima en el modelo de clasificación de dominio magnético teórico de Butler - Banerjee (fig. 4) se corrobora que la mayoría de los cristales caen en el campo de estructura de dominio único (SD), los cuales son estable y uniformemente magnetizados, siendo capaces de preservar la dirección de su momento magnético. Sin embargo, hay un porcentaje importante de magnetosomas con tamaño menor a 30 nm, que cae en el rango superparamagnético (SPM) (2,27% para los cocos de la represa La Fe y 3,43% de cocos de Calima), con una magnetización uniforme, pero con momentos no constantes en dirección por reversiones del momento magnético, generando un momento promedio igual a cero [31,32].
Figura 4. Campo de estabilidad del dominio único de la magnetita en función del factor forma y de la longitud. Los esquemas de la derecha representan el arreglo de los momentos magnéticos en partículas con dominio doble, monodominio y superparamagnéticas. La línea punteada inferior muestra el límite SD/superparamagnético, determinado por paralelepípedos rectangulares (Butler y Banerjee, 1975). También se estima la longitud mínima SD en el factor forma cercana a 1. La línea punteada superior separa el campo SD estable del campo SD metaestable, tomado a partir de modelos micromagnéticos de Witt et al. (2005) para cristales de magnetosomas con formas características. La línea punteada roja muestra la ubicación de los cristales de MTBs de la represa La Fe y Lago Calima. Las regiones sombreadas marcan el tamaño y forma de cristales de bacterias magnetotácticas (Tomado de Kopp y Kirschvink, 2008 [33]).
Figure 4. Stability field of single domain magnetite in function of form factor and length. The diagrams on the right represent the arrangement of magnetic moments in double domain, single domain and superparamagnetic particles. The lower dotted line shows the SD/superparamagnetic limit determined by rectangular parallelepipeds (Butler and Banerjee, 1975). It is also estimated the shortest length in the SD form factor close to 1. The upper dotted line separates the stable SD field of metastable SD field, taken from Witt et al. (2005) micromagnetic models for magnetosomes crystals with characteristic shapes. The red dotted line shows the location of MTB crystals from La Fe dam and Calima Lake. The shaded regions mark the size and shape of MTB crystals (From Kopp and Kirschvink, 2008 [33]).
El modelo muestra que al disminuir el tamaño de partícula, se entra en un tamaño crítico en el que el grano no puede alargar la pared del dominio. Por debajo de ese tamaño crítico, la estructura de SD es el estado de energía más baja.
El tamaño crítico depende de varios parámetros (magnetización de saturación, anisotropía magnetocristalina, intercambio de energía y forma del grano). Así, el modelo predice que el límite SD - TD (dos dominios) es de 76 nm y que con el incremento en la elongación de la partícula, incrementa el tamaño crítico llegando a tener un factor forma <0,2. La anisotropía de forma aumenta el límite SD con disminución en la razón para partículas no equidimensionales [32].
4. CONCLUSIONES
Con este trabajo se determinó la presencia de cocos con actividad magnetotáctica en la represa La Fe, Antioquia y Lago Calima, (Valle del Cauca), que no habían sido reportadas en Colombia, cuya velocidad de nado parece depender de la disposición y cantidad de los cristales en la célula, encontrando mayor velocidad en cocos con cristales dispuestos en cadena y menor en cocos con cristales agrupados.Por EDX se determinó que los nanocristales sintetizados por los magnetotocos en estudio son óxidos de hierro tipo magnetita y no sulfuros de hierro, tipo greigita.
Dichos cristales mostraron diferencias en forma y tamaño, resultantes del control cristaloquímico ejercido por cada microorganismo en el proceso biomineralización.
Se mostró que la gran mayoría de los cristales pertenecen a una estructura de dominio magnético único, con la presencia de algunos cristales que caen en el rango superparamagnético al poseer tamaños menores a 30 nm.
En general, los resultados obtenidos muestran ligeras diferencias entre los magnetosomas de los magnetococos de los dos sitios en estudio, con diferencias en tamaño y número de cristales que no se consideran significativas entre los dos tipos de cocos encontrados, aunque las pequeñas diferencias presentadas y las diferencias en los microambientes de donde se obtuvieron las MTBs pueden ser señales de tener dos especies bacterianas diferentes, sin embargo es necesario realizar análisis filogenéticos que permitan afirmarlo.
5. AGRADECIMIENTOS
Los autores agradecen al Programa Nacional de Biotecnología de Colciencias por la financiación del proyecto. A Empresas Públicas de Medellín (EEPPM) y COMFENALCO y a Empresas Eléctricas del Pacífico S.A. por autorizar el muestreo y facilitar la logística en la represa La Fe y Lago Calima respectivamente. Al Instituto de Microbiología Profesor Paulo de Góes de la Universidad Federal de Río de Janeiro, al laboratorio de Mineralogía Aplicada de la Universidad Nacional de Colombia, Sede Medellín. A.L.M. agradece el apoyo parcial del CODI, Universidad de Antioquia.
REFERENCIAS
[1] AMEMIYA, Y., ARAKAKI, A., STANILAND, S., TANAKA, T., MATSUNAGA, T. Controlled formation of magnetite crystal by partial oxidation of ferrous hydroxide in the presence of recombinant magnetotactic bacterial protein Mms6. Biomaterials, 28, 35, 5381-5389, 2007. [ Links ]
[2] HAN, L., LI S., YANG, Y., ZHAO, F., HUANG, J., CHANG, J. Comparison of magnetite nanocrystal formed by biomineralization and chemosynthesis, J. of magnetism and magnetic material, 312, 236-242, 2007. [ Links ]
[3] BLAKEMORE, R., MARATEA, D. AND WOLFE, R. Isolation and pure culture of a freshwater magnetic spirillum in chemically defined medium, J. of Bacteriology, 140, 720-729, 1979. [ Links ]
[4] FRANKEL, R., PAPAEFTHYMIOU, G, BLAKEMORE, R., O'BRIEN, W. Fe3O4 precipitation in magnetotactic bacteria, Biochimica et Biophysica Acta (BBA)- Molecular Cell Research, 763, 2, 22, 147-159, 1983. [ Links ]
[5] BAZYLINSKI, D., HEYWOOD, B., MANN, S., FRANKEL, R. Fe3O4 and Fe3S4 in a bacterium, Nature, l, 366, 218, 1993. [ Links ]
[6] DUBBELS, B., DISPIRITO, A., MORTON, J., SEMRAU, J., NETO, J., BAZYLINSKI, D. Evidence for a copper-dependent iron transport system in the marine, magnetotactic bacterium strain MV-1, Microbiology, 150, 2931-2945, 2004. [ Links ]
[7] SCHÜLER, D., BAEUERLEIN, E. Iron-limited growth and kinetics of iron uptake in Magnetospirillum gryphiswaldense. Arch. Microbiol., 166, 301-307, 1996. [ Links ]
[8] BAZYLINSKI D., SPRING, S. Magnetotactic bacteria. Disponible en Internet: http://141.150.157.117:8080/prokPUB/chaphtm/281/complete.htm. 2000. [ Links ]
[9] AMERICAN PUBLIC HEALTH ASSOCIATION; AMERICAN WATER WORK ASSOCIATION; WATER POLLUTION CONTROL FEDERATION. 1992. Métodos normalizados para el análisis de agua potables y residuales. 17ª edición. [ Links ]
[10] LINS, U., FREITAS, F., KEIM, C., LINS DE BARROS, H., ESQUIVEL, D., FARINA, M. Simple homemade apparatus for harvesting uncultured magnetotactic microorganisms, Braz J Microbiol., 34, 111-116, 2003. [ Links ]
[11] SIMMONS, S., SIEVERT, S., FRANKEL, R., BAZYLINSKY, D., EDWARDS, K. Spaciotemporal Distribution of Marine Magnetotactic Bacteria in a Seasonally Stratified Coastal Salt Pond, Applied and Enviromental Microbiology, 70, 10, 6230-6239, 2004. [ Links ]
[12] THOMAS-KEPRTA, K., CLEMETT, S., BAZYLINSKI, D., KIRSCHVINK, J., MCKAY, D., WENTWORTH, S., VALII, H., EVERETT, K., GIBSON, J., MCKAY, M., ROMANEK, C. Truncated hexa-octahedral magnetite crystals in ALH84001: Presumptive biosignatures. Edited by Bruce Watson, Rensselaer Polytechnic Institute, Troy, NY. PNAS., Vol. 98. N° 5. 2001. [ Links ]
[13] SILVA, K., ABREU, F., ALMEIDA, F., KEIM, C., FARINA, M., LINS, U. Flagellar apparatus of south - seeking many - celled maganetotoactic prokaryotes, Microsc Res Tech., 70, 10-17, 2007. [ Links ]
[14] MANN, S., FRANKEL, R. Magnetite biomineralization in unicellular organisms. In: Biomineralization: Chemical and Biochemical Perspectives. Mann S, Webb J, Williams RJP (eds) VCH Publishers, New York. 389 - 426. 1989. [ Links ]
[15] BALKWILL, R., HUGH, R., MARC, B. Late phanerozoic structures, Canadian Arctic Archipelago, Palaeogeography, Palaeoclimatology, Palaeoecology, 30, 219-227, 1980. [ Links ]
[16] MANN, S., SPARKS, N., FRANKEL, R., BAZYLINSKI, D., JANNASCH, H. Biomineralization of ferromagnetic greigite (Fe3O4 and iron pyrite (FeS2) in a magnetotactic bacterium. Nature, 343, 258-261, 1990. [ Links ]
[17] SCHÜLER, D. Magnetoreception and Magnetosomes in Bacteria, Microbiology Monographs, Spring. 3 edition. Vol. 3. 2007. [ Links ]
[18] GORBY, Y., BEVERIDGE, T., BLAKEMORE, R. Characterization of the Bacterial Magnetosome Membrane, J. Bacteriol., 170, 834-841, 1988. [ Links ]
[19] GRÜNBERG, K., MULLER, E., OTTO, A., RESZKA, R., LINDER, D., KUBE, M., REINHARDT, R., SCHÜLER, D. Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense, Appl Environ Microb., 70, 1040-1050, 2004. [ Links ]
[20] KOMEILI, A., LI, Z., NEWMAN, D., JENSEN, G. Magnetosomes are cell membrane invaginations organized by the actin-like protein MamK, Science, 311, 242-245, 2006. [ Links ]
[21] THOMAS-KEPRTA, K., BAZYLINSKI, D., KIRSCHVINK, J., CLEMETT, S., MCKAY, D., WENTWORTH, S., VALII, H., GIBSON, E., ROMANEK, C. Elongated prismatic magnetite crystals in ALH84001 carbonate globules: Potential Martian magnetofossils, Geochimica et Cosmochimica Acta, 64, 23, 4049-4081, 2000. [ Links ]
[22] COX, B., POPA, R., BAZYLINSKI, D., LANOIL, B., DOUGLAS, S., BELZ, A., ENGLER, D., NEALSON, K. Organization and Elemental Analysis of P, S, and Fe rich Inclusions in a Population of Freshwater Magnetococci, Geomicrobiology Journal, 19, 387-406, 2002. [ Links ]
[23] BLAKEMORE, R. Magnetotactic bacteria, Ann. Rev. Microbiol. 36, 217-238, 1982. [ Links ]
[24] SCHÜLER, D., FRANKEL, R. Bacterial magnetosomes: microbiology, biomineralization and biotechnological applications, Appl Microbiol Biotechnol., 52, 464-473, 1999. [ Links ]
[25] SCHÜLER, D. The biomineralization of magnetosomes in Magnetospirillum gryphiswaldense. Int Microbiol., 5, 209-214, 2002. [ Links ]
[26] CULLITY, B. Domains and the magnetization process. In: Intruduction to magneticmaterials. Addison-Wesley. Reading, Massachusetts. 287-352, 1972. [ Links ]
[27] DÁVILA, A. Detection and function of biogenic magnetite. Tésis doctoral. Ludwig Maximilians UniverstitÄat MÄunchen, Deutschland. 135. 2005. [ Links ]
[28] BAZYLINSKI, D., GARRATT-REED, A., FRANKEL, R. Electron microscopic studies of magnetosomes in magnetotactic bacteria, Microscopy Res. Tech., 27, 389-401, 1994. [ Links ]
[29] PÓSFAI, M., MOSKOWITZ, B., ARATÓ, B., SCHÜLER, D., FLIES, C., BAZYLINSKI, D., FRANKEL, R. Properties of intracellular magnetite crystals produced by Desulfovibrio magneticus strain RS-1, Earth and Planetary Science Letters, 246, 444-455, 2006. [ Links ]
[30] BAZYLINSKI, D., FRANKEL, R. Magnetic iron oxide and iron sulphide minerals within microorganims: Potencial biomarkers. In: Biomineralization. Progress in Biology, molecular biology and application. 2° completed revised and extended edition. Edited by Edmun Baeuerlein. 17-43, 2004. [ Links ]
[31] ROBIN, C., LYNN, J. Magnetofossils, the magnetization of sediments, and the evolution magnetite biomineralization. Ann. Rev. Earth Planet. Sci., 17, 169-95, 1989. [ Links ]
[32] BAZYLINSKI, D., MOSKOWITZ, B. Microbial mineralization of magnetic iron minerals. Microbiology, magnetism and environmental significance. In Geomicrobiology. 181-223, 2003. [ Links ]
[33] KOPP, R., KIRSCHVINK, J. The identification and biogeochemical interpretation of fossil magnetotactic bacteria, Earth-Science Reviews, 86, 42-61, 2008. [ Links ]
[34] WITT, A., FABIAN, K., BLEIL, U. Three-dimensional micromagnetic calculations for naturally shaped magnetite: octahedra and magnetosomes, Earth And Planetary Science Letters, 233, 311-324. 2005. [ Links ]














