Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
DYNA
versão impressa ISSN 0012-7353versão On-line ISSN 2346-2183
Dyna rev.fac.nac.minas v.77 n.164 Medellín out./dez. 2010
EVALUACIÓN Y CARACTERIZACIÓN MINERALÓGICA DEL PROCESO DE BIOOXIDACIÓN EN UN REACTOR CONTINUO DE TANQUE AGITADO
EVALUATION AND MINERALOGICAL CHARACTERIZATION OF BIOOXIDATION PROCESS IN A CONTINUOS STIRRED TANK REACTOR
DIANA ARROYAVE G.
M.Sc. Universidad Nacional de Colombia sede Medellín, dmarroya@unal.edu.co
MARCO MÁRQUEZ G.
Ph.D. Escuela de Materiales, Universidad Nacional de Colombia sede Medellín, mmarquez@unal.edu.co
DARIO GALLEGO S.
M.Sc, Escuela de Procesos y Energía, Universidad Nacional de Colombia - sede Medellín, dgallego@unal.edu.co
GAMALIEL PACHECO
Ing. Metalúrgico, Empresa Consorcio de Inversionistas S.A., gamapacheco@hotmail.com
Recibido para revisar Marzo 12 de 2009, aceptado Octubre 17 de 2009, versión final Noviembre 19 de 2009
RESUMEN: La biooxidación del mineral refractario de oro de la mina El Zancudo (Titiribí-Antioquia) se realizó en un reactor continuo de tanque agitado usando microorganismos nativos acidófilos compatibles con Acidithiobacillus ferrooxidans y Acidithiobacillus thiooxidans. El reactor se operó inicialmente en discontinuo para alcanzar la máxima concentración de hierro férrico en solución, antes de iniciar el proceso en continuo. La caracterización mineralógica se hizo a muestras recolectadas en discontinuo, estado transitorio y estacionario en continuo, usando Microscopia Electrónica de Barrido (SEM) y Difracción de Rayos X (DRX). La caracterización mineralógica mostró una oxidación avanzada de la pirita y arsenopirita en discontinuo y parcial en continuo. Adicionalmente, se encontró la formación de silicatos, jarosita y brushita. Los resultados indican que el sistema alcanzó el estado estacionario después de 8 días de operación en continuo, logrando una concentración de hierro férrico en solución de 8.3 g/l, correspondiente a un porcentaje de extracción de oro y plata de 78 y 80 %, respectivamente.
PALABRAS CLAVE: Biooxidación, Acidithiobacillus, reactor, cianuración, SEM, DRX
ABSTRACT: The bioxidation of refractory gold mineral of the "El Zancudo" mine (Titiribi-Antioquia) was carried out in a continuous stirred tank reactor using an acidofile microorganisms compatible with Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans. The reactor was operated initially in batch to achieve the ferric iron maximum concentration in solution, before beginning the continuos process. The mineralogical characterization was performed to samples gathered in batch, transitory and steady state in continuous using Scanning Electron Microscopy (SEM) and X-Ray Diffraction (DRX). The mineralogical characterization showed an advanced oxidation of the pyrite and arsenopyrite in batch and partial in continuous operation. Additionally, it was found the formation of silicates, jarosite and brushita. The results indicate that the system reached the steady-state after 8 days of operation in continuous, achieving a ferric iron concentration in solution of 8.3 g/l corresponding to a gold and silver extraction percentage of 78 and 80%, respectively.
KEYWORDS: Biooxidation, Acidithiobacillus, reactor, Cyaniding, SEM, DRX
1. INTRODUCCIÓN
La necesidad de procesar minerales refractarios cada vez más complejos ha generado el desarrollo y la aplicación de nuevas tecnologías que permitan mejorar la extracción de metales localizados en este tipo de depósitos [1]. La biooxidación de menas refractarias de oro en reactores de tanque agitado usando bacterias mesófilas como pretratamiento al proceso de extracción de oro por cianuración, ha demostrado ser económicamente factible y una alternativa competitiva a los procesos tradicionales de tostación y oxidación a presión [2, 3]. Actualmente, este proceso biotecnológico es aplicado para la recuperación de oro en varias plantas a nivel comercial, entre las que se encuentran las establecidas en Australia, Sudáfrica, Ghana, Perú y Brasil [2, 4, 5].
El mineral de la mina el Zancudo se ha caracterizado como refractario con base en estudios mineralógicos realizados [6, 7, 8], debido a los siguientes aspectos: (i) la gran mayoría de los granos de oro (60%) se encuentra como inclusiones finas (<10µm) en pirita y arsenopirita, (ii) la presencia de minerales altamente cianicidas como la tetraedrita, pirrotita, boulangerita y jamesonita, (iii) la presencia de cantidades importantes de oro invisible en ciertos minerales como la galena y sulfosales del tipo jamesonita-boulangerita. La caracterización mineralógica se ha convertido en una herramienta usada como soporte en el entendimiento, control de procesos naturales e industriales en las áreas de biohidrometalurgia, metalurgia extractiva , geología, etc. [6, 8, 9].
Este trabajo tiene como objetivo realizar la evaluación y caracterización mineralógica del proceso de biooxidación en un reactor continuo de tanque agitado como pretratamiento oxidante para mejorar la extracción de oro y plata del mineral de la mina el Zancudo. La caracterización mineralógica por medio de Microscopía Electrónica de Barrido con Analizador en Estado Sólido (SEM/EDX) y Difracción de Rayos X (DRX) permitió determinar el nivel de oxidación de los sulfuros y las nuevas fases generadas después del proceso de biooxidación.
2. METODOLOGÍA
2.1. Microorganismos y preparación del inoculo para el experimento
En este estudio fue utilizado un consorcio de microorganismos acidófilos compatible con A. ferrooxidans y A. thiooxidans, previamente aislados de la Mina el Zancudo e identificados por métodos bioquímicos [10]. La mezcla de microorganismos fue adaptada a crecer en el medio 9K modificado [11], en el cual el sulfato ferroso y azufre fueron reemplazados por el mineral. El cultivo se mantuvo a un pH entre 1.6 -1.9, temperatura de 35ºC y agitación de 230 rpm en un agitador orbital.
2.2. Equipo y condiciones de operación para el reactor de biooxidación
El proceso de biooxidación se realizó en un reactor de acrílico de 8 l, con un volumen de trabajo de 5 l. Una turbina paletas planas inclinada 45º de bombeo hacia arriba con 6 paletas fue usada. El tamaño del impulsor y de los deflectores se basó en el diámetro del reactor (T=19 cm) para conformar un diseño estándar de un reactor de tanque agitado [12].
Para favorecer la suspensión de sólidos y la oxidación bacteriana, el reactor se operó a una agitación de 800 rpm, aireación de 1.8 vvm y 10 % de densidad de pulpa [12]. Una velocidad de dilución de 0.25 d1- correspondiente a un tiempo de residencia teórico de 4 días fue usada [12]. El proceso se operó inicialmente en discontinuo, con el fin de alcanzar la máxima concentración de hierro férrico en solución. El funcionamiento continuo del reactor se hizo alimentando de manera independiente los sólidos, mediante una tolva con rastrillo, y el medio de cultivo 9K, por medio de una bomba peristáltica. La salida de flujo fue realizada por rebose en la parte media superior del reactor. Para mantener la densidad de pulpa constante (10%), se alimentó 0.87 l/min de medio y 3.0 gr de mineral cada 35 min. En este sistema el pH se mantuvo en un valor controlado de 1.7 y una temperatura de 35ºC. El estado estacionario en modo continuo se consideró que se alcanzó cuando la concentración de hierro férrico varió menos de 5% durante un periodo de tiempo igual a un tiempo teórico de residencia [13].
2.3. Caracterización mineralógica
La caracterización mineralógica inicial fue realizada por medio de microscopía óptica de luz plana polarizada, modo luz reflejada (MOLPP/LR) y difracción de rayos X (DRX) para determinar las proporciones iníciales de sulfuros contenidos en el mineral. Para obtener información acerca del grado de oxidación de los sulfuros, las fases minerales preexistentes y generadas a través del proceso, antes y después de iniciar la alimentación para la operación continúa del reactor, se usaron los datos obtenidos por medio de difracción de rayos X (DRX) y microscopía electrónica de barrido modo de electrones electro-proyectados, con analizador en estado sólido (SEM/BSE/EDX). Para la caracterización mineralógica se tomaron muestras en los días 10 y 21 en discontinuo, estado transitorio y estacionario en continuo.
Los análisis de SEM se realizaron en un microscopio electrónico de barrido Jeol 5910 JSM-LV. Para los análisis de DRX se usó un difractómetro PANalytical X'pert PRO MPD. Todos los difractogramas se corrieron bajo las mismas condiciones, usando 0.017 tamaño de paso, un tiempo por paso de 14.2 segundos, un ángulo de barrido entre 5 y 80º. Para tener un patrón de comparación en la caracterización mineralógica, se empleó un blanco o control (muestra abiótica), usando las mismas condiciones de operación del reactor.
2.4. Cianuración
Las muestras después del pretratamiento oxidante mediante la biooxidación fueron filtradas, lavadas y secadas para el proceso posterior de lixiviación con cianuro. Las pruebas de cianuración fueron hechas a la muestra pretratada y al blanco, para determinar el aumento en la extracción de oro. La cianuración se hizo en un reactor de 2 litros de volumen efectivo, bajo las siguientes condiciones: la relación sólido - líquido fue 1:3, el pH se mantuvo entre 10.2-10.8, la concentración de cianuro fue entre 1.0 - 1.5 g/l, temperatura (28- 30 ºC), velocidad de agitación de 500 rpm y un tiempo de cianuración 24 horas.
3. RESULTADOS Y DISCUSIÓN
3.1. Caracterización mineralógica inicial del mineral
A partir de los resultados obtenidos por microscopía óptica de luz plana polarizada (modo de luz reflejada) (MOLPP/LR) y difracción de rayos X (DRX) para la muestra inicial, fue posible establecer que esta estaba compuesta por 33.2 % de pirita, 26.2% de arsenopirita, 8.3% de esfalerita, 6.1 de galena, 4.2% calcopirita y 22.0% de minerales de la "ganga". Los minerales presentes en la ganga fueron cuarzo, moscovita, caolinita y carbonatos (dolomita y aragonito). Adicionalmente mediante los resultados por espectrometría de absorción atómica de la muestra inicial, se pudo determinar que la composición química del mineral fue 23.3% Fe, 2.3% As, 2.3% Pb, 1.05% Zn, 0.22% Sb y 0.085% Cu. El tamaño de partícula del mineral fue pasante malla 325.
3.2. Evaluación del proceso de biooxidación
En la Figura 1 se muestra la variación en la concentración de hierro férrico y ferroso en solución durante el proceso en modo de funcionamiento discontinuo y continuo. La concentración del ión ferroso disminuyó de 0,64 g/l a 0,073 g/l mientras que el ión férrico aumentó en el tiempo de 1,10 a 17,11 g/l en modo discontinuo. Este comportamiento fue interpretado como una evidencia de que el principal mecanismo catalítico de la bacteria consiste en la oxidación de Fe2+ a Fe3+, de acuerdo con lo establecido por otros autores [14]. La máxima concentración de hierro férrico en solución fue de 17.94 g/l y se alcanzó a los 14 días (335 h) de oxidación. A partir de este punto y hasta los 21 días (477 h) no se presentó un incremento de la concentración del ión férrico en la solución sino una ligera disminución debida posiblemente a la precipitación del mismo en forma de jarosita [15]. De acuerdo con esto, en el día 21 se inició la alimentación, presentándose un descenso en la concentración de hierro férrico en la solución hasta que la velocidad de generación del ión férrico de los microorganismos dentro del reactor compensó la salida y estabilizó el sistema (Figura 1). El tiempo que el reactor se demoró en estabilizarse se denomina estado transitorio [13]. El estado estacionario se alcanzó después de 8 días de funcionamiento continuo, dado que la diferencia entre las concentraciones fue de aproximadamente 5 % entre el día 4 y 8 de la operación, estabilizando el sistema en una concentración de hierro férrico en solución de 8.3 g/l.
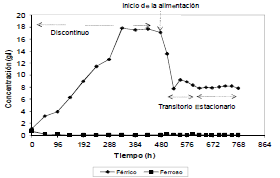
Figura 1. Variación de la concentración de hierro férrico y ferroso en operación discontinua y continua del reactor
Figure 1. Variation of ferric and ferrous iron concentration in batch and continuous operation of the reactor
3.3. Caracterización mineralógica del proceso de biooxidación
Los resultados obtenidos a partir de la información por SEM/BSE fueron analizados con base en dos criterios fundamentales: (i) texturas típicas de oxidación presentes en los sulfuros, como es el caso de golfos de corrosión, películas de recubrimiento sobre los sulfuros, entre otras, y (ii) generación de aglomerados y aumento en su tamaño. En este trabajo se considera que ambos son evidencia del avance en la oxidación bacteriana de los sulfuros.
La Figura 2 muestra imágenes de SEM/BSE a una magnificación de 90X, donde es evidente el crecimiento del tamaño de los aglomerados de las muestras biooxidadas al compararlas con el blanco (muestra abiótica), indicando un aumento considerable en la generación del material de la matriz. Las imágenes de SEM para 10 y 21 días de biooxidación, Figuras 2 (b) y 2 (c), presentan un tamaño del aglomerado mayor que el observado para las condiciones de operación en continuo, indicando en principio una oxidación más avanzada, que estaría de acuerdo con lo mostrado en la Figura 1, dado que para los 10 y 21 días se tiene una concentración de hierro férrico en solución mayor, debido a un tiempo más prolongado de oxidación bacteriana. El tamaño de los aglomerados disminuye a partir del día 21 en el modo discontinuo hasta el estado estacionario en continuo. Esto se debe probablemente a que el estado transitorio se inicia con la salida del mineral con un tiempo de oxidación de 21 días (Figura 1), razón por la cual, se presentan todavía aglomerados comparativamente similares a los obtenidos en discontinuo (Figura 2 (c) y 2 (d)). Mientras que en el estado estacionario han pasado 12 días a partir del inicio la alimentación, dando tiempo suficiente para que el contenido del reactor fuera renovado con nuevo mineral y medio líquido, por lo que el tiempo de oxidación de los sulfuros fue menor (tiempo de residencia teórico de 4 días), ocasionado de esta manera una menor formación de aglomerados (Figura 2 (e)).

Figura 2. Imágenes de SEM/BSE del proceso de biooxidación en discontinuo y continuo (aumento de 90X)
Figure 2. SEM/BSE images of the biooxidation process in batch and continuous (90X)
Al comparar las imágenes de SEM/ BSE con un aumento de 650X (Figura 3) se puede ver que son comunes los granos de arsenopirita y pirita intensamente corroidos, mientras que en la muestra abiótica (blanco) no se observan este tipo de cambios, evidenciados por los granos de arsenopirita y pirita prácticamente intactos. En la Figura 3 se observa un estado de oxidación de los sulfuros mayor en discontinuo y estado transitorio en modo continuo que en el estacionario. Estados avanzados de oxidación, texturas típicas de oxidación como la aparición de golfos de corrosión en los diferentes sulfuros presentes, especialmente en arsenopirita y pirita (principales constituyentes de la mena) son observados en la Figura 4. De igual forma, con menor frecuencia, debido a la menor proporción en la que ésta se encuentra en la mena, se vieron granos de galena intensamente oxidados, presentando casi siempre una película externa de anglesita (sulfatos de Pb), que evidencia además la baja solubilidad de este sulfato (Figura 4 a).

Figura 3. Imágenes de SEM/BSE del proceso de biooxidación en discontinuo y continuo (aumento de 650X). Aspa: arsenopirita, Gn: ganga, Py: pirita
Figure 3. SEM/BSE images of the biooxidation process in batch and continuous (650X). Aspa: arsenopyrite, Gn: gangue, Py: pyrite

Figura 4. Estado de los sulfuros después de la oxidación bacteriana del mineral
Figure 4. State of the sulphurs after the bacterial oxidation of the mineral
En la Figura 5 se presenta el análisis microquímico con los respectivos espectros de rayos X característicos y las proporciones aproximadas de los diferentes elementos presentes en la matriz de los aglomerados en la operación en discontinuo y continua del reactor, analizado mediante SEM/EDX. La composición química de la matriz de los aglomerados formados tiene como característica especial la presencia dominante de Fe con cantidades importantes pero algunas veces variables de S, Si y Al, entre otros, indicando que bajo las condiciones actuales de oxidación, se disolvió buena parte de los silicatos presentes en el concentrado, los cuales posteriormente se precipitaron, generando una masa de sulfato/silicato compleja de Al/Fe, seguramente de baja cristalinidad (de acuerdo con la morfología y variabilidad química observada). La disolución extensiva de los silicatos se da debido posiblemente al ataque del ácido sulfúrico [16], en vista de las condiciones controladas del pH a lo largo del proceso (~1,7). Las matrices de los aglomerados presentan además en cantidades menores K, Na, Ca, Mg, Pb y As, donde la presencia de As y Pb evidencian la oxidación de la arsenopirita y galena, respectivamente. El K y Mg pueden provenir del medio de cultivo 9K o de la disolución de algunos minerales de la ganga presentes como feldespatos, micas, entre otros. De otro lado elementos como Ca, Na y Si son claramente provenientes de la disolución de los silicatos.
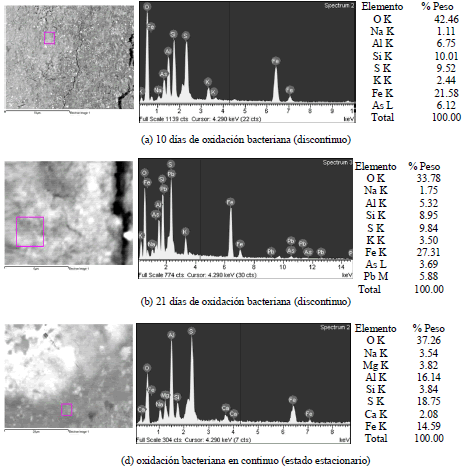
Figura 5. Análisis micro-químico del proceso de biooxidación en discontinuo y continuo
Figure 5. Micro-chemical analysis of the biooxidation process in batch and continuous
Con base en los resultados a partir de las imágenes SEM/BSE, se puede concluir que en el proceso no se observó la formación de cantidades apreciables de jarosita, en la forma de granos independientes de tamaño considerable, como los observados en otros estudios [8-10], lo que se debido probablemente al control ejercido sobre el pH (1.7 ±0.1) durante el proceso de biooxidación. A valores de pH por encima de 2.5 el hierro férrico tiene una baja solubilidad, ocasionando la formación de hidroxisulfatos básicos de Fe(III) con fórmula general MFe3(SO4)2(OH)6, donde M es K+ (jarosita), Na+ (natrojarosita), NH4+(amoniojarosita), H3O+ (hidroniojarosita), Ag+ (argentojarosita), Pb2+ (plumbojarosita), entre otros [17, 18]. La biooxidación de minerales diferentes de los sulfuros, como los óxidos, carbonatos y silicatos, ocurre simplemente por el ataque ácido, mientras que la disolución de los sulfuros es una combinación de un ataque ácido y oxidativo por parte de las bacterias [16]. Esto explicaría la corrosión avanzada de los sulfuros en la Figura 4 y la elevada presencia de silíceo en la matriz de los aglomerados (Figura 5).
La Figura 6 presenta la evolución en las proporciones relativas de sulfuros y las fases formadas en las muestras biooxidadas en discontinuo y continuo, obtenida a partir de los resultados del análisis por DRX. Es de notar que las proporciones relativas muestran las tendencias de las transformaciones de los minerales y fases formadas en el proceso. Estos resultados confirman lo observado en las imágenes de SEM/BSE y SEM/EDX.
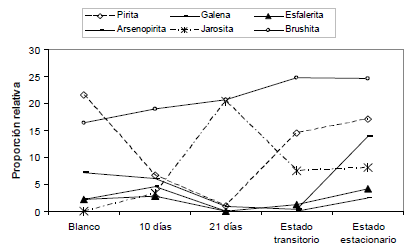
Figura 6. Proporciones relativas de los minerales y fases formadas en el proceso de biooxidación determinadas con DRX
Figure 6. Provide relative of the minerals and phases formed in the biooxidation process with DRX
Al igual que en SEM, los resultados de DRX muestran una oxidación avanzada para la pirita y arsenopirita a los 10 días y casi total a los 21 días de biooxidación en modo discontinuo. Para el sistema en continuo, se presentó una oxidación parcial de estos sulfuros, dado que en este sistema se da la entrada y salida permanente de mineral que tiene un tiempo de contacto menor (Figura 6). Para el caso de la esfalerita y galena, el comportamiento fue similar pero a menor escala, debido a la menor proporción en la que estos minerales se presentaron en la mena original, desapareciendo prácticamente en su totalidad en el día 21 del proceso en discontinuo.
En la Figura 6 se aprecia también el comportamiento que tuvo la jarosita en el sistema de biooxidación. Durante los primeros 10 días de oxidación se observa que la cantidad de jarosita es mucho menor que a los 21 días, esto se debe posiblemente a que el sistema a los 10 días de oxidación no presenta una concentración tan alta de hierro férrico (Figura 1). De otro lado, entre los días 14 y 21 se presenta una ligera tendencia a la disminución de férrico en solución (Figura 1), debido posiblemente a una precipitación, evidenciada por un aumento en la formación de jarosita, a pesar del pH controlado alrededor de 1.7± 0.1. La formación de jarosita nuevamente disminuye en el modo de funcionamiento continuo, seguramente debido a la salida continua de Fe3+ y algo de jarosita.
De los resultados obtenidos para las proporciones relativas se observa que para el día 21 se dio la máxima formación de jarosita debido posiblemente a la alta concentración de hierro férrico en la solución, es de notar que la formación de jarosita en el proceso no fue tan alta como la observada en otros estudios [8-10]. Esto se debido probablemente a que el control de pH provoco que la magnitud en la precipitación de la jarosita tendiera a disminuir durante los primeros días y no fuera tan alta al final, como lo sugieren algunos autores [15, 17, 19].
En la Figura 6 se muestra también la formación de cantidades considerables de brushita (CaHPO4.2(H2O)), tanto en las muestras biooxidadas como en el blanco, siendo las proporciones mayores en las muestras biooxidadas. Esto se debe posiblemente a la reacción entre el HPO4-, proveniente del fosfato ácido de potasio adicionado en el medio 9K usado y los carbonatos presentes en el mineral. Se pudo observar una mayor proporción de brushita en el modo continuo que en discontinuo, lo que se podría explicar debido a la entrada y salida permanente de mineral (conteniendo carbonatos) y medio 9K (con fosfato ácido de potasio). Debido a que el fósforo es un macro-nutriente para el crecimiento de los microorganismos la precipitación de brushita podría ser más crítica en un sistema funcionando en discontinuo, debido a que la caída en P en el sistema podría afectar el crecimiento y la actividad microbiana [17].
A partir de los resultados por DRX no fue posible identificar fases minerales del grupo de los silicatos formadas durante el desarrollo del proceso, razón por la cual se considera que el alto contenido en sílica, detectado en la matriz de los aglomerados formados durante éste, debe estar presente en la forma de algún compuesto amorfo o de muy baja cristalinidad, similar a lo encontrado por otros autores [9]. Por DRX fue posible detectar la desaparición casi total de fases minerales presentes en el mineral como la clinozoisita y la actinolita. La albita presenta una pequeña disminución en el proceso de biooxidación, sin embargo demasiado pequeño como para ser considerado como un dato confiable. Otras fases como moscovita no presenta cambios durante el proceso. Para el caso de la clorita y el cuarzo, el comportamiento no es coherente con cambios que se puedan interpretar como lógicos en el proceso, por lo que se considera que aparentemente los cambios observados no obedecen al proceso de biooxidación si no a la preparación de las muestras.
3.4. Resultados de cianuración
En la Tabla 1 se presentan los resultados de la cianuración para el proceso de biooxidación en continuo. Al comparar las muestras de la cabeza de la cianuración para el oro se observaron valores similares pero la recuperación fue mayor para la muestra biooxidada, debido a que en las colas se obtuvo 5,6 g/t, valor tres veces menor que el obtenido en las colas del blanco; evidenciando la acción oxidante de los microorganismos. La recuperación oro y plata para la muestra oxidada fue de 77.78 y 80.11 %, respectivamente, mientras la recuperación de oro y plata para el blanco fue de 40.94 y 51.63 %, respectivamente. Algunos autores reportan que el proceso de biooxidación en modo discontinuo y continuo aumenta la recuperación de oro de alrededor 45 -50 % a alrededor de 85 -90 %, mientras la recuperación de plata de un 60 a 97 %, para un concentrado de pirita - arsenopirita y cantidades menores de esfalerita, galena y calcopirita, en un reactor de 6 litros [14, 20].
Tabla 1. Resultados de la cianuración para el proceso de biooxidación en continuo
Table 1. Results of the cyaniding for the biooxidation process in continuous
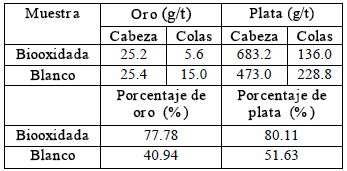
Al comparar estos resultados con los obtenidos en el presente estudio, se evidencia que los porcentajes de extracción de oro y plata fueron bastante buenos y cercanos a los reportados por otros autores para un concentrado de sulfuros similar.
4. CONCLUSIONES
- La caracterización mineralógica por SEM y DRX del mineral sometido al proceso de biooxidación en discontinuo y continuo, permitió conocer el nivel de oxidación de los diferentes sulfuros en el proceso, mostrando una oxidación avanzada de la pirita y arsenopirita en discontinuo y parcial en continuo. Adicionalmente, se hizo un seguimiento de las fases minerales preexistentes y generadas durante la oxidación bacteriana, encontrándose la formación de silicatos, jarosita y brushita, lo que permitió tener un mejor conocimiento del comportamiento del sistema.
- Los resultados de la cianuración indican que los ensayos de biooxidación realizados en modo continuo mostraron mejorar la recuperación de oro de 40 % (blanco) a 79 %, mientras que la plata aumenta de 51 % a 80 %. A partir de estos resultados se puede considerar que la biooxidación de sulfuros del mineral de la mina el Zancudo, en un reactor de tanque agitado, se torna en una opción prometedora como pretratamiento oxidante antes del proceso de cianuración.
5. AGRADECIMIENTOS
Al Programa Nacional de Biotecnología de COLCIENCIAS, la empresa minera Consorcio de Inversionistas S.A. y el Laboratorio de Biomineralogía de la Universidad Nacional sede Medellín.
REFERENCIAS
[1] DENG, T., LIAO, M., WANG M., CHEN, Y. AND BELZILE, N. Investigations of accelerating parameters for the biooxidation of low-grade refractory gold ores. Miner. Eng. , 13, 1543-1553, 2000. [ Links ]
[2] ACEVEDO, F. The use of reactor in biominig processes. Electron J. of Biotechnol., 3, 184-190. 2000. [ Links ]
[3] AKCIL, A. Potential bioleaching developments towards commercial reality: Turkish metal mining's future. Miner. Eng. , 17, 477-480, 2004. [ Links ]
[4] DAS, T. AND SEN, P.K. Bio-reactor simulation and modeling for a gold bio leaching process. Miner. Eng. , 14, 305-316, 2001. [ Links ]
[5] GONZÁLEZ, R, GENTINA, J. AND ACEVEDO, F. Biooxidation of a goal concentrate in a continuous stirred tank reactor: matehematical model and optimal configuration. Biochem. Eng. J., 19, 33-42, 2004. [ Links ]
[6] GALLEGO, N. Y ZAPATA, D. Caracterización mineralógica como soporte para la implementación y mejoramiento del proceso de extracción de oro mina de oro el Zancudo, Titiribí, Antioquia. [Tesis de Grado]. Universidad Nacional de Colombia Sede Medellín, 2003. [ Links ]
[7] MÁRQUEZ, M., GAVIRIA, A., MUÑOZ A. Y OSSA M. Informe Colciencias - Proyecto: Biooxidación de sulfuros complejos mediada por bacterias como pretratamiento, para el mejoramiento de la extracción de valiosos vía lixiviación con cianuro de sodio, mina El Zancudo, Titiribí, Antioquia. 2005. [ Links ]
[8] ZAPATA, D., GALLEGO, A. AND MARQUEZ, M. Definition of the type of refractoriness in El Zancudo Golg Mine, Antioquia, Colombia. Appl. Miner., Pecchio et. al. (eds). 2004. [ Links ]
[9] MÁRQUEZ, M. Mineralogia dos processos de oxidação sobre pressão e bacteriana do minério de ouro da mina São Bento, MG. [Tess Ph.D]. Universidade de Brasília, 1999. [ Links ]
[10] OSSA, M. Biolixiviación de sulfuros utilizando cepas nativas de acidófilos como pretratamiento, para el beneficio de metales preciosos, mina El Zancudo, Titiribí, Antioquia. [Tesis M.Sc.]. Universidad Nacional de Colombia Sede Medellín. 2004. [ Links ]
[11] SILVERMAN, M. AND LUNDGREN, D. Studies on the chemolithotrophic iron bacterium Ferrobacillus ferrooxidans. An improved medium and a harvesting procedure for securing high cell yields. J. Bacteriol., 77, 642-647,1959 [ Links ]
[12] ARROYAVE, D. Evaluación del proceso del proceso de biooxidación a escala de laboratorio del mineral aurífero de la Mina el Zancudo, Titiribí, Antioquia. [Tesis M.Sc.]. Universidad Nacional de Colombia Sede Medellín, 2008. [ Links ]
[13] GÓMEZ, J. Y CANTERO, D. Kinetic study of biological ferrous sulphate oxidation by iron - oxidising bacteria in continuos stirred tank and packed bed bioreactors. Process Biochem., 38, 867-875, 2003. [ Links ]
[14] NATARAJAN, K., MODAK, J. AND RAICHUR, A. Bioreactor Engineering for treating refractory gold-bearing concentrates: An Indian Experience. En: Biohydrometallurgy: Fundamentals, Tecnology and Sustainable Development. Ciminelli y Garcia Jr. (Editors). Part A. 183-189, 2001. [ Links ]
[15] DAOUD, J. AND KARAMANEV, D. Formation of jarosite during Fe2+ oxidation by Acidithiobacillus ferrooxidans. Miner. Eng. , 19, 960-967, 2006. [ Links ]
[16] SAND, W. AND GEHRKE, T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron(III) ions and acidophilic bacteria. Resear. Microbiol., 157, 49-56. 2006. [ Links ]
[17] GÓMEZ, J. Y CANTERO, D. Biooxidación del ión ferroso. En: Fundamentos y Perspectivas de las Tecnologías Biomineras. Fernando Acevedo y Juan Gentina (Editores). 25-43, 2005. [ Links ]
[18] MOUSAVI, S., YAGHMAEI, S. AND JAFARI A. Influence of process variables on biooxidation of ferrous sulfate by an indigenous Acidithiobacillus ferrooxidans. Part II: Bioreactor experiments. Fuel, 86, 993-999, 2007. [ Links ]
[19] DAS, T, AYYAPPAN, S. AND CHAUDHURY, G. Factors affecting bioleaching kinetics of sulfide ores using acidophilic micro-organisms. BioMetals, 12, 1-10, 1999. [ Links ]
[20] CHANDRAPRABHA, M., MODAK, J., NATARAJAN, K. AND RAICHUR, A. Strategies for efficient start-up of continuous biooxidation process for refractory gold ores. Miner. Eng.,15, 751-753, 2002. [ Links ]














