Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353On-line version ISSN 2346-2183
Dyna rev.fac.nac.minas vol.78 no.165 Medellín Feb./Mar. 2011
EQUILIBRIO DE FASES PARA SISTEMAS ETANOL-AGUA EN PRESENCIA DE POLIALCOHOLES Y SALES
PHASE EQUILIBRIUM FOR ETHANOL-WATER SYSTEMS IN THE PRESENCE OF SALTS AND POLYALCOHOLS
LUIS RIOS
Grupo Procesos Fisicoquímicos Aplicados, Facultad de Ingeniería, Universidad de Antioquia, larios@udea.edu.co
JUAN MARÍN
Grupo Procesos Fisicoquímicos Aplicados, Facultad de Ingeniería, Universidad de Antioquia, jmmarin@udea.edu.co
Recibido para revisar septiembre 8 de 2009, aceptado Agosto 4 de 2010, versión final Agosto 13 de 2010
RESUMEN: Se propone un modelo termodinámico semiempírico para el equilibrio líquido-vapor del sistema etanol-agua con polialcoholes y sales. El modelo usa las ecuaciones Gibbs-Duhem y Debye-Hückel, las cuales modifican el modelo UNIQUAC-E. Se consideran las fuertes interacciones químicas asociadas a los fenómenos de solvatación e hidratación de iones, y el concepto de solvatación del modelo de Ohe. Se tienen en cuenta las interacciones de corto alcance, dadas por las fuerzas de van der Waals, y las interacciones de largo alcance consideradas en el término de Debye-Hückel. Se determinaron los parámetros empíricos de ajuste para los sistemas etanol-agua-polialcohol-cloruro de calcio y acetato de potasio; estos sistemas son de interés industrial debido a que la adición de polialcohol y sal mejora la eficiencia de la separación.. Las mediciones isobáricas del equilibrio líquido-vapor se realizaron en un destilador Othmer. Este modelo termodinámico sería útil para diseñar y simular columnas para destilación extractiva agua-etanol.
PALABRAS CLAVE: Equilibrio líquido-vapor, Polialcoholes, Efecto salino, sistema etanol-agua.
ABSTRACT: A semi-empirical thermodynamical model was proposed for the liquid-vapor equilibrium of ethanol-water systems in the presence of salts and polyalcohols. The model uses the Gibbs-Duhem and Debye-Hückel equations, which modify the UNIQUAC-E model. Strong chemical interactions, associated with hydration and solvation phenomena of ions, as well as the Ohe model were considered. Short-range interactions, like van der Waals forces, and long-range interactions involved in the Debye-Hückel equation were also considered. Empirical parameters were obtained for ethanol-water-polyalcohol-calcium chloride and potassium acetate systems, these systems are important in industrial applications because the addition of polyalcohol and salt improves the efficiency of the separation. Measurements of the isobaric vapor-liquid equilibrium were performed in an Othmer distiller. This thermodynamic model could be useful to design and simulate the extractive distillation water-ethanol.
KEYWORDS: Liquid-vapor equilibrium, polyalcohols, salt-effect, ethanol-water system.
1. INTRODUCCIÓN
La separación de mezclas azeotrópicas en fracciones de elevada pureza constituye uno de los problemas técnicos y económicos más importantes y retadores de la industria de procesos químicos. Específicamente, la producción de etanol anhidro es una una prioridad a nivel ambiental, tecnológico y económico. Los resultados de la presente investigación contribuirán al desarrollo de un proceso industrial tecnológicamente factible, sin embargo, es necesario realizar un estudio económico para determinar su viabilidad.
Tradicionalmente, la separación del sistema etanol-agua se hace con destilación azeotrópica, usando benceno, pentano o dietil éter como solventes, o mediante destilación extractiva empleando etilenglicol o gasolina; estas tecnologías, sin embargo, involucran altos costos de capital y de operación [1]. El uso del pentano, por ejemplo, es efectivo pero requiere altas presiones, mientras que con etilenglicol la proporción del solvente en el alimento es demasiado alta, normalmente 5:1, lo que incrementa el consumo energético [2]. Reducir la cantidad de etilenglicol equivale a disminuir riesgos de irritación de ojos, nariz y garganta, daños a los riñones y al cerebro; además esta sustancia debe tratarse como un teratógeno, es decir, un agente ambiental que causa anomalías morfológicas cuando hay exposición entre la tercera y la novena semana de gestación, por otra parte, éste es un líquido combustible cuyo punto de inflamabilidad es 111ºC y al incendiarse produce gases venenosos [3].
Para romper o desplazar el azeótropo también se puede aprovechar el efecto salino, el cual se presenta cuando una sal se disuelve en una solución de líquidos y altera el equilibrio termodinámico, e incluso, puede afectar la solubilidad del sistema [4,5].
En la decada de los 30s, aparece como alternativa el proceso HIAG (licenciado por DEGUSSA en Alemania) que se implementó en cerca 100 plantas con capacidades de producción superiores a 43000 ton/año; este proceso utilizaba una mezcla 70/30 de KCOOCH3 y NaCOOCH3 como agente de separación para romper el azeótropo [6], pero el problema de corrosión en los equipos, generado por el manejo de las sales, han motivado la búsqueda de nuevos sitemas para la producción industrial.
La destilación extractiva, con una combinación de sal y solvente como agente de separación, permite obtener productos de alta pureza, mejora la disolución de la sal, la reutilización y el transporte,
con la ventaja adicional de que la cantidad de agente de separación necesario se reduce considerablemente, lo cual disminuye los requerimientos energéticos de manera sustancial [7]. Actualmente, se conocen varios procesos que usan sales disueltas en etilenglicol [7,8], sin embargo, considerando las restricciones de seguridad industrial con relación al manejo del etilenglicol dada su alta toxicidad, se está investigando otro tipo de solventes como agentes de separación que permitan desarrollar procesos factibles técnicamente, menos riesgosos y más rentables.
En este trabajo se logró desarrollar un proceso para remover el azeótropo etanol-agua a la presión atmosférica de Medellín - Colombia (646 mmHg) empleando el polialcohol PAW, mezclas polialcohol PAW-CaCl2, y mezclas polialcohol PAW-KCOOCH3, como agentes mejoradores de la separación. La ventaja que ofrece esta sustancia comparativamente con otros solventes anteriormente usados, como el etilenglicol, son su baja peligrosidad, la disponibilidad de sus componentes en el mercado y el excelente efecto mostrado en la ruptura del azeótropo agua-etanol. Actualmente, se está gestionando la patente del polialcohol PAW
En el presente trabajo se propone un nuevo modelo semiempírico simple que emplea únicamente tres parámetros de ajuste para calcular los coeficientes de actividad para sistemas compuestos por etanol, agua, polialcohol y sal. Los parámetros fueron determinados usando datos reportados en la literatura [7], y el modelo se verificó con los datos obtenidos en nuestro laboratorio; se obtuvieron desviaciones promedio en la composición en la fase de vapor de 0.04 y en la temperatura de 2.40. El modelo propuesto modifica la ecuación UNIQUAC con parámetros de ajuste e incluye ecuaciones derivadas del modelo de solvatación de Ohe [9], y además involucra el témino de la fuerza iónica de la teoría de Debye-Hückel.
Para la obtención de los datos experimentales se utilizó un destilador othmer modificado y las muestras se analizaron mediante cromatografía gaseosa.
2. CONSIDERACIONES TEÓRICAS
2.1 Efecto del polialcoholEl polialcohol usado como "disolvente" en la destilación extractiva convencional, altera la volatilidad relativa de los componentes originales y permite, de esa forma, la separación. Debido a la baja volatilidad del polialcohol, éste no se evapora de modo apreciable en la columna de destilación, y sale como producto de fondo junto con los componentes más pesados.
2.2 Efecto salino
Cuando se disuelve una cantidad apreciable de sal en un líquido se modifica la presión de vapor del líquido. Una explicación simple se obtiene a partir de las fuerzas de hidratación: los iones (especialmente los cationes) suelen formar complejos con agua (hidratación), dejando menos agua "libre" disponible para interactuar con otros compuestos más volátiles. Esta influencia aumenta normalmente con valores crecientes de la carga iónica y decreciente del radio iónico. Así, una sal disuelta puede tener influencia sobre la composición del vapor en equilibrio con una disolución acuosa de un líquido volátil [10]. Cuando las sales disueltas se solvatan preferentemente con las moléculas de un componente, la sal puede tener un efecto selectivo sobre las volatilidades de los dos líquidos y, por consiguiente, sobre la composición del vapor en equilibrio, aunque no haya sal presente en la fase de vapor [11].
Generalmente, dado que la sal es un componente no volátil, sólo está presente en la fase líquida, mientras que en el vapor en equilibrio se encuentra la mayor concentración del componente en el cual la sal es menos soluble. Los iones de la sal tienen tendencia a aglomerarse preferencialmente con moléculas de los componentes más polares, por eso la selectividad y la magnitud del efecto de la sal sobre la composición de la fase vapor depende de la diferencia de solubilidades individuales de la sal con los componentes líquidos [2,12,13].
3. MODELOS TERMODINÁMICOS PARA SISTEMAS CON ELECTRÓLITOS
Los modelos que representan el equilibrio de fases líquido-vapor para sistemas que contienen electrólitos son necesarios para procesos de análisis, diseño y optimización de columnas para destilación extractiva. Varios modelos se han desarrollado [14-20]. El modelo UNIQUAC-Extendido [21,22] se aplica para describir equilibrios líquido-sólido, vapor-líquido y propiedades térmicas de sistemas acuosos con electrólitos. El modelo UNIQUAC-E es un modelo de composición local derivado del modelo original [23,24] al cual se le adiciona un término para interacciones de largo alcance dado por Debye-Hückel [14,25].
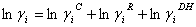 (1)
(1)
Takamatsu y Ohe [9], desarrollaron un método para la predicción del equilibrio líquido-vapor de sistemas electrolíticos basado en el fenómeno de solvatación [11], usando el concepto de número de solvatación entre cada solvente puro y la sal. De acuerdo al modelo Ohe, la relación entre el coeficiente de actividad 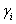 , definido convencionalmente (ecuación UNIQUAC), y el coeficiente de actividad
, definido convencionalmente (ecuación UNIQUAC), y el coeficiente de actividad 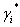 , relacionado con la fracción molar efectiva, está dada por:
, relacionado con la fracción molar efectiva, está dada por:
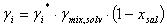 (2)
(2)
Donde:
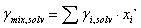 (3)
(3)
Este modelo se ha aplicado exitosamente para correlacionar y expresar el efecto salino para 386 solventes binarios y 47 sistemas simples con sal [11].
4. PARTE EXPERIMENTAL
4.1 Materiales
En las pruebas experimentales se trabaja con etilenglicol, polialcohol PAW, CaCl2 y KCOOCH3 (grado reactivo, Merck). El etanol que se usa para la preparación de las mezclas de diferente concentración es de grado analítico con una concentración del 99.5% v/v.
4.2 Equipos
Para la destilación extractiva de la mezcla etanol-agua con sales disueltas en un polialcohol se utiliza un destilador OTHMER modificado, (figura 1). El equipo, construido de vidrio borosilicato y que opera a la presión atmosférica de Medellín ( 646 mm Hg), tiene una chaqueta de manta cerámica recubierta con papel aluminio. El sistema se calienta con una cinta THERMOLYNE BriskHeat y la temperatura se controla con un PID Maxtermo MC-2038 con una precisión de ± 0.1ºC ; el termopar tipo J se sumerge en la fase líquida. Las muestras de vapor y líquido se recogen en sendos viales y se llevan a una cámara de refrigeración, para evitar pérdidas por evaporación de etanol. El sistema alcanza la estabilidad gracias al reflujo continuo que se genera con un condensador, el cual se enfría con una mezcla agua-polietilenglicol a -10°C . La muestra de vapor se toma usando una jeringa de 10 cm3.
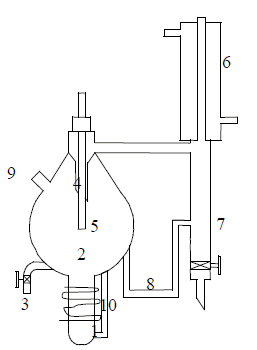
Figura 1. Destilador Othmer modificado. 1. Resistencia eléctrica, 2. Celda contenedora de la mezcla, 3. Válvula toma muestra fase líquida, 4. Salida de vapor, 5. Termopar conectado a controlador PID, 6. Condensador, 7. Acumulador de condensado, 8. Ducto para recirculación, 9. Válvula toma muestra de fase vapor, 10. Tubo de agitación
Figure 1. Modified Ohtmer Distiller. 1. Electric heating, 2. Sample cell, 3. Liquid sampler, 4. Vapor exit, 5. Termocouple-PID, 6. Condenser, 7. Condensate storage, 8. Recirculation, 9. Vapor sampler, 10. Stirring
La concentración de las fases se mide en un cromatógrafo de gases Agilent Technologies 6890N, con una Carbowax de 30 m de longitud y 0.25 mm de diámetro interno, y un flujo de 2 mL/min de hidrógeno como gas de arrastre. En el método cromatográfico, la temperatura del horno de 60ºC , se lleva hasta 170ºC a 40ºC/min, y se mantiene durante 2 minutos; la temperatura del inyector y del detector TCD es 180ºC .
4.3 Procedimiento experimental
Inicialmente se mezcla etanol al 99.5% con el agente de separación, luego se carga en el destilador, y se comienza el calentamiento en la celda y la refrigeración en el condensador. Después de 1 hora, cuando la temperatura se estabiliza, se toman muestras de las fases y se inyectan al cromatógrafo. Para mantener constante el volumen de la mezcla y para variar su composición se adiciona agua y agente de separación, nuevamente; después de 1 hora, se toman muestras y se continúa con este procedimiento hasta recorrer todas las composiciones requeridas.
5. MODELO TERMODINÁMICO PROPUESTO
Se propone una modificación a la ecuación UNIQUAC para ser aplicada al sistema etanol-agua-polialcohol-sal utilizando tres parámetros de ajuste. El coeficiente de actividad obtenido mediante el método UNIFAC se corrige usando la fuerza iónica I (parámetro importante en la teoría de Debye-Hückel) y las ecuaciones derivadas del modelo Ohe, como se muestra a continuación:
La presión parcial del componente i se puede describir con las siguientes ecuaciones:
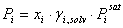 (4)
(4)
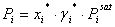 (5)
(5)
Igualando (4) y (5) se tiene que:
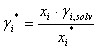 (6)
(6)
Se define la fracción molar efectiva del componente i como:
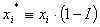 (7)
(7)
Donde la fuerza iónica I está dada por:
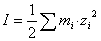 (8)
(8)
Sustituyendo (7) en(6) se tiene:
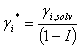 (9)
(9)
Reemplazando (9) en (2):
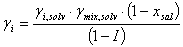 (10)
(10)
Despejando el coeficiente de actividad del componente i en la mezcla con polialcohol y sal se tiene:
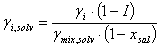 (11)
(11)
Para resolver este sistema inicialmente se asume un valor para el coeficiente de actividad de la mezcla, 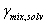 , y con este valor se calculan los
, y con este valor se calculan los 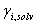 . Con los
. Con los 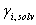 se calcula
se calcula 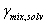 , y se repite este procedimiento hasta que los valores no cambien apreciablemente. Para la resolución matemática de este sistema se empleó MATLAB 7.0; la función objetivo se definió como:
, y se repite este procedimiento hasta que los valores no cambien apreciablemente. Para la resolución matemática de este sistema se empleó MATLAB 7.0; la función objetivo se definió como:
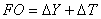 (12)
(12)
Donde:
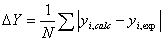 (13)
(13)
y
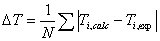 (14)
(14)
La función de MATLAB empleada para optimizar la función objetivo FO fue: fminsearch, esta función encuentra los mínimos locales de ecuaciones multidimensionales y no lineales, utilizando el método Nelder-Mead Simplex de búsqueda directa.
La ecuación (11) se ajustó a los datos experimentales con tres parámetros de ajuste, uno afecta el término combinatorial, otro el término residual del modelo UNIQUAC convencional, y un tercero que modifica el término derivado del modelo de Ohe, como se muestra a continuación:
El modelo UNIQUAC modificado está dado por las siguientes ecuaciones:
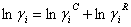 (15)
(15)
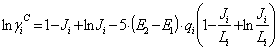
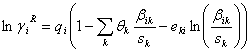
Donde:
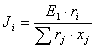
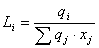
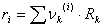
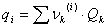
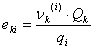
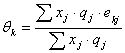
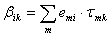
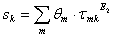
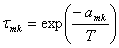
Como se puede apreciar, el modelo UNIQUAC se modificó con los parámetros E1 y E2. Finalmente, la ecuación (11) se ajusta elevando a un exponente E3 el término  .
.
Todas las variables de este modelo (excepto E1 , E2 y E3) son las mismas que se definieron ya en la literatura citada [14, 23-25].
Los valores encontrados correspondientes a los nuevos parámetros son:
E1 = 2.50
E2 =0.70
E3 = -0.05
A continuación se muestran los resultados obtenidos con este modelo. Se incluyen también los resultados correspondientes a los sistemas donde se utilizan solamente polialcoholes como agentes modificadores del azeótropo.
6. RESULTADOS
Los sistemas agua-etanol-polialcoholes se representan con la ecuación UNIQUAC modificada con los parámetros E1 y E2. En las Figuras 2, 3 y 4, se observa que las desviaciones promedio en la fracción molar en la fase de vapor es 0.05 y en la temperatura de 2.76, aunque estos valores no son los mejores, no son malos considerando la simplicidad de la ecuación empleada. En la literatura disponible ampliamente consultada no se encuentran modelos para describir el efecto del polialcohol como agente de separación o modificador del azeótropo agua-etanol. Esta primera aproximación que planteamos es importante para el diseño de columnas de destilación extractiva, pero hace falta más experimentación que nos permita mejorar la confiabilidad de la ecuación y explicar desde el punto de vista molecular el efecto de las interacciones ion-moléculas de solventes en la volatilidad de las sustancias.
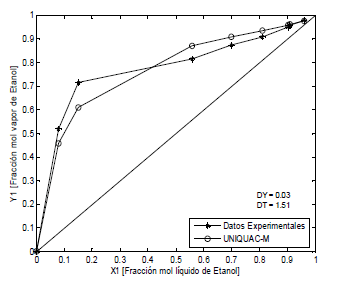
Figura 2. ELV Etanol-agua-etilenglicol, P = 101.3 kPa (Lei et al, 2002)
Figure 2. ELV Ethanol-water-ethyleneglycol, P = 101.3 kPa (Lei et al, 2002)
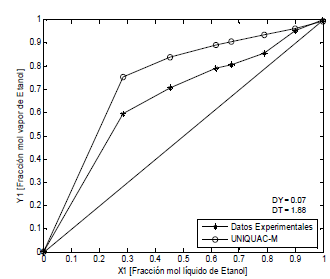
Figura. 3. ELV Etanol-agua-etilenglicol, P = 82 kPa (Datos propios)
Figure 3. ELV Ethanol-water- ethyleneglycol P = 82 kPa (Own data)
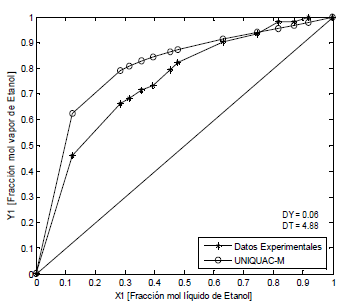
Figura 4. ELV Etanol-Agua-PAW, P = 82 kPa (Datos propios)
Figure 4. ELV Ethanol-water-PAW, P = 82 kPa (Own data)
Las Figuras 5, 6 y 7, presentan los sistemas agua-etanol-polialcohol-sal, en donde los datos teóricos fueron calculados (11), UNIQUAC-EM. Las desviaciones promedio en las fracciones molares en la fase de vapor son 0.04 y en la temperatura 2.40. Al igual que para los sistemas anteriores, el modelo propuesto representa mejor los datos experimentales a medida que la fracción molar tiende a la unidad.
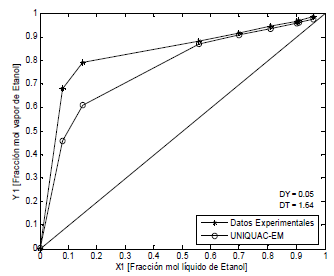
Figura 5. ELV Etanol-Agua-Etilenglicol-CACl2, P = 101.3 kPa (Lei et al, 2002)
Figure 5. ELV Ethanol-water-thyleneglycol-CACl2, P = 101.3 kPa (Lei et al, 2002)
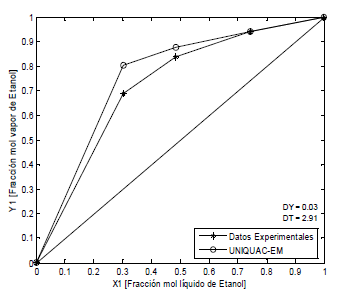
Figura 6. ELV Etanol-Agua-PAW-CaCl2, P = 82 kPa (Datos propios)
Figure 6. ELV Ethanol-water-PAW-CaCl2, P = 82 kPa (Own data)
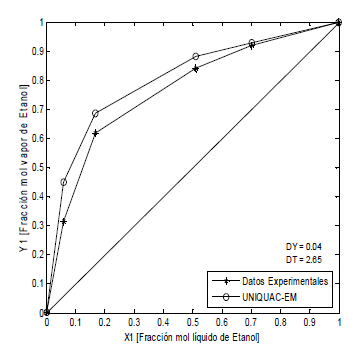
Figura 7. ELV Etanol-Agua-PAW-KCH3COO, P = 82 kPa (Datos propios)
Figure 7. ELV Ethanol-water-PAW- KCH3COO, P = 82 kPa (Own data)
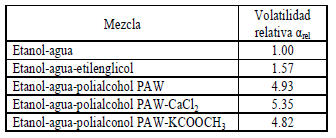
En cuanto a la modificación debida a la adición de sales y solventes a la mezcla agua-etanol, se verifica con la volatilidad relativa arel = ketanol/kagua (k=y/x) de los diferentes sistemas, como se muestra en la tabla 1. Para concentraciones globales alrededor de la composición azeotrópica de la mezcla agua-etanol, se observó que tanto el etilenglicol, como el acetato de potasio y el cloruro de calcio, rompen el azeótropo y aumentan la volatilidad relativa; sin embargo, el poliaclcohol PAW hace que arel sea prácticamente el doble de la obtenida con la adición de etilenglicol.
Tabla 1. Volatilidades relativas del etanol en los sistemas estudiados
Table 1. Relative volatilities of ethanol in studied systems
7. CONCLUSIONES
El modelo termodinámico propuesto es simple porque utiliza solamente tres parámetros de ajuste, sin embargo, las desviaciones promedio obtenidas, tanto para las composiciones (0.04) como para la temperatura (2.40), son aceptables. Se espera en próximos trabajos mejorar el modelo y soportarlo sobre teorías de termodinámica molecular. El modelo propuesto se usará para diseñar una columna de destilación empacada, a escala piloto, para evaluar el comportamiento del polialcohol PAW, con miras a desarrollar un proceso industrial rentable para la obtención de etanol anhidro.
El polialcohol PAW muestra ser un mejor agente de modificación del azeótropo agua-etanol que el etilenglicol, lo que implica desde el punto de vista del diseño de las columnas de destilación, que se alcance la separación deseada con un número menor de etapas para el fraccionamiento. Adicionalmente, esto implica un equipo de menor diámetro ya que se manejarían menores flujos para la obtención de un alcohol de alta pureza, y posiblemente bajos costos representados en el consumo del polialcohol PAW, ya que es más económico que el etilenglicol. Los requerimientos energéticos y los costos de los equipos posiblemente también bajarían.
Nota: Por el momento la naturaleza del polialcohol PAW se mantiene en reserva mientras se adelanta el proceso de registro de la patente.
LISTA DE SÍMBOLOS

AGRADECIMIENTOS
Agradecemos la financiación de la Universidad de Antioquia a através del programa Estrategia Sostenibilidad de Grupos.
REFERENCIAS
[1] BLACK, C. Distillation modeling of ethanol recovery and dehydration processes for ethanol and gasohol, Chem. Eng. Prog., 9, 78-85, 1980. [ Links ]
[2] BARBA, D., BRANDANI, V., DI GIACOMO, G. Hyperazeotropic ethanol salted-out by extractive distillation. Theoretical evaluation and experimental check, Chem. Eng. Sci., 40, 2287-2292, 1985. [ Links ]
[3] MERCK, The Merck Chemicals Databases. Disponible en: http://www.merck-chemicals.com/. [citado 30 de noviembre de 2008]. [ Links ]
[4] ILLIUTA, M., THYRION, F. Effect of calcium chloride on the isobaric vapor-liquid equilibrium of 1-propanol + water, J. Chem. Eng. Data., 41, 402-408, 1996. [ Links ]
[5] SUN, T., BULLOCK, K., TEJA, A. Correlation and prediction of salt effect on vapour liquid equilibrium in alcohol-water-salt system, Fluid Phase Equilib., 219, 257-264, 2004. [ Links ]
[6] FURTER, W. F. Extractive distillation by salt effect, Chem. Eng. Commun., 116, 35-40, 1992. [ Links ]
[7] LEI, Z., WANG, H., ZHOU, R., DUAN, Z. Influence of salt added to solvent on extractive distillation, Chem. Eng. J., 87, 149-156, 2002. [ Links ]
[8] ZHOU, R., DUAN, Z. Extractive distillation with salt in solvent. Department of Chemical Engineering, Tsinghua University , Beijing ( China ), 1-6, 2004. [ Links ]
[9] TAKAMATSU, H., OHE, S. Modified solvation model for salt effect on vapour-liquid equilibria, Fluid Phase Equilib., 194-197, 701-715, 2002. [ Links ]
[10] FURTER, W. F., COOK, R. A. Salt effect in distillation, Int. J. Heat Mass Transfer, 10, 23-36, 1967. [ Links ]
[11] OHE, S. Prediction of salt effect on vapor liquid equilibria, Fluid Phase Equilib., 144, 119-129, 1998. [ Links ]
[12] FURTER, W. F. Extractive distillation by salt effect, Adv. Chem. Series, 115, 35-45, 1972. [ Links ]
[13] MERANDA, D., FURTER, W. F. Salt effect on vapor liquid equilibrium: some anomalies, AIChE J., 1, 103-108, 1974. [ Links ]
[14] SANDER, B., FREDENSLUND, A., RASMUSSEN, P. Calculation of vapor-liquid equilibria in mixed solvent/salt system using an extended UNIQUAC equation., Chem. Eng. Sci,. 41, 1171-1183, 1986. [ Links ]
[15] MOCK, B., EVANS, L., CHEN, C. Thermodynamic representation of phase equilibria of mixed-solvent electrolyte systems, AIChE J., 32,1655-1664, 1986. [ Links ]
[16] MACEDO, E. A., SKOVBORG, P., RASMUSSEN, P. Calculation of phase equilibria for solutions of strong electrolytes in solvent-water mixtures, Chem. Eng. Sci., 45, 875-882, 1990. [ Links ]
[17] KIKIC, I., FERMEGLIA, M., RASMUSSEN, P. UNIFAC prediction of vapour-liquid equilibria in mixed solvent-salt systems, Chem. Eng. Sci., 46, 2775-2780, 1991. [ Links ]
[18] ACHARD, C., DUSSAP, C., GROS, J. B. Representation of vapour-liquid equilibria in water-alcohol-electrolyte mixtures with a modified UNIFAC group-contribution method, Fluid Phase Equilib., 98, 71-89, 1994. [ Links ]
[19] ZERRES, H., PRAUSNITZ, J. M. Thermodynamics of phase equilibria in aqueous-organis systems with salt, AIChE J., 40, 676-691, 1994. [ Links ]
[20] LI, J., POLKA, H., GMEHLING, J. A gE model for single and mixed electrolyte systems. 1. Model and results for strong electrolytes, Fluid Phase Equilib., 94, 89-114, 1994. [ Links ]
[21] THOMSEN, K., RASMUSSEN, P., GANI, R. Correlation and prediction of thermal properties and phase behaviour for a class of aqueous electrolyte systems, Chem. Eng. Sci., 51, 3675-3683, 1996. [ Links ]
[22] THOMSEN, K., Y RASMUSSEN, P. Modeling of vapour-liquid-solid equilibrium in gas-aqueous electrolyte systems, Chem. Eng. Sci., 54, 1787-1802, 1999 [ Links ]
[23] ABRAMS, D. S., PRAUSNITZ, J. M. Statistical thermodynamics of liquid mixtures: A new expression for the Gibbs energy or partly o completely miscible systems, AIChE J., 21, 116-128, 1975. [ Links ]
[24] MAURER, G., PRAUSNITZ, J. M. On the derivation and extension of the UNIQUAC extension, Fluid Phase Equilib., 2, 91-99, 1978. [ Links ]
[25] SANDER, B. Extended UNIFAC/UNIQUAC models for gas solubility calculations and electrolyte solutions [Ph.D. thesis]. Denmarck: Technical University of Denmarck, 1984. [ Links ]














