Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
DYNA
versão impressa ISSN 0012-7353versão On-line ISSN 2346-2183
Dyna rev.fac.nac.minas v.78 n.165 Medellín fev./mar. 2011
EFECTO DEL CONTENIDO DE SODIO EN LA OBTENCIÓN DE Na+-b-ALÚMINA UTILIZANDO EL MÉTODO DE PRECURSOR POLIMÉRICO
THE EFFECT OF THE CONTENT OF SODIUM IN THE OBTAINING OF Na+-b-ALÚMINA UTILIZED THE POLYMERIC PRECURSOR METHOD
VANESSA RUIZ
Universidad del Cauca, Grupo de Ciencia y Tecnología de Materiales Cerámicos (CYTEMAC), cvruiz@unicauca.edu.co
JORGE RODRIGUEZ
Universidad del Cauca,Grupo de Ciencia y Tecnología de Materiales Cerámicos (CYTEMAC), jnpaez@unicauca.edu.co
Recibido para revisar junio 8 de 2009, aceptado septiembre 7 de 2009, versión final octubre 13 de 2009
RESUMEN: En este trabajo se muestran los resultados obtenidos al emplear el método de precursor polimérico (Pechini) para sintetizar polvos cerámicos de Na+-b-alúmina, utilizando sales inórganicas, tomando como parámetro de estudio la cantidad inicial del precursor de sodio y su efecto sobre la fase cristalina obtenida al final del proceso. Los polvos fueron caracterizados utilizando espectroscopia Infrarroja (FTIR), Difracción de Rayos X (DRX) y Microscopía Electrónica de Barrido (MEB). Se encontró que el efecto de la cantidad de sodio inicial en la muestra es determinante en la naturaleza del producto final obtenido. Utilizando la cantidad estequiométrica de NaOH requerida, para la obtención del compuesto NaAl11O17, se obtuvo al final del proceso (1450ºC) a-alúmina y b-alúmina y/o Na2Al2xO3x-1 en muestras tratadas térmicamente entre 1000ºC y 1350ºC. Cuando se uso una mayor cantidad de NaOH, muestra no estequiométrica, se obtuvo un sólido con el compuesto NaAl11O17 como fase mayoritaria.
PALABRAS CLAVE: Na+-b-alúmina, síntesis, precursor polimérico, estequiometría, caracterización.
ABSTRACT: In this work was utilized the Polymeric Precursor method to synthesis ceramic powders of Na+-b-alúmina. We were interested in determinate the initial quantity from sodium precursor and its effect on crystalline phase obtained. Powders obtained were characterized using Infrared Spectroscopy (FTIR), X-Ray Diffraction (XRD) and Scanning Electron Microscopy (SEM). The effect of the initial quantity of sodium in the sample was very important in the nature of the final product. If we used one stoichiometric quantity of NaOH, to obtain NaAl11O17 compound, we obtained a-alúmina as finish product (1450ºC). On the other hand, b-alúmina and/or Na2Al2xO3x-1 were obtained in samples treated thermicalment from 1000ºC to 1350ºC. When we used a higher quantity of NaOH, sample non-stoichiometric, a solid with NaAl11O17 as majority phase was obtained.
KEYWORDS: Na+-b-alúmina, stoichiometric, non-stoichiometric, polymeric precursor.
1. INTRODUCCION
Las cerámicas de Na+-b-alúmina, sistema binario Na2O-Al2O3, son una familia de óxidos que exhiben conductividad iónica rápida. Esta propiedad hace que el material sea uno de los mejores electrolitos sólidos conocidos y por eso se considera adecuado su uso en modernos dispositivos electrónicos tales como: baterías secundarias, celdas de combustible, convertidores termoeléctricos, sensores, etc [1,2]. Es un buen candidato como electrólito sólido debido a su alta estabilidad química y física [3,4].
La Na+-b-alúmina, NaAl11O17, tiene una estructura hexagonal constituida por dos bloques tipo espinela, estrechamente empaquetados y una capa de conducción poco empaquetada de iones oxígeno y sodio. Los bloques tipo espinela están separados de la capa de conducción y el enlace entre los bloques y la capa, se da a través de puentes que establecen los iones oxígeno [5]. El transporte de carga ocurre a lo largo de los planos bidimensionales de conducción que están ocupados parcialmente por iones Na. Los valores de energía de activación, para el transporte de iones en los planos de conducción, es baja, entre 0.12 y 0.27 eV, debido al movimiento correlacionado de los pares de Na+ intersticiales en lugar del mecanismo estándar de vacancias [1].
Con relación a su obtención, la síntesis convencional de Na+-b-alúmina se realiza utilizando reacción en estado sólido de la a-alúmina con el Na2CO3 y una pequeña cantidad de MgO y/o Li2O como estabilizadores. Otros métodos no convencionales se han utilizado para obtener este compuesto, destacándose entre ellas [1,2,6]: hidrólisis de alcóxidos (sol-gel), co-precipitación y combustión, principalmente. Aunque el método de síntesis por combustión permitió obtener una sola fase del material, a baja temperatura (500ºC), fue necesario realizarle al producto un tratamiento a altas temperatura (1600ºC) para obtener la b-alúmina de interés [6].
Las otras rutas químicas, sol-gel y co-precipitación, se han utilizado para obtener una sola fase del material pero se requieren prolongados tratamientos térmicos, varias horas, a temperaturas que exceden los 1500ºC para obtener la fase de interés. Para la mayoría de las aplicaciones, la fase pura de b-alúmina compactada, en la forma deseada, se sinteriza para obtener materiales con alta densidad. Es bien conocido que la b-alúmina sintetizada por el método convencional no densifica bien a temperaturas por debajo de 1577ºC [6]. Una alta temperatura de sinterización puede ocasionar una perdida de sodio lo que generaría una variación en la composición de la muestra y por lo tanto una disminución de la conductividad eléctrica en el sólido sinterizado, condición que se debe tener en cuenta cuando se utilice la b-alúmina como electrólito sólido [6].
El método de síntesis utilizado en este trabajo, para obtener la Na+-b-alúmina, fue el denominado precursor polimérico (Pechini) [7] y se estudio el efecto de la cantidad inicial de precursor de sodio (NaOH) sobre la naturaleza de la fase cristalina del producto final. Los polvos obtenidos se caracterizaron utilizando diferentes técnica (DRX, FTIR y MEB) y se logró determinar que para un tratamiento térmico a 1450ºC, para la muestra no estequiométrica con mayor cantidad de NaOH que el requerido para obtener NaAl11O17, se obtuvo como fase cristalina mayoritaria Na+-b-alúmina, mientras que para la muestra estequiométrica, cantidad de NaOH adecuada para obtener el NaAl11O17 y tratada a la misma temperatura, se obtuvo a-alúmina. Este resultado indica que la cantidad de sodio presente en las muestras tiene gran importancia sobre las fases cristalinas que se forman en el producto final.
2. PARTE EXPERIMENTAL
2.1 Síntesis de Na+-b-alúmina por el método de precursor polimérico
Inicialmente se peso 62.18 g de etilenglicol (Fisher Chemicals) que posteriormente se calento a 70ºC y al que se le adicionó, lentamente, 52,14 g de ácido cítrico (Merck 99.5%), manteniendo constante la temperatura del sistema a 70ºC y agitando continuamente hasta obtener una mezcla homogénea y transparente. Posteriormente, se pesaron 0.7593 g de hidróxido de sodio (NaOH-Mallinckrodt 98.7%) y 1.9743 g de nitrato de aluminio (Al(NO3)3.9H2O-Merck 95%) que se adicionaron a la mezcla de etilenglicol y ácido cítrico; estas cantidades adicionadas conducirían a la obtención de una muestra no estequiométrica. Para la muestra estequiométrica se adicionó, a la mezcla inicial de ácido cítrico y etilenglicol, 36.7110 g de nitrato de aluminio y 0.3424 g de hidróxido de Sodio, cantidades que garantizarían la obtención de NaAl11O17 estequiométrico.
Cuando la mezcla precursores - etilenglicol y ácido cítrico se torno totalmente transparente, el sistema se puso a enfriar. Luego se adicionó, lentamente, el hidróxido de amonio (NH4OH- Mallinckrodt 28%), mientras la mezcla se agitaba continuamente, y hasta que el sistema alcanzó un pH de aproximadamente 5. El sistema se calentó a 120ºC, en continua agitación, hasta que se formo una resina de color negro. Esta resina se trato térmicamente en un horno a una temperatura de 350ºC por 24 horas; el sólido resultante de este proceso de pre-calcinación se macero en un mortero de ágata y al polvo obtenido se le realizaron diferentes tratamientos térmicos y su correspondiente caracterización.
2.2 Caracterización de los polvos cerámicos obtenidos
Los polvos obtenidos, utilizando el método de precursor polimérico, se caracterizaron utilizando espectroscopia infrarroja (Termo Nicolet IR200 Spectrometer) para identificar los principales grupos funcionales existentes en las muestras, estequiométrica y no estequiométrica, y como ellos evolucionaban al ser sometidos a diferentes tratamientos térmicos.
Para determinar las fases cristalinas existentes en los sólidos se utilizó difracción de rayos X (DRX) (Siemens D5000, radiación CuKa (1.54056 Å) en el rango de 10º a 70º) y para conocer el tamaño y morfología de las partículas de las muestras se utilizó Microscopía Electrónica de Barrido (MEB) (JEOL 6460LV).
3. RESULTADOS Y DISCUSIÓN
3.1 Efecto del tratamiento térmico
En la Figura 1 se muestran los espectros IR correspondientes a sólidos tratados a diferentes temperaturas, tanto para la muestra estequiométrica como para la no estequiométrica. Los espectros, Figura 1, presentan una banda a 3440 cm-1 que se puede asignar al modo vibracional de tensión del H-O-H, mientras que la banda a 1630 cm-1 corresponde al modo de flexión del agua. La banda a 1430 cm-1 se puede asociar a la vibración de grupos orgánicos C-H residuales [8]. La región del espectro entre 1000 y 400 cm-1 es donde se encuentran los enlaces catión-oxígeno, catión-OH y catión-C; concretamente para la muestra tratada a 1450ºC, muestra no estequiométrica (Figura 2(a)), las bandas ubicadas en esta región corresponden al espectro característico de la Na+-b-alúmina [1] . Se observa una banda a 1050 cm-1 que corresponde a la vibración de flexión de Al-O, mientras que las bandas a 650 y 460 cm-1 se pueden asociar a las vibraciones de los octahedros AlO6; las bandas ubicadas a 950 y 750 cm-1 corresponderían a los tetraedros AlO4 [9]. La banda ubicada entre 460 y 450 cm-1, una banda de poca intensidad en el espectro de la muestra tratada a 1450ºC, se podría asociar al enlace Na-O. En el espectro de la muestra estequiométrica tratada a 1450ºC, figura 2(b), la banda entre 450 y 440 cm-1 es una banda intensa que se puede asociar al enlace Al-O. Esta banda es evidente en los espectros desde el tratamiento térmico a 1200 ºC e indicaría que en la muestra existe un óxido de aluminio bien formado [10].
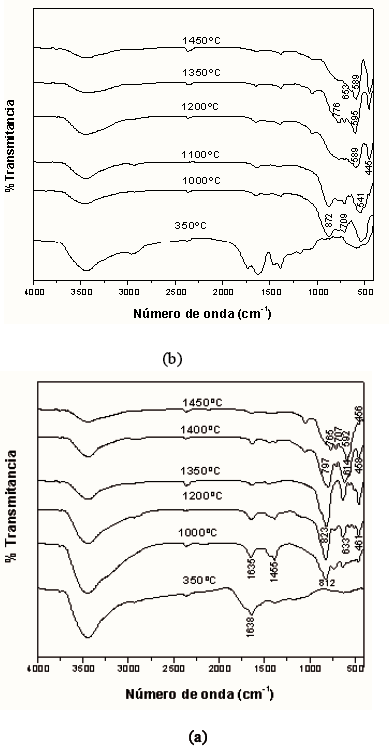
Figura 1. Espectros de Infrarrojo de los polvos cerámicos obtenidos por el método de Precursor Polimérico correspondientes a las muestras: (a) no estequiométrica y (b) estequiométrica
Figure 1. FTIR spectra of the ceramic powders obtained for the Polymeric Precursor method corresponding to the samples: (a) nonstoichiometric and (b) stoichiometric
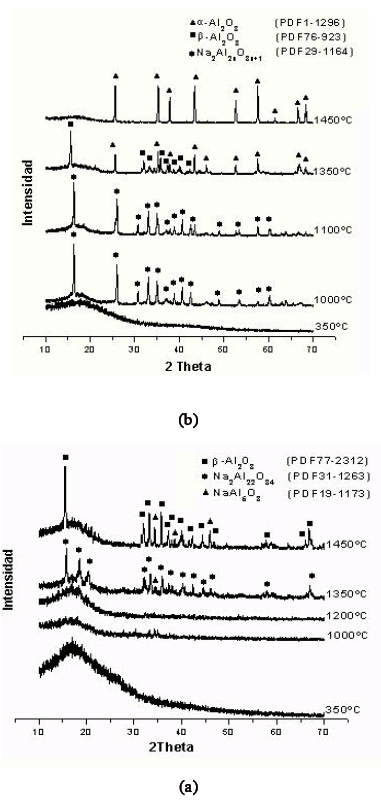
Figura 2. Difractogramas de Rayos X correspondientes a polvos cerámicos obtenidos por el método de precursor polimérico, de muestras: (a) no estequiométrica y (b) estequiométrica, tratadas a diferentes temperaturas
Figure 2. XRD spectra corresponding to ceramic powders obtained for the Polymeric Precursor method, of samples: a) nonstoichiometric and (b) stoichiometric, treated thermicalment
Por otro lado, en la Figura 2 se muestran los difractogramas de los sólidos del sistema Al(NO3)3.9H2O-NaOH, tanto para la muestra no estequiométrica, Figura 2(a), como para la estequiométrica, Figura 2(b), sometidas a diferentes tratamientos térmicos.
Los difractogramas de la muestra no estequiométrica, Figura 2(a), muestran que los sólidos tratados a 1000ºC y 1200ºC son amorfos. A la temperatura de 1350ºC, en el difractograma aparecen los picos correspondientes a óxidos de sodio aluminio: Na2Al22O34 (PDF 31-1263) y NaAl5O8 (PDF 19-1173). En la muestra no estequiométrica, tratada a 1450ºC, se observa que la fase cristalina más importante es la b-Alúmina (PDF 77-2312) y como fase minoritaria el óxido de sodio aluminio NaAl5O8.
En la Figura 2(b), difractogramas de la muestra estequiométrica tratada a diferentes temperaturas, se observa que el sólido tratado a 1000ºC ya está bien cristalizado, condición que no presentó la muestra no estequiométrica (Figura 2(a)). Para la muestra estequiométrica se observa que, a 1000ºC y 1100ºC, la fase cristalina predominante es el Na2Al2xO3x+1 (PDF 29-1164). Al tratar el sólido a 1350ºC se observa una mezcla de fases a-alúmina y b-alúmina, mientras que para la muestra estequiométrica tratada a 1450ºC predomina la fase a-Al2O3. La pérdida de Na2O, por la volatilización del sodio, pudo propiciar que el sistema adquiriera la estructura tipo corindón (a-alúmina), más que la tipo espinela de la b-alúmina, por lo que prevalecerían los enlaces del tipo Al-O favoreciendo la formación de la primera estructura que es muy estable; esta condición es justificada por los resultados del estudio de espectroscopia IR (Figura 2(b)). Para la muestra no estequiométrica, el exceso de sodio dentro del sistema propicio la formación de enlaces Na-O de tal forma que se favoreció la fase esperada, predominando la estructura espinela frente a la corindón.
3.2 Morfología y tamaño de la partícula de los polvos cerámicos obtenidos
En la Figura 3 se muestran las micrografías obtenidas con MEB de los polvos cerámicos sintetizados por el método Pechini: sólido no estequiométrico (Figura 3(a)) y sólido estequiométrico (Figura 3(b)). Las micrografías muestran un tamaño de partícula del orden micrométrico. Se observa en la muestra no estequiométrica la presencia de gran cantidad de aglomerados, por lo que el tamaño realmente debe corresponder al de las partículas secundarias y no al de las partículas primarias. Para la muestra estequiométrica, se observan superficies lisas en los aglomerados que brindan una apariencia de gran dureza; además aparecen partículas con forma de agujas.

Figura 3. Micrografías obtenidas con Microscopía Electrónica de barrido, MEB, de los polvos cerámicos sintetizados por Pechini, tratados a 1450ºC durante 1 hora, de las muestras: (a) no estequiométrica y (b) estequiométrica
Figure 3. Micrographs obtained with Scanning Electron Microscopy, SEM, of the ceramic powders synthesized for Pechini, treated t at 1450ºC during 1 hour, of the samples: a) nonstoichiometric and (b) stoichiometric
4. CONCLUSIONES
Con base en los resultados obtenidos se puede concluir que se requiere un exceso de NaOH de partida para favorecer la presencia de Na+-b-alúmina (NaAl11O17) en el producto final.
La caracterización con espectroscopia Infrarroja permitió determinar la existencia de Na+-b-alúmina a 1450ºC debido a la presencia de las bandas características de este compuesto en el intervalo entre 400 y 1000 cm-1. La banda intensa entre 450-440 cm-1, presente en las muestras estequiométricas tratadas térmicamente a 1200ºC, 1350ºC y 1450ºC, pone en evidencia enlaces tipo Al-O que indica la formación de a-alúmina. Por otro lado, en la muestra no estequiométrica, la banda de poca intensidad entre 460 y 450 cm-1 se puede asociar a la formación de enlaces Na-O y por lo tanto la presencia, como fase mayoritaria, de la b-alúmina.
La muestra no estequiométrica tratada a 1000ºC es aún amorfa pero si se trata a 1350ºC predomina el compuesto Na2Al22O34 y a 1450ºC la fase mayoritaria es la b-Alúmina. Por su parte, la muestra estequiométrica tratada térmicamente a 1000ºC y 1100ºC presenta, principalmente, la fase Na2Al2xO3x+1, y a 1350ºC una mezcla de a-alúmina y b-alúmina; finalmente, al tratar el sólido a 1450ºC se obtiene a-alúmina.
Los resultados anteriores indican la importancia que tiene la cantidad de sodio presente en la muestra para la obtención de NaAl11O17; si hay pérdida de Na2O, por la volatilización del sodio, se favorece la fase corindón frente a la espinela, como ocurrió con la muestra estequiométrica. Un exceso de NaOH permitió invertir la anterior condición y favorecer la estructura espinela frente a la de corindón, propiciando la obtención de Na+-b-alúmina.
REFERENCIAS
[1] SARTORI, S., MARTUCCI, A., MUFFATO, A. AND GUGLIELMI, M. Sol-gel synthesis of Na+ beta-Al2O3 powders, J. Eur Cec Soc., 24, 911-914, 2004. [ Links ]
[2] JAYARAMAN, V., PERIASWAMI, G. AND KUTTY, T.R.N. Gel- to -crystallite conversion technique for the syntheses of M-b /b''-alumina (M = Li, Na, K, Rb, Ca or Eu), Mat Res B. 2007.
[3] SUBASRI, R., NÄFE, H. An alternative approach to characterize the equilibrium in a biphasic a-Al2O3/Na-b-alumina mixture as a function of sodium activity, Elect Acta, 48, 3535-3540, 2003.
[4] HE, G., GOTO, T., NARUSHIMA, T. AND IGUCHI, Y. Application of Sr b-alumina solid electrolyte to a CO2 gas sensor, Sol St Ion. 121, 313-319, 1999.
[5] ZHANG, Y., AKASHI, T., ZHANG, B.P. AND GOTO, T. Electrical conductivity of partially ion exchanged Sr and Ba b-alumina single crystals determined by a.c. impedance spectroscopy, Mat Let, 60, 2834-2836 2006.
[6] SUBASRI, R., MATHEWS, T., SREEDHARAN, O.M. AND RAGHUNATHAN, V.S. Microwave processing of sodium beta alumina, Sol St Ion., 158,199- 204, 2003. [ Links ]
[7] PECHINI, M.P. Method of preparing Lead and Alkaline-Earth titanates and Niobates and coating method using the same form a capacitor, U.S. Pat. N° 3.330.697, 1967. [ Links ]
[8] NAKAMOTO, K., Infrared Spectra of Inorganic and Coordination Compounds. John Wiley & Inc,. New Cork-London, 1962. [ Links ]
[9] SUBASRI, R., Investigations on the factors assisting a one-step synthesis cum sintering of sodium beta alumina using microwaves, Mat Sci & Eng B, 112, 73-78, 2004. [ Links ]
[10] COBO, J., VILLAQUIRAN, C.F., SCIAN, A. AND PÁEZ-RODRÍGUEZ, J.E. Síntesis de Nanopartículas de a-Al2O3 a partir de Al2(SO4)3.18H2O: Estudio de los mecanismos de formación de las Partículas, Rev Lat Met y Mat, 26 (2), 95-106, 2006. [ Links ]




![CORROSION RESISTANCE OF [TiN/AlTiN]n MULTILAYERS DEPOSITED ONTO AISI 1045 STEEL](/img/pt/prev.gif)









