Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353
Dyna rev.fac.nac.minas vol.78 no.169 Medellín Oct. 2011
PRODUCCIÓN DE ETANOL A PARTIR DE HARINA DE YUCA EN UN SISTEMA DE HIDRÓLISIS ENZIMÁTICA Y FERMENTACIÓN SIMULTÁNEA
ETHANOL PRODUCTION FROM CASSAVA FLOUR IN SIMULTANEOUS ENZYMATIC HYDROLYSIS AND FERMENTATION SYSTEM
HADER CASTAÑO PELAEZ
Msc, Docente, Politécnico Colombiano Jaime Isaza Cadavid, Medellín, Colombia, hicastano@elpoli.edu.co
MARIANA CARDONA BETANCUR
Msc, Docente, Universidad de Antioquia, Medellin, Colombia
CARLOS MEJÍA GOMEZ
Msc, Docente, Universidad de Antioquia, Medellín Colombia
ALEJANDRO ACOSTA CÁRDENAS
Msc, Docente, Universidad de Antioquia, Medellín, Colombia
Recibido para revisar Abril 30 de 2011, aceptado Agosto 10 de 2011, versión final Agosto 31 de 2011
RESUMEN: La necesidad mundial en la producción de biocombustibles, ha llevado a explorar nuevas estaretegias de proceso y a usar materias primas alternativas con el objetivo de optimizar la producción; por tal razón se desarrolla en esta investigación el estudio del proceso de producción de etanol a partir de harina de yuca integrando las etapas de hidrólisis enzimatica (licuefacción y sacarificación) y fermentación simultaneamente (HEFS), mediante el uso del complejo enzimático Stargen TM 001. El diseño experimental fue una Superficie de Respuesta de un diseño Central Compuesto de dos factores a dos niveles (48 - 80 ° C y 400 - 600 rpm) en la etapas de prelicuado, y luego la temperatura se ajusto a 37 °C manteniendo las otras condiciones de proceso en la integración de los etapas. La experimentacion se desarrollo con una concentración de sólidos de la harina de yuca de 28% p/v, pH de 5.3, inóculo de 0.75 g/l de la levadura Ethanol Red® y una carga enzimática de 4 ml/l. La temperatura es la variable de mayor efecto sobre la producción de etanol si se compará con la agitación; aunque, ambos factores presentan significancia estadístca sobre la variable de respuesta. A 64° C y 500 rpm se alcanza una concentración de etanol de 14.6% v/v y una productividad de 2.5 g/lh (48 horas de proceso).
PALABRAS CLAVE: HEFS, Harina de Yuca, Producción de etanol, StargenTM 001.
ABSTRACT: The global need for the production of biofuels, has led to explore new strategies process and use alternative raw materials in order to optimize production, for this reason this research is developed in the study of the ethanol production process from flour cassava integrating the stages of enzyme hydrolysis (liquefaction and saccharification) and fermentation simultaneously (HEFS), using the enzyme complex Stargen TM 001. The experimental design was a response surface central composite design with two factors and two levels (temperature: 48 - 80 ° C and agitation: 400 - 600 rpm) in liquefaction stages previous, and then the temperature was adjusted to 37 ° C keeping the other conditions in the integration process of the stages. The experimentation was developed with a solids concentration of cassava flour of 28% w/v, pH 5.3, inoculums of 0.75 g/l of yeast Ethanol Red ®, and an enzyme concentration of 4 ml / l. The temperature is variable with greatest effect on the production of ethanol when compared to the agitation, though; both factors have statistic significance on the response variable. A 64 ° C and 500 rpm is reached an ethanol concentration of 14.6% v/v and a productivity of 2.5 g/lh (at 48 hours of processing)
KEYWORDS: SEHF, Cassava flour, ethanol production, StargenTM 001.
1. INTRODUCCIÓN
La acelerada disminución de las reservas mundiales de hidrocarburos, los precios internacionales del petróleo, la tensa situación política internacional en las más grandes áreas de producción de petróleo y la alta preocupación por los niveles de contaminación y el calentamiento global han desencadenado una fiebre mundial por la producción de biocombustibles, lo que ha conllevado a su vez a la implementación de leyes que obligan a la utilización de combustibles mezclados con alcohol carburante.
Para satisfacer plenamente la demanda de etanol como alcohol carburante a nivel mundial, se han desarrollando diferentes metodologías [1] durante las dos últimas décadas y se han empleado diferentes sustratos no convencionales como materia prima para su producción, entre ellos los más competitivos son la caña de azúcar y el maíz, debido a que a partir de estos sustratos agroindustriales se logran alcanzar excelentes rendimientos con una relación entre la energia producida/energia utilizada del 11.2 y 1.22 respectivamente; pero para abarcar y satisfacer la demanda actual de este combustible se requiere ampliar la cobertura de los cultivos y/o sustratos destinados para tal fin [1]. Desde esta perspectiva, fuentes amiláceas como la yuca (mandioca) representan una excelente alternativa para la producción de etanol, debido a que estos tubérculos constituyen una de las fuentes de energía más importantes en las regiones tropicales del mundo, y dependiendo de la variedad se pueden obtener rendimientos de 140 a 170 litros de etanol por tonelada de raíces frescas [2]. Como cultivo, la producción de yuca tiene como ventaja su gran rendimiento por hectárea (30 ton/ha año), su tolerancia a la sequía y a los suelos degradados y su flexibilidad a la siembra y la cosecha. Como fuente de almidón, ésta es muy competitiva, pues contiene más almidón por peso en seco que otros cultivos alimenticios; y la obtención del mismo es fácilmente procesable [3]. La producción de etanol a partir de yucas amargas (uso industrial) y no dulces (consumo humano) no pone en riesgo la seguridad alimentaria de poblaciones que dependan energéticamente de la yuca como alimento.
Para obtener azucares fermentables a partir de fuentes amiláceas como la harina de yuca, ésta debe ser sometida a un proceso previo de hidrólisis (licuefacción y sacarificación) con el objetivo de promover la conversión hidrolítica de los polímeros del almidón en azucares para luego transformarlo en etanol. Recientes avances en el desarrollo de amilasas termoestables han permitido mejorar la eficiencia del proceso de licuefacción y en la actualidad son grandes los avances a nivel de la tecnología ADN recombinante para la obtención de enzimas industriales de este tipo [4].
La estrategia de proceso de sacarificación y fermentación simultánea (SSF) ha sido ampliamente utilizada en la producción de etanol a partir de fuentes amiláceas y residuos lignocelulósicos [4], presentando ventajas comparativas con los procesos convecionales donde las etapas se desarrollan en forma independiente; y se ha modificado al integrar la etapa de licuefacción, gracias al uso de enzimas con capacidad de hidrolizar el almidón nativo sin necesidad de realizar los procesos de cocción y licuefacción a altastemperaturas [5].
El sistema de Hidrólisis Enzimática-Fermentación Simultánea (HEFS), acopla los procesos de licuefacción, sacarificación y fermentación etanólica, hecho que permite la unión de tres metodologías antes trabajadas independientemente, lo que representa grandes ventajas con relación a los procesos convencionales de obtención de bioetanol, pues permiten obtener mayores rendimientos por unidad de grano, reduce gastos energéticos y de producción por unidad de etanol producido; además, reduce la cantidad de unidades de operación requeridas durante el proceso [6].
STARGEN™ 001 es una enzima desarrollada por Genencor® Internacional para hidrolizar almidón granular a glucosa para la producción de etanol, ésta enzima está compuesta por alfa-amilasas de Aspergillus kawachi expresadas en Trichoderma reesei y Glucoamilasas de Aspergillus niger. La hidrólisis y fermentación simultánea empleando STARGEN™ 001 permite hidrolizar el almidón sin la necesidad de gelatinizarlo ya que las actividades máximas de estas dos enizmas se encuentran por debajo de las temperaturas de gelatinización del almidón, lo que reduce una etapa en el proceso productivo; además, la enzima mantiene una actividad alta a las condiciones de pH y temperatura requeridas para favorecer a la levadura en el proceso fermentativo (0.23 g almidón/mlmin, a pH 4.3 y temperaturas 37 °C); produce glucosa continuamente durante todo el proceso de hidrólisis y no requiere activadores como sales de calcio o sodio para mantener su carga, su estructura y aumentar su actividad.
Wang et al [7] evaluaron el uso de la enzima Stargen sobre los procesos convencioanles de producción de etanol a través de la metodologia de Molienda de maíz en seco, mostrando las bondades del uso del complejo enzimático. La literatura reporta estudios en donde se compara con el proceso convencional descrito por Shing et al [8] en la producción de etanol a partir de maíz con procesos que involucran tratamientos enzimáticos (procesos convencionales de licuefacción y sacarificación, y procesos alternativos de SSF) en donde evaluaron el efecto del uso de la enzima Stargen sobre la producción de etanol a partir de maíz bajo la estrategia de proceso de molienda en seco [9].Bialas et al [10] examinaron el efecto de recircular los residuos de destilería en la producción de etanol utilizando el proceso SSF y la enzima StargenTM 001 como enzima hidrolítica del almidón granular de maíz; en donde la velocidad de producción de etanol no se vio influenciada por la recirculación de las vinazas.Es posible el uso de mezclas de enzimas amilolíticas operando a temperaturas inferiores a las de gelatinización de almidones lo que permite la reducción de las necesidades energéticas de los procesos de licuefacción y sacarificación. Uthumporn et al [11] y Shariffa et al [5] encontraron que el complejo enzimático StragenTM 001 fue capaz de hidrolizar almidón granular a una temperatura inferior a la de gelatinización de los almidones de yuca y patata, validando la viabilidad de desarrollar los procesos hidrolíticos de los almidones a temperaturas medias (35°C). Al aumentar la temperatura de hidrólisis enzimática hasta 70 - 90°C y disminuirla abruptamente a la temperatura a la que se lleva a cabo el proceso fermentativo (30 - 37°C) se obtiene una alta conversión a glucosa (90 - 95%) lo que favorece la producción de alcohol carburante [11,12].
En el presente trabajo se realizó la evaluación de diferentes condiciones de operación de la enzima STARGENTM 001 en el proceso de producción de etanol a partir de harina de yuca en un sistema de hidrólisis enzimática y fermentación simultánea con el fin de analizar los rendimientos de la producción de etanol bajo las condiciones establecidas.
2. MATERIALES Y MÉTODOS
2.1 Harina de yuca
Para este estudio se empleó yuca variedad Copiblanca obtenida de la región del Urabá Antioqueño, se recolectó yuca fresca en los Municipios de Mutatá, Chigorodo y Carepa, y se procesó en la planta piloto de producción de harina de yuca de la Universidad de Antioquia ubicada en el Municipio de Mutatá. Para la obtención de la harina de yuca, el tubérculo fue lavado, picado, triturado, deshidratado y tamizado hasta obtener un tamaño de partícula de 0,15mm. La harina de yuca fue caracterizada bromatológicamente por el Laboratorio Tecnimicro de la ciudad de Medellin. La harina de yuca se llevó a estufa a 100 +/- 0.1° C por tres horas con el objetivo de reducir la carga microbiana y evitar la contaminación del medio.
2.2 Enzima
La enzima comercial STARGENTM 001 es una enzima comercial de Genencor INC (Genencor International, Palo Alto, CA). Esta enzima contiene Aspergillus kawachi alfa amilasa expresada en Trichoderma reesei y glucoamilasa de Aspergillus niger. La gravedad específica de la enzima es 1.10-1.15 g/ml, pH óptimo 4.0-4.5 y la temperatura recomendada 20-40°C. La actividad de la enzima fue determinada por la reacción a 37 °C de una suspensión amortiguada (pH 4.3) de almidón soluble de la casa MERK al 1%; alícuotas fueron tomadas a los 10 minutos para determinar la glucosa liberada de la reacción; la cual fue determinada usando el método del ácido Dinitrosalicilico [12]. (La actividad de la enzima fue 0.23 g almidón/ (ml de enzima x min).
Proceso de Hidrólisis enzimática y Fermentación simultánea.
Para la producción de etanol se empleó un biorreactor B-Braund® con un volumen útil de 5 litros, agitado mecánicamente con control de pH y temperatura. Al reactor se le adicionó una masa de harina de yuca estéril, que luego de aforar con agua potable estéril hasta un volumen de 4 l alcanzó una concentración (28% p/v); posteriormente, se adicionó la enzima STARGEN™ 001 hasta alcanzar una concentración de 2 ml/l. Se prelicuó durante 10 minutos a una temperatura y frecuencia de agitación según las condiciones establecidas por el diseño de experimentos, luego se ajusto la temperatrura hasta 37oC y se adicionó otra alícuota de la enzima hasta completar una concentración final de 4 ml/l. El reactor se inoculó con 0,75 g/l de la levadura comercial saccharomyces cerevisiae Ethanol RED®, la cual media hora antes de la inoculación fue activada en 400 ml de medio YM (contiene por litro 3g de extracto de levadura; 3g de Extracto de Malta; 5g de peptona y 10g de Glucosa monohidratada) a 37oC , 150 rpm y un pH 5.3; y se continuó el proceso fermentativo a 37 °C, y una velocidad de agitación establecida por el diseño de experimentos durante 72 horas.2.4 Diseño experimental
Los tratamientos evaluados corresponden al diseño de superficie de respuesta central compuesto rotable de dos factores (Temperatura y frecuencia de agitación) (tabla 1) evaluados a dos niveles, con cuatro puntos factoriales, cuatro puntos axiales y tres replicas del punto central, utilizando el paquete estadístico Desing Expert vesrión 8.0 (Versión de prueba).
Tabla 1. Diseño experimental para evaluar la producción de etanol en sistema HEFS.
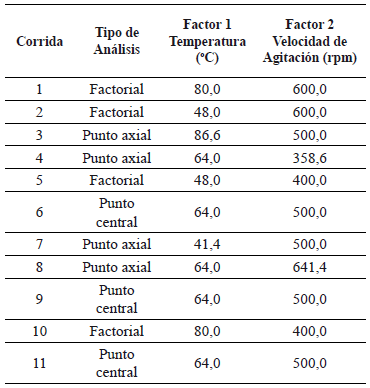
2.5 Técnicas Analíticas
Muestras fueron tomadas cada 12 horas y analizadas por duplicado. Los perfiles de fermentación (concentración vs. tiempo) de etanol y glucosa se cuantificaron por cromatografía liquida de alta eficiencia (HPLC) usando un cromatógrafo Agillent 1200, utilizando una columna BioRad Aminex HPX-87H (300x 7.8 mm); como fase móvil se utilizó una solución de 0.012 N de ácido sulfúrico grado HPLC con un flujo de 0.5 ml/min, con una temperatura de columna de 65°C utilizando detector de Índice de Refracción Agillent. Los azúcares reductores se determinaron por el método de Miller [13] usando un espectrofotómetro UV visible Genesys 20.
3. RESULTADOS Y DISCUSIÓN
3.1 Análisis Bromatológico de la harina de yuca variedad Copiblanca
En la tabla 2 se observa la composición de la harina de yuca variedad Copiblanca. En esta se puede observar el alto contenido de proteína de la harina, característica de la variedad de yuca utilizada (3.03%).
Tabla 2. Análisis Bromatológico de la harina de yuca variedad Copiblanca
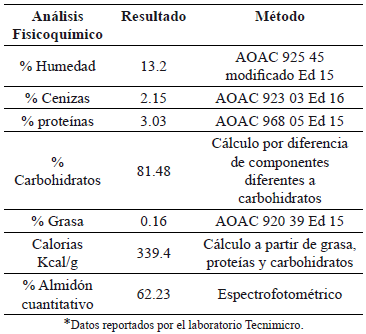
3.2 Etapa de prelicuado
En la tabla 3 se observan los valores de concentraciones de azucares reductores y glucosa obtenidas en la fase del prelicuado (fase de matenimiento por 10 minutos a la temperatura según diseño de experimentos, más fase de enfriamiento hasta alcanzar 37°C). El análisis de varianza del modelo de superficie de respuesta permite establecer que la temperatura tiene un marcado efecto sobre la hidrólisis de los gránulos de almidón presentes en la harina. A la temperatura de 86°C y frecuencia de agitación 500 rpm se alcanza una concentración de azúcares reductores y glucosa de 200.48 g/l y 177 g/l, respectivamente, esto representa una efeciencia de conversión de almidón en Azúcares reductores y Glucosa de 79% y 69% respectivamente, valores altos para una fase de prelicuado si se comparan con los tiempos de proceso implementados por Castaño et al [4] en la etapa de licuefacción en un proceso SSF (47.1 %) para 2.5 h de proceso, utilizando la enzima Liquozyme® a una temperatura de 90 ° C; y Shavanas et al [14] que alcanzaron eficiencias de hidrólisis máximas de 17% en la etapa de licuefacción en el proceso de SSF para obtención de etanol a partir de supensiones de almidón de yuca, utilizando la enzima Spezyme® Xtra a similares condiciones de proceso a las utilizadas en esta investigación.
Tabla 3. Obtención de azucares reductores y glucosa durante la fase de prelicuado ( El medio se sostuvo por 10 min a la temperatura del tratamiento experimental)
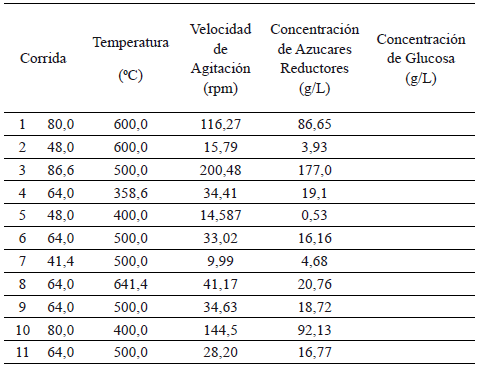
3.3 Licuefacción, sacarificación y fermentación simultáneas del prelicuado de harina de yuca.
La tabla 4, muestra las concentraciones finales de etanol obtenidas en el proceso de hidrólisis enzimática y fermentación simultáneas al cabo de las 72 horas de proceso. Se alcanzó una concentración máxima de etanol de 115.5 g/L (14.62 %v/v), valor comparable a los obtenidos en las replicas del punto central, 64ºC y 500 rpm (14.5 %v/v), y representa un Y p/s = 0,47 g etanol/g sustrato, que equivale a un rendimiento teórico del 91 %. Srichuwong et al [15] alcanzaron concentraciones de 16.61 %v/v de etanol con rendimientos teóricos del 89 % a partir de papa fresca utilizando la estrategia SSF acompañada de dos etapas previas, una etapa de reducción de viscosidad de la suspensión, seguida de una etapa de licuefacción que utilizó la enzima amilolítica Liquozyme® SC; es necesario aclarar que la estrategia utilizada en éste proyecto no requirió el uso de enzimas reductoras de viscosidad de la suspención; pese al uso de altas concentraciones de sólidos disueltos.
Tabla 4. Concentración de etanol (% v/v y g/l) a las 72 horas de proceso según el diseño de experimentos
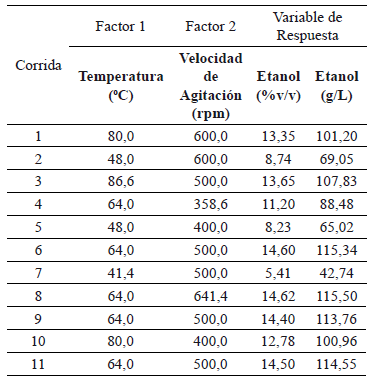
Wang et al [7] utilizando procesos de molienda en seco enzimático y convencional, alcanzaron rendimientos y concentraciones en la producción de etanol a partir de maíz de 0.395 y 0.417 l /kg y 15.5 %v/v y 14.2 %v/v respectivamente. Wang et al [9] compararon los resultados de tres tratamientos enzimáticos (dos procesos convencionales de licuefacción y sacarificación y un proceso alternativo SSF, (no fue necesario la etapa de licuefacción)), donde evaluaron el efecto del uso de la enzima StargenTM 001 sobre la producción de etanol a partir de maíz bajo la estrategia de proceso de molienda en seco; al cabo de las 72 horas no encontraron diferencias significativas en rendimientos y concentraciones de etanol entre los tres tratamientos, mostrando las ventajas de uso de la enizma en un proceso SSF que no requiere del uso de la etapa de licuefacción.
Se observa el significativo efecto que tiene la temperatura del proceso en la fase de prelicuado sobre la producción de etanol en el proceso de hidrólisis y fermentación simultáneas, gracias a que en esta etapa se alcanzan niveles de concentración de glucosa suficientes para soportar el metabolismo fermentativo de la levadura. Ver tabla 3.
3.4 Efecto de las variables evaluadas
El analisis estadistico realizado a los resultados del diseño experimental presentan una diferencia estadisticamente significativa (p-value ≤ 0.05) tanto para la temperatura como para la agitacion en sus terminos lineales y cuadráticos; la interacción de los factores no presenta influencia sobre el proceso. El ANOVA del proceso refuerza el hecho que la etapa de prelicuado es fundamental para alcanzar altos niveles de rendimiento de almidón granular en etanol, presentando correspondencia con la metodología utilizada por Shariffa et al [5], en donde el pretratamiento a temperaturas de subgelatinización mejoran los niveles de hidrólisis del almidón nativo por acceso de la enizma al gránulo.
Tabla 5. Anova del diseño experimental.
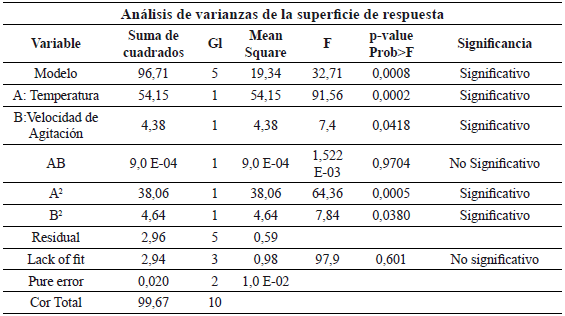
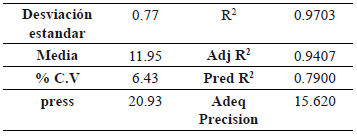
El modelo de superficie de respuesta presenta un R2 = 0.9703 y un R2 ajustado (0.94). En los modelos de superfice de respuesta central compuesto es deseable obtener un índice de precisión mayor a 4, y en nuestro caso el modelo presento valor de 15.62 lo que indica que se logra predecir el comportamiento de producción de etanol en función de la frecuencia de Agitación y de la temperatura (tabla 6).
Tabla 6. Estadísticos del análisis de varianza del modelo de superficie de respuesta
El modelo predicho para la concentración de etanol en el proceso HEFS en función de los factores evaluados se representa por la ecuación (1)
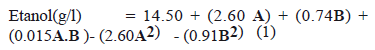
Para examinar la interacción de las variables y determinar el nivel óptimo de cada variable para maximizar la variable respuesta se obtuvo la gráfica de superficie de respuesta (figura 1). El comportamiento sobre la variable respuesta que tienen la Temperatura y Agitación, evidencian que al aumentar la temperatura de hidrólisis enzimática (temperatura de la fase de prelicuado) aumenta la producción de etanol. A partir de 64oC la cantidad de etanol obtenido comienza a ser constante. La velocidad de agitación del sistema no presenta un efecto tan marcado sobre la producción de etanol, al menos en el intervalo donde se evaluó el diseño experimental, pues según el Análisis de varianza, éste factor presenta mayor significancia estadística al comparar el estadístico p-value de los factores agitación y temperatura (0.0418 vs 0.0002 para los terminos lineales y 0.038 vs 0.0005 para los términos cuadráticos respectivamente).
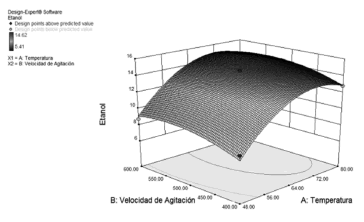
Figura 1. Superficie de respuesta diseño experimental.
3.5 Rendimientos y productividades alcanzadas.
En la tabla 7 se pueden apreciar los rendimientos y las productividades para cada una de las corridas de diseño experimental a las 48 y 72 horas de proceso.
Tabla 7. Rendimientos y productividades de cada una de las corridas.
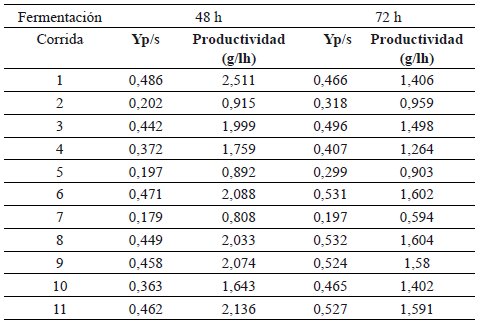
A las 48 horas de proceso se logran las mas altas productividades (2 - 2.5 g/lh) y los rendimientos alcanzan valores de 0.486, mientras que a las 72 horas de proceso se logran valores productividades del orden de 1.60 g/Lh. Bialas et al [10] lograron un 83,3% del rendimiento teórico con una productividad de 1.32 g/lh en la producción de etanol a partir de almidón granular de maíz utilizando la enzima STARGENTM 001 en procesos de SSF con reuso de vinazas; estos valores están por debajo si son comparados con los resultados con harina de yuca y el uso de la enzima STARGENTM 001 a las condiciones de proceso usadas en esta investigación (92% y 2.1 g/lh respectivamente).
Estos resultados son muy satisfactorios debido a que se alcanzaron productividades similares a las obtenidas con los procesos convencionales por lotes de 1.8 - 2.5 g/lh por Cardona et al [15], donde las etapas de sacarificación y fermentación se realizan en forma independientes, y mayores a las productividades en procesos SFS (1.33 g/lh) [4,10], los cuales requieren un proceso de licuefacción adicional a 80-90oC, mientras que con la utilización de la enzima STARGENTM 001 y el resultado alcanzado en esta investigación permite disminuir la etapa de licuefacción a solo 1 hora de proceso (incluye las etapas de calentamiento hasta 64° C, sostenimiento a 64 °C (por 10 minutos) y enfriamiento a 37° C), lo que implica un ahorro energético considerable dentro de los costos del proceso fermentativo para la producción de etanol si se compara con las condiciones de proceso convencionales.
4. CONCLUSIONES
El factor temperatura influye marcadamente sobre la eficacia de producción de etanol mediante la estrategia de integración de las etapas de licuefacción, sacarificación y fermentación, este hecho se refleja en la necesidad de conducir una etapa inicial de pre licuado. La frecuencia de agitación presenta menor relevancia sobre la producción de etanol bajo esta estrategia de proceso.
Los resultados del proyecto permiten validar la viabilidad técnica del proceso de obtención de etanol a partir de harina de yuca mediante la integración de las etapas utilizadas en los procesos convencionales de producción de etanol a partir de fuentes amiláceas.
Mediante el uso del complejo enzimático STARGENTM 001 es posible la hidrólisis del almidón de yuca presente en la harina sin necesidad de desarrollar procesos de cocción a temperaturas superiores a las de gelatinización, lo que permite la reducción en costos energéticos: sin embargo, es necesario realizar un prelicuado a una temperatura moderada (64°C) que favorezca la hidratación parcial de los gránulos de almidón, lo que facilita la acción de las enzimas presentes en el complejo enzimático.
La concentración de etanol obtenida en el proceso se expresa para los niveles evaluados bajo un modelo cuadrático de la temperatura y frecuencia de agitación. Las mayores concentraciones de etanol obtenidas en el proceso (14.6 %v/v de alcohol) se presentan a las condicones de los factores (64°C y 500 rpm) y representa una productividad de 2.1 g/lh.
Pese a que el proceso fue monitoreado por 72 h, sólo es necesario 48 horas de proceso para obteber rendimientos de sustrato en productos de 0.47 g etanol/g sustrato, lo que representa eficiencia del 92% frente al valor teórico.
AGRADECIMIENTOS
Los autores expresan su agradecimeinto al Programa de Gestión Tecnológica de la Universidad de Antioquia y al Politécnico Colombiano Jaime Isaza Cadavid por la financiación del proyecto PGT-CI-022-08.
REFERENCIAS
[1] Federación Nacional de Biocombustibles. ABC de los Alcoholes Carburantes. Disponible en: http://www.fedebiocombustibles.com/v2/main-pagina-id-5.htm [citado: 27 de mayo de 2009]. [ Links ]
[2] Castaño, H.I., La yuca como alternativa para la producción de alcohol carburante. Politécnica, 6, 25-37, 2008 [ Links ]
[3] Ospina, B Y. y Ceballos, H., La yuca en el tercer Milenio: Sistemas Modernos de producción, procesamiento, utilización y comercialización. CIAT. Cali, 2002. [ Links ]
[4] Castaño, H.I. y Mejia, C.E., Producción de etanol a partir de almidón de yuca utilizando la estrategia de proceso Sacarificación- Fermentación Simulténeas SSF. Vitae, 15, pp. 51-58, 2008 [ Links ]
[5] Shariffa, Y.N, Karim, A.A., Fazilah, A. y Zaidul, L.S.M., Enzymatic hydrolysis of granular native and mildy heat-treated tapioca and sweet potato starches at subgelatiniation temperature. Food Hydrocolloids, 23, pp. 434-440, 2009. [ Links ]
[6] Genencor International. STARGEM 001. Ficha técnica. Available: http://sabacchusdistillery.com/yahoo_site_admin/assets/docs/STARGEN_001.163134924.pdf [citado: Agosto 23 de 2011] [ Links ]
[7] Wang. P., Singh, V., Xu, L., Johnston, D.B., Rausch, K.D. and Tumbleson, M.E., Comparison of Enzymatic (E-Mill) abd conventional Dry-GRing Corn Processing using a Granular starch Hydrolysing Enzyme. Cereal Chemistry, 82 (6), pp. 734-738, 2005 [ Links ]
[8] Shing, V., Johnston, D.B., Naidu, K., Rausch, K.D., Belyeca, R.L. and Tumbleson, M.E., Comparison of modified Dry-gring corn process for fermentation characteristics abd DDGS composition. Cereal Chem. 82, pp. 187-190, 2005 [ Links ]
[9] Wang, P., Singh, V., Xue, H., Johnston,D.B., Rausch, K.D. and Tumbleson, M.E., Comparison of raw starch Hydrolysiing Enzyme with conventional liquefaction and saccharificatiopn Enzymes in Dry*Grinf Corn Processing. Cereral Chemistry, 84 (1), pp. 10-14, 2007 [ Links ]
[10] Bialas, W., Szymonoswka, D. and Grajek, W., Fuel ethanol production from granular corn starch using saccharomyces cerevisiae in a long term repeated SSF process with full sitillage recycling. Biosorces Technology,101 (10), 3126-3131, 2010 [ Links ]
[11] Uthomporn, U., Zaidul, I.S.M. and Karim, A.A. Hydrolysis of granular starch at sub-gelatinization temperature using a mixture of amylolitic enzymes. Food and Bioprocessing, 88, pp. 47-57, 2010 [ Links ]
[12] Johnson, R., Padmaja, G. and Moorthy, S.N. Comparative production of glucose and high fructose syrup from cassava and sweet potato root by direct conversion techniques, Innovative Foods Science and E merging Technologies, 10, pp. 616-620, 2009 [ Links ]
[13] Miller, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem. 31, pp. 426-428, 1959 [ Links ]
[14] Shavanas, S., Padmaga, G., Moorthy, S.N., Sajeev, M.S. and Sheriff, J.T., Process optimization for bioethanol production from cassava stach using novel eco-friendly enzymes. Biomass and Bioenergy. 35, pp. 907-909, 2011 [ Links ]
[15] Srichuwong, S., Fujiwara, M., Wang, X., Seyama, T., Shiroma, R., Arakane, M., et al. Simultaneous saccharification and fermentation (SSF) of very haigh gravity (VHG) potato mash forv the production of ethanol, Biomass and Bioenergy, 33, pp. 890-898, 2009 [ Links ]
[16] Sánchez. O.J. y Cardona, C.A., Producción biotecnológica de alcohol carburante I. Obtención a partir de diferentes materias Primas. Interciencia, 30, pp. 671-678, 2005. [ Links ]













