Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353
Dyna rev.fac.nac.minas vol.80 no.179 Medellín May/June 2013
SÍNTESIS DE FERRITAS DE Pb, Cd y Mn VÍA HIDROQUÍMICA: INCIDENCIA DEL ANIÓN Y EL FLUJO DE AIRE
FERRITE SYNTHESIS OF Pb, Cd AND Mn HYDROCHEMICAL ROUTE: EFFECT OF ANION AND THE FLOW OF AIR
ELIAZAR AQUINO TORRES
Dra., Centro de Investigaciones Químicas. Universidad Autónoma del Estado de Hidalgo, Pachuca, Hidalgo. México, eliazar_aquino@yahoo.com.mx
FRANCISCO PRIETO GARCÍA
Dr, Centro de Investigaciones Químicas. Universidad Autónoma del Estado de Hidalgo. Pachuca, Hidalgo. México, prietog@uaeh.edu.mx
CARLOS A. GALÁN VIDAL
Dr, Centro de Investigaciones Químicas. Universidad Autónoma del Estado de Hidalgo. Pachuca, Hidalgo. México, cagalan@uaeh.edu.mx
JOSÉ A. RODRÍGUEZ ÁVILA
Dr, Centro de Investigaciones Químicas. Universidad Autónoma del Estado de Hidalgo. Pachuca, Hidalgo. México, jarodriguez@uaeh.edu.mx
ENRIQUE BARRADO ESTEBAN
Dr.Departamento de Química Analítica, Facultad de Ciencias. Valladolid, España. ebarrado@qa.uva.es
Recibido para revisar Febrero 27 de 2012, aceptado Abril 2 de 2013, versión final Abril 11 de 2013
RESUMEN: No se conocen estudios de los efectos de las sales usadas en las síntesis sobre la estequiometría final de las ferritas de tipo MxFeII(1-x)FeIIIO4 vía hidroquímica. Realizar la síntesis de ferritas de Pb, Cd y Mn en relación 15:1 Fe2+/M2+ variando condiciones del flujo de aire y utilizando nitratos de Pb, Cd y Mn y cloruros de Cd y Mn, ha sido el objetivo del trabajo. Se partió de soluciones de nitratos [Pb(NO3)2; Cd(NO3)2.4H2O y Mn(NO3)2.6H2O] y cloruros [CdCl2.2½H2O y MnCl2.4H2O]. Las estequiometrías conseguidas fueron las mismas (Pb0.04Fe2.96O4, Cd0.06Fe2.94O4, Mn0.12Fe2.88O4) no encontrando dependencia del anión de partida. En las ferritas base ion nitrato, se mostró una tendencia de disminución de Fe2+, con el aumento del flujo de aire. Para las de cadmio y manganeso sintetizadas a partir de cloruro, se observó una disminución mayor de Fe2+ que en las obtenidas a partir de nitratos; probablemente debido a la presencia de Cl- que en medio básico pasa a ClO- y éstos dan lugar a la oxidación de Fe2+ a Fe3+ catalizada por los propios iones Fe2+, Fe3+ y Mn2+. Para la ferrita de cadmio se determinaron contenidos de Fe2+ mayores a los encontrados en las ferritas de manganeso; posiblemente no se oxidó todo el Fe2+ por menor concentración de cloruros (0.018M) que en la de manganeso (0.036M).
PALABRAS CLAVE: ferritas; iones ferrosos; nitratos, cloruros, hipoclorito
ABSTRACT: Studies are not known the effects of the salts used in the syntheses on the final stoichiometry of ferrites of type MxFeII (1-x) FeIIIO4 hydrochemical way. To realise the ferrite synthesis of Pb, Cd and Mn in relation Fe2+/M2+ 15:1 being varied conditions of the air flow and using nitrates of Pb, Cd and Mn and chlorides of Cd and Mn, has been the objective of this work. The secured stoichiometries were the same (Pb0.04Fe2.96O4, Cd0.06Fe2.94O4, Mn0.12Fe2.88O4) not finding dependency of the anion to begin with. On ferrites it bases ion nitrate, was a tendency of diminution of Fe2+, with the increase of the air flow. For those of synthesized cadmium and manganese from chloride, a greater diminution of Fe2+ than in the obtained ones from nitrates was observed; probably due to the presence of Cl- that in the middle basic happens to ClO- and these they give rise to the potential oxidation Fe2+ to Fe3+ catalyzed by the own ions participant Fe2+, Fe3+ and Mn2+ in the synthesis. For the cadmium ferrite smaller contents of Fe2+ to the found ones in cadmium ferrites were determined from nitrates; possibly all the Fe2+ by smaller chloride concentration did not oxidize (0.018M) that in the one of manganese (0.036M) and only incidence the catalytic ion effect Fe2+ and Fe3+.
KEY WORDS: ferrites; ferrous ions; nitrate, chlorides, hypochlorite
1. INTRODUCCIÓN
Las ferritas se obtienen mediante diferentes procesos tales como el cerámico, vía sol-gel, coprecipitación, entre otros [1]. La elección del método de síntesis depende de las características deseadas y adecuadas del sólido para su aplicación. Muchos estudios han estado dirigidos hacia la obtención de ferritas con diversas propiedades físicas y químicas, por ejemplo altas propiedades magnéticas, alta cristalinidad y elevada área superficial. La ruta de síntesis (en particular la razón Fe2+/Fe3+), tiene un rol importante en las propiedades finales de las ferritas [2].
Existe una amplia variedad de factores que pueden ser ajustados en su obtención, por ejemplo para la preparación de nanopartículas de óxidos de hierro con características deseables (tamaño, características magnéticas o propiedades de superficie); se ha demostrado que ajustando parámetros como el pH, fuerza iónica, temperatura, naturaleza de las sales (percloratos, cloruros y nitratos) o la concentración de radio FeII/FeIII se pueden obtener partículas de tamaño entre 2 a 17 nm [3]. En este mismo sentido, Ayyappan y col. [4] estudiaron el efecto del tiempo de digestión sobre el tamaño, distribución y propiedades magnéticas de la ferrita de CoFe2O4 sintetizada por el método de coprecipitación y descubrieron que el tamaño de partícula disminuía de 14 a 19 nm conforme la digestión (pH 1.5, temperatura 90°C y agitación 1000 rpm) aumentaba de 1 a 120 min. Por lo que sugirieron que 1 min de digestión es suficiente para obtener nanopartículas de CoFe2O4 con la pureza y estequiometria correcta [4]. Sin embargo no se conocen estudios acerca de los efectos de las sales usadas en el proceso de síntesis en la estequiometría final de las ferritas de tipo MxFeII(1-x)FeIIIO4 sintetizadas por vía hidroquímica. Realizar la síntesis de ferritas de Pb, Cd y Mn en relación 15:1 Fe2+/M2+ vía hidroquímica variando las condiciones del flujo de aire y utilizando como reactivos nitratos de Pb, Cd y Mn y cloruros de Cd y Mn, ha sido el objetivo de este trabajo.
2. METODOLOGÍA
Se sintetizaron por separado ferritas de Pb, Cd y Mn bajo la metodología reportada y optimizada en trabajos previos [5-7] y que se muestran en la tabla 1.
Se prepararon muestras sintéticas partiendo de sales de los metales en forma de nitratos [Pb(NO3)2; Cd(NO3)2.4H2O y Mn(NO3)2.6H2O] y cloruros [CdCl2.2½H2O y MnCl2.4H2O]. Las disoluciones fueron preparadas a concentración de 1000 mg/L del ion metálico. Se realizaron los cálculos necesarios para obtener las cantidades requeridas de FeSO4.7H2O para obtener la relación molar 15:1 Fe2+/M2+ en cada caso.
El procedimiento de síntesis se llevó a cabo en un reactor de 500 mL conectado a un termostato, se adicionaron 250 mL de la solución de Me2+ en forma de NO3- o Cl-, de se introdujo a la solución un electrodo combinado (vidrio-Calomell) y un sensor de temperatura. La solución se agitó y se mantuvo a 60°C, posteriormente se adicionaron la cantidades de FeSO4.7H2O, luego de su disolución, se agregaron unas gotas de solución de NaOH 2M y se puso en contacto un flujo de aire, se continuó agregando la solución básica hasta ajustar el pH a 10.0±0.2 durante una hora. Transcurrido el tiempo de reacción, la solución se dejó enfriar a temperatura ambiente, posteriormente se filtró a vacío. El sólido se lavó con abundante agua destilada para eliminar los excesos de NaOH y el Na2SO4 que se forman- Posteriormente se secó a 100°C en una estufa por 2h. El resto del agua depurada se neutralizó con HCl hasta un pH entre 6-7.5; quedando dispuesta para su vertido.
Se pesaron 0.1g de muestra de cada ferrita, se disolvieron en 5 mL de HCl y se aforaron a 50 mL. De esta solución primaria se tomaron 5mL y se aforaron a 100 mL para ser analizadas Espectroscopía de Emisión Atómica con plasma acoplado inductivamente (ICP). Para el análisis se utilizó un espectrofotómetro Perkin Elmer Óptima 3000. Por otro lado, se llevó a cabo la determinación de Fe2+ por el método fotocolorimétrico de la 1-10-fenantrolina por espectrofotometría UV-VIS a 510 nm en un equipo Perkin Elmer Instruments Lambda 40 UV/Vis Spectrometer. Se prepararon estándares de Fe2+ en concentración hasta 0.5 mg. Para las determinaciones se tomaron 5mL de la solución primaria se le agregaron 15 mL de H2O, 5mL de solución buffer de acetato de amonio/ácido acético (pH=4.2), 5 mL de solución 1-10-fenantrolina (5x10-3 M) y 1 mL de HCl concentrado y posteriormente se aforaron a 50 mL.
3. DISCUSIÓN DE RESULTADOS
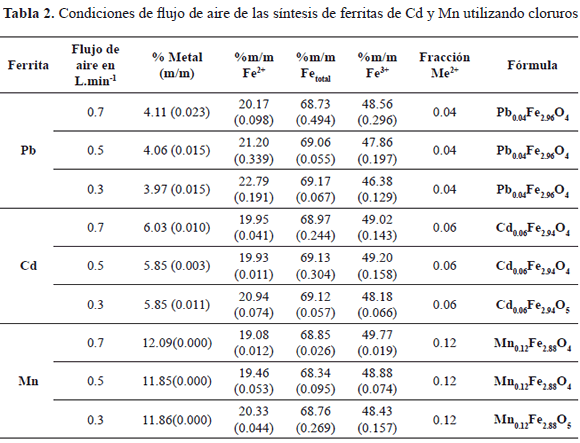
En la tabla 2 se muestran los porcentajes de Fe (total), Fe2+, Fe3+, Pb2+, Cd2+ y Mn2+ contenidos en cada ferrita obtenidas a partir de nitratos y a flujos de 0.3, 0.5 y 0.7 L.min-1 y calculados según se ha reportado [5-8]. Conociendo el porcentaje de cada elemento en las ferritas de Pb, Cd y Mn se determinó la estequiometria de las mismas, observándose la misma estequiometria para las tres ferritas de cada metal (con base al contenido de Fe total). Sin embargo se observó que varían en el contenido de Fe2+, esto debido a las condiciones de flujo de aire; a mayor flujo de aire existe menor cantidad de Fe2+, ya que la oxidación parcial a Fe3+ durante el proceso de síntesis se ve incrementada a mayor cantidad de oxígeno. La cantidad de metal incorporado (Pb, Cd y Mn) es igual en las tres ferritas de cada metal para las tres condiciones de flujo de aire, es decir, no se aprecian variaciones significativas.
En la figura 1 se muestra como el contenido de Fe2+ disminuye conforme el flujo de aire aumenta. Se puede notar que en la ferrita de plomo en un flujo de aire de 0.3 L.min-1 tiene mayor contenido de Fe2+ en comparación a la de cadmio y está a su vez tiene mayor Fe2+ que la de manganeso, la misma tendencia es observada en 0.5 y 0.7 L.min-1. Esto índica que el manganeso sustituye con mayor facilidad el Fe2+ en la ferrita, debido a su tamaño de radio iónico que es menor en comparación a los tamaños de los iones cadmio y plomo y es a su vez similar al del Fe2+. Los sitios que ocupan estos iones metálicos son los octaédricos, es decir sustituyen a los iones Fe2+ que ocupan estas posiciones en la espinela inversa lo que concuerda con lo reportado en las bibliografías consultadas [9].
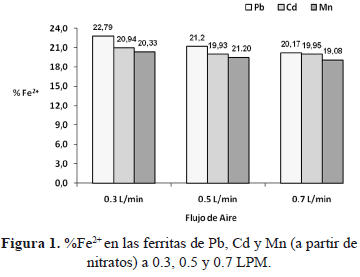
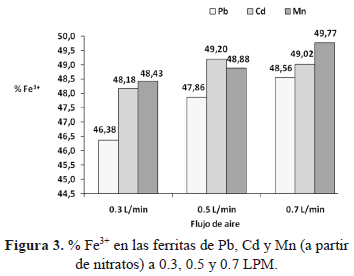
Esto es explicado aplicando la teoría de estabilización del campo cristalino y el desdoblamiento energético de los orbitales "d" (D) en un campo octaédrico o tetraédrico y calculando las energías de estabilización de los respectivos campos cristalinos (EECC). Se puede observar en la figura 2, los cálculos para el ion Fe2+, el cual no muestra preferencia por ninguna de las posiciones antes indicadas, resultando que la energía requerida para su estabilización en cualquier campo cristalino es la misma, EECC= 2/5 D0. Para el Mn2+ (3d5) por su parte, se requiere menor energía (EECC = 0 D0) para su estabilización en un campo cristalino octaédrico. De manera similar sucede para los iones Cd2+ (4d10) y Pb2+ (5d10). Esto permite atribuir que en efecto la orientación preferencial de estos iones, es hacia el octaedro [10-11], de donde es sustituido el Fe2+. En la figura 3 se presenta el contenido de Fe3+ con respecto al flujo de aire en las ferritas sintetizadas.
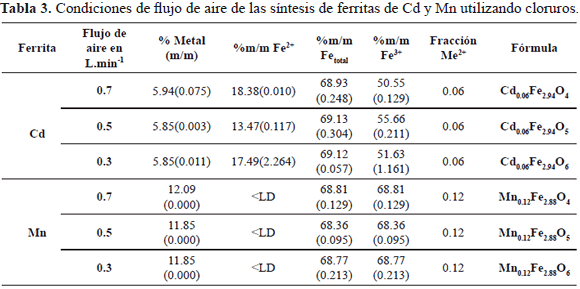
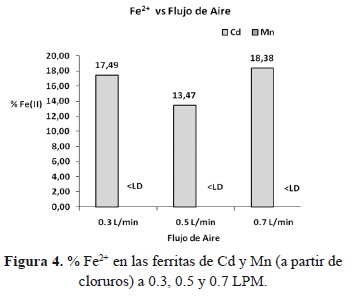
Para las ferritas sintetizadas a partir de las sales de cloruro de Cd2+ o Mn2+, se exponen los valores obtenidos en la tabla 3. El % de Cd y Mn incorporado en estas ferritas es similar al incorporado en las ferritas que se obtuvieron por sales de nitrato. Presentan la misma composición estequiométrica, pero el contenido de Fe2+ es distinto. En la ferrita de cadmio se observa que el contenido de este metal es ligeramente menor y no disminuye en cuanto aumenta el flujo de aire (figura 4). En la ferrita de manganeso el Fe2+ es menor al límite de detección (LD), es decir todo el Fe2+ se oxidó a Fe3+.
La ausencia de Fe2+ en la ferrita de manganeso a partir de cloruros probablemente se deba a que el Cl2 así como los otros halógenos puede oxidarse y reducirse a sí mismo en medio básico, en lo que se conoce como el fenómeno de dismutación. La ecuación (1) es dependiente del pH, en tanto que la ecuación (2) no lo es, resultando el proceso total en la ecuación (3) [12].
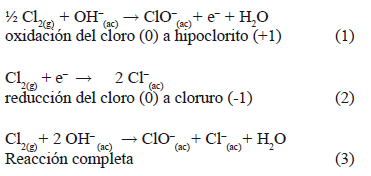
Al analizar la ecuación (2) en el sentido de la oxidación de iones Cl- (ecuación 4), es factible explicar que en Potenciales redox Cl- a Cl2 en medio fuertemente básico (pH=10.00 ± 0.20) se formen pequeñas cantidades de Cl2 que queden disueltas en el medio acuoso y que a su vez se oxidan rápidamente a ion hipoclorito (ecuación 5) dando una reacción total de oxidación de iones cloruro en medio básico hasta iones hipoclorito (ecuación 6):
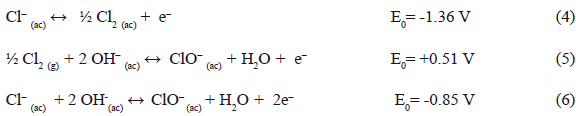
Puede considerarse que la formación de ClO- es catalizada por la propia presencia de los iones Fe2+ (los cuales son agregados durante la síntesis de las ferritas) y esto coincide con lo señalado por Brown y Salle [13]. La ecuación (6) en forma invertida regenera los iones cloruros iníciales tras la reducción de los iones hipoclorito (ecuación 7) a expensa de la oxidación de los iones Fe2+ (ecuación 8). La ecuación (9) representa el proceso total que permite explicar las bajas concentraciones de Fe2+ en la formación de ferritas de metales al partir de sales en forma de cloruros en función de la espontaneidad [14]:
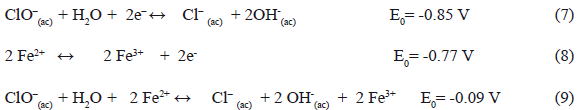
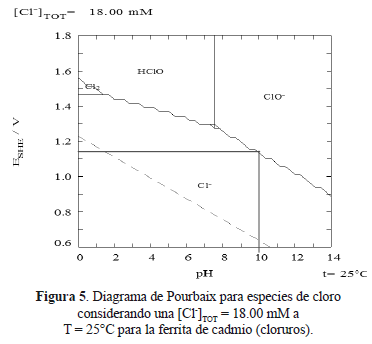
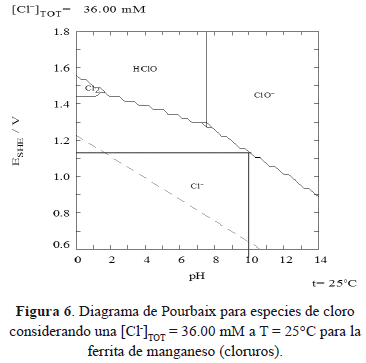
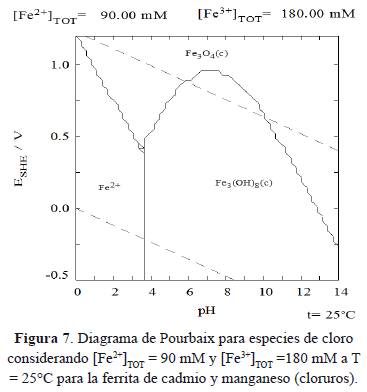
De la reacción anterior (9) se puede entender que el ión Fe2+ que fue sustituido por el ión Me2+ (Cd2+ y Mn2+ en este caso) durante la formación de la ferrita, es oxidado a ión Fe3+ y con ello se reduce la potencial formación de magnetita (Fe3O4) y predeciblemente dando lugar a la formación de gohetita (FeOOH). Según el diagrama de Pourbaix para las especies de cloro (figuras 5 y 6, según concentración de Cl- en la ferrita de Cd2+ y Mn2+, respectivamente) se puede apreciar la potencialidad del equilibrio representado en la ecuación (6) [15]. En combinación con el diagrama de Pourbaix para las especies de hierro de la figura 7 se puede entender la ecuación 9.
Es posible que para el caso de la ferrita de manganeso, el ion Mn2+ actué inicialmente como catalizador junto al ion férrico formado [16-17], lo que explicaría que cinéticamente ocurra la ecuación (4) a mayor velocidad debido a la formación de Cl2 disponible, por tanto a mayor concentración de ClO- (ecuación 5) y mayor potencialidad de oxidación de los iones Fe2+ a Fe3+. Esto podría explicar una probable formación de una ferrita de manganeso de tipo MnxFe(III)3-xO4; es decir en ausencia de Fe2+.
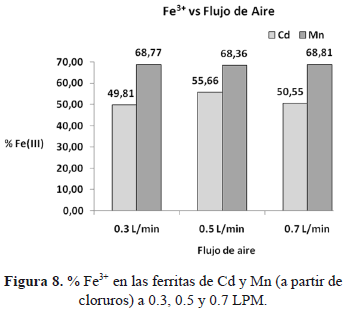
Finalmente podemos observar en la figura 8 los contenidos de Fe3+ en las ferritas de cadmio y manganeso a los diferentes flujos de aire. Para la ferrita de cadmio el % Fe3+ varia significativamente sin seguir una tendencia clara. Por otro lado, la ferrita de manganeso el % Fe3+ es prácticamente igual al Fetotal determinado por ICP.
4. CONCLUSIONES
Se sintetizaron ferritas de plomo cadmio y manganeso para evaluar la incidencia de los aniones nitrato y cloruro bajo condiciones optimizadas previamente, sin embargo se variaron las condiciones de flujo de aire y el anión en la sal de partida. En las ferritas de plomo, cadmio y manganeso del ion nitrato, se mostró una tendencia de disminución de Fe2+, con el aumento del flujo de aire de 0.3 a 0.7 LPM. Para las ferritas de cadmio y manganeso sintetizadas a partir de las sales de cloruro, se observó una disminución mayor de Fe2+ que en las ferritas obtenidas a partir de nitratos. Probablemente debido a la presencia de cloruros que en medio básico pueden convertirse a ClO- y éste de lugar a la oxidación potencial Fe2+ a Fe3+ catalizada por los propios iones Fe2+, Fe3+ y Mn2+ participantes en la síntesis. Para la ferrita de cadmio se determinaron contenidos de Fe2+ menores a los encontrados en las ferritas de cadmio a partir de nitratos, posiblemente no se oxidó todo el Fe2+ ya que había una menor concentración de cloruros (0.018M) que en la ferrita de manganeso (0.036M) y sólo se considera el efecto catalítico de iones Fe2+ y Fe3+ (ausentes en este caso los iones Mn2+). Se puede concluir que el cambio de las soluciones de nitrato a cloruro de cadmio y manganeso en la síntesis de ferritas metálicas de tipo MxFe3-xO4 por vía hidroquímica, tiene un efecto en la disminución de Fe2+ mayor que en las ferritas obtenidas por sales de nitrato. Este hecho fue más notable en la ferrita de manganeso, en la cual se observó que prácticamente todo el Fe2+ se oxidó a Fe3+.
REFERENCIAS
[1] Morán, E., Blesa, M. C., Medina, M. E., Tornero, J. D., Menéndez, N. and Amador, U., Nonstoichiometric Spinel Ferrites Obtained from a-NaFeO2 via Molten Media Reactions, Inorg. Chem., 41(23), pp 5961-5967, 2002. [ Links ]
[2] Sivakumar, M., Takami, T., Ikuta, H., Towata, A., Yasui, K., Tuziuti, T., Kozuka, T., Bhattacharya, D. and Lida, Y., Fabrication of Zinc Ferrite Nanocrystals by Sonochemical Emulsification and Evaporation: Observation of Magnetization and Its Relaxation at Low Temperature, J. Phys. Chem. B., 110(31), pp. 15234-15243, 2006. [ Links ]
[3] Laurent, S., Forge, D., Port, M., Roch, A., Robic, C., Elst, L.V. and Muller, R. N., Magnetic Iron Oxide Nanoparticles: Synthesis, Stabilization, Vectorization, Physicochemical Characterizations, and Biological Applications, Chem. Rev., 108(6), pp. 2064-2110, 2008. [ Links ]
[4] Ayyappan, S., Philip, J. and Raj, B., Effect of Digestion Time on Size and Magnetic Properties of Spinel CoFe2O4 Nanoparticles, J. Phys. Chem. C., 113(2), pp. 590-596, 2009. [ Links ]
[5] Prieto, F., Rodríguez, J. A., Castañeda, A. y Barrado, E., Síntesis hidrotermal de ferritas de plata. Una opción para depurar aguas residuales y recuperar plata en la industria minera. Rev. LatinAm. Met. Mat., 22(2), pp. 26-37, 2002. [ Links ]
[6] Prieto, F., Sánchez, F., Méndez, M. A., García, G. y Gordillo, A. J., Obtención y caracterización de ferritas de manganeso por mecanosíntesis. Boletín de la Sociedad Geológica de México, 59(1), pp.125-132, 2007. [ Links ]
[7] Barrera, G., Prieto, F., Méndez, M. A., Bolarín, A. M. y Sánchez, F., Obtención por vía hidroquímica de ferritas de manganeso, Revista Lat Amer de Met y Mat. Venezuela, 27(2), pp. 95-105, 2007. [ Links ]
[8] Prieto, F., Gordillo, A. J., Rivera, E. y Méndez, M. A., Evaluación de ferritas de Níquel y Manganeso obtenidas por mecanosíntesis. Revista DyNA, Revista de la Facultad de Minas. Universidad Nacional de Colombia, 158, pp. 55-68, 2009. [ Links ]
[9] Li, F., Liu, J., Evans, D. G. and Duan, X., Stoichiometric Synthesis of Pure MFe2O4 (M= Mg, Co, and Ni) Spinel Ferrites from Tailored Layered Double Hydroxide (Hydrotalcite-Like) Precursors, Chem. Mater., 16 (8), pp. 1597-1602, 2004. [ Links ]
[10] Rohrer, G. S. Structure bonding in crystalline materials, Cambridge University Press, 2001, p. 306. [ Links ]
[11] Silberberg, M. S. Chemistry: The Molecular Nature of Matter and Change. New York: Mc Graw Hill Company, 1028-1034, 2006. [ Links ]
[12] http:/www.oaq.uba.ar/Labescuela/Exp-10.htm, (consultada el 25-03-2009) [ Links ]
[13] Brown, Glenn; Sallee, Eugene M., Química cuantitativa, Editorial Reverte, p. 322, 1977. [ Links ]
[14] Alonso, M. G., Arnaud, M. R. y Rojas, R., Higiene y Sanidad Ambiental, 4: pp. 98-105, 2004. [ Links ]
[15] Schweitzer, G. K. and Pesterfield, L. L., The aqueous chemistry of the elements, Oxford University Press Inc. 2010 [ Links ]
[16] Herranz, T., Rojas, S., Ojeda, M., Prez-Alonso, F. J. P. Terreros, K., Pirota, J. L. and Fierro, G., Fe-Mn Mixed Oxides Prepared by Microemulsion, Chem. Mater., 18(9), 2364-2375, 2006. [ Links ]
[17] Wu, Z., B. Jiang, Y., Liu, H. and Wang, R., Jin, Study of Manganese/Titania-Based Catalysts for Low-Temperature Selective Catalytic Reduction of NO with NH3, Environ. Sci. Technol., 41(16), pp. 5812-5817, 2007. [ Links ]