Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
DYNA
versão impressa ISSN 0012-7353
Dyna rev.fac.nac.minas vol.80 no.181 Medellín set./out. 2013
INFLUENCIA DE LA INCORPORACIÓN DE UN CO-MONÓMERO ALCALINO E HIDROXIAPATITA EN LAS PROPIEDADES DE CEMENTOS ÓSEOS ACRÍLICOS
INFLUENCE OF ALKALINE CO-MONOMER AND HYDROXYAPATITE ON THE PROPERTIES OF ACRYLIC BONE CEMENTS
KAREN LOZANO
Ing. Universidad del Valle, Colombia, kajeloni@hotmail.com
JOSE MINA
Dr. Universidad del Valle. Colombia, jose.mina@correounivalle.edu.co
FABIO ZULUAGA
Dr. Universidad del Valle, Colombia, hector.zuluaga@correounivalle.edu.co
CARLOS VALENCIA
Esp. Departamento de Odontología, Universidad del Valle, Colombia, carvalenc@gmail.com
MAYRA VALENCIA
MSc. Universidad de San Buenaventura, Colombia, mevalencia@usbcali.edu.co
Recibido para revisar Diciembre 04 de 2012, aceptado Mayo 17 de 2013, versión final Agosto 27 de 2013.
RESUMEN: Se formularon cementos óseos acrílicos utilizando una relación sólido / líquido de 2. El componente líquido se basó en metacrilato de metilo (MMA), como monómero y dimetil-p-toluidina (2.5%) como acelerador; a su vez, el componente sólido consistió en perlas de polimetacrilato de metilo (PMMA) como carga, sulfato de bario como agente radiopaco y peróxido de benzoilo (2%) como iniciador. Finalmente, una hidroxiapatita como carga bioactiva y un metacrilato de dimetil amino etilo (DMAEM) como co-monómero alcalino, fueron incorporados en diferentes porcentajes (0-20% p/p, para el primero y 0-10% p/p, para el segundo). Como era de esperarse, las muestras elaboradas con las formulaciones de cementos óseos acrílicos sin modificar, presentaron calores de reacción elevados (>80ºC) y una resistencia a la compresión (124.0 MPa) por encima de lo especificado en la norma ISO 5833. Con la incorporación de la hidroxiapatita y el co-monómero alcalino, se presentaron bajas temperaturas de polimerización, bajos módulos y resistencias mecánicas, así como la fijación de una capa similar a la apatita biológica en la superficie del material después de su inmersión por 30 días en un fluido biológico simulado.
PALABRAS CLAVES: Cemento óseo, regeneración ósea, co-monómeros alcalinos, Hidroxiapatita, pruebas in vitro.
ABSTRACT: Acrylic bone cements with a solid/liquid 2/1 ratio were formulated. Methyl methacrylate (MMA) was the liquid monomer and 2.5% dimethyl-p-toluidine was the accelerator. The solid component included poly(methylmethacrylate) as load, PMMA, Barium sulfate as radio opaque agent, and 2% benzoyl peroxide as initiator. Finally, hydroxyapatite as bioactive load, and dimethyl amino ethyl methacrylate (DMAEM) as alkaline co-monomer, were incorporated into the material in different percentages (0-20% w/w for the first one and 0-10% for the latter). As expected, the samples prepared from the above formulations presented high reaction temperatures (>80ºC) and high resistance to compression (124.0 MPa) above those specified by ISO 5833 standard. An increase in the percent of hydroxiapatite and alkaline co-monomer lead to low polymerization temperatures, low modules and low mechanical resistance, as well as a deposition of a dense layer similar to biological apatite on the surface of the material after being dipped in a simulated biological fluid for 30 days.
KEY WORDS: Bone cements, bone regeneration, alkaline co-monomers, hydroxyapatite, in vitro tests
1. INTRODUCCIÓN
Desde hace algunos años, se viene dando una tendencia creciente en la búsqueda y empleo de materiales para la reparación y sustitución temporal o permanente de porciones dañadas de tejido óseo. Esto es debido principalmente a los inconvenientes asociados al uso de los diferentes tipos de injertos de hueso tales como, intervenciones quirúrgicas complejas y costosas, largos períodos de recuperación y la exposición a infecciones por parte del paciente. Entre estos materiales alternativos se encuentran los cementos óseos acrílicos, los cuales son polímeros que se utilizan mayoritariamente en cirugía ortopédica con el objetivo de fijar prótesis articulares. Estos cementos se utilizan no solo como relleno entre la prótesis y el hueso sino que también proporcionan un medio para transferir cargas mecánicas [1, 2].
A pesar de lo anteriormente comentado, es un hecho conocido que los cementos óseos acrílicos disponibles comercialmente poseen desventajas como: altos calores de reacción, nula biocompatibilidad e inadecuadas propiedades mecánicas (generalmente son materiales frágiles). Los altos calores de reacción pueden originar necrosis en el tejido óseo mientras que la falta de biocompatibilidad y las inadecuadas propiedades mecánicas, pueden conducir al aflojamiento del implante (prótesis) [3, 4]. Sin embargo, hay que destacar que estos polímeros presentan propiedades físicas, químicas y otras de índole práctico que los hacen atractivos para estas aplicaciones [1]. Es por ello que los estudios actuales están encaminados a crear nuevas formulaciones de cementos óseos que incluyan en su composición materiales elastoméricos, fibras sintéticas, co-monómeros hidrofílicos, activadores de baja toxicidad y/o cerámicas biocompatibles (hidroxiapatita - HA), para mejorar la bioactividad [5, 6, 7, 8, 9]. La HA es el principal componente inorgánico del tejido óseo y uno de los materiales de mayor biocompatibilidad con el hueso, por lo que no provoca reacción de rechazo al ser implantada, de ahí el gran interés despertado por ese tipo de cerámicas. Los efectos de su adición sobre las propiedades mecánicas, térmicas y biológicas del cemento óseo acrílico es un fenómeno bien conocido y se ha logrado determinar en la mayoría de las investigaciones que algunas de las formulaciones de estos compuestos presentan un desempeño mecánico que cumple con la norma de interés (ISO 5833), logrando conservar la biocompatibilidad característica de la HA [10, 11, 12].
Por otro lado, en trabajos previos se ha demostrado que la incorporación de co- monómeros con grupos amino a las formulaciones de cementos óseos conduce a una mejora en la biocompatibilidad del material, debida a que las células generadoras de hueso (osteoblastos) se depositan y proliferan mejor en superficies parcialmente hidrófilas cargadas positivamente, como las generadas por la protonación de los grupos amino del co-monómero [4, 13, 14]. A pesar de lo anterior, no se han reportado hasta el momento, investigaciones en las que se estudie el comportamiento in vitro de la incorporación del metacrilato de dimetilamino etilo (DMAEM) en compuestos de cementos óseos reforzados con Hidroxiapatita. Siendo comercialmente el DMAEM, uno de los comonómeros alcalinos de menor costo.
Con lo expuesto anteriormente, este trabajo tiene como objetivo principal evaluar la temperatura y tiempo de curado, la cantidad de monómero residual y la resistencia a la compresión de cementos óseos acrílicos modificados con el co-monómero metacrilato de dimetilamino etilo (DMAEM) e hidroxiapatita (HA). Además, se estimará el comportamiento biológico de estos compuestos mediante pruebas in vitro llevadas a cabo por inmersión del material en un fluido biológico simulado. Con el estudio realizado se busca plantear una alternativa para poder aumentar la bioactividad y mejorar la biocompatibilidad del cemento óseo, promoviendo el crecimiento de tejido óseo en el material y de esta forma tratar de mejorar la adhesión cemento - hueso.
2. METODOLOGÍA EXPERIMENTAL
2.1. Materiales
La fase sólida de los cementos estuvo compuesta por perlas de polimetacrilato de metilo (PMMA) adquiridas en Veracril® (New Stetic), con un tamaño de partícula de 63.6 mm; el peróxido de benzoilo (BPO), 97% peso seco y el sulfato de bario (BaSO4) precipitado, con una pureza del 99%, fueron de la marca Alfa Aesar®, (Johnson Matthey Company); la Hidroxiapatita comercial de referencia Emprove Eh EUR, BP E341 presentó un diámetro medio de 7.7 mm, una relación calcio - fosforo (Ca/P) de 1.54, una pureza >96% y fue adquirida en Merck. La fase líquida se preparó con metacrilato de metilo (MMA) estabilizado para síntesis, con una pureza >99%, ?20°C=0.942 g/cm3, M=100.12 g/mol; metacrilato del 2-(dimetilamino etilo) (DMAEM), estabilizado con éter monometílico de hidroquinona, 99% de pureza, M=157.21 g/mol, ?20°C=0.930 g/cm3, y N.N-dimetil- p-toluidina (DMPT) para síntesis, pureza >99%, ?20°C=0.935 g/cm3, M=135.21 g/mol; estos últimos componentes fueron adquiridos en Merck.
2.2. Diseño experimental
En esta investigación se utilizó un modelo de superficie de respuesta para evaluar la influencia del contenido de la hidroxiapatita (HA) y el co-monómero en las propiedades físico-químicas y mecánicas de los cementos óseos. El intervalo en el que se estudió cada componente fue de 0 a 21% p/p para la HA y de 0 a 10% p/p para el DMAEM, estos valores fueron elegidos con base en resultados reportados en trabajos anteriores [4,15]; cabe resaltar que en todos los casos se mantuvo constante el BPO (2% p/p) en la fase sólida y la DMPT (2.5 %p/p) en la fase líquida. Con ayuda del paquete estadístico Minitab 15®, se construyó y analizó el modelo de superficie de respuesta para las variables anteriormente definidas. Este diseño se presenta en la Tabla 1.
2.3. Preparación de los cementos
De acuerdo con las proporciones de cada uno de los componentes, establecidas en el diseño de experimentos previo, se prepararon los cementos óseos acrílicos con el co-monómero y la HA. Para tal efecto, en primer lugar se dosificaron los componentes líquidos (MMA + co-monómero + DMPT) y sólidos (PMMA + BPO + BaSO4 + carga) en recipientes separados, y luego se mezclaron ambas fases, teniendo cuidado de incorporar el componente líquido a la fase sólida, manteniendo siempre una relación sólido/líquido de 2. Previo a la realización de la mezcla manual de las fases, ambos componentes fueron mantenidos a 23±2ºC durante 2 horas aproximadamente.
2.4. Prueba de curado
Después de su mezclado manual, se introdujeron 25 g de cemento en un molde cilíndrico de teflón con una cavidad interna de 42 mm de diámetro y 15 mm de altura. La prueba se realizó a una temperatura de 23°C (norma ASTM F451), la muestra al interior del molde alcanzó una altura aproximada de 13 a 14 mm. La toma de datos se inició inmediatamente después de la mezcla de los dos componentes y se finalizó al alcanzarse la temperatura máxima en el material. La temperatura de curado se determinó a partir del modelo presentado en la ecuación 1, propuesta en la norma ISO5833, 1992.
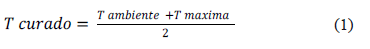
Por otra parte, el tiempo de curado se estimó a partir de los gráficos de temperatura vs tiempo, definiéndose como aquel tiempo que le correspondió a la temperatura de curado.
2.5. Resistencia a la compresión
El ensayo de compresión se realizó en una máquina de ensayos universales INSTRON modelo 3369, con una celda de carga de 5 kN, a una rapidez de desplazamiento entre mordazas de 20 mm/min de acuerdo con lo estipulado en la norma ISO 5833. Las probetas utilizadas fueron cilindros de 6 mm diámetro y 12 mm de altura; para efectos del análisis se reportó el promedio de 6 cilindros ensayados; las variables respuesta fueron la resistencia máxima y el módulo de elasticidad a compresión.
2.6. Monómero residual
El ensayo de resonancia magnética nuclear protónica (1H-RMN) se llevó a cabo a temperatura ambiente y a una frecuencia de 400.13 MHz, en un equipo de resonancia magnética nuclear BRUKER usando tetrametilsilano (TMS) como referencia interna. Las muestras de MMA, PMMA, DMAEM, cemento óseo sin modificar y de las formulaciones con HA y DMAEM, después de 7 días de curado, fueron mezcladas con cloroformo deuterado (CDCl3) hasta su completa disolución. El porcentaje de monómero residual (MR) del cemento óseo se determinó mediante la integración de las señales de los protones metoxilo del metacrilato de metilo (MMA) y del polimetacrilato de metilo (PMMA). Las señales de los protones metilo del Metacrilato del 2- (dimetilamino etilo) (DMAEM), no se pudieron integrar debido a que la cantidad que se incorporó en el cemento óseo de este co-monómero fue muy pequeña y no se logró identificar en el espectro en la posición referenciada en trabajos previos [16]. La ecuación 2 fue empleada para el cálculo del MR.

2.7. Inmersión en un fluido biológico simulado (FBS)
Para estimar la posible interacción de los cementos con el medio fisiológico, se sumergieron 3 réplicas del material sin modificar y modificado con HA y DMAEM en un FBS durante 30 días. El FBS cuya composición iónica es similar a la del plasma sanguíneo humano, fue preparado según la formulación planteada por Kim et al. [17]. La relación: volumen de FBS/área de cemento empleada en el estudio fue de 10 ml/cm2. Los especímenes de ensayo se sumergieron en un volumen adecuado del FBS (57 ml por probeta) a una temperatura de 23 ± 2°C. A los 30 días se extrajeron los especímenes del FBS, se lavaron con agua destilada y se secaron suavemente con aire caliente, quedando dispuestos para su posterior observación por medio de microscopia.
2.8. Microscopia Electrónica de Barrido (SEM)
La superficie de los cementos después de su inmersión en el FBS, se observó en un microscopio electrónico de barrido JEOL SEM modelo JSM - 6490LV; las muestras fueron recubiertas previamente con oro para garantizar su conductividad. El equipo SEM se acopló a un sistema de micro-análisis químico por espectroscopía de energía dispersiva (EDS) para el análisis cualitativo y semicuantitativo de la composición química de las muestras. Es importante resaltar que para efectos de análisis en los resultados de la espectroscopía de energía dispersiva (EDS) se reportó el promedio de 6 mediciones en cada una de las muestras que se analizaron.
3. RESULTADOS Y DISCUSIÓN
3.1. Prueba de curado
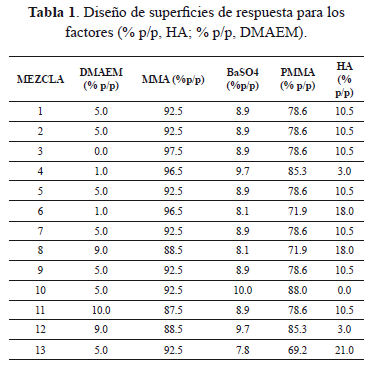
La superficie de contorno correspondiente al tiempo de curado (tc) de los cementos óseos con HA y DMAEM se presenta en la Figura 1. La norma estándar para cementos de resina acrílica (ISO5833, 1992), establece que la temperatura máxima alcanzada por los cementos óseos durante el curado debe ser menor a 90±5ºC y que el tiempo de curado de éstos debe estar entre 3 y 15 minutos.
De acuerdo con la Figura 1, el tiempo de curado del cemento resultó ser mayor a 6.4 minutos, cuando el contenido de HA se encontró entre 3 y 14%, y el contenido de co-monómero entre 0 y 3%. Es posible que éste comportamiento sea consecuencia de la disminución en la velocidad de polimerización, ya que en un sistema tan heterogéneo como el cemento óseo, la disponibilidad de los monómeros puede ser alterada por su distribución entre las fases [18]; además, al existir poca compatibilidad entre la carga cerámica y el medio orgánico, se dificulta el mezclado entre las dos fases y de esta manera se retrasa el inicio del proceso de polimerización [19]. Por otra parte, para porcentajes de co-monómero superiores al 9% el tiempo de curado obtenido fue menor a 3.2 minutos, independientemente de la cantidad de HA incorporada; es decir que solo se pueden emplear porcentajes de co-monómero menores a este valor, para que los tiempos de curado cumplan con las especificaciones establecidas por la norma de interés (ISO5833). Lo anterior indica que en la medida que disminuye el contenido de MMA (aumenta el contenido de DMAEM) la cantidad de HA produce una variación casi despreciable en el tc del cemento óseo. En este sentido, se puede inferir que la HA no afecta drásticamente la velocidad de polimerización del DMAEM, pero si la del MMA.
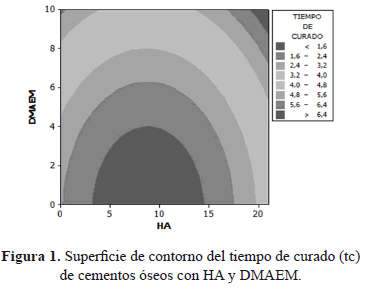
La temperatura máxima de curado (TMax) de los cementos óseos con HA y DMAEM se presenta en la Figura 2. Aquí se puede observar que para porcentajes de co-monómero menores a aproximadamente 1.5%, la temperatura de curado fue mayor a los 80ºC; también se aprecia que a medida que aumenta la cantidad de co-monómero, la temperatura disminuye considerablemente hasta alcanzar valores de aproximadamente 30ºC.
De acuerdo con los resultados obtenidos, es posible afirmar que la incorporación del co-monómero si influyó en la disminución de la temperatura máxima generada en la reacción, siendo este comportamiento similar al encontrado por otros autores [15] quienes para cementos modificados, reportaron la consecución de menores temperaturas de polimerización debidas a la incorporación de un co-monómero alcalino. Esta disminución se puede deber a que la reactividad del iniciador de la reacción de polimerización decrece debido a la formación de una sal del ácido benzoico, a partir de la amina alifática básica, la cual llega a retardar considerablemente la descomposición del peróxido [20]. En la superficie de contorno de la Figura 2 se observa que la HA no influye de manera marcada en la disminución de la temperatura máxima de curado para contenidos inferiores al 10%, puesto que las líneas de contorno tienden a ser perpendiculares al eje de la variable DMAEM; para porcentajes superiores a este 10% la HA genera una caída apreciable en la TMax. Esta disminución de la temperatura se debe, principalmente, a que la carga cerámica actúa como un núcleo absorbente del calor generado por la reacción de polimerización y evita que se disipe hacia el medio circundante [15, 21, 22].
3.2. Ensayo de Compresión.
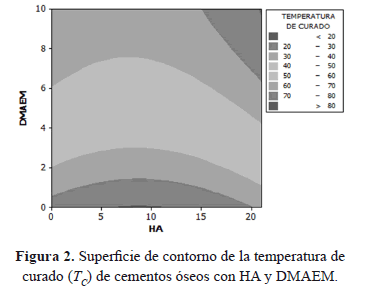
La superficie de contorno correspondiente a los cementos óseos con HA y DMAEM, se presenta en la Figura 3. El requerimiento mínimo establecido en la norma (ISO5833, 1992), para la resistencia a compresión (R.C.) de cementos óseos acrílicos es de 70 MPa.
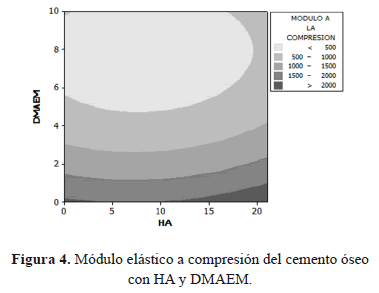
Como se puede observar en la gráfica de contorno, la cantidad de co-monómero influye de manera considerable en la R.C. del material; para porcentajes menores a aproximadamente el 3% de co-monómero, la R.C. es mayor a 70 MPa, a medida que la cantidad de DMAEM aumenta, a valores del orden del 10%, este parámetro mecánico decrece hasta alcanzar valores inferiores a 20 MPa. El comportamiento descrito anteriormente fue similar al reportado en investigaciones previas [4], en las que encontraron que para porcentajes superiores al 6% de DMAEM no se cumple con los valores de R.C. mínimos establecidos en el estándar (ISO5833, 1992), incluso reportaron resistencias por debajo de 20 MPa cuando incorporaron un 10% del co-monómero. Por otro lado, en la superficie de contorno se observa claramente que la HA no influye de manera marcada sobre la R.C., puesto que las líneas de contorno tienden a ser paralelas al eje HA; solo para porcentajes entre el 3 y el 10% la HA tiende a aumentar levemente la R.C.; en algunas investigaciones [23] se ha planteado un aumento en la R.C. a bajas concentraciones de HA (8%), indicando que este comportamiento se debe a que las partículas de HA en bajas proporciones se encuentran homogéneamente distribuidas en la matriz y se comportan como concentradores de carga ayudando a aumentar la resistencia del material. Sin embargo, si la concentración de HA aumenta hasta un 14%, se detecta una disminución en la R.C. debido a que puede ocurrir una distribución no homogénea de la HA, lo que origina agregados de partículas con poca adhesión a la matriz. La superficie de contorno del módulo elástico a compresión (Ec) de los cementos óseos con HA y DMAEM se presenta en la Figura 4.
Aquí se puede observar una tendencia similar a los resultados que se presentaron previamente para la R.C. Cuando la cantidad de co-monómero es superior al 5%, el Ec tiende a disminuir y para porcentajes entre el 5 y el 15% de Hidroxiapatita, éste tiende a aumentar.
Con respecto a la disminución en la resistencia y el módulo a la compresión de los cementos modificados con DMAEM, en algunas investigaciones [4, 25] plantean que este comportamiento se debe a que los copolímeros generados entre el MMA y el co-monómero con grupo amino, durante el proceso de curado del cemento, poseen una temperatura de transición vítrea (Tg) menor que la obtenida en los cementos preparados únicamente con MMA. Lo anterior conduce a que el cemento modificado sea más dúctil y por consiguiente la resistencia y el módulo elástico se vean disminuidos.
3.3. Resonancia Magnética Nuclear Protónica (1H-RMN).
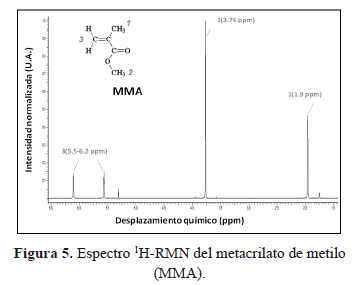
En la Figura 5 se observa el espectro 1H-RMN correspondiente al metacrilato de metilo (MMA), aquí se observan las señales características del MMA producidas por la resonancia de los hidrógenos metilenicos (d= 5.50 - 6.20 ppm, -CH2), metoxilo (d = 3.76 ppm, -OCH3) y metilico (d = 1.90 ppm, -CH3) [5]. La señal más intensa en el espectro, está asociada a los hidrógenos del grupo metoxilo y se utilizará para determinar el porcentaje de monómero residual en el cemento óseo.
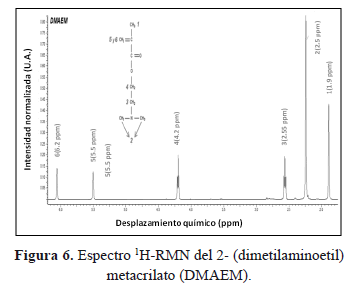
En la Figura 6 se presenta el espectro de 1H-RMN del co-monómero 2-(dimetilaminoetil) metacrilato (DMAEM). La señal a 1.90 ppm corresponde al hidrógeno metilico (-CH3), a 2.25 ppm se sitúan los hidrógenos que pertenecen al grupo -N-(CH3)2, a 2.55 ppm y 4.20 ppm los etilenicos (-CH2), y finalmente a 5.5 ppm y 6.2 ppm se encuentran los vinílicos (=CH2). La señal más intensa en el espectro, correspondiente a los hidrógenos del grupo -N-(CH3)2, se empleará para determinar el porcentaje de monómero residual en el cemento óseo.
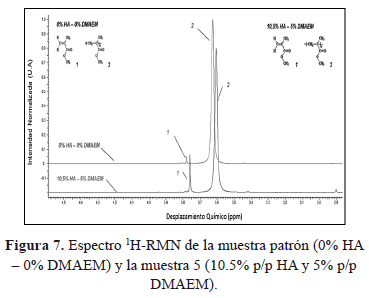
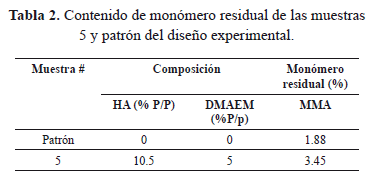
En la Figura 7, se muestra el espectro 1H-RMN de la muestra patrón de cemento óseo que no contiene ni co-monómero ni HA y la muestra 5 que contiene 10.5% p/p HA y 5% p/p DMAEM. En el espectro 1H-RMN de la muestra patrón, la señal en 3.76 ppm corresponde al hidrógeno metoxilo (-OCH3) del MMA y el pico en 3.6 ppm corresponde al grupo metoxilo del PMMA. El desplazamiento de esta señal hacia la izquierda con respecto a la generada por el mismo grupo en el MMA se debe al ambiente químico diferente, dado que en el PMMA el metoxilo hace parte de una macromolécula rodeada de otras macromoléculas que generan un fenómeno de apantallamiento, es decir, que el campo magnético que realmente llega al núcleo es más débil que el campo externo.
Como resultado, se produce una emisión de frecuencias diferentes que producen el desplazamiento de la señal hacia frecuencias mayores (campo alto, lado izquierdo de la gráfica).
El espectro 1H-RMN de la muestra 5 que contiene 10.5% p/p HA y 5% p/p DMAEM, Como se puede observar, es muy parecido al de la muestra patrón; razón por la cual se puede inferir que las condiciones experimentales seguidas no permitieron apreciar la formación del copolímero MMA-DMAEM.
Vale la pena resaltar que algunos autores han reportado la formación de este tipo de copolímeros MMA-DMAEM cuando se incorporan cantidades de DMAEM superiores al 10% p/p (porcentaje más alto utilizado en esta investigación) [16]. Por otro lado, se obtuvo una mayor cantidad de monómero residual MMA (3.45%) cuando fue incorporado aproximadamente un 5% p/p de co-monómero al cemento óseo (ver Tabla 2); este valor resultó ser inferior al 5.6% reportado por Valencia [26] quien utilizó aproximadamente la misma cantidad de DMAEM que la empleada en la presente investigación, y similar a los valores reportados por otros investigadores para diferentes tipos de cementos acrílicos [27, 28].
Con lo anterior se comprueba que la incorporación de DMAEM influye notablemente en la cinética de polimerización del cemento óseo, afectando la reacción del MMA que es el monómero más reactivo.
3.4. Inmersión en un fluido biológico simulado (FBS).
En la Figura 9 se presenta la imagen SEM de la superficie de la muestra patrón, sin co-monómero ni cargas bioactivas, después de su inmersión durante 4 semanas en el fluido biológico simulado. Se pueden observar las perlas de PMMA (círculos claros) sin disolver, rodeadas de una matriz de monómero polimerizado (zonas oscuras).
Algunos autores han mencionado en trabajos anteriores, que la integración incompleta de las perlas de polímero con el monómero se debe a la escasa solubilidad entre los mismos [13]; esto a su vez afecta la resistencia a la tensión como consecuencia de la perdida de adherencia interfacial entre las perlas y la matriz. Lo anterior está de acuerdo con las bajas resistencias a la tensión reportadas previamente. Por otro lado, el micro-análisis químico hecho por espectroscopia de energía dispersiva (EDS) para determinar la composición química de la muestra (0% HA - 0% DMAEM), arrojó que esta última presentaba 61.45% p/p de C, 17.55% p/p de O2, 3.26% p/p de S y 17.17 % p/p de Ba.
En ningún caso se identificó la presencia de P o Ca, lo que sin lugar a dudas demuestra que no se depositó apatita durante la inmersión en el FBS y por tanto el cemento óseo acrílico se caracterizó por ser un polímero con un desempeño nulo, desde el punto de vista de la bioactividad. Este comportamiento se debió fundamentalmente a que la matriz de MMA polimerizado es altamente hidrofóbica, por lo que se reduce el contacto carga - solución y a su vez se dificulta el crecimiento de apatita sobre la superficie.
En algunas investigaciones [3] se ha reportado que la incorporación de co-monómeros con grupos amino, a las formulaciones de cemento óseo, conduce a una mejora en la biocompatibilidad del material ya que las células generadoras de hueso (osteoblastos) se depositan y proliferan mejor en superficies parcialmente hidrófilas cargadas positivamente, como las generadas por la protonación de los grupos amino del co-monómero. Para corroborar lo anterior se decidió sumergir en el FBS la muestra 10, que contenía 5% p/p de 2- (dimetilamino etilo), durante cuatro semanas.
En la Figura 10 se muestra la imagen SEM de la superficie del cemento óseo modificado después de 30 días de inmersión. Como era de esperarse, aquí se pueden identificar aglomerados y pequeñas capas de apatita depositadas desde las primeras semanas, lo que demuestra que el co-monómero efectivamente aumenta la bioactividad del cemento óseo. Al realizar el análisis EDS, se identificó calcio (2.79 % p/p) y fosforo (1.46% p/p) en la superficie del cemento óseo.
En la Figura 11 se muestra la micrografía SEM de la superficie de un cemento óseo con 10.5% p/p de HA, correspondiente al tratamiento número tres del diseño experimental, después de estar sumergido en FBS durante 30 días. Se aprecia la aparición de aglomerados de partículas que presentan una apariencia densa, producto de la formación de nuevas estructuras sobre las partículas de HA iniciales. Algunas zonas de estas capas densas conservan una morfología porosa, la cual tiende a desaparecer con el tiempo.
También se aprecia la presencia de partículas de apariencia esférica formando pequeños cúmulos débilmente condensados; esta nueva capa es la apatita neoformada, semejante a la apatita biológica, formada por el material bioactivo al estar en contacto con el FBS. Con el microanálisis EDS se encontró que la relación Ca/P de la capa neoformada era de 2.95 después de los 30 días de inmersión. Con base en lo anterior, se logró comprobar que el tratamiento estudiado tiene potencialidad para la formación de una nueva capa de apatita sobre su superficie, al ponerse en contacto con el FBS, teniendo en cuenta que la relación Ca/P de la Hidroxiapatita inicial era de 1.54.
4. CONCLUSIONES
Aunque en el presente estudio se demostró que la incorporación del co-monómero, con grupos amino (DMAEM), a las formulaciones de cemento óseo produce una disminución en las propiedades mecánicas (resistencia y módulo) a compresión. Vale la pena resaltar que la presencia de éstos repercute positivamente desde el punto de vista de la bioactividad del material, tal como se pudo observar con los resultados de los ensayos in vitro realizados.
Pese a la naturaleza inorgánica de la HA, su incorporación hasta porcentajes del 15% p/p no afectó de manera significativa las propiedades mecánicas de los cementos óseos trabajados. No obstante, cantidades superiores al valor anterior llegaron a ser la causa principal de una falla prematura en la interface polímero-cerámico y la consecuente disminución del desempeño mecánico del material.
Por su comportamiento bioactivo y buen desempeño mecánico, algunas formulaciones estudiadas son susceptibles de emplear en la fijación de prótesis ortopédicas y/o dentales.
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectoría de Investigaciones de la Universidad del Valle, por el apoyo otorgado en el marco de la Convocatoria Interna para la conformación del banco de proyectos de investigación 2010, así mismo se le agradece al Ingeniero Irvin Castro por las micrografías SEM y a la Dra. Marisol Gordillo por su apoyo en el análisis estadístico.
REFERENCIAS
[1] López, M., y González, R., Cementos óseos acrílicos modificados con hidroxiapatita para implantes óseos. CENIC Ciencias Biológicas, 37, pp. 77-87, 2006. [ Links ]
[2] Lewis, G., Properties of acrylic bone cement: State of the art review. J. of Biomedical Mat. Research, 38, pp. 155-182, 1997. [ Links ]
[3] Planell, J., Ginebra, M., Fernández, E., Khairoun, I., Clément, J. y Gil, F., Nuevas tendencias en dos familias de cementos óseos: acrílicos y basados en fosfatos de calcio. Revista Mexicana de Física, 45 (1), pp. 49-53, 1999. [ Links ]
[4] May-Pat, A., Cervantes-UC, J. y Flores, S., Propiedades Mecánicas de cementos óseos acrílicos preparados con co-monómeros con grupos Amino. IBEROMET XI, 2010. [ Links ]
[5] Pourdeyhimi, B. and Wagner, H., Elastic and ultimate properties of acrylic bone cements reinforced with ultra-high-molecular-weight polyethylene fibers. J Biomed Mater Res, 23, pp. 63-80, 1989. [ Links ]
[6] Pilliar, R., Blackwell, R., Macnab, I. and Cameron, H., Carbon fiber reinforced bone cement in orthopedic surgery. J Biomed Mater Res, 10, pp. 893-906, 1976. [ Links ]
[7] Gilbert, J., Ney, D. and Lautenschlager, E., Self-reinforced composite poly(methyl methacrylate): static and fatigue properties. Biomaterials, 16, pp.1043-1055, 1995. [ Links ]
[8] Artola, A., Gurruchaga M., Vazquez, B., San roma, J. and Goñi, I., Elimination of barium sulphate from acrylic bone cements. Use of two iodine-containing monomers. Biomaterials, 24, pp. 4071-4080, 2003. [ Links ]
[9] Vazquez, B., Deb, S., Bonfield, W., and San Roman, J., Characterization of new acrylic bone cements prepared with oleic acid derivates. J Biomed Mater Res (Appl Biomater), 63, pp. 88-97, 2002. [ Links ]
[10] Garcia, C., Paucar, C., y Gaviria, J., Estudio de algunos parámetros que determinan la síntesis de HA por la ruta de precipitación. Dyna, 73 (148), 9- 15, 2006. [ Links ]
[11] Dalby, M., Di silvio, L., Harper, E. and Bonfield, W., in vitro evaluation of a new polymethylmethacrylate cement reinforced with hydroxyapatite. Journal of Materials Science: Materials in Medicine, 10, 793, 1999. [ Links ]
[12] Vallo, C., Montemartini, P., Fanovich, M., Porto, J. and Cuadrado, T., Polymethylmethacrylate- Based Bone Cement Modified with Hydroxyapatite. J. Biomed. Mater. Res. (Appl. Biomater.), 48, 150 P, 1999. [ Links ]
[13] Cervantes-UC, J., Vásquez, H., Cauich, J., Vázquez, B. and San Román, J., Comparative study on the properties of acrylic bone cements prepared with either aliphatic or aromatic functionalized methacrylates. Biomaterials, 26, pp. 4063-4072, 2005. [ Links ]
[14] Kishida, A., Iwata, H., Tamada, Y. and Ikada, Y., Cell behavior on polymer surfaces grafted with non-ionic and ionic monomers. Biomaterials, 12, 786-pp. 792, 1991. [ Links ]
[15] Islas-Blancas, M., Cervantes, J., Cauich, J., Vargas, R., Vera, R. and Martínez, A., Characterization of bone cements prepared with functionalized methacrylates and hydroxyapatite. J. Biomater. Sci. Polymer Edn, 12 (8), pp. 893-910, 2001. [ Links ]
[16] Camail, M., Essaoudi, H., Margaillan, A. and Vernet, J., Copolymerisation radicalaire de methacrylates de 2-Aminoethyle Avec le Methacrylate de Methyle. Eur. Polym. J., 31, pp. 1119-1125, 1995. [ Links ]
[17] Kim, H., Miyazaki, T., Kokubo, T. and Nakamura, T., Revised Simulated Body Fluid. Key Eng. Material, 47, pp. 192-195, 2001. [ Links ]
[18] Billmeyer, W. Ciencia de los polímeros. Editorial REVERTÉ, S.A. 1975. [ Links ]
[19] Hernández, L., Gurruchaga, M. y Goñi, I., Formulación de cementos bioactivos mediante la adición de sales de Hidroxiapatita-Estroncio. Biomecánica, 16 (1), pp.13-20, 2008. [ Links ]
[20] Brauer, G., Davenport, M. and Hansen, W. Accelerating effect of amines on polymerization of methyl methacrylate. Modern Plastics. 34, pp. 153-168, 1956. [ Links ]
[21] Espigares, I., Elvira, C., Mano, J., Vázquez, B. San román, J., and Reis, R., New partially degradable and bioactive acrylic bone cements based on starch blends and ceramic fillers. Biomaterials, 23, pp.1883-1895, 2002. [ Links ]
[22] Guadarrama, D., Lopez, M. and Brizuela, N. Determinación de propiedades mecánicas y temperatura máxima de polimerización de cementos óseos acrílicos modificados con micro y nanopartículas de hidroxiapatita. Revista Latinoamericana de Metalurgia y Materiales, 31 (1), pp. 91-98, 2011. [ Links ]
[23] Serbetci, K., Korkusuz, F. and Hasirci, N. Thermal and mechanical properties of hydroxyapatite impregnated acrylic bone cements. J. Polym. Test., 145, 25 P, 2004. [ Links ]
[24] Pascual, B., Gurruchaga, M., Ginebra, M., Gil, F., Planell, J., Vazquez, San román, J. and Goñi, I., Modified acrylic bone cement with high amounts of ethoxytriethyleneglycolmethacrylate. Biomaterials, 20, pp. 453-463, 1999. [ Links ]
[25] Cisneros, O., Cauich, J., Cervantes-UC, J., Vásquez, B. and San román, J., Combined influence of barium sulfate content and co-monomer concentration on properties of PMMA bone cements for vertebroplasty. J. Biomaterials Sci., 22, pp. 1563-1580, 2011. [ Links ]
[26] Valencia, M., Caracterización reológica de cementos óseos acrílicos para vertebroplastia y/o cifoplastia preparados con monómeros alcalinos. [Tesis Maestría]. Universidad del Valle, Facultad de Ingeniería, 2005. [ Links ]
[27] Hernández, L., Fernández, M., Collia, F., Gurruchaga, M. and Goñi, I., Preparation of acrylic bone cements for vertebroplasty with bismuth salicylate as radiopaque agent. Biomaterials, 27, pp 100-107, 2006. [ Links ]
[28] Mendez, J., Fernández, M. and Gonzalez, A., Injectable self-curing bioactive acrylic-glass composites charged with specific anti-inflammatory/analgesic agent. Biomaterials, 25, pp. 2381-2392, 2004. [ Links ]