Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353
Dyna rev.fac.nac.minas vol.81 no.185 Medellín May/June 2014
https://doi.org/10.15446/dyna.v81n185.38552
http://dx.doi.org/10.15446/dyna.v81n185.38552
Bioethanol production by fermentation of hemicellulosic hydrolysates of african palm residues using an adapted strain of Scheffersomyces stipitis
Producción de bioetanol por fermentación de hidrolizados hemicelulósicos de residuos de palma africana usando una cepa de Scheffersomyces stipitis adaptada
Frank Carlos Herrera-Ruales a & Mario Arias-Zabala b
a Facultad de Ciencias. Universidad Nacional de Colombia. Colombia. fcherrerar@unal.edu.co
b Facultad de Ciencias. Universidad Nacional de Colombia. Colombia. marioari@unal.edu.co
Received: June 25th, de 2013. Received in revised form: January 22th, 2014. Accepted: February 20th, 2014.
Abstract
Ethanol production using a strain of Scheffersomyces stipitis (Pichia stipitis) adapted to inhibitors of african palm hydrolysates was evaluated. The strain adaptation by cultivations in mediums progressively concentrated with inhibitors after 20 subcultures was achieved. Then the variables orbital agitation, medium volume and inoculum volume were studied for ethanol production, finding that orbital agitation and culture medium volume were significant on maximal ethanol concentration while culture medium volume and inoculum volume were significant on ethanol productivity. Maximal ethanol concentration and yield were 8.48 gl-1 and 0.39 gg-1 achieved with 125 rpm, 6.75x107 cells ml-1 and 140 ml of medium. Maximal ethanol productivity was 0.062 gl-1h-1 achieved with 125 rpm, inoculum of 99.63x107 cells ml-1 and 90 ml of culture medium. Yeast adaptation showed to be and good strategy to produce ethanol from hemicellulosic residues of african palm tree, avoiding the detoxification processes.
Keywords: ethanol; african palm tree; hemicellulosic hydrolysate; Scheffersomyces stipitis.
Resumen
Se evaluó la producción de etanol a escala matraz usando una cepa de Scheffersomyces stipitis (Pichia stipitis) adaptada a inhibidores presentes en hidrolizados hemicelulósicos de palma africana. La adaptación se logró luego de 20 subcultivos en medios progresivamente concentrados en inhibidores. La evaluación de la producción de etanol mostró que la agitación orbital y el volumen de medio influyen significativamente sobre la concentración máxima de etanol, mientras que el volumen del medio y la concentración del inóculo influyen sobre la productividad máxima de etanol. La máxima concentración y rendimiento de etanol fueron 8.48 gl-1 y 0,39 gg-1, respectivamente, alcanzados con 125 rpm, inóculo de 6.75x107 células ml-1 y 140 ml de medio. La productividad máxima fue 0.062 gl-1h-1 alcanzada con 125 rpm, inóculo de 99,63x107 células ml-1 y 90 ml de medio, mostrando que es posible producir etanol a partir de hemicelulosa de palma africana usando la adaptación de cepas.
Palabras clave: etanol; palma africana; hidrolizado hemicelulósico; Scheffersomyces stipitis.
1. Introducción
Actualmente existe un marcado incremento en la demanda energética mundial, la cual se suple en un 87% con el empleo de combustibles fósiles, responsables de la mayoría de emisiones de gases causantes del efecto invernadero [1]. Por tanto, desde hace algún tiempo se han desarrollado estudios enfocados a encontrar nuevas alternativas energéticas, provenientes de fuentes renovables amigables con el ambiente; dentro de éstas están los combustibles provenientes de biomasa como el bioetanol y el biodiesel [2,3]. La producción de biocombustibles se ha visto cuestionada cuando se obtienen a partir de materias primas alimentarias. Debido a ello, los biocombustibles de segunda generación han ganado importancia frente a las formas tradicionales de producción de biocombustibles, ya que optimizan el uso de las materias primas y minimizan el impacto sobre otros sectores alimentarios. En ese sentido, la utilización de residuos agrícolas procedentes del proceso de extracción de aceite de la palma africana resulta atractiva. En este proceso se genera gran cantidad de racimos vacíos conocidos como raquis cuyo contenido hemicelulósico alcanza un 24% del peso seco [4]. Esta hemicelulosa está compuesta principalmente por xilosa, que debido a su abundancia presenta un gran potencial en la producción de etanol por vía fermentativa.
Entre los microorganismos capaces de transformar la xilosa a etanol y que muestran buen potencial fermentativo está Scheffersomyces stipitis (Pichia stipitis) que viene de un grupo de levaduras aisladas de la madera y con la capacidad de utilizar muchos de los azúcares presentes allí. Este microorganismo tiene una prometedora aplicación industrial, ya que fermenta xilosa con un alto rendimiento de etanol y es capaz de fermentar un amplio rango de azúcares, incluyendo glucosa. La manera en que S. stipitis produce etanol o masa celular a partir de xilosa, depende de diversidad de factores entre los cuales se pueden destacar la presencia de inhibidores del crecimiento celular y la cantidad de O2 disponible en los medios de crecimiento. El efecto negativo de inhibidores del crecimiento como furfural, hidroximetilfurfural (HMF), ácido acético y derivados de la lignina puede ser reducido por diferentes estrategias entre las cuales están la adaptación de las cepas microbianas a tales inhibidores por medio de su exposición prolongada a los mismos [5, 6, 7]. Con respecto al efecto del oxígeno, se ha determinado que un alto suministro del mismo sólo produce crecimiento celular y con bajos suministros de oxígeno, conocidos como microaireación, se produce etanol [8, 9]. Se han realizado diversos estudios utilizando S. stipitis en la producción de etanol a partir de materiales lignocelulósicos, mostrando una amplia variabilidad de resultados en función de la naturaleza del material [10, 11]. Este estudio explora la producción de etanol a partir de hidrolizados hemicelulósicos de residuos de raquis de palma africana, determinando la efectividad de un proceso de adaptación de una cepa de la levadura S. stipitis a los inhibidores, así como el efecto de la concentración celular y las variables que intervienen en la transferencia de oxígeno al medio de cultivo, como la agitación orbital y el volumen de medio.
2. Métodos
2.1. Microorganismo e inóculos
Una cepa de S. stipitis donada por la Universidad Federal de Río de Janeiro fue usada en este estudio, la cual se conservó en refrigeración a 4°C en un medio sólido compuesto por xilosa 15 gl-1, extracto de levadura 4 gl-1, peptona 3 gl-1, (NH4)2SO4 2 gl-1, MgSO4.7H2O 0.5gl-1 y agar 20 g l-1. Luego de sometida al proceso de adaptación al hidrolizado hemicelulósico del raquis de palma africana, la cepa se conservó en refrigeración a 4°C en medios sólidos y líquidos compuestos por hidrolizados de raquis de palma enriquecidos con extracto de levadura 4 gl-1, peptona 3 gl-1, (NH4)2SO4 2 gl-1, MgSO4.7H2O 0.5gl-1 y agar 20 gl-1. Luego de sometida al proceso de adaptación al hidrolizado hemicelulósico la cepa se conservó en refrigeración a 4°C en medios sólidos y líquidos compuestos por hidrolizados de raquis enriquecidos con extracto de levadura 4 gl-1, peptona 3 gl-1, (NH4)2SO4 2 gl-1 y MgSO4.7H2O 0.5gl-1.
Se prepararon preinóculos del microorganismo transfiriendo una asada de la levadura a matraces de 100 ml conteniendo 10 ml de medio compuesto por hidrolizado neutralizado de raquis enriquecido. La incubación se realizó durante 48 horas a 30°C con una velocidad de agitación de 150 rpm. A partir de estos medios se prepararon inóculos usando un 10% v/v de preinóculo, transfiriéndolo a matraces de 250 ml con 30 ml de hidrolizado enriquecido y cultivándolos a 30°C y 150 rpm hasta alcanzar concentraciones aproximadas a 9.0 x 108 células ml-1.
2.2 Material lignocelulósico
Racimos vacíos o raquis de palma africana fueron facilitados por el Centro de Investigación de CENIPALMA ubicado en Barrancabermeja, Santander. Una vez en el laboratorio, se sometieron a esterilización a 121°C por 20 minutos. Seguidamente, el material se sometió a un proceso de corte en húmedo en un molino equipado con cuchillas de acero, permitiendo abrir las fibras del raquis facilitando el proceso de secado, el cual se llevó a cabo durante 24 horas en un secador de bandejas con flujo de aire a 60°C. Una vez seco, el material se molió en un molino de cuchillas equipado con un tamiz con orificios de 3 mm de diámetro.
2.3 Hidrólisis ácida
El material lignocelulósico proveniente de la molienda se sometió a hidrólisis ácida con H2SO4 al 2% v/v y temperatura de 121°C durante 30 minutos usando una carga sólido/líquido de 0.2 g ml-1, en matraces de 1 litro [12]. El hidrolizado ácido se filtró para eliminar los restos de celulosa y el filtrado se neutralizó mediante la adición de NaOH y Ca(OH)2 hasta un valor de pH aproximado a 6.0. Se filtró nuevamente y se estableció su pH final en un valor de 6.00± 0.05 con la adición de H2SO4 ó NaOH.
2.4. Adaptación de la cepa
La adaptación de la cepa se llevó a cabo a través del repique continuo de la levadura en medios líquidos aireados por agitación orbital, cuya concentración de hidrolizado hemicelulósico fue incrementada progresivamente. Las fermentaciones de adaptación se realizaron en matraces de 100 ml con 20 ml de medio a un pH de 6.00 y agitación de 150 rpm a temperatura ambiente.
Las concentraciones de hidrolizado hemicelulósico de raquis se incrementaron progresivamente en 25, 40, 60, 75, 85 y 100% v/v. El medio fue enriquecido con extracto de levadura 4 gl-1, peptona 3 gl-1, (NH4)2SO4 2 gl-1 y MgSO4.7H2O 0.5 gl-1. El contenido inicial de azúcares reductores del medio se fijó en 30 gl-1 adicionando xilosa grado analítico. La cepa fue repicada de 3 a 4 veces en cada una de las concentraciones de hidrolizado antes de ser llevada a una concentración mayor. Luego de los repiques continuos en cada una de las concentraciones, se cultivó la cepa en medios líquido y sólido, de igual composición al de adaptación, durante 48 horas a temperatura ambiente y luego se almacenó en refrigeración a 4°C.
2.5. Fermentación en matraz
Las fermentaciones se realizaron en matraces Erlenmeyer de 250 ml a una temperatura constante de 30°C, usando volúmenes de inóculo entre 5% y 10% v/v con respecto al medio de fermentación. Se evaluó el efecto de las condiciones de transferencia de oxígeno, estableciendo valores de agitación orbital entre 100 y 150 rpm y volúmenes de medio de cultivo entre 40 y 140 ml.
2.6. Métodos analíticos
2.6.1. Cuantificación de biomasa
La concentración de células se determinó por recuento en cámara de Neubauer; el conteo se realizó promediando el número de células encontrado en los 25 cuadrados que conforman el cuadrante de 0.1 mm2; el promedio de células se multiplicó por el factor de dilución y se calculó como células ml-1 de medio de cultivo.
2.6.2. Cuantificación de etanol, xilosa, glucosa, ácido acético, furfural e hidroximetil furfural
La concentración de estos compuestos se determinó por HPLC en un cromatógrafo Shimadzu con columna Aminex HPX-87H (300x7.8 mm); se utilizó en el horno una temperatura de 60°C, la fase móvil fue ácido sulfúrico 0.005 M con un flujo de 0.6 ml min-1. Previo a la inyección, las muestras fueron centrifugadas y filtradas con membrana de tamaño de poro igual 0.22 µm. La detección de etanol, xilosa, glucosa y ácido acético se llevó acabo con un detector de índice de refracción DIR, mientras que el furfural e HMF fueron detectados con un detector PDA a una longitud de onda de 210 nm [11, 13].
2.7. Métodos estadísticos
La producción de etanol en función del volumen de inóculo, agitación orbital y volumen de medio de cultivo se evaluó a través de un diseño central compuesto cubo estrella con dos puntos centrales. La significancia de las variables así como sus interacciones fueron determinadas con un nivel de significancia del 5%.
3. Resultados y Discusión
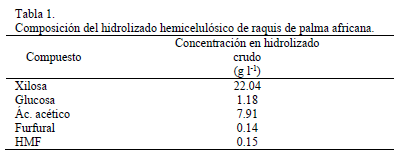
La tabla 1 muestra la composición del hidrolizado hemicelulósico de raquis de palma africana usado en la adaptación y en las fermentaciones con S. stipitis. La adaptación de la levadura a los inhibidores del medio se llevó a cabo basándose en reportes de la literatura que muestran el desarrollo satisfactorio de cepas de levadura del género Scheffersomyces, tolerantes a diferentes concentraciones de furfural, HMF, ácido acético y ácido levulínico, en medios compuestos por diferentes concentraciones de hidrolizados de varias fuentes lignocelulósicas [5, 6, 7]. Para la adaptación se utilizaron medios líquidos en agitación orbital en lugar de medios sólidos; estos últimos han sido reportados como poco efectivos para la adaptación de levaduras del género Scheffersomyces [6].
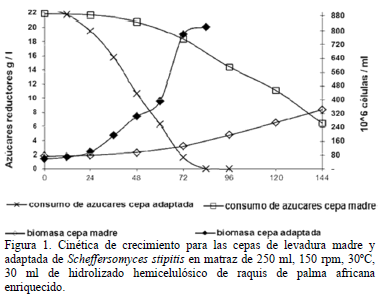
Se obtuvo una adaptación satisfactoria de S. stipitis al hidrolizado hemicelulósico de raquis de palma africana tras repicar la cepa madre de 3 a 4 veces en cada una de las concentraciones de hidrolizado (25, 40, 60, 75, 85 y 100% v/v) para un total de 20 repiques consecutivos de adaptación. En la Fig. 1 se observan las cinéticas de crecimiento de las cepas madre y adaptada creciendo en condiciones aerobias. La cepa madre mostró una velocidad máxima de crecimiento, µmax, de 0.013 h-1, 3 veces inferior a la velocidad máxima de crecimiento de la cepa adaptada, la cual creció a µmax de 0.040 h-1. La cepa adaptada presentó una fase de latencia de 12 horas, luego de la cual muestra una fase de aceleramiento del crecimiento, consumiendo el 95% de los azúcares en 72 horas a una rata promedio de consumo de 0.30 gl-1h-1, mientras la cepa de levadura madre tiene una fase de latencia de 48 horas, logrando asimilar sólo 17 gramos de azúcares reductores a los 6 días de fermentación a una rata de asimilación promedia de 0.10 gl-1h-1, mostrando una baja tolerancia a los inhibidores. Liu et al. [14], usando medios sintéticos, evaluaron el efecto de 10, 30, 60 y 120 mM de furfural e HMF sobre el crecimiento de S. stipitis encontrando que estos compuestos actuando por separado y en función de su concentración pueden alargar la fase de latencia hasta por 48 horas cuando se usan máximo 30 mM. Además, actuando en combinación se presenta sinergismo inhibitorio, siendo 1.26 y 0.96 g/l las concentraciones de HMF y furfural, respectivamente, tolerables para la levadura. Aunque estas concentraciones son mayores a las de furfural e HMF (0.14 y 0.15 gl-1) determinadas en los hidrolizados de palma africana neutralizado de este estudio, la presencia de otros compuestos inhibitorios como ácido acético, 7.91 gl-1, y compuestos derivados de la lignina no cuantificados, explicarían la baja velocidad de asimilación de la cepa madre. Nigam [15], demostró que ácido acético, furfural y compuestos derivados de la lignina tienen un efecto de inhibición sinérgica sobre el crecimiento, productividad volumétrica y rendimiento en base a sustrato de S. stipitis; las concentraciones de inhibidores usadas en tal estudio son similares a las esperadas en el hidrolizado de raquis de palma de este estudio, así que podemos decir que las concentraciones de inhibidores del hidrolizado de raquis de palma disminuyen la capacidad metabólica de S. stipitis y que tal efecto puede ser reducido en parte a través de la adaptación de la levadura a medios de cultivo compuestos por hidrolizados hemicelulósicos que contengan progresivamente mayor cantidad de inhibidores.
Tal adaptación no ha sido completamente entendida pero parece estar determinada por un cambio en la actividad enzimática de la levadura, aunque furfural e HMF pueden romper el DNA, inhibir la síntesis de proteínas y afectar la actividad de enzimas de las levaduras [14, 16, 17]. S. stipitis ha mostrado ser capaz de biotransformar estos compuestos para reducir su efecto inhibitorio. Palmqvist et al. [18] reportan que el furfural es reducido a furfuril alcohol aumentando la capacidad de asimilación de azúcares; más recientemente se ha descrito la conversión de HMF a 2,5-bishidroximetilfurfural, con una correspondiente reducción en la inhibición del crecimiento [14]; la xilosa reductasa parece ser la enzima encargada de esta conversión, ya que se ha demostrado que la expresión de la enzima xilosa reductasa de Pichia stipitis en cepas de Saccharomyces cerevisiae, incrementa la tolerancia de esta última a altas concentraciones de HMF [19]. En resumen, se logró obtener una cepa capaz de crecer en medios compuestos por hidrolizado hemicelulósico de raquis de palma africana cuyas concentraciones promedio de xilosa, furfural, HMF y ácido acético son 22.04, 0.14, 0.15 y 7.91 gl-1, respectivamente.
Una vez obtenida la cepa de S. stipitis capaz de crecer en un medio compuesto por hidrolizado de raquis de palma africana, la misma fue evaluada para determinar la capacidad de producción de etanol bajo diferentes condiciones de cultivo a nivel de matraz.
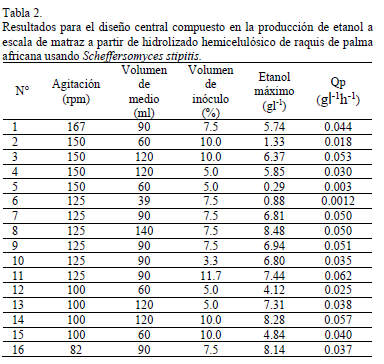
Se evaluaron diferentes condiciones de agitación orbital y volúmenes de medio de cultivo, que determinan la transferencia de oxígeno, con miras a establecer las que pudiesen favorecer la producción de etanol en el hidrolizado de raquis de palma. De igual manera se estudió la influencia de la concentración inicial de inóculo en la producción de etanol y su posible interacción con la agitación y volumen de medio. Los resultados se presentan en la tabla 2.
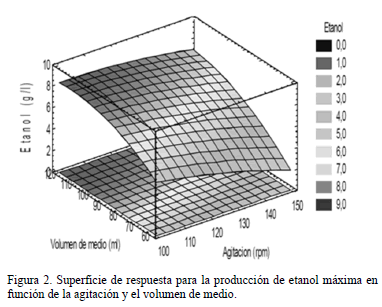
El análisis de varianza para la variable de respuesta, etanol gl-1, mostró que la agitación y el volumen de medio fueron significantes y que no hay interacciones entre los mismos, de forma que el efecto que ejerce cada uno de ellos en la producción de etanol es independiente del valor de las demás dentro de los niveles evaluados. La Fig. 2 muestra la superficie de respuesta para la concentración de etanol en función de las condiciones de transferencia de oxígeno determinadas por la agitación y volumen de medio de cultivo; en ella se puede observar cómo la concentración de etanol se incrementa a medida que la agitación se reduce de 150 rpm a 100 rpm. Tal incremento es más notable cuando el volumen de medio de cultivo está en 60 ml comparado con 120 ml. En el volumen de 120 ml, la concentración de etanol parece ser más estable en diferentes niveles de agitación; esto se corrobora con los datos de la tabla 2, donde se puede observar que entre 150 y 100 rpm los valores de etanol varían entre 5.85 y 8.28 gl-1, mientras que a 60 ml los valores de etanol entre 150 y 100 rpm varían de 0.29 a 4.84 g l-1.
De la Fig. 2 también podemos concluir que a pesar de que las concentraciones de etanol son mayores a bajas velocidades de agitación y altos volúmenes de medio de cultivo, las mismas tienden a estabilizarse en un máximo cercano a 8 gl-1 cuando los niveles de agitación son menores a 125 rpm y los volúmenes de medio son superiores a 90 ml, mostrando que el establecer condiciones de transferencia de oxígeno que reduzcan de manera excesiva el oxígeno disuelto del medio, no es garantía para la producción de altas concentraciones de etanol cuando se usa S. stipitis; de hecho S. stipitis, al ser sometida a condiciones cercanas a anaerobiosis, consume de manera insignificante xilosa, influyendo de manera negativa en la producción de etanol.
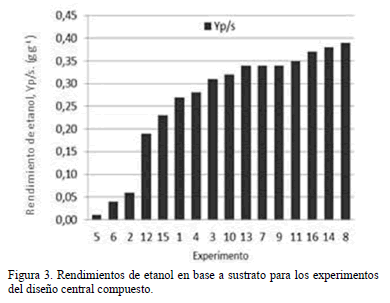
Los resultados de la concentración máxima de etanol en función de la agitación y volumen de medio muestran gran variabilidad basada en que estas dos variables determinan la concentración del oxígeno disponible en el medio de cultivo para ser asimilado por la levadura. De acuerdo con Du Preez [8], la aireación es el factor más importante en los procesos de fermentación de xilosa con levaduras del género Scheffersomyces, ya que ésta determina la partición del flujo del carbono entre la formación de etanol y el crecimiento celular. Se puede decir que S. stipitis, usando como medio nutritivo xilosa proveniente de hidrolizados hemicelulósicos de palma de aceite africana, ve estimulado su metabolismo hacia la producción cuando las condiciones de transferencia de oxígeno están establecidas por volúmenes ≥ 90 ml y agitaciones ≤ 125 rpm usando matraces de 250 ml. En general, S. stipitis demostró ser capaz de producir mayores cantidades de etanol conforme la combinación de agitación y volumen favorecen condiciones de baja transferencia de oxígeno. En la tabla 2 y Fig. 3, se observa que los rendimientos de etanol más altos fueron 0.39 gg-1, 0.38 gg-1 y 0.37 gg-1, correspondientes a combinaciones de agitación y volumen de medio iguales a 125 rpm-140 ml, 100 rpm-120 ml y 82.96 rpm-90 ml, respectivamente. Estos resultados contrastan con las bajas concentraciones de etanol alcanzadas con las combinaciones de agitación y volumen de medio iguales a 150 rpm-60 ml y 125 rpm-39.55 ml, para las cuales los rendimientos de etanol en base a sustrato fueron 0.06 gg-1 y 0.04 gg-1, demostrando que tales combinaciones de variables transfieren oxígeno en exceso, desestimulando el flujo del carbono hacia la producción de etanol y dirigiéndolo hacia la producción de biomasa.
En este tipo de bioproceso los rendimientos de etanol en base a sustrato, superiores a 0.40 g g-1, se obtienen generalmente en hidrolizados lignocelulósicos que han sido sometidos a procesos de destoxificacion con sobretitulación con Ca(OH)2 en combinación con otras técnicas como adición de carbón activado, membranas de intercambio iónico y rota-evaporación. En contraste, los trabajos llevados a cabo con hidrolizados crudos neutralizados, en su gran mayoría alcanzan rendimientos inferiores a 0.40 g g-1, siendo los mejores cercanos a 0.36 g g-1. En este sentido los rendimientos de etanol en base a sustrato iguales a 0.35, 0.37, 0.38 y 0.39 g g-1 de los experimentos 11, 16, 14 y 8 encontrados en este estudio, demuestran que a partir de hidrolizados hemicelulósicos de raquis de palma africana no destoxificados, es posible producir etanol con buenos
rendimientos usando una cepa de S. stipitis adaptada. El hecho que no se hayan usado métodos de destoxificación en la producción de los hidrolizados usados en la fermentación es de gran importancia, ya que éstos representarían un incremento significativo en los costos de producción de etanol, pensando en una perspectiva de producción a mayor escala. Con respecto a la productividad volumétrica de etanol, Qp, los resultados muestran que las variables volumen de medio y volumen de inóculo, son las variables significantes, no presentando interacciones entre ellas.
De acuerdo con los resultados obtenidos para las variables productividad y concentración de etanol, podemos decir que el usar altas concentraciones celulares de S. stipitis como inóculo, aumenta la productividad del etanol, basándose en la reducción de los tiempos de fermentación más que en un aumento de las concentraciones y rendimientos de etanol. Tal reducción de tiempo se puede dar como consecuencia de mayores ratas de asimilación de azúcares y producción de etanol inherentes a un mayor número de células presentes en el medio, o también podría estar muy relacionada con la capacidad de las células de levaduras del género Scheffersomyces para reducir las concentraciones de furfural e HMF presentes en hidrolizados lignocelulósicos, a través de su biotransformación a furfuril alcohol y 2,5-bishidroximetilfurfural, respectivamente [18, 14]. En ese sentido, una mayor concentración de células adaptadas reduciría a mayor velocidad y proporción las concentraciones de inhibidores del medio de cultivo, facilitando por lo tanto el metabolismo de los azúcares, reduciendo los tiempos de la fase de latencia y de fermentación en general.
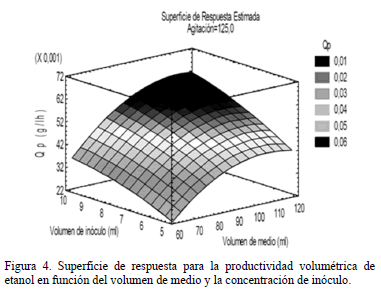
La superficie de respuesta para la productividad volumétrica de etanol representada en la Fig. 4, muestra la marcada influencia de la variable volumen de medio sobre la productividad. Esta última se ve favorecida a medida que el volumen de medio de cultivo varía de 60 a 120 ml, lo cual es aún más notorio cuando las concentraciones de inóculo son más altas. Análogamente, el inóculo muestra un efecto positivo sobre la productividad a medida que aumenta su concentración desde 5 a 10%; estos valores
corresponden a 4.50 y 9.00 x 107 células ml-1. En general, se puede observar que a concentraciones de inóculo mayores que 7.5% (6.75 x 107 células ml-1) y volúmenes de medio mayores a 90 ml, se alcanzan las productividades más altas, superando los 0.050 gl-1h-1
Teniendo en cuenta que tanto Qp como la concentración de etanol son importantes para determinar la viabilidad económica de la producción de etanol a partir de hidrolizados de raquis de palma, se realizó la optimización multivariada de los mismos, encontrando que para valores óptimos de concentración de etanol y productividad volumétrica iguales a 7.50 g l-1 y 0.06 g l-1 h-1, los valores de las variables agitación orbital, volumen de medio y concentración de inóculo deberían establecerse en 116.90 rpm, 92.44 ml y 10.7% v/v (9.63x107 células ml-1), respectivamente.
4. Conclusiones
Se encontró que es factible adaptar una cepa de S. stipitis a los inhibidores de un hidrolizado hemicelulósico de raquis de palma africana no destoxifiado a través de un proceso de aclimatación en hidrolizados progresivamente más concentrados en inhibidores, dando la posibilidad de explorar la producción de etanol, evitando los altos costos de los procesos de destoxificacion. Teniendo en cuenta la importancia del rendimiento y la productividad en la viabilidad económica del bioproceso, se determinó por optimización multivariable, que establecer las condiciones de fermentación en 116.90 rpm, 96.44 ml y 10.70% v/v (9.63x107 células ml-1) como volumen de inóculo, optimizaría el bioproceso de producción de etanol alcanzando hasta 8.00 g l-1 y 0.065 g l-1h-1.
Referencias
[1] BP British Petroleum. Statistical Review of World Energy. [consulta, junio 21 de 2010]. Disponible en: http://www.bp.com/liveassets/bp_internet/globalbp/globalbp_uk_english/reports_and_publications/statistical_energy_review_2008/STAGING/local_assets/2010_downloads/statistical_review_of_world_energy_full _report_2010.pdf [ Links ]
[2] Saxena, R., Adhikari, D. and Goyal, H., Biomass-based energy fuel through biochemical routes: A review. Renewable and Sustainable Energy Reviews, 13 (1), pp. 167–178, 2009. [ Links ]
[3] Monsalve, J., Medina, V. y Ruiz, A., Producción de etanol a partir de la cáscara de banano y de almidón de yuca. Revista Dyna, 73 (150), pp. 21-27, 2006. [ Links ]
[4] Rahman, S., Choudhury, J. and Ahmad, A., Production of xylose from oil palm empty fruit bunch fiber using sulfuric acid. Biochemical Engineering Journal, 30, pp. 97-103, 2006. [ Links ]
[5] Huang, C., Lin, T., Guo, G. and Hwang, W., Enhanced ethanol production by fermentation of rice straw hydrolysate without detoxification using a newly adapted strain of Pichia stipitis. Bioresource Technology, 100 (17), pp. 3914-3920, 2009. [ Links ]
[6] Nigam, J., Development of xylose-fermenting yeast Pichia stipitis for ethanol production through adaptation on hardwood hemicellulose acid prehydrolysate. Journal of Applied Microbiology, 90 (2), pp. 208-215, 2001. [ Links ]
[7] Amartey, S. and Jeffries, T., An improvement in Pichia stipitis fermentation of acid-hydrolysed hemicellulose achieved by overliming (calcium hydroxide treatment) and strain adaptation. World Journal of Microbiology and Biotechnology, 12 (3), pp. 281-283, 1996. [ Links ]
[8] Du Preez, J., Process parameters and environmental factors affecting D-xylose fermentation by yeasts. Enzyme and Microbial Technology, 16 (11), pp. 944-956, 1994. [ Links ]
[9] Agbogbo, F., Coward, G., Torry, M. and Wenger, K., Fermentation of glucose/xylose mixtures using Pichia stipitis. Process Biochemistry. 41 (11), pp. 2333-2336, 2006. [ Links ]
[10] Hande, A., Mahajan, S. and Prabhune, A., Evaluation of ethanol production by a new isolate of yeast during fermentation in synthetic medium and sugarcane bagasse hemicellulosic hydrolysate. Annals of Microbiology, 63 (1), pp. 63-70, 2012. [ Links ]
[11] Canilha, L., Carvalho, W., Silva, F. and Giulietti, M., Ethanol production from sugarcane bagasse hydrolysate using Pichia stipitis. Applied Biochemistry and Biotechnology, 161, pp. 84-92, 2010. [ Links ]
[12] Llano, J., Gómez, N. y Santamaría, M., Recuperación de xilosa a partir de material lignocelulósico procedente de la extracción de aceite de palma. Memorias IIV Simposio sobre Biofábricas los Grupos de Investigación en Biotecnología y la Formación de Investigadores. Medellín, Colombia, 2009. [ Links ]
[13] Walton, S., Heiningen, A. and Walsum, P., Fermentation of near-neutral pH extracted hemicellulose derived from northern hardwood. 2013 [consulta, 18 de Agosto de 2013]. Disponible en http://archivos.labcontrol.cl/ [ Links ]
[14] Liu, Z., Slininger, P., Dien, B., Berhow, M., Kurtzman, C. and Gorsich, S., Adaptive response of yeasts to furfural and 5-hydroxymethylfurfural and new chemical evidence for HMF conversion to 2,5- bis-hydroxymethylfuran. Journal of Industrial Microbiology and Biotechnology, 31(8), pp. 345-352, 2004. [ Links ]
[15] Nigam, J., Ethanol production from wheat straw hemicellulose hydrolysate by Pichia stipitis. Journal of Biotechnology. 87 (1), pp. 17-27, 2001. [ Links ]
[16] Tian, S., Zhu, J. and Yang, X., Evaluation of an adapted inhibitor-tolerant yeast strain for ethanol production from combined hydrolysate of softwood. Applied Energy, 88 (5), pp. 1792-1796, 2011. [ Links ]
[17] Taherzadeh, M., Ethanol from lignocellulose: Physiological effects of inhibitors and fermentation strategies. Doktorsavhandlingar Vid Chalmers Tekniska Hogskola, (1485), pp. 1-57, 1999. [ Links ]
[18] Palmqvist, E. and Hahn, B., Fermentation of lignocellulosic hydrolysates. II: Inhibitors and mechanisms of inhibition. Bioresource Technology, 74 (1), pp. 25-33, 2000. [ Links ]
F. C. Herrera-Ruales, se graduó como Ingeniero Agroindustrial de la Universidad de Nariño (Pasto, Nariño) en el año 2007. Obtuvo su título de Magíster en Ciencias-Biotecnología en la Universidad Nacional de Colombia sede Medellín en el año 2013. Ha trabajado en el área de aprovechamiento de residuos agroindustriales vía fermentación para la producción de bioetanol. Actualmente realiza estudios de doctorado en la Universidad de Antioquia (Medellín-Colombia).
M. Arias-Zabala, se graduó como Ingeniero Químico en 1983 en la Universidad de Antioquia (Medellín, Colombia). Obtuvo su título de Magíster en Tecnología de Procesos Bioquímicos en la Universidad Federal de Río de Janeiro (Brasil) en 1990 y el Doctorado en Ingeniería Química en 2005 en la Universidad Nacional de Colombia (Bogotá, Colombia). Actualmente es Profesor Asociado en la Facultad de Ciencias de la Universidad Nacional de Colombia sede Medellín y director del área de Biotecnología de la misma facultad. Es líder fundador del grupo de investigación Biotecnología Industrial (Categoría A, Colciencias-2014) y director fundador del Laboratorio de Bioconversiones. Su área de trabajo son los procesos fermentativos tanto microbianos como utilizando células vegetales en suspensión y el aprovechamiento de residuos agroindustriales vía biotecnológica.