Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
DYNA
versão impressa ISSN 0012-7353
Dyna rev.fac.nac.minas vol.81 no.188 Medellín nov./dez. 2014
https://doi.org/10.15446/dyna.v81n188.41815
http://dx.doi.org/10.15446/dyna.v81n188.41815
Effect of additives on diffusion coefficient for cupric ions and kinematics viscosity in CuSO4-H2SO4 solution at 60°C
Efecto de aditivos en el coeficiente de difusión de iones cúpricos y la viscosidad cinemática en solución CuSO4-H2SO4 a 60°
Eugenia Araneda-Hernández a, Froilán Vergara-Gutierrez b & Antonio Pagliero-Neira.c
a Departamento de Metalurgia, Facultad de Ingeniería, Universidad de Concepción. Concepión, Chile. euaraned@udec.cl
b Departamento de Metalurgia, Facultad de Ingeniería, Universidad de Concepción. Concepión, Chile. fvergar@udec.cl
c Departamento de Metalurgia, Facultad de Ingeniería, Universidad de Concepción. Concepión, Chile. apaglier@udec.cl
Received: January 29th, de 2014. Received in revised form: April 10th, 2014. Accepted: April 25th, 2014
Abstract
The effect of levelling and grain-refining agents on the diffusion coefficient of cupric ion was studied. Tests were performed using synthetic solutions with Cu2+ concentration and acidity similar to those of a copper electro-refining industrial electrolyte by means of rotating disc electrode (RDE) technique. The diffusion coefficient was calculated according to Levich's expression from measurements of limiting current for different rotating speed of the RDE. Arrhenius dependence of the diffusion coefficient with temperature in the absence of additives was verified. In presence of additives, the variation of the limiting current is mainly attributed to changes in diffusion coefficient of cupric ion observed.
Keywords: diffusion coefficient cupric ions; electrorefining copper; glue; thiourea; chloride.
Resumen
En este estudio se determinó el efecto de la adición de agentes inhibidores y/o afinadores de grano comúnmente utilizados en la electrorefinación industrial de cobre sobre el coeficiente de difusión de ión cúprico a composición de ácido, cobre y temperatura en el rango industrial promedio. El coeficiente de difusión del ión cúprico DCu2+ se obtuvo de acuerdo a la expresión de Levich a través de mediciones de corriente límite sobre electrodo de disco rotatorio de acero inoxidable 316 L en soluciones sintéticas de composición 40 g/L de Cu2+ y 200 g/L de H2SO4 a 60°C con adición de cola, tiourea y cloruro a tres niveles de concentración y se compararon con el valor obtenido en soluciones en ausencia de estos aditivos. La incorporación de aditivos resulta en una leve disminución del coeficiente de difusión del Cu2+ siendo más significativa en presencia de iones cloruro.
Palabras clave: coeficiente de difusión iones cúpricos; electrorefinación cobre; cola; tiourea; cloruro.
1. Introducción
El proceso de electrorefinación de cobre desde un sistema CuSO4-H2SO4 ocurre mediante las semi reacciones anódicas y catódicas:
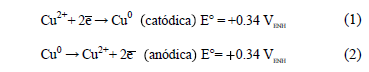
La electrodepositación de cobre involucra además una semirreacción intermedia de transferencia de carga dada por la reducción de Cu2+ a Cu+ a 0.15 mVENH. La electrodepositación de cobre de acuerdo a la semirreacción (1) comprende tres etapas, a) la transferencia de masa de iones a través del electrolito soporte hacia las vecindades del electrodo, b) la transferencia de carga para obtener ad-átomos o ad-iones y c) la incorporación de los ad-átomos o ad-iones a la superficie catódica. La primera de ellas ocurre principalmente por la difusión de iones cúpricos hacia las proximidades del cátodo a través de la capa difusiva y el flujo másico global está dado por la primera ley de Fick cuya constante de proporcionalidad corresponde al coeficiente de difusión de la especie electroactiva, en este caso, iones cúpricos.
Por otro lado, en la producción industrial de cátodos electrorefinados es común el uso de agentes nivelantes e inhibidores adicionados al electrolito en pequeñas concentraciones para la obtención de depósitos más compactos y de menor rugosidad [1-4]. El mecanismo de acción de estos aditivos en la morfología de los depósitos se explica dependiendo de su naturaleza. En el caso de aditivos orgánicos: cola animal y tiourea, diversos estudios sostienen que estos actúan bloqueando sitios activos en la superficie del cátodo por fenómenos de adsorción superficial mientras que el ión cloruro actuaría como catalizador de la reacción de reducción global (1).
Se han realizado algunos estudios [5-7] para determinar el coeficiente de difusión del ión cúprico, referidos principalmente al efecto de la composición de cobre y acidez y en algunos casos se agrega el efecto de la temperatura, pero en rangos diferentes a los usados industrialmente [8,9] ni tampoco consideran el efecto de los agentes nivelantes y/o afinadores de grano.
El presente estudio pretende entregar una contribución a la data disponible del coeficiente de difusión del ión cúprico en el sistema CuSO4-H2SO4 a composición de cobre y ácido en el rango industrial y el efecto que tendrían sobre este parámetro los aditivos más utilizados en los procesos de electro refinación de cobre. Todas las experiencias fueron realizadas usando la técnica de electrodo de disco rotatorio (EDR) y el coeficiente de difusión se determinó a partir de mediciones de corriente límite para diferentes velocidades de rotación.
Adicionalmente se realizaron mediciones de viscosidad cinemática del electrolito soporte bajo las diferentes condiciones experimentales consideradas para ser utilizadas en el cálculo del coeficiente de difusión.
2. Metodología experimental
2.1. Electrolito soporte
El electrolito soporte utilizado en las mediciones de viscosidad y en las pruebas electroquímicas consistió de una solución ácida sintética de composición 40 g/L de Cu2+ (a la forma de CuSO45H2O pro análisis) y 200 g/L de H2SO4, denominada solución base. Los aditivos considerados en este estudio corresponden a tiourea, cola animal y cloruro, que son los habituales en el proceso de electro refinación de cobre. Los dos primeros proporcionados por la refinería de Chuquicamata y el último adicionado a la forma de KCl pro análisis. Estos se adicionaron individualmente a la solución justo antes de cada prueba, previa dilución en agua destilada, cada uno de los test se realizó dentro de los 30 minutos de adicionado el aditivo.
Se consideraron concentraciones de 1, 10 y 100 mg/L para cada uno de ellos. Las soluciones se mantuvieron en contacto con la atmósfera con agitación magnética hasta alcanzar la temperatura requerida del ensayo. Durante cada prueba la solución fue calentada y mantenida a la temperatura previamente fijada, con variaciones de ±1°C, usando una celda electrolítica de doble camisa conectada con un baño termostático.
2.2. Mediciones de viscosidad
Las mediciones de viscosidad de cada una de las soluciones se realizaron en triplicado en un ViscoSystem® AVS 370 de Schott Instruments con viscosímetros capilares Cannon-Fenske routine.
2.3. Mediciones electroquímicas
Como electrodo de trabajo se utilizó un electrodo rotatorio EDI 101 de Radiometer, con un disco de platino de 0.0314 cm2. El que fue sometido a una limpieza electrolítica en solución ácida libre de cobre previo a cada ensayo. El electrodo de referencia correspondió a un electrodo de calomel saturado (ECS) y un alambre de platino de alta pureza se empleó como contra electrodo.
El registro de las variaciones de potencial y de corriente se realizó con un potenciostato Voltalab 40 PGZ301 de Radiometer. Las pruebas voltamétricas se llevaron a cabo en el rango -200 a -1200 mVECS con una velocidad de barrido de 5 mV/s.
3. Resultados y Discusiones
3.1. Viscosidad cinemática del electrolito
3.1.1. Efecto de la temperatura
La viscosidad cinemática en sistemas líquidos se relaciona exponencialmente con la temperatura de acuerdo a [10]:
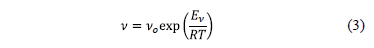
donde n es la viscosidad cinemática en cm2/s, no una constante, T es la temperatura absoluta en Kelvin, R es la constante de los gases y En es la energía de activación de la viscosidad en kJ/mol.
Este comportamiento se verifica claramente en Fig. 1 en el caso de la solución base en el rango de temperatura analizado, encontrando la correlación empírica dada por la ec. (4) con un coeficiente de correlación de 0.99:
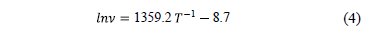
De la misma figura, se observa una disminución de la viscosidad cinemática con un aumento en la temperatura de la solución lo que concuerda con lo reportado por Price y Davenport [11] en el mismo rango de temperatura (para concentraciones de Cu y H2SO4 en los rangos 5 a 55 g/L y 10 a 165 g/L, respectivamente) y Subbaiah y Das [12] a 20, 30, 40 y 60ºC (para concentraciones de Cu y H2SO4 en los rangos 1.04 a 43.5 g/L y 147.1 a 450 g/L, respectivamente.
A partir de la ec. (4) se determinó la energía de activación para la viscosidad cinemática a partir de la expresión para la solución base en el rango de temperatura 20 a 80°C la que resulta en 11,3 kJ/mol.
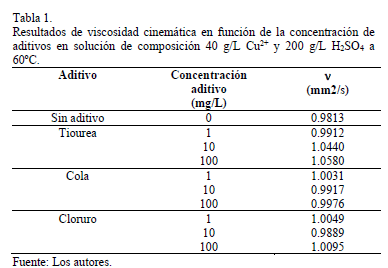
3.1.2. Efecto de los aditivos
La viscosidad cinemática medida al electrolito en presencia de aditivos para tres concentraciones se muestran en Tabla 1. Se observa un leve aumento de la viscosidad en presencia de cola y cloruro con diferencias en el rango 0.77% a 2.9% respecto de la solución base a la misma temperatura. A 10 y 100 mg/L de tiourea las desviaciones observadas respecto de la solución de composición base son de 6.4% y 7.8%, respectivamente. En general, la presencia de cola, tiourea y cloruro no modificaría de manera significativa la movilidad iónica en el electrolito soporte.
3.2. Determinación de corriente límite IL
3.2.1. Efecto de la velocidad de rotación
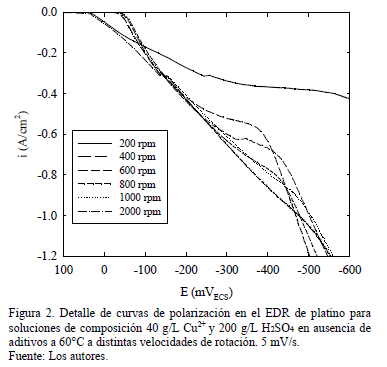
Un detalle de las curvas de la solución base para diferentes velocidades de rotación del EDR bajo las condiciones experimentales se muestran en los voltagramas de Fig. 2. A bajas velocidades de rotación, inferior a 800 rpm, y a bajos potenciales catódicos, inferiores a -300 mVECS (considerados en valor absoluto), la corriente aumenta hasta alcanzar un valor límite. A velocidades de rotación sobre 800 rpm este valor límite prácticamente desaparece por la alta turbulencia originada en el electrolito.
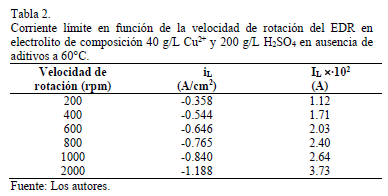
Los valores de corriente límite a distintas rpm extraídos de los voltagramas se presentan en Tabla 2. Estos muestran un aumento en el valor de IL al incrementar la velocidad de rotación del EDR.
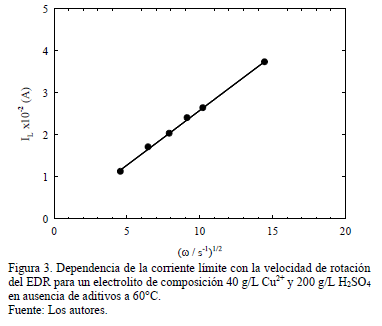
Graficando el valor de corriente límite IL en función de la velocidad de rotación del EDR, se verifica una dependencia lineal entre ambos (Fig. 3), tal como lo predice Levich [10] para régimen laminar controlado por difusión de acuerdo a la expresión:
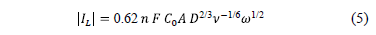
donde IL es la corriente límite catódica en amperes, n es el número de moles equivalentes, F es la constante de Faraday en coulomb, C0 es la concentración de iones cúpricos en el seno del electrolito en mol/cm3, A es el área efectiva catódica en cm2 (asumiendo área geométrica del electrodo), n es la viscosidad cinemática en cm2/s, w es la velocidad de rotación del EDR en rpm y D es el coeficiente de difusión de los iones cúpricos en cm2/s.
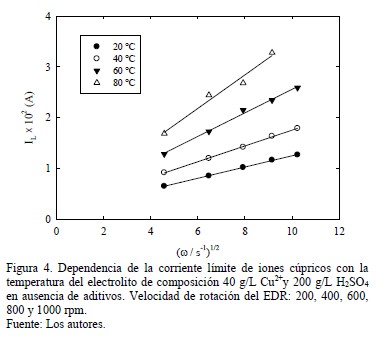
3.2.2. Efecto de la temperatura
Los resultados de la variación de corriente límite en función de la velocidad de rotación del EDR para distintas temperaturas se muestran en Fig. 4. Se mantiene la dependencia lineal descrita por Levich de acuerdo a la ec. (5) con un coeficiente de correlación de entre 0.97 a 0.99 en todo el rango de temperatura estudiado, observándose un aumento de la corriente límite con la temperatura asociado principalmente a un incremento en la movilidad iónica y a una disminución de la viscosidad del electrolito soporte de acuerdo al modelo de Arrhenius verificado en Fig. 1.
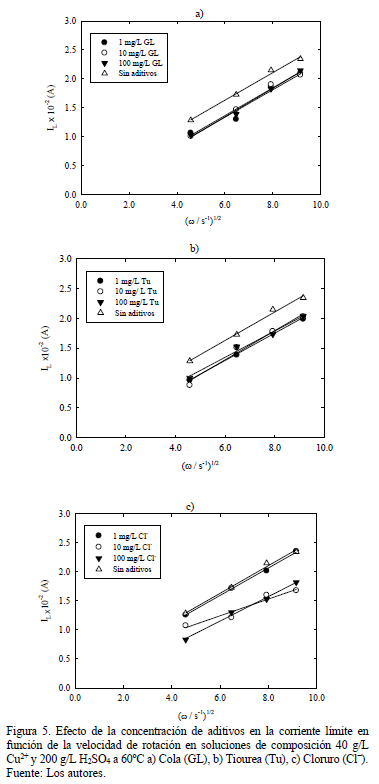
3.2.3. Efecto de la concentración de aditivos
Los resultados muestran en general una relación lineal entre la corriente límite experimental IL y la velocidad de rotación del EDR en soluciones en presencia de aditivos (Fig. 5), lo que indica que se mantiene el mecanismo difusional como controlante de la transferencia de masa en el electrolito. Sin embargo, en presencia de cola (Fig. 5a) y tiourea (Fig. 5b) esta presenta una leve disminución respecto del valor observado en soluciones en ausencia de aditivos aún a bajas concentraciones de ambos inhibidores (1 mg/L) y se mantiene constante al aumentar la concentración a 10 y 100 mg/L.
En el caso de soluciones con adición de ión cloruro (Fig. 5c), a baja concentración no se observan variaciones significativas en los valores de corriente límite respecto de los obtenidos para la solución en ausencia de Cl-. A mayor concentración de ión cloruro se observa una disminución significativa de la corriente límite respecto de la solución base en todo el rango de velocidad de rotación considerado.
Considerando que la temperatura de la solución se mantiene fija y que el gradiente de concentración de iones cúpricos entre el seno de la solución y la interfase catódica permanece prácticamente constante, esta disminución en la corriente límite medida experimentalmente estaría asociada más bien a una disminución en el área efectiva disponible por una adsorción de los aditivos en la interfase del electrodo.
3.3. Coeficiente de difusión del ión cúprico
3.3.1. Efecto de la temperatura
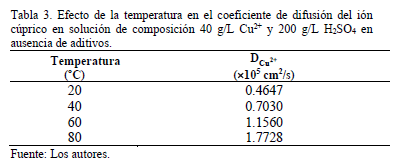
A partir de la pendiente de la gráfica de Fig. 3 y de la expresión de Levich (ec. 5) se determinó el coeficiente de difusión del ión cúprico para cuatro valores de temperatura del electrolito considerando en este cálculo la variación de la viscosidad cinemática medida en función de la temperatura. Los resultados obtenidos para el coeficiente de difusión se muestran en Tabla 3 siguiente.
Estos resultados concuerdan con los reportados en estudios previos [1-3] para similar composición de cobre y rango de temperatura utilizando en algunos casos otras técnicas electroquímicas.
Para un electrolito de similar composición Gladysz et al. [13] utilizando una configuración de dos electrodos, un disco de oro (ultramicroelectrodo) como electrodo de trabajo y una placa de cobre como electrodo auxiliar obtienen un coeficiente de difusión de 0.700'10-5 cm2/s para 36.9 g/L Cu2+ a 40ºC muy cercano a 0.703'10-5 cm2/s que es el obtenido en este estudio a la misma temperatura.
Moats et al. [14] reportan un coeficiente de difusión a 65ºC para un electrolito de 40 g/L Cu, y 160 g/L H2SO4 de 1.23'10-5 cm2/s, levemente superior a 1.16 '10-5 cm2/s obtenido a 60ºC en este estudio. Esta diferencia estaría asociada principalmente a las diferentes temperaturas entre ambas experiencias, que como se sabe tiene un efecto significativo en la difusividad de especies iónicas.
El coeficiente de difusión del ión cúprico de acuerdo a la correlación de Levich en función de T-1, se muestra en Fig. 6 el que exhibe un comportamiento lineal asimilable al de tipo Arrhenius con la temperatura de acuerdo a:
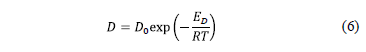
donde D es el coeficiente de difusión en cm2/s, D0 es el factor de frecuencia, ED es la energía de activación para difusión en J/mol, R es la constante de los gases (8.314 J mol/K) y T es la temperatura absoluta. A partir de esta expresión y por lo tanto, de la pendiente de la recta de la misma figura se encontró que el coeficiente de difusión del ión cúprico se relaciona con la temperatura por la expresión ln D = -2328.2 T-1 - 4.3703, con D en cm2/s. De esta correlación se obtiene que la energía de activación por difusión es de 19.36 kJ/mol, muy cercana a 19.2 kJ/mol obtenida por Moats et al. [14]. Un valor mayor, 26.8 kJ/mol, es el que reportan Gladysz et al.[13] para un electrolito industrial que contiene ión cloruro y varias impurezas como Ni, As, Fe, Sb y Bi.
Considerando la variación de la viscosidad cinemática del electrolito con la temperatura, la energía de activación efectiva para un flujo laminar Elam [10] en un disco rotatorio (Reynolds del orden de 104) expresada en términos de la energía de activación para el coeficiente de difusión ED y la viscosidad cinemática Enestá dada por:
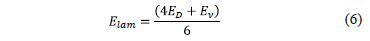
donde ED y En corresponden a la energía de activación para difusión y para la viscosidad cinemática, respectivamente.
El valor de En fue de 11.6 kJ/mol y se determinó a partir de la correlación obtenida de la gráfica de Fig. 1 (ec. 4) con un coeficiente de correlación de 0.99, resultando en un valor para la energía de activación Elam de 14.8 kJ/mol, levemente inferior a 15.3 kJ/mol, obtenido por Moats et al. [14] quienes estimaron la viscosidad cinemática a partir de la correlación empírica obtenida por Price y Davenport [15] que considera la presencia de impurezas en solución provenientes de la disolución anódica, las que no fueron abordadas en este estudio.
3.1.2. Efecto de los aditivos
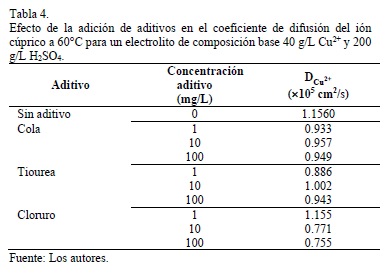
Los resultados del coeficiente de difusión del ión cúprico en presencia de aditivos a diferentes concentraciones se muestran en Tabla 4 siguiente:
A baja concentración de cola y tiourea (1 mg/L) el coeficiente de difusión del ión cúprico disminuye levemente respecto del observado en la solución de composición base en 18.7% y en 23.4% en presencia de cola y tiourea, respectivamente. Al aumentar la concentración a 10 y 100 mg/L para ambos aditivos, el coeficiente de difusión se mantiene prácticamente constante. Sin embargo, si se considera que estos dos aditivos actúan mediante un mecanismo de adsorción sobre la superficie catódica [16-19], la presencia de moléculas adsorbidas disminuiría el área efectiva disponible para la semi reacción de reducción en concordancia con la disminución observada en la corriente límite en presencia de estos aditivos sumando a esto el nulo efecto de la incorporación de aditivos en la movilidad iónica del electrolito.
En el caso del ión cloruro, a bajas concentraciones (1 mg/L) el coeficiente de difusión es muy cercano al de la solución base a la misma temperatura, sin embargo, al aumentar la concentración de cloruro a niveles de 10 mg/L, el valor del coeficiente de difusión disminuye significativamente en 34.7% respecto del obtenido en soluciones en ausencia de aditivos, manteniéndose constante a aumentos posteriores de 10 y 100 mg/L. Esta disminución en el coeficiente de difusión podría estar asociada a la formación de un film de cloruro cuproso en las vecindades del cátodo. El CuCl presenta una constante de equilibrio a 60°C de 1.14'106 y considerando el equilibrio:
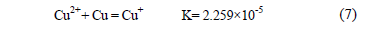
que para una concentración de Cu2+ de 40 g/L resulta en una concentración de equilibrio de cloruro de aproximadamente 8.2 mg/L. Dado el alto valor de la constante de equilibrio del CuCl, un aumento en la concentración de Cl- promueve la reducción de Cu2+ a Cu+ por sobre la reducción directa de Cu2+ a Cu metálico.
4. Conclusiones
Se verifica una disminución de la viscosidad cinemática del electrolito con un aumento en la temperatura, en el rango 20 a 80°C, en ausencia de aditivos. Esta dependencia de tipo Arrhenius está asociada principalmente a un incremento en la movilidad iónica en el electrolito soporte.
Se constató una disminución en la corriente límite en el electrolito de composición 40 g/L de Cu2+ y 200 g/L de H2SO4 a 60°C con la presencia de aditivos en solución, en el rango de concentración estudiado, sin embargo, en el caso de la cola y la tiourea, esta disminución es prácticamente constante para los tres niveles de concentración utilizados 1, 10 y 100 mg/L.
Para el ión cloruro, esta disminución se observó a concentraciones de 10 y 100 mg/L.
Utilizando el criterio de Levich, se obtuvo una correlación empírica para el coeficiente de difusión del ión cúprico en solución de composición base (40 g/L de Cu2+ y 200 g/L de H2SO4) en ausencia de aditivos, en función de la temperatura de la solución dada por la expresión ln D = -2328.2 (1/T) - 4.3703, con D en cm2/s, en el rango de temperatura estudiado. De acuerdo a esta correlación, en una solución de composición base a 60°C y en ausencia de aditivos, el coeficiente de difusión del ión cúprico es de 1.156'10-5 cm2/s.
La adición de cola y tiourea, en soluciones de composición base a 60°C resulta en una leve disminución del coeficiente de difusión del ión cúprico. El mismo efecto se observó en soluciones en presencia de cloruro pero a concentración de 10 y 100 mg/L.
El efecto de tiourea y cola sobre la disminución del coeficiente de difusión de ión cúprico en la interface cátodo-solución se originaría en un mecanismo de bloqueo de sitios activos en presencia de moléculas absorbidas en la superficie del electrodo. Para el cloruro, en cambio, resultaría de la formación de un film de cloruro cuproso a una concentración crítica de cloruro en solución, la que en este estudio sería cercana a 10 mg/L.
Referencias
[1] Alodan, M.A. and Smyrl, W.H.. Confocal laser scanning microscopy, electrochemistry, and quartz crystal microbalance studies of leveling effects of thiourea on copper deposition. Journal of the Electrochemical Society, 145 (3), pp. 957-963, 1998. http://dx.doi.org/10.1149/1.1838372 [ Links ]
[2] Ke, B., Hoekstra, J.J., Sison, B.C. and Trivich, D, Role of thiourea in the electrodeposition of copper. Journal of the Electrochemical Society, 106 (12), pp. 1081-1082, 1959. [ Links ]
[3] Sun, M. and O'Keefe, T.J., The effect of additives on the nucleation and growth of copper onto stainless steel cathodes. Metallurgical and Materials Transactions B, 23B (5), pp. 591-599, 1992. [ Links ]
[4] Arango, L., Carmona, J., Vallejo, E. y Hoyos, B., Efecto de aditivos en la dureza de los depósitos de níquel utilizando corriente pulsante. DYNA, 73 (150), pp. 59-66, 2006. [ Links ]
[5] Quickenden, T.I. and Jiang, X., The diffusion coefficient of sulphate in aqueous solution. Electrochimica Acta, 29 (6), pp. 693-700, 1984. http://dx.doi.org/10.1016/0013-4686(84)80002-X [ Links ]
[6] Hinatsu, J.T. and Foulkes, F.R., Diffusion coefficients for copper (II) in aqueous cupric sulfate-sulfuric acid solutions. J. Electrochem. Soc., 136 (1), pp. 125-132, 1989. http://dx.doi.org/10.1149/1.2096571 [ Links ]
[7] Machardy, S.J. and Janssen, L.J.J., The diffusion coefficient of Cu(II) ions in sulfuric acid-aqueous and methanesulfonic acid-methanol solutions. Journal of Applied Electrochemistry, 34 (2), pp. 169-174, 2004. http://dx.doi.org/10.1023/B:JACH.0000009956.75577.ef [ Links ]
[8] Cifuentes, G., Vargas, C. and Simpson, J., Analysis of the main variables that influence in the cathodic rejection in copper electrorefining, Proceedings of The Seminar First Meeting on Minor Contaminants in Copper Metallurgy. Concepción, Chile, pp. 37-43. October 25-26, 2007. [ Links ]
[9] Biswas, A.K. and Davenport, W.G., Extractive metallurgy of copper. Fourth Edition, Pergamon Press, 2002. [ Links ]
[10] Levich, V.G., Physicochemical hydrodynamics, Prentice Hall, Inc. Englewood Cliffs, N.J., 1962. [ Links ]
[11] Price, D.C. and Davenport, W.G., Physico-chemical properties of copper electrorefining and electrowinning electrolytes, Metallurgical Transactions B, 12B, pp. 639-643, 1981. [ Links ]
[12] Subbaiah, T. and Das, S.C., Physico-chemical properties of copper electrolytes, Metallurgical Transactions B, 20B (3), pp. 375-380, 1989. [ Links ]
[13] Gladysz. O., Los, P. and Krzyzak, E., Influence of concentrations of copper, levelling agents and temperature on the diffusion coefficient of cupric ions in industrial electro-refining electrolytes. Journal Applied Electrochemistry, 37 (10), pp. 1093-1097, 2007. http://dx.doi.org/10.1007/s10800-007-9363-8 [ Links ]
[14] Moats, M.S., Hiskey, J.B. and Collins, D.W., The effect of copper, acid, and temperature on the diffusion coefficient of cupric ions simulated electrorefining electrolytes. Hydrometallurgy, 56 (3), pp. 255-268, 2000. [ Links ]
[15] Price, D. and Davenport, W., Densities, electrical conductivities and viscosities of CuSO4/H2SO4 solutions in the range of modern electrorefining and electrowinning electrolytes. Metallurgical Transactions B, 11B (1), pp. 159-163, 1980. [ Links ]
[16] Quinet, M., Lallemand, F., Ricq, L., Hihn, J. and Delobelle, P., Adsorption of thiourea on polycrystalline platinum. Surface & Coatings Technology, 204 (20), pp. 3108-3117, 2010. http://dx.doi.org/10.1016/j.surfcoat.2010.01.025 [ Links ]
[17] Tarallo, A. and Heerman, L., Influence of thiourea on the nucleation of copper on polycrystalline platinum. Journal of Applied Electrochemistry, 29 (5), pp. 585-591, 1999. http://dx.doi.org/10.1023/A:1003410720266 [ Links ]
[18] Tantavichet, N., Damronglerd, S. and Chailapakul, O., Influence of the interaction between chloride and thiourea on copper electrodeposition. Electrochimica Acta, 55 (1), pp. 240-249, 2009. http://dx.doi.org/10.1016/j.electacta.2009.08.045 [ Links ]
[19] Bletcha, V.K., Wang, Z.Z. and Krueger, D.W., Glue analysis and behavior in copper electrolyte, Metallurgical Transactions B, 24B (2), pp. 277-287, 1993. [ Links ]
E. Araneda, recibió su título en Ingeniería Metalúrgica en 1998 y es candidata al grado de Doctor en Ingeniería Metalúrgica en la Universidad de Concepción, Chile. Desde el año 2001 se desempeña como Investigador y Colaborador Académico en el Departamento de Ingeniería Metalúrgica de la Universidad de Concepción, participando en diversos proyectos de investigación y desarrollo en minería con énfasis en las áreas de electroquímica y caracterización avanzada de materiales.
F. Vergara, recibió su título de Ingeniero Metalúrgico en 1975 y en 1978, el grado de Doctor de la Université Scientifique et Medicale de Grenoble, Francia. Desde el año 1978 se desempeña como Profesor en el Departamento de Ingeniería Metalúrgica realizando docencia e investigación en el área electrometalurgia. Actualmente es Director del mismo departamento.
A. Pagliero, recibió su título de Ingeniero Químico en 1972 y en 1976, el grado de Doctor del Institut National Polytechnique de Grenoble, Francia. Desde el año 1972 se desempeña como Profesor en el Departamento de Ingeniería Metalúrgica realizando docencia de pre y postgrado e investigación en el área electroquímica y electrometalurgia del cobre.