1. Introducción
La industria biomédica está compuesta por 4 segmentos: farmacéutico, biotecnológico, dispositivos médicos y de diagnóstico [1]. En 2013, en Estados Unidos se invirtieron más de 6,53 billones de dólares en esta industria, la cual es dominada por este país con más del 50% de la participación en el mercado mundial [2,3]. A parte de los segmentos antes mencionados, los biomateriales poliméricos también son aplicables en las áreas de ingeniería de tejidos y medicina regenerativa, para las cuales se espera que se generen 89,7 billones de dólares en 2016 [4].
Los términos medicina regenerativa e ingeniería de tejidos frecuentemente se usan indistintamente y ambos buscan la regeneración del cuerpo de manera controlada utilizando biomateriales. Sin embargo, se pueden diferenciar en que la primera busca la regeneración in vivo de un órgano o tejido mediante señales biológicas y, la segunda, la creación in vitro de órganos o tejidos para su posterior implante a partir de células de un paciente enfermo [5, 6]. Para lograr lo anterior, en ingeniería de tejidos y medicina regenerativa es muy importante contar con materiales porosos, que imiten la matriz extracelular y, a su vez, guíen el crecimiento celular hacia el desarrollo de un tejido tridimensional.
Los materiales usados en estas disciplinas deben ser, por ende, biocompatibles y proporcionar un ambiente mecánico donde el nuevo tejido pueda ser sometido al estrés normal de la célula, ser porosos y permeables para permitir el ingreso de nutrientes a las células y disponer de una estructura superficial adecuada para que las células se adhieran [6-8].
Los mercados biomédicos, de medicina regenerativa e ingeniería de tejidos han impulsado el avance de la ciencia de los materiales hacia el desarrollo de polímeros biodegradables, biocompatibles, bioabsorbibles y bioactivos[9,10], ya que los polímeros, frente a los materiales metálicos y cerámicos, poseen dos ventajas principales: alta procesabilidad y versatilidad [6].
El objetivo de esta revisión es analizar, científica y tecnológicamente, la tendencia en publicaciones y patentes de biomateriales poliméricos y, posteriormente, abordar las aplicaciones en biomedicina de estos. Al final se presenta un análisis de las respuestas inmunes de algunos materiales tratados en esta revisión.
2. Análisis cientifico y técnologico
Con miras a observar la importancia de la temática, se realizó un análisis de las tendencias científicas y tecnológicas, por medio de búsquedas en bases de datos y herramientas especializadas. Para los artículos científicos se buscó en Scopus con las palabras “polymer biomaterials” en un período comprendido entre 1972 y 2015, excluyendo las palabras “bionsensors” y “sensors”, debido a que estos dispositivos no están directamente en contacto con el cuerpo humano; también, se descartaron las temáticas de economía, veterinaria, ciencias de la tierra, física y negocios. En total, se encontraron 9.561 artículos y, de estos, se utilizaron 2.000 con fecha de publicación entre 2013 y 2015 para analizar sus palabras claves, las universidades, institutos y países de afiliación (descargando los abstracts de Scopus y analizándolos en el software VantagePoint®).
Para realizar el análisis tecnológico se buscaron las patentes mediante el software Acclaim IP® entre 2010 y 2015, encontrandose 25.379 resultados con los criterios descritos con anterioridad. En la herramienta se discriminó por país de adjudicación e instituciones.
2.1. Análisis científico
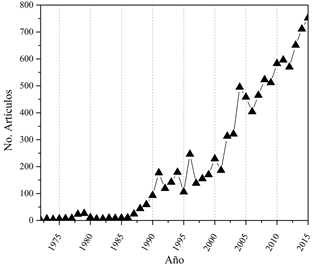
Históricamente se conoce que los primeros biomateriales poliméricos utilizados fueron la celulosa y la seda (en el antiguo Egipto), los cuales se emplearon como apósitos para heridas y suturas, respectivamente [11,12]; la placenta (compuesta de colágeno) ha sido utilizada en aplicaciones biomédicas desde 1900 [13]. En los 40 se desarrollaron el celuloide (un derivado de la celulosa) y el polimetil metacrilato (PMMA) para uso en ortopedia [13,14]. En 1972 se registra en la base de datos Scopus el primer artículo, de acuerdo con los factores clave de vigilancia utilizados para realizar la búsqueda. En la Fig. 1 se presenta la tendencia en publicaciones referentes a biomateriales poliméricos.
Analizando la Fig. 1, de 1985 en adelante se presentó un crecimiento exponencial en el número de publicaciones científicas, llegando a 752 en 2015. En los últimos años, las tendencias en las investigaciones científicas en el área se centraron en aspectos como la biocompatibilidad, la síntesis y aplicaciones de biomateriales poliméricos. Las palabras “células” y “propiedades mecánicas” resaltan dentro de los términos representativos en los “abstracts” de los artículos, lo que indica la importancia de la evaluación in vitro de los materiales con líneas celulares y la importancia de conocer el comportamiento mecánico para determinar la idoneidad, toxicidad y el desempeño del biomaterial en un ambiente simulado de trabajo, lo que se conoce como biomateriales de tercera generación, los cuales buscan estimular respuestas celulares específicas [15,16].
En la Fig. 3. se muestran los referentes mundiales en investigación de biomateriales biomédicos. El mayor número de publicaciones pertenece a Estados Unidos con el 43,7 %, seguido de China con un porcentaje de 14,6 % (ver Fig. 3a). En cuanto a universidades e institutos, el “Massachusetts Institute of Technology” con el 16,1 % y la “Universidade do Minho” con el 12,6 % dominan las publicaciones científicas.
En el ámbito latinoamericano, la región se encuentra relegada, ya que sus publicaciones no son representativas en comparación con las de otros países. Por ejemplo, en nuestro país, se encontró en Scopus un total de 7 publicaciones entre la Universidad Nacional de Colombia y la Universidad de Antioquia, evidenciándose el bajo interés de la investigación colombiana en biomateriales poliméricos.
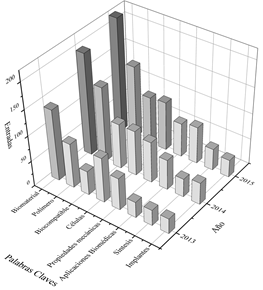
Fuente: Imagen de construcción propia utilizando como criterios de búsqueda las palabras mencionadas en la Fig. 2, fuente Scopus y VantagePoint.
Figura 2 Palabras clave en 2000 artículos de biomateriales poliméricos entre el 2013 al 2015.
2.2. Análisis tecnológico
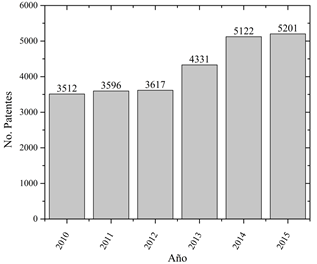
El número de patentes es elevado en comparación con el número de artículos científicos en la literatura (25.379), lo que se podría interpretar que en la temática se prioriza la protección de los productos frente a la divulgación científica. El crecimiento de los artículos científicos es acelerado, no obstante, el crecimiento en el número de patentes no es pronunciado (ver Fig. 4), mostrando una tendencia a estabilizarse. De 1.000 patentes evaluadas durante este lustro, se encontró que los temas de mayor protección son la composición de los biomateriales para dispositivos médicos ortopédicos, cardiovasculares y suturas, representando el 55,5 % de las patentes, seguido de los métodos para su elaboración con un porcentaje de 10,4 %.
De acuerdo con la Fig. 3c, los países con el mayor registro de patentes en el tema son Estados Unidos, con el 63,3%, y China, con el 13,6%. La institución con mayor número de patentes adjudicadas (ver Fig. 3d) es la Universidad de California, con el 14,4%. Las compañías de capital privado poseen el 68,9% de las patentes en el ámbito global.
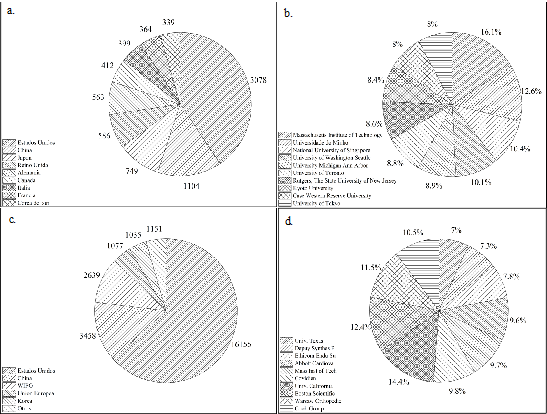
Fuente: Imagen de construcción propia utilizando como fuente Scopus y Acclaim IP.
Figura 3 Referentes mundiales en investigaciones y patentes con biomateriales poliméricos a. países líderes en investigación; b. Universidades/Institutos líderes en investigación; c. Países líderes en patentes; d. Universidades/Institutos líderes en patentes.
3. Biomateriales
La definición más reciente sobre biomateriales fue dada por Jeffrey O. Hollinger [17], quien define un biomaterial como “una sustancia (diferente a un medicamento) o conjunto de sustancias sintéticas o naturales, que pueden ser usados por un período de tiempo como parte de un sistema, el cual trata de curar, mejorar o reemplazar un órgano, un tejido o una función del cuerpo” [17,18]. El “National Institute of Health”, de Estados Unidos, agrega a esta definición que tales biomateriales deben mejorar o mantener la calidad de vida de los individuos [13]. Sobre la base de estas definiciones, los biomateriales deben ser biocompatibles [17-20].
La definición más utilizada de biocompatibilidad fue introducida en 1999 en el diccionario Williams de biomateriales, el cual la precisa como la “capacidad de un material para llevar a cabo con una respuesta inmune apropiada en una situación específica” [13]. Aunque esta definición es efímera, habla de la interacción de los biomateriales en su entorno biológico y no solo de cumplir la función de diseño, lo cual centra, desde el punto de vista investigativo, la necesidad de desarrollar biomateriales que presenten una respuesta inmune adecuada.
Uno de los requerimientos de diseño más importantes de los biomateriales son las propiedades mecánicas, ya que de estas dependerá su utilidad, por ejemplo, ortopedia, apósitos, injerto de tejido suave, entre otros. En la Tabla 1, se reportan el módulo de elasticidad y resistencia máxima de algunos biomateriales, órganos y tejidos.
Las propiedades mecánicas de los biomateriales poliméricos están en el rango de los órganos y tejidos del cuerpo humano. Cabe aclarar que en el caso que se requiera imitar el comportamiento mecánico de un tejido en particular, la alta versatilidad de los polímeros permite modular factores como el grado de polimerización, la humedad, entre otros, con el objetivo de generar diferentes propiedades. Es así como la nanocelulosa bacteriana, en estado seco puede llegar a tener un módulo de 78 GPa [21], pero en estado húmedo, tan solo de 2,9 MPa [22]. En este caso un mismo material podría ser utilizado tanto en aplicaciones óseas como de tejido blando, tan solo modificando su contenido de humedad. Otra estrategia, sería diseñar materiales híbridos como los materiales compuestos, con los cuales se pueden generar propiedades sinérgicas que responden tanto a la biocompatibilidad, como a los requerimientos de diseño.
Tabla 1 Módulo de elasticidad y resistencia máxima de diferentes biomateriales y tejidos. Microestrucutra amorfo (A), semicristalino (S).
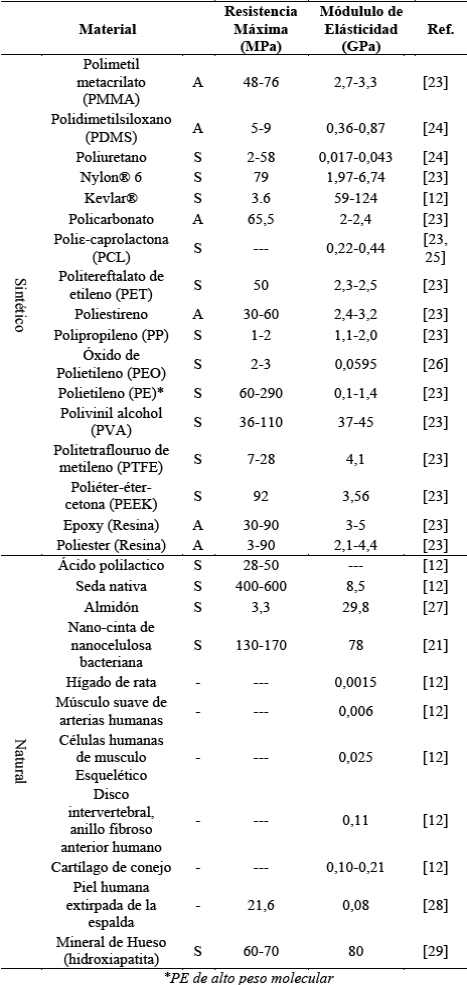
Fuente: Construcción propia.
Los biomateriales se clasifican de acuerdo con su origen, en naturales y sintéticos, siendo los naturales los que se extraen a partir de una fuente presente en la naturaleza y los sintéticos, los que se obtienen por reacciones químicas, en el caso de los polímeros a partir de su respectivo monómero [9].
4. Biomateriales poliméricos sintéticos
Los polímeros sintéticos son los materiales más versátiles. Dentro de las aplicaciones biomédicas se encuentran: lentes de contacto, vehículos farmacéuticos, materiales odontológicos, sustratos para ingeniería de tejidos, entre otros [9]. Kumbar et al. y Hollinger [9, 30], señalan que las investigaciones se deben centrar en el desarrollo de polímeros sintéticos biodegradables y/o bioadsorbibles, que puedan descomponerse a medida que avanza la regeneración del tejido [9, 30], como es el caso de los poliacrilatos, polisiloxanos, poliamidas, policarbonatos, poliésteres, poliuretanos, poliestirenos, polipéptidos sintéticos, polialquenos y polioles [9,17,31].
4.1. Poliacrilatos
Los poliacrilatos son una familia de polímeros que parten de ácidos carboxílicos insaturados. Los poliacrilatos poseen un amplio rango de aplicaciones en biomedicina [32]. Dentro de los poliacrilatos, el más usado en el mundo es el polimetil metacrilato (PMMA) (2 millones de toneladas en el 2008) [32]. El PMMA es un termoplástico transparente de menor densidad que el vidrio y con alta resistencia al impacto [9]; tiene buena biocompatibilidad con los tejidos humanos y es usado en el desarrollo de lentes rígidos intraoculares [9]. En la actualidad se ha avalado su uso en ortopedia como adhesivo para hueso, prótesis craneales y para reparaciones óseas [32,34]. Otras aplicaciones del PMMA también incluyen su uso como vehículo para la liberación de material genético, sustituyendo los vehículos virales [32].
4.2. Polisiloxanos
Los polisiloxanos, también conocidos como siliconas, están construidos por cadenas alternadas de oxígeno y silicio con grupos orgánicos laterales [35]. Estos biomateriales fueron los primeros polímeros inorgánicos desarrollados y poseen aplicaciones diversas debido a sus propiedades físico-químicas, eléctricas, mecánicas (elástomero) y de biocompatibildad [30]. Los polisiloxanos, comprenden una gran familia de resinas, aceites y gomas. Para biomédicas se destaca el polidimetilsiloxano (PDMS) [36]. El PDMS es un termoestable inodoro que no permite el crecimiento bacteriano, es resistente a la corrosión de la sangre y permeable al oxígeno [9,30]. Este polímero puede ser entrecruzado de forma tal que sus propiedades puedan imitar tejidos suaves como implantes mamarios, maxilofaciales, catéteres y articulaciones, bombas de sangre y marcapasos [36]. Una de las limitantes del uso de PDMS, es su hidrofobicidad, por lo cual el PDMS no permite la adhesión celular. En este sentido, investigaciones recientes se centran en modificarlo superficialmente con plasma, rayos gamma, láser, tratamientos de corona y “grafting”, con el objetivo de generar superficies que permitan la adhesión celular [9,36].
4.3. Poliamidas sintéticas
Las poliamidas son polímeros con grupos amidas unidos a grupos aromáticos, alifáticos o ambos, en la cadena principal del polímero. Las amidas con grupos bencenos en su cadena principal se denominan aramidas, cuyo representante principal es el Kevlar® [37]. Entre las poliamidas alifáticas, el polímero más representativo es el Nylon® y de las semiaromáticas, el Trogamid® [9]. Las poliamidas sintéticas tienen excelentes propiedades de hilado debido a la presencia de puentes de hidrógeno entre cadenas y a su alto grado de cristalinidad, lo cual incrementa su fuerza en dirección de la fibra. Las aplicaciones de las poliamidas sintéticas se centran en la liberación controlada de medicamentos. En estos casos se utilizan materiales nanocompuestos elaborados por electrohilado con biopolímeros naturales como el quitosano reforzados con poliaramidas. Comercialmente se encuentran suturas de estos biomateriales [9,38,39].
4.4. Policarbonatos
Los policarbonatos son una familia compuesta por polímeros con grupos funcionales carbonato, sintetizado por apertura de anillo, R-O-C(=O)-O-R’. Dependiendo de los sustituyentes R y R’, los policarbonatos pueden ser aromáticos o alifáticos [40]. Los policarbonatos alifáticos (PAC) son biodegrables, de fácil hidrólisis y baja respuesta fisiológica en comparación con otros materiales [40,41]. La principal aplicación del PAC es en implantes biodegradables, en donde su ventaja es que no es necesaria una segunda intervención quirúrgica para retirar el biomaterial. Para el uso de la PAC se requiere una funcionalización o copolimerización con aminoácidos o sustancias bioactivas (L-Tirosina, Desaminotirosina, tiramina, antibióticos, entre otros) [40,42,43].
4.5. Poliésteres sintéticos
Los poliésteres son polímeros con grupos esteres en su cadena principal. Son creados mediante reacciones de condensación [9] o reacciones de apertura de anillo como en el caso de la poli ε-caprolactona (PCL). Algunos poliésteres son biodegradables como en el caso de PCL [44].
La PCL se ha investigado como soporte para la ingeniería de tejidos [45]. Adicionalmente, este es un biomaterial muy versátil y permite el diseño de nanoesferas, nanofibras, espumas, entre otros, para aplicaciones en cirugía ortopédica y maxilofacial, sistemas de liberación controlada de medicamentos, suturas, refuerzo de tejidos, regeneración de nervios, etc [45].
Otro polímero que entra en este grupo es el politereftalato de etileno o PET. Es utilizado en materiales compuestos con poliuretanos, colágeno, Polimetacrilato de 20-hidroxietil, gelatina, entre otros, en aplicaciones de reemplazo de tendón, injertos vasculares, reemplazo de cartílagos y prótesis de pared abdominal [38].
4.6. Poliuretanos
Los poliuretanos (PU) están compuestos de cadenas de isocianato. La mayoría de estos son termoestables, se pueden copolimerizar con ésteres o carbonatos para generar materiales de mayor flexibilidad, tenacidad, resistencia a la abrasión y al rasgado. Los poliuretanos y sus derivados han sido aplicados en el desarrollo de corazones artificiales, catéteres, tubos de alimentación, bombas de balón intra-aorticas, guantes hipoalergénicos, prendas apósitos, sistemas de diálisis, entre otros [9]. Al igual que otros polímeros sintéticos, para evitar formaciones de coágulos, infecciones y trombosis se pueden modificar superficialmente [46].
4.7. Poliestirenos
Los poliestirenos (PS) son polímeros con grupos bencenos laterales unidos a la cadena principal del polímero, son generados a partir de reacciones de adición con un catalizador aniónico [47]. Este material tiene aplicación en ingeniería de tejidos y en la actualidad es el sustrato de referencia para el crecimiento, sostenimiento y análisis de cultivos celulares [48, 49]. Al igual que en otros polímeros es necesario realizar un tratamiento superficial para logar una buena adhesión celular. En el caso de PS, se le pueden adicionar fibronectinas, colágeno, gelatina. También se puede tratar con plasma, rayos gamma, láser, tratamientos de corona y ácidos fuertes [9,48,49].
4.8. Polipéptidos sintéticos
Los polipéptidos sintéticos son desarrollados por apertura de anillo a partir de N- carboxianhídridos de α-aminoácidos. Los sistemas biológicos naturales tienen la capacidad de producir polipéptidos y copolímeros autoensamblados, con secuencias y composiciones específicas. Sintéticamente, se han desarrollado homopolipéptidos como la poli L-lisina y el poli L-ácido aspártico y copolímeros hasta de 3 bloques [50]. Estos polipéptidos tienen la ventaja de generar estructuras que pueden imitar la matriz extracelular de las células, lográndose muy buena biocompatibilidad y adhesión celular. Sin embargo, aún no se logran las estructuras complejas que se encuentran en la naturaleza [50].
Las principales aplicaciones de estas proteínas son vehículos para sistemas de liberación controlada de medicamentos, soportes en ingeniería de tejidos, adhesivos, antimicrobianos, inmuno-modulantes y agentes de modificación superficial de polímeros sintéticos y naturales [40,45,50-52].
4.9. Poliolefinas
Las poliolefinas son los polímeros estructuralmente más simples y están compuestos por cadenas alifáticas. En el ámbito internacional se consideran poliolefinas al polipropileno y al polietileno [53]. El polipropileno (PP), por ejemplo, es utilizado para suturas y el polietileno (PE) de alto peso molecular y sus materiales compuestos, son ampliamente utilizados en aplicaciones ortopédicas de reemplazo total de cadera, de rodilla y, en general, como reemplazo de hueso [38,54].
4.10. Polioles
Los polioles son polímeros con grupos hidroxilos en su estructura, como el polivinil alcohol (PVA) y sus derivados oxidados como el polióxido de propileno (PPO) y el óxido de polietileno (PEO) [30,55,56]. El PPO y el PEO se pueden copolimerizar con poliuretanos para generar cadenas con segmentos fuertes y suaves, aumentando la tenacidad del material final. Dentro de las aplicaciones de estos copolímeros se encuentran marcapasos cardíacos, bombas de infusión, diálisis peritoneal, entre otros [17].
El PVA es sintetizado a partir del acetato de vinilo seguido de la polimerización de este a polivinil acetato (PVAc) y posterior hidrólisis a PVA [57]. El PVA es un polímero soluble en agua, que puede generar hidrogeles mediante entrecruzamiento químico o enlazamiento físico [57-60]. Adicionalmente, con el PVA se pueden desarrollar materiales compuestos y mezclas. En la literatura se reportan mezclas PVA/celulosa, PVA/quitosano, PVA/colágeno, PVA/hidroxiapatita, PVA/almidón, PVA/PEO entre otras [59].
Las aplicaciones del PVA son muy variadas, entre estas se encuentran: córneas artificiales, lentes de contacto, páncreas artificiales, hemodiálisis, reemplazo de cartílagos, sistemas de liberación controlada de medicamentos, lágrimas artificiales, soportes para ingeniería de tejidos, entre otras. Las anteriores aplicaciones son posibles debido a sus características hidrófilas y a su carga parcial negativa [57,59-61].
4.11. Haloalcanos
Los haloalcanos son compuestos orgánicos sustituidos con halógenos. En el caso de compuestos poliméricos halogenados, estos se pueden obtener a partir de adición electrofílica con alquenos, adición de Markovnikov, radicales libres, entre otros [47]. Muchos compuestos halogenados pueden ser tóxicos, sin embargo dentro de esta familia se destaca el politetrafluoruro de metileno (PTFE), también conocido con el nombre comercial de Teflon® [23]. En aplicaciones biomédicas sobresale por sus buenas propiedades mecánicas, las cuales lo sitúan como candidato para reemplazo de cartílagos, huesos, tendones y como material para cirugías de reemplazo total de cadera [38].
4.12. Policetonas
Las policetonas son consideradas como termoplásticos de ingeniería de altas prestaciones, ya que pueden llegar a tener temperaturas de trabajo cercanas a los 220 ºC y resistir leves exposiciones por encima de los 320 ºC. En esta familia se destaca el Poli éter éter cetona (PEEK). El PEEK se produce mediante el desplazamiento nucleofílico de haluros aromáticos activados en disolventes polares a través del proceso Friedel-Crafts [23]. Este polímero posee excelente resistencia al impacto y química [23]. En biomedicina estas propiedades lo hacen idóneo como material para placas óseas, tornillos, clavos intramedulares y aplicaciones que requieran un alto desempeño mecánico [38].
4.13. Resinas termoestables
Las resinas termoestables se obtienen a partir del curado de resinas termoplásticas precursoras. Estas resinas, por lo general líquidas, se transforman en sólidos duros mediante entrecruzamiento [62]. Las resinas epoxi y poliéster cubren una amplia gama de productos químicos, dentro de los que se encuentran las aplicaciones biomédicas.
Los precursores de las resinas epoxi son la epiclorohidrina y bisfenol A, y los del poliéster son ácidos orgánicos dibásicos y alcoholes polivalentes [63]. Estas resinas suelen ser frágiles, por lo cual se utilizan reforzadas con fibra de vidrio (FV), de carbono (FC), Kevlar®, entre otros [62]. En aplicaciones biomédicas sobresale el uso de fibra de carbono, debido a que generan menor efecto alergénico. Materiales compuestos de fibra de carbono se usan en aplicaciones odontológicas, placas óseas, tornillos, fijaciones externas (brindan igual resistencia y un menor peso en comparación a las metálicas) y reemplazo total de cadera [38].
5. Biomateriales poliméricos naturales
Los biomateriales poliméricos naturales son polimerizados en seres vivos, ya sean animales, plantas, microorganismos u hongos, y posteriormente aislados para su uso. Este tipo de biomateriales y sus derivados tienen la ventaja de poseer alta biocompatibilidad, buenas reacciones inmune in vivo, funcionalidad y durabilidad [9]. Estos polímeros pueden clasificarse en proteínas, poliésteres naturales y polisacáridos [44].
5.1. Proteínas
Las proteínas son polímeros naturales compuestos de L-α-aminoácidos. En la naturaleza se encuentran alrededor de 20 aminoácidos y su estructura puede ser descrita desde 4 niveles: la primaria se refiere a la secuencia de los aminoácidos presentes, la secundaria es formada por el doblamiento de las cadenas polipéptidas en α hélices o β hojas, la terciaria está formada por el doblamiento de las estructuras secundarias en una estructura tridimensional y la cuaternaria por múltiples subunidades de estructuras terciarias [30]. En esta clasificación sobresalen el colágeno, la queratina y la fibroína [10].
5.1.1. Colágeno
El colágeno es la proteína más abundante en los animales, en donde representa alrededor del 30% del total de las proteínas. Es el mayor componente de la matriz extracelular y es de vital importancia en la resistencia mecánica de tejidos, órganos y la regulación fisiológica [64]. El uso de colágeno se expandió rápidamente por la industria farmacéutica y actualmente es usado como biomaterial para el desarrollo de la ingeniería de tejidos y sistemas apósitos, piel artificial, injertos de hueso, córneas, implantes de tendones, regeneración de nervios, piel y órganos. Todo lo anterior debido a su baja toxicidad y alta adhesión celular [10,64]. Existen 21 tipos de colágeno. El colágeno Tipo I, es el más investigado debido a su gran capacidad de formar fibras, su estabilidad térmica y su resistencia a la tracción. La obtención de este biopolímero se hace mediante su aislamiento de piel de bovino, de cerdo, entre otros [10].
5.1.2. Queratina
La queratina es una proteína insoluble en agua, asociada a fibras intermedias de los citoplásmidos epiteliales y apéndices epidérmicos (pelo, lana, garras, uñas, etc.), en la actualidad se puede aislar para obtener películas, fibras, esponjas, hidrogeles y soportes celulares [65]. Las aplicaciones de la queratina en biomedicina aún están en investigación. Sin embargo, mediante estudios in vivo e in vitro se ha demostrado que induce la proliferación, la migración y la diferenciación celular y, además, promueve la regeneración de tejido nervioso [65].
5.1.3. Fibroína
La fibroína es una proteína fibrosa de la seda, compuesta por la unión de los aminoácidos Glicina, Alanina y Serina. La fibroína es biocompatible, biodegradable, permeable, presenta mínima reacción inflamatoria in vivo y alta resistencia mecánica. Actualmente, la fibroína se ha empleado para la fabricación de matrices y cultivos de células para la formación de una gran variedad de tejidos, en los que se incluye el cartílago, ya que facilita la adhesión y la proliferación celular [66,67]. También se ha usado en suturas y recubrimientos para heridas [12].
5.2. Poliésteres naturales
Los poliésteres naturales están compuestos principalmente por los polihidroxialcanoatos (PHAs) producidos por fermentación bacteriana de lípidos o azúcares como reserva de energía [68]. Los PHAs se forman como esferas en el cuerpo del microorganismo, debido a sus altos costos de producción, han tenido un nicho de mercado reducido a las aplicaciones biomédicas, en donde se usan para suturas, implantes, válvulas cardíacas o “stents” y soportes para regeneración de hueso [69].
5.3. Polisacáridos
Son carbohidratos constituidos de azúcares sencillos unidos por enlaces glucosídicos. En aplicaciones biomédicas los mayores representantes son la celulosa, el almidón, el quitosano, el alginato y el hialuronato que poseen como estructura básica la glucosa [44,47].
5.3.1. Almidón
El almidón está compuesto por α-D-glucopiranosa unidas por enlaces (1-4) y (1-6). Este es un polímero ampliamente disponible, renovable, de bajo costo, y biodegradable. El procedimiento general para la producción de materiales a partir del almidón, implica su irrupción granular mediante la combinación de temperatura, cizalla y un agente plastificante. El material resultante es conocido como almidón termoplástico (TPS) [70]. Las aplicaciones biomédicas del almidón son la funcionalización de soportes en ingeniería de tejidos, sistemas de liberación controlada de medicamentos (tabletas y pastillas) y microencapsulación de componentes bioactivos [71].
5.3.2. Celulosa
La celulosa es el biopolímero renovable más abundante en la naturaleza. Está conformada por unidades de D-glucosa, unidas mediante un enlace glucosídicoβ-1,4. Este material forma parte de varias especies vivas (plantas, animales, bacterias y algunos hongos) [72,73]. En la mayoría de estos actúa como material estructural, caracterizándose por su hidrofilicidad, biodegradabilidad, gran capacidad para ser modificada químicamente y alta cristalinidad [58,73-80].
De cualquiera de las fuentes mencionadas, cuando alguna de las dimensiones de la celulosa se encuentra por debajo de los 100 nm se denomina nanocelulosa.
La nanocelulosa bacteriana (NCB) es un producto extracelular de bacterias Gram-negativas [81]. Dentro de estas se encuentra la Gluconacetobacter sp, estudiada debido a su eficiencia en la producción de celulosa y adaptabilidad a diferentes medios de cultivo [82].
En el ámbito mundial se pueden encontrar productos cosméticos con nanocelulosa bacteriana como ingrediente en cremas humectantes capaces de penetrar la piel y llevar agentes bioactivos, modificante reológico, estabilizante de suspensiones, entre otros [83]. Compañías como L’Oreal y Procter & Gamble actualmente tienen en el mercado productos como Cellulon® y máscaras faciales exfoliantes de NCB [83]. Bionext®, una empresa brasilera, actualmente comercializa NCB como un sustituto temporal de piel artificial [84].
5.3.3. Quitosano
El quitosano es polisacárido natural derivado de la quitina. Es un copolímero de β-(1-4) glucosamina y N-acetil glucosamina. La biocompatibilidad, la biodegradabilidad (mediada por lisozimas), la no toxicidad y la similitud química del quitosano con los componentes de la matriz extracelular de los tejidos como el sulfato de condroitina, el sulfato de queratán y el ácido hialurónico, hacen que este biomaterial sea apropiado para su uso en la ingeniería de tejidos, específicamente, en la regeneración y reparación de tejidos como la piel, el hueso, el cartílago y los nervios, [85-88]. La citocompatibilidad del quitosano y biodegradabilidad del quitosano se ha observado in vitro con células del miocardio, endoteliales y epiteliales, fibroblastos, hepatocitos, condrocitos y queratinocitos [87,89-93].
5.3.4. Ácido hialurónico
El ácido hialurónico tiene importantes funciones estructurales y biológicas en los tejidos animales. Este polisacárido se compone de sub-unidades de β-(1-4)- ácido-D-glucurónico y β-(1-3)-N-acetil-D-glucosamina. Tiene una gran capacidad para la lubricación y absorción de agua, que influye en varias funciones celulares, como la migración, la adhesión y la proliferación [94-96].
5.3.5. Alginato
El Alginato es un polisacárido aniónico constituido por los ácidos D-manurónico y L-gulurónico. Su fuente de obtención son las paredes celulares de las algas marinas pardas. Es un material biocompatible y biodegradable. En el cultivo de células in vitro ha mostrado que ayuda a mantener su fenotipo, pero puede generar reacciones inflamatorias después de su implante in vivo. El alginato presenta poca adherencia celular pero combinado con péptidos u otros polímeros, como el quitosano, se mejora la adhesión y la proliferación celular in vitro [97,98].
En la Fig. 5 se muestra un resumen de las aplicaciones biomédicas de los biopolímeros sintéticos y naturales, al igual que algunos materiales compuestos a partir de estos.
6. Reacciones inmunes de los biomateriales poliméricos
Aunque por definición los biomateriales se diseñan para que sean biocompatibles y puedan mejorar la calidad de vida de los individuos, la complejidad de los sistemas biológicos hace que esta propiedad sea difícil de cumplir. Los ensayos de biocompatibilidad se evalúan bajo estándares internacionales (Normas ISO o ASTM) en modelos celulares, pruebas de hemocompatibilidad, toxicidad, genotoxicidad, mutagenicidad, carcinogenicidad, modelos animales, entre otros [99-101]. No obstante, los biomateriales pueden presentar reacciones inmunes, incluso años después de ser implantados en el cuerpo humano, lo cual es una preocupación en el ámbito investigativo. Por ejemplo, se estima que en el 2015 se publicaron alrededor de 9205 artículos científicos referentes a la respuesta inmune (fuente: Scopus).
La respuesta inmune no es algo trivial e incluye una cascada de reacciones de moduladores inmunes [102,103] en donde se identifican: interacciones de los biomateriales con la sangre, formación de una matriz provisional, respuesta inflamatoria aguda y crónica, desarrollo de tejido de granulación, reacción de cuerpo extraño y fibrosis [92,104,105]. Muchas de estas respuestas inmunes se dan a largo plazo o pueden ser desencadenadas de repente [102,106], lo que dificulta su compresión por parte de los investigadores.
Por ejemplo, los polisiloxanos o siliconas que se han usado en cirugías estéticas desde 1961 y, aunque fueron aprobados por la “Food and Drug Administration” (FDA), aún no se tiene conocimiento completo de la interacción de estos con el cuerpo humano. Investigaciones recientes señalan que los componentes de bajo peso molecular de los implantes de silicona pueden migrar hacia otros tejidos, desencadenando respuestas inmunes [24].
Dentro de los biomateriales naturales, el aislamiento del colágeno de fuentes exógenas (animales) es un desafío para los investigadores [107]. Reportes de Keane et. al (2012) acerca de la eficacia en el aislamiento del colágeno demostraron que existe una asociación entre la respuesta inflamatoria con la presencia de proteínas exógenas en el biomaterial [107].
Requema et al. (2011) exponen en su artículo, casos clínicos de reacciones adversas de implantes de tejido suaves inyectables de biomateriales como el colágeno, PLA, ácido hialurónico, silicona líquida, PMMA e hidrogeles de poliamidas y polioles [106]. Los anteriores biomateriales generaron edemas, granulomas y reacciones inflamatorias en pacientes en el contorno del rosto y otras partes del cuerpo [106].
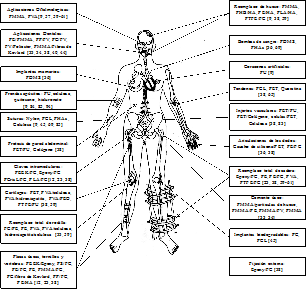
Fuente: Construcción propia.
Figura 5 Aplicaciones biomédicas de biopolímeros sintéticos y naturales. FC: fibras de carbono, FV: fibras de vídrio, PMMA: Polimetil metacrilato, PS: Poliestireno, PP: Polipropileno, PE: Polietileno de alto peso molecular, PLA: Poli L-ácido láctico, PC: Policarbonato, PEEK: Poliéter-éter-cetona, HA: hidroxiapatita, PU: poliuretano, PTFE: Politetraflouruo de metileno, PET: Politereftalato de etileno, PELA: Copolímero de bloque ácido láctico y polietilenglicol, PCris: Polímero en cristal líquido, PHAs: Polihidroxialcanoatos, PDMS: Polidimetil meta siloxano, PEO, polióxido de etileno.
7. Conclusiones
Los polímeros naturales y sintéticos han sido de gran ayuda en la biomedicina desde tiempos ancestrales hasta nuestra era. Debido a la versatilidad de sus propiedades mecánicas, biodegradabilidad, biocompatibilidad, entre otras, han permitido su vigencia en el tiempo y su permanencia como temática de punta a través de los años (5.900 publicaciones en el 2015). La posibilidad de explorar copolímeros, mezclas, materiales compuestos y modificaciones superficiales, abre el panorama hacia nuevos desarrollos de dispositivos médicos e ingeniería de tejidos y medicina regenerativa.
La biocompatibilidad y respuesta inmune que estos polímeros puedan generar, es una preocupación constante, en gran medida a que estos fenómenos aún no están completamente dilucidados y, por ende, las interacciones biológicas del tejido humano con los biomateriales son desconocidas. A medida que se puedan conocer estos mecanismos se estaría más cerca de desarrollar biomateriales de altas prestaciones para el mejoramiento de la calidad de vida de los individuos.