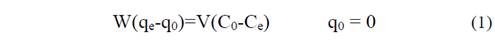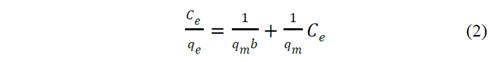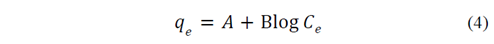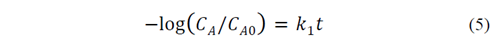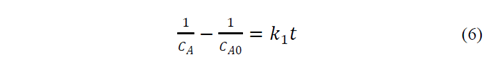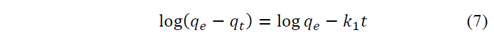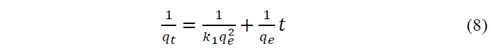1. Introducción
Como consecuencia del desarrollo y constante crecimiento industrial y económico del sector manufacturero y minero, se ha presentado un incremento en la generación de residuos sólidos tipo ceniza provenientes de las plantas termoeléctricas de dichas industrias. Particularmente en Colombia se generan alrededor de 600 kt/año de (FA) de cenizas volantes [1], las cuales en su mayoría no se aprovechando debidamente. Dada la problemática ambiental que generan este tipo de residuos se hace necesario la búsqueda de alternativas de manejo para convertir estos subproductos sólidos en productos de mayor valor agregado. Estos residuos poseen una composición química alta en sílice y alúmina mayor al 70%, lo cual los convierten en potenciales precursores para la síntesis de zeolitas.
La obtención de zeolitas a partir de cenizas volantes ha sido reportada en diversos trabajos bajo el método de síntesis hidrotérmica [2-5]. Los productos obtenidos luego del proceso cubren un amplio rango de estructuras zeolíticas pero con bajo rendimiento en la conversión. Sin embargo, con el fin de mejorar el rendimiento de la reacción durante la síntesis, se han estudiado otros métodos como la fusión alcalina previa a la síntesis hidrotermal. Dicho tratamiento facilita la formación de sales de aluminosilicatos de sodio que son altamente activos y solubles en agua, promoviendo a su vez la formación de fases cristalinas de zeolitas con alta de capacidad de adsorción e intercambio catiónico (CEC) [3,6-8].
Es necesario subrayar que las zeolitas son materiales de gran importancia a nivel industrial principalmente como catalizadores, intercambiadores iónicos y adsorbentes. Si bien, en los últimos 20 años el uso de estos materiales en síntesis inorgánica de productos intermedios y químicos finos ha tenido gran crecimiento, también cabe señalar que su uso en aplicaciones ambientales ha aumentado considerablemente gracias a su alta capacidad de adsorción e intercambio iónico. En efecto, las propiedades físico-químicas de estos materiales los hacen bastante útiles en procesos para la remoción de metales pesados o para el ablandamiento de aguas, e incluso residuos nucleares, siendo de especial utilidad zeolitas con alto contenido de aluminio como las zeolitas tipo A y X [3,8,9].
Entra las diversas aplicaciones ambientales de las zeolitas se destaca la remoción de cromo, aplicación en la cual dichos materiales han demostrado ser altamente eficientes. Por lo que se refiere al cromo, este es uno de los metales de mayor uso a nivel industrial, puesto que está involucrado en gran variedad de procesos como curtientes, pigmentos y conservantes textiles, aleaciones, pinturas, catalizadores, agentes anticorrosivos, fungicidas, conservantes de madera, recubrimientos metálicos, electrogalvanizados, entre otros [10]. Actualmente, no se encuentran tecnologías necesarias para la remoción de este metal en aguas residuales, inclusive se han encontrado procesos industriales en los cuales no se presenta ningún control de este contaminante en los residuos. A causa de ello el estudio de materiales y tecnologías que puedan ser aplicados para la remoción de cromo en distintos procesos industriales se ha convertido en un tema de investigación profunda.
De acuerdo a lo anterior, en este artículo se propone el desarrollo de procesos a escala de laboratorio para la producción de zeolitas tipo A y X a partir de residuos generados por industrias locales de Antioquia, con el fin de evaluar su capacidad como adsorbente en la remoción de Cr3+, y evaluar los fenómenos físico-químicos y la cinética que tiene lugar durante la adsorción del metal mediante un ajuste matemático a tres modelos isotérmicos de adsorción Langmuir, Freundlich y Temkin; y cuatro perfiles cinéticos.
2. Metodología experimental
2.1. Selección de residuos industriales
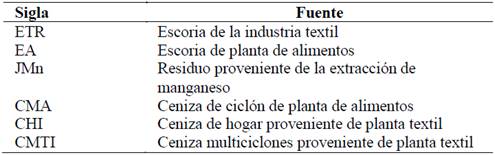
Luego de un estudio de diferentes residuos generados en las industrias del departamento de Antioquia, se seleccionaron diversas actividades con alto impacto ambiental en el medio. Dicha selección buscaba intervenir actividades empresariales que fueran representativas en el departamento, y en donde la cantidad de residuos producidos fuera significativa. En particular, las actividades económicas seleccionadas fueron principalmente la explotación de minas y canteras e industrias manufactureras, como se muestra en la Tabla 1.
2.2. Síntesis de zeolitas
Para la síntesis de las zeolitas a partir de los residuos seleccionados en la Tabla 1, se mezcló homogéneamente una cantidad del residuo con hidróxido de sodio (NaOH Merck) en una relación 1/1.2 en peso. Dicha mezcla se calcinó en una cápsula de platino a 700°C durante tres horas a una velocidad de 1°C/min, en una etapa conocida como fusión alcalina. El sólido resultante se mezcló con agua desionizada en una proporción de 4.89 mL H2O/g residuo, y se coloco en agitación continua por 24 horas. El gel resultante se dispuso en reactores de acero inoxidable con recubrimiento interno de teflón para la cristalización, a una temperatura de 100 °C, durante varias horas. Para minimizar efectos en la co-cristalización de fases semicristalinas se convino, (i) ajustar la relación Si/Al en el gel de síntesis a un valor cercano a 1, mediante la adición de alúmina pseudobohemita (NaAlO2 Riedel-de Haen) en el gel de síntesis, y (ii) utilizar distintos tiempo de cristalización de 7 y 24 horas. Finalmente, el sólido obtenido se recuperó por filtración al vacío y secado a 60°C por 8 horas.
2.3. Caracterización de los materiales
La composición química de los residuos y materiales obtenidos luego de la transformación hidrotérmica fue determinada por fluorescencia de rayos - X en un espectrómetro PANalytical® modelo Axios de longitud de onda dispersiva con fuente de Rodio. Las muestras fueron perladas en una relación de 1/7 g muestra/g de fundente. De igual forma, se identificaron las distintas fases cristalinas presentes en los sólidos por Difracción de Rayos X (XRD) en un difractómetro PANalytical® Empyrean, equipado con tubo de rayos - X de Cu en configuración θ -2 θ. La recolección de datos se llevó a cabo en el rango 2θ (5-50°), con un tamaño de paso de 0.02°. Los difractogramas fueron analizados mediante refinamiento Rietveld semicuantitativo en el programa Xpert Highscore Plus V3.0 utilizando la base de datos (ICSD) suministrado por PANalytical®.
Por otra parte, la morfología de los productos sintetizados fue determinada por microscopía electrónica de barrido (SEM) en el equipo Jeol JSM-6490LV, usando como detector multielementos de estado sólido de electrón retrodisperso y una resolución de 3.0 mm. Los materiales fueron preparados por deposición del producto en un portamuestras de aluminio usando discos de carbón adhesivo recubiertos con oro para reducir la carga estática. Finalmente, el área BET y volumen de microporos de las zeolitas sintetizadas fueron determinados en un equipo Micromeritics ASAP 2020 Plus, con 100 mg de zeolita, desgasificación a 90°C por una hora y posterior calentamiento a 10°C/min hasta 350 °C por 8 horas.
La capacidad de intercambio iónico efectiva se determinó mediante un proceso en el cual 10 g del material se puso en contacto con 500 mL de una solución de NH4Cl de concentración molar 0.25 mol/L, bajo agitación constante durante 24 horas; tiempo después del cual se analizó el contenido de sodio (Na) y potasio (K) por adsorción atómica.
2.4. Remoción de Cromo
Se realizaron estudios de sorción de cromo por lotes para determinar los datos de equilibrio y velocidad del sistema. Para ello se usaron distintas soluciones de nitrato de Cromo (CrNO3 9H20) de 42, 88, 135, 150 y 200 ppm preparadas con agua destilada. En particular, se adicionaron 50 mL de estas soluciones a distintos balones volumétricos que contenían diferentes cantidades del material sintetizado (0.1 g, 0.175 g y 0.25 g). Dichas soluciones fueron agitadas magnéticamente y filtradas al vacío luego de ciertos tiempos de contacto con el adsorbente (5, 10, 20, 60 y 90 min). Finalmente, la solución sobrenadante de cromo fue analizada por absorción atómica.
Es preciso definir que la concentración de cromo retenida en el adsorbente es calculada como la diferencia entre la concentración original de la solución y la concentración final en solución luego del equilibrio. El balance de masa puede ser expresado mediante la eq. 1 como:
Donde q0 y qe son las concentraciones iniciales y en el equilibrio del adsorbente respectivamente, y C0 y Ce las concentraciones iniciales y en el equilibrio de la solución respectivamente.
La aplicación exitosa del proceso de adsorción requiere del desarrollo de los modelos característicos (Langmuir, Freundlich y/o Temkin) y de los parámetros cinéticos que rigieron la sorción del metal. Por ello, el efecto del tiempo de contacto, la cantidad de adsorbente y la concentración del adsorbato fueron estudiadas.
3. Resultados y discusión
3.1. Residuos industriales
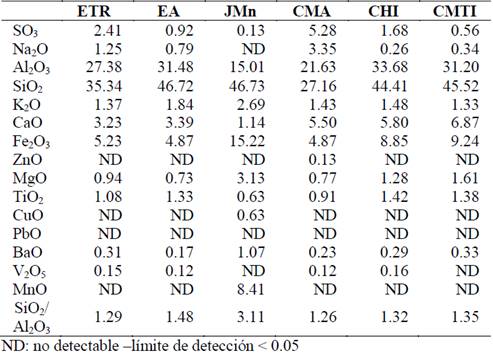
En la caracterización físico química de los residuos industriales se utilizaron en específico dos técnicas convencionales. En la primera de ellas se determinó la composición química mediante fluorescencia de rayos - X, como se muestra en la Tabla 2, permitiendo hallar la relación SiO2/Al2O3 y la presencia de distintos elementos que se encuentran en los residuos. Dicha composición es determinante al momento de seleccionar los residuos que serán usados para la obtención de las zeolitas, puesto que como se ha concluido en diversos estudios la relación SiO2/Al2O3 es uno de los parámetros más importantes en la síntesis [5,11]. Particularmente, una relación SiO2/Al2O3 de 1.2 es el valor apropiado para obtener materiales tipo zeolita de bajo contenido de Si con una alta capacidad de intercambio iónico.
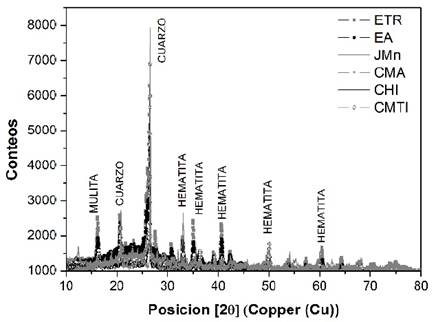
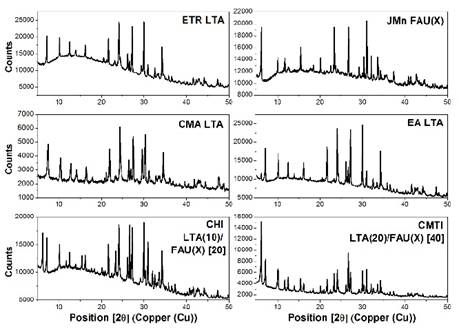
Por otro lado, mediante difracción de rayos X se logró determinar la presencia de distintas fases cristalinas en los residuos, tal como se muestra en la Fig. 1. Como resultado, se lograron identificar tres fases cristalinas principales correspondientes al cuarzo, la mulita y la hematita.
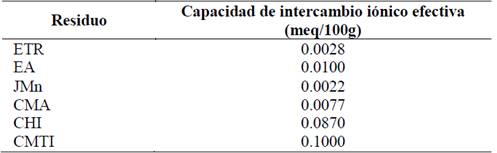
Adicionalmente, se determinó la capacidad de intercambio iónico efectiva de estos residuos. Como era de esperarse la capacidad de intercambio iónica de estos residuos se encuentra muy por debajo de los valores encontrados para otras fases minerales y zeolitas con alta capacidad de intercambio (caolinita, 3-15 meq/100g; vermiculita 100-150 meq/100g, bentonita, 100 meq/100g, faujasita, 390 meq/100g, mordenita 230 meq/100g) [10] como se muestra en la Tabla 3.
3.2. Caracterización zeolitas
El sólido obtenido luego de realizar el tratamiento térmico (fusión alcalina) e hidrotérmico a los residuos seleccionados fue caracterizado bajo diversas técnicas. Como primer paso se realizó una identificación estructural del solido por medio de difracción de rayos - X, donde se pudo observar un decrecimiento en la intensidad de las reflexiones de cuarzo y mulita en los residuos utilizados, conjunto con la aparición de picos correspondientes a las fases LTA, FAU, CAN, SOD (ver Fig. 2). La presencia de estas fases revela una secuencia de reacciones durante la transformación de los residuos, que podría comenzar con la formación de un material amorfo seguido por la subsecuente co-cristalización de las fases LTA, FAU, LTA-FAU y/o CAN y SOD.
Estos resultados son consecuentes con el carácter meta-estable de las fases zeolíticas obtenidas. La aparición conjunta de fases meta estables se ve favorecida por las diferencias en la relación Si/Al y el efecto de los cationes presentes en las materias primas y/o residuos.
Cabe señalar que se pudo observar ciertas características específicas en el proceso de síntesis. Por un lado, las zeolitas sintetizadas a partir de los residuos EA, CMTI, y CHI, evidenciaron el aumento en la formación de zeolita LTA luego de la adición de NaAlO2. Simultáneamente, el aumento en el tiempo de cristalización condujo a un aumento de la fase FAU en todos los casos de síntesis, independiente de la adición de NaAlO2. No obstante, la proporción de la fase FAU disminuyo paulatinamente en relación al contenido de potasio en el gel de síntesis, promoviendo así la formación de la fase LTA (CMTI ≥ CMA ≥ CHI ≥ EA ≥ JMn). Particularmente, este hecho se manifiesta debido a que el potasio no tiene la capacidad de compensar las numerosas cargas negativas, dado su gran volumen con respecto al sodio, facilitando así la sustitución de Si por Al (reduciendo la aparición de cargas negativas) en la estructura e induciendo la formación de la zeolita FAU, que posee una relación Si/Al más alta.
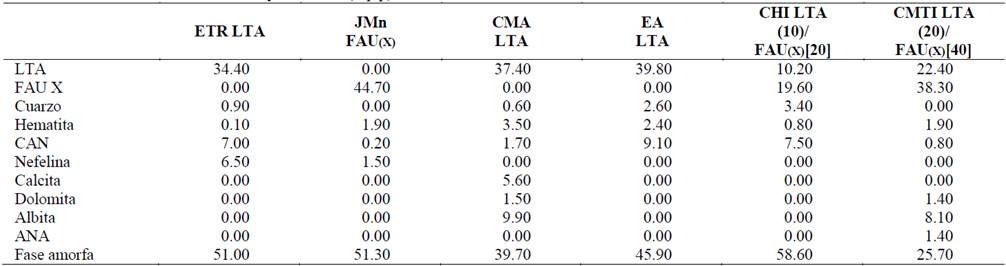
De igual manera por medio de difracción de rayos - X se puede realizar un análisis semicuantitativo más detallado de los porcentajes en peso de la fase amorfa y cristalina para cada producto. En general, tal como se muestra en la Tabla 4, se observó aparte de la formación de zeolitas, la alta proporción de fase amorfa que puede ser referida a la presencia de geopolímeros [1,12]. Específicamente, los geopolímeros pueden ser identificados como el equivalente amorfo de estructuras cristalinas de aluminosilicatos que coinciden en composición química con las zeolitas, pero que presentan una estructura desordenada a diferencia de la estructura ordenada propia de las zeolitas [13].
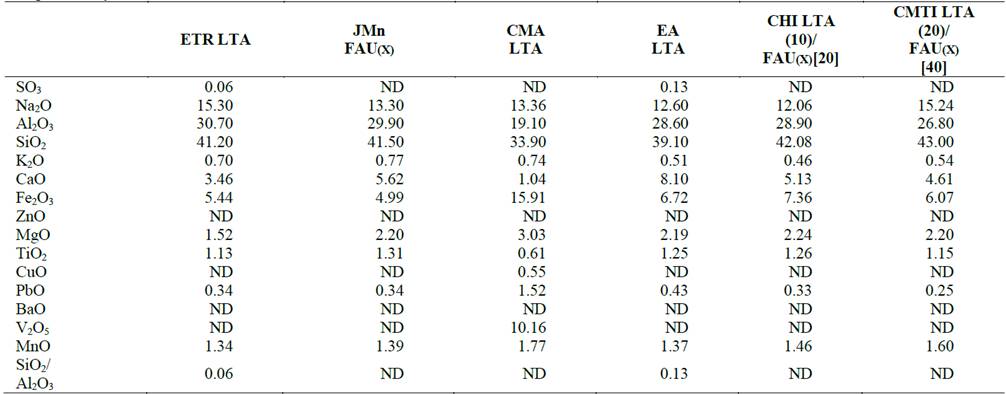
Además de la identificación estructural arrojada por difracción de rayos - X, los sólidos sintetizados se caracterizaron por fluorescencia de rayos - X para determinar su composición química. De los resultados de fluorescencia de rayos X mostrados en la Tabla 5, se observa que el porcentaje en peso de los materiales sintetizados cambia luego de los tratamientos realizados.
En general, las impurezas de los residuos de partida disminuyen bien sea por la acción de los tratamientos térmicos e hidrotérmicos y/o por efectos de dilución luego de la adición de nuevos componentes en el gel de síntesis como la alúmina y el NaOH. No obstante, los porcentajes de Na+ aumentan significativamente debido a la incorporación de NaOH como agente mineralizante en la síntesis de los materiales. Este hecho en específico se debe a la captura de iones Na+ por parte de la estructura zeolitica, con el fin de neutralizar la carga negativa del aluminio en la zeolita y/o geopolímero cuando estos se han formado [14].
Por otra parte, luego de conocer detalladamente las características estructurales y químicas de los sólidos sintetizados, fue necesario la caracterización morfológica y textural con el fin de tener un mapa de caracterización más completo del sólido.
En primer lugar, la morfología del solido fue identificada por microscopia electrónica de barrido. En las microfotografías obtenidas y presentadas en las Fig 3-6, se logra evidenciar la presencia de agregados policristalinos de prismas tetragonales, y la aparición de agolomerados lefisfericos alrededor de la superficie de los prismas tetragonales, tal como se muestran en la Fig. 3 y 4. Particularmente, los aglomerados lefisfericos son característicos de las fases sodalita y cancrinita, mientras los prismas tetragonales representan una morfología típica de cristales de las fases LTA y FAU [15,16]. Además de ello en las Fig. 5 y 6, se observa un crecimiento epitaxial de una morfología cubica perfecta, característica de la fase LTA, con una interpenetración de una morfología octaédrica, característica de la fase FAU. Estos agregados son similares a los crecimientos epitaxiales entre las fases LTA y FAU descritos por varios autores [17-19].
Por otra parte, el tamaño de partícula de las zeolitas sintéticas determinada en las micrografías correspondió a los siguientes valores: 6 µm para ETR LTA, 1 µm para EA LTA, 3 µm para JMn FAU(X), 4 µm para CMA LTA, 1.5 µm para CHI LTA(10)/FAU(X)[20], y 2 µm para CMTI LTA(20)/FAU(X)[40]. Además de ello, también se pudo identificar pequeñas trazas de cenosferas de alrededor de 1 µm. Finalmente estas características descritas anteriormente corresponden a los patrones morfológicos de las fases halladas por difracción de rayos - X.
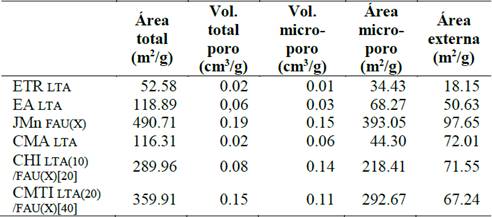
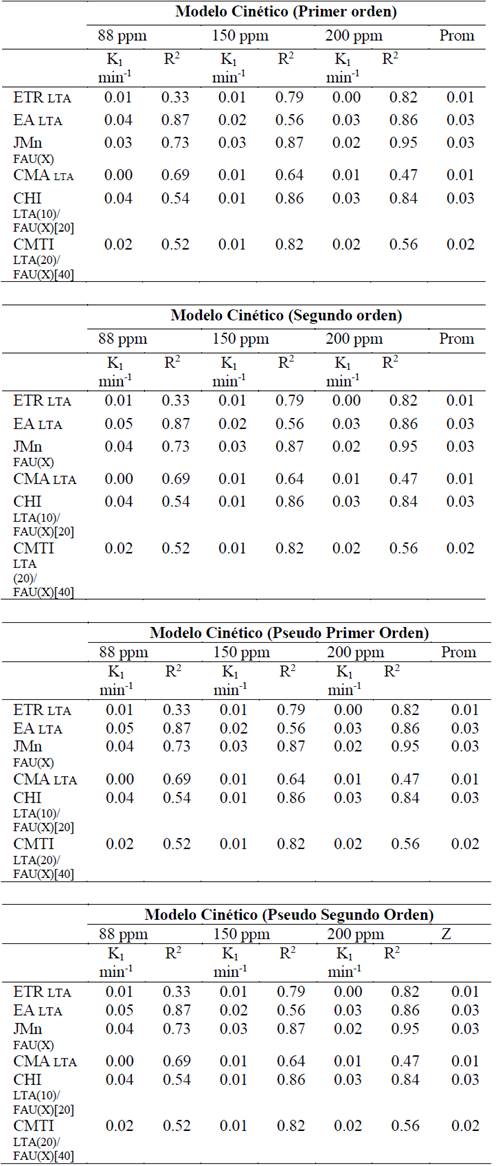
Avanzando en la caracterización textural, se pudo determinar mediante fisisorción de N2 las propiedades texturales de los materiales sintetizados, tal como se resume en la Tabla 6. Particularmente, las isotermas de adsorción de N2 mostradas en la Fig. 7-a para los materiales sintetizados, presentan una isoterma tipo IV, según la clasificación IUPAC, con una histéresis a una presión relativa de 0.4. Así mismo, las isotermas de desorción de N2 presentan una histéresis tipo H1, que evidencia la aglomeración de partículas en el sólido [20], características en su totalidad típicas de sólidos microporosos.
Fuente: Autores
Figura 7 (a) Isotermas de adsorción de N2, (b) Distribución de tamaño de poro (DFT).
No obstante y a pesar de que las isotermas de adsorción-desorción presentadas por los todos los sólidos son del mismo tipo, la cantidad de volumen adsorbida por cada zeolita es diferente, e incrementa cuando la fase cristalina mayoritaria es del tipo FAU. Dicha característica es más evidente cuando se grafica la distribución de tamaño de poro (DFT) mostrado en la Fig. 7-b, en donde se observa un incremento en la formación de microporos alrededor de 0.6 nm para las zeolitas JMn FAU(X), CHI LTA(10)/FAU(X)[20] y CMTI LTA(20)/FAU(X)[40] comparado con las zeolitas ETR LTA, EA LTA y CMA LTA.
3.3. Remoción de Cr(III)
Finalmente, luego de haber caracterizado el material y tener certeza sobre sus propiedades físico-químicas, se procedió a realizar las pruebas de remoción de cromo en sistemas por lotes usando los materiales sintetizados. En particular se realizaron un total de 450 experimentos para la remoción catiónica de Cr3+, en donde se tuvo en cuenta variables como la concentración del ion metálico, la cantidad de zeolita sintetizada y el tiempo de contacto. La correlación en estos datos medida a través del coeficiente de correlación por el paquete estadístico de EXCEL arrojo valores superiores a 0.98.
3.3.1. Comparación modelos de equilibrio
Luego de obtener una buena correlación entre los datos obtenidos, se realizó un ajuste matemático de los datos sobre tres modelos de adsorción (Langmuir, Freundlich y Temkin), que describen el efecto que se tiene sobre la concentración del metal en la solución luego de haber logrado el equilibrio químico y posterior adsorción sobre el material adsorbente.
Bajo el primer modelo de Langmuir, representado en la eq. 2, la adsorción se explica como un fenómeno de quimisorción monocapa del adsorbato, cromo en este caso, sobre el adsorbente.
El segundo modelo o modelo de Freundlich representado en la eq. 3, describe la adsorción como un proceso de fisisorción multicapa bajo la cual la adsorción varía exponencialmente debido al recubrimiento superficial sobre el adsorbente.
Y por último el modelo de Temkin, representado en la eq. 4 describe sistemas cuya entalpía de adsorción decrece linealmente con el porcentaje de posiciones ocupadas sobre la superficie del adsorbente.
En estas tres ecuaciones los parámetros indican: b [=] L∙mg-1 constante de afinidad adsorbente - adsorbato, qm [=] mg∙L-1 capacidad máxima de sorción del adsorbente, Ce [=] mg∙L-1 concentración en equilibrio del metal en solución acuosa, qe [=] mg∙g-1 cantidad de cationes metálicos adsorbidos por gramo de adsorbente en equilibrio, K [=] (mg∙g-1)(mg∙L-1) indicador aproximado de la capacidad de adsorción, 1/n [=] intensidad de la adsorción, A [=] (mg∙g-1) capacidad máxima de adsorción, y B [=] (L∙mg-1) la energía de adsorción.
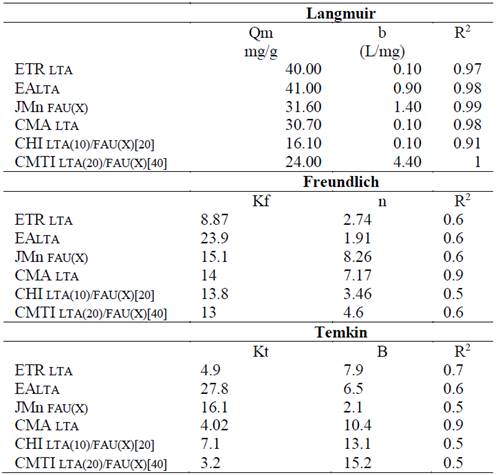
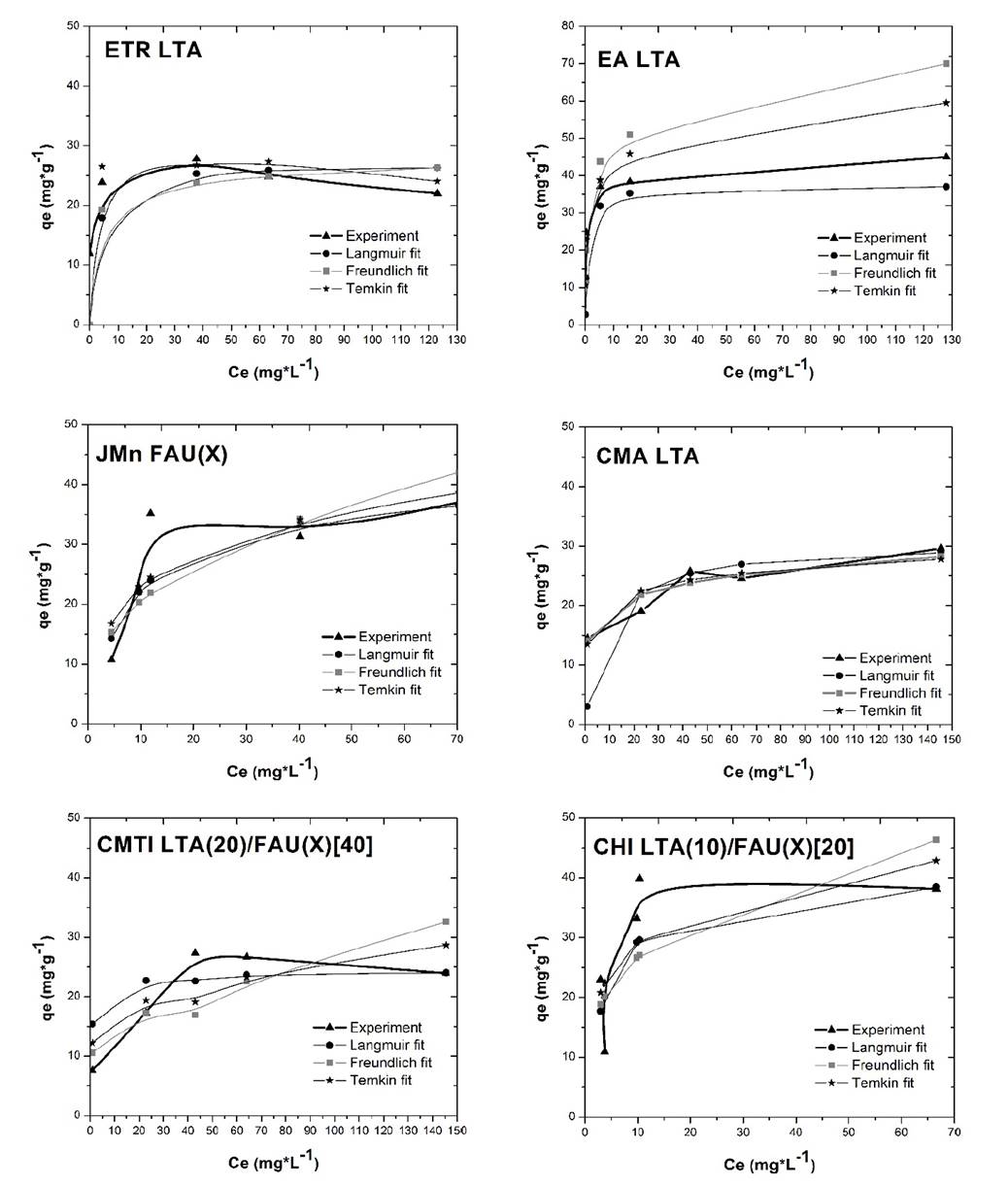
Como resultado se obtuvieron las isotermas de adsorción presentadas en la Fig. 8, donde se representa la relación entre la cantidad de cromo adsorbido por unidad de masa del adsorbente (qe) y la concentración de cromo en el equilibrio (Ce). Además de ello, para la determinación de cada uno de los parámetros de los modelos en cuestión, fue necesario un ajuste mediante regresiones lineales del paquete estadístico de EXCEL, en donde se pudo estimar el coeficiente de determinación. Los parámetros obtenidos se reportan en la Tabla 7.
Fuente: Autores
Figura 8 Capacidad de equilibrio (qe) versus concentración en el equilibrio (Ce) para la adsorción de Cr3+ con zeolitas sintetizadas a partir de cenizas.
En general y como de esperarse se logra apreciar que los datos experimentales para la remoción de Cr3+ se ajustan mejor al modelo matemático de Langmuir, en donde se observan coeficientes de determinación R2 superiores a 0.97. Este hecho supone que la adsorción del metal sobre las zeolitas sintetizadas se da como un fenómeno de atracción electrostática en donde la energía de adsorción es uniforme.
Durante este proceso de adsorción, los cationes metálicos tienden a moverse a través de los poros y los canales de la zeolita reemplazando en su desplazamiento cationes intercambiables como el sodio Na+ y el potasio K+, presentes en los materiales sintetizados como se evidencia en la Tabla 5.
Por otra parte se puede asumir que debido al pH de la solución y la electronegatividad del cromo, se pueden formar complejos hidroxilados tal como se presenta en la eq. 10, que son fácilmente adsorbidos sobre la superficie catiónica de la zeolita.
Particularmente en algunos materiales como la zeolita CMA LTA se presentan buenos coeficientes de determinación R2 para los modelos de Freundlich y Temkin, indicando que la adsorción de Cr3+ sobre este material no se realizó de manera tan uniforme como en los demás casos. Este hecho se debe quizás a la alta presencia de hematita (Fe2O3) en la superficie del material, como se evidencia en la Tabla 4 y 5, que supone impedimentos estéricos para la adsorción del metal.
No obstante, estos resultados reflejan que en todos los casos se da una adsorción favorable del metal sobre la zeolita, bajo un modelo acorde a los fenómenos superficiales que se evidencian en la estructura zeolitica. Así mismo, los parámetros obtenidos en la Tabla 7 demuestran que la remoción de Cr3+ por parte de los materiales sintetizados es tan efectiva como aquella lograda por otros materiales: ANIZ: Langmuir-Qo=24, Freundlich-Kf=3.33; Zeolita NaX: Langmuir-Qo=24, Freundlich-Kf=3.33; Al2O3: Langmuir Qo=24, Freundlich Kf=3.33; zeolite Y comercial Langmuir-Qo=64 [21].
3.3.2. Comparación modelos cinético
Por otro lado, así como los modelos de adsorción ayudan a establecer la eficiencia en el proceso, también es importante determinar el mecanismo cinético. Los modelos cinéticos de adsorción expresan el tiempo de contacto requerido para la completa adsorción de la especie química. A partir de ellos podemos establecer las condiciones óptimas para un proceso de remoción continua del metal y/o escalado a nivel industrial. Para ello cuatro modelos cinéticos en la interface solido líquido del material zeolitico fueron estudiados [6,22].
El primer modelo representado en la eq. 5, está basado en la variación de la concentración de la solución.
El segundo modelo, representado en la eq. 6, está basado en la concentración de la solución y el sólido.
El tercer modelo denominado modelo de primer pseudo-orden o de Lagergren, representado en la eq. 7, está basado en la capacidad de adsorción del sólido.
Y finalmente el modelo de segundo pseudo-orden o de Ho&Mckay, representado en la eq. 8, está basado en la quimisorción entre el adsorbato-adsorbente.
Los parámetros en estos modelos indican: k1[=]min-1 constante de velocidad de adsorción, CA[=]mg∙L-1 concentración final del metal en solución acuosa, CAO[=]mg∙L-1 concentración inicial del metal en solución acuosa, qt[=]mg∙g-1 cantidad de cationes metálicos adsorbidos por gramo de adsorbente en el tiempo y qe[=]mg∙g-1 cantidad de cationes metálicos adsorbidos por gramo de adsorbente en equilibrio.
Los datos de remoción de cromo obtenidos en función del tiempo fueron entonces ajustados a estos modelos cinéticos y nuevamente se determinaron los parámetros mediante regresiones lineales del paquete estadístico de EXCEL. De acuerdo al ajuste lineal realizado y presentado en la Tabla 8, los coeficientes de determinación R2 sugieren que el modelo cinético de pseudo-segundo orden describe de forma adecuada el mecanismo cinético de adsorción de cromo sobre la zeolita sintetizada. Este mecanismo indica una adsorción química del metal sobre el material sintetizado en correlación al modelo de adsorción encontrado, que De igual modo se puede asumir que la difusión del metal en los canales de la zeolita no es la etapa limitante en el proceso de adsorción del cromo en la zeolita [23], lo cual explicaría la adsorción uniforme sobre la superficie del material adsorbente.
Se observa entonces tal como lo demuestra la constante de velocidad de adsorción en este modelo, que los porcentajes de remoción de cromo son altos en soluciones no saturadas del metal (88 ppm), pero como era de esperarse a medida que la concentración del metal aumenta (150 y 200 ppm) la remoción tiende a disminuir debido a la saturación superficial de la estructura zeolitica.
4. Conclusiones
A partir de métodos hidrotérmicos de síntesis y fusión alcalina, se lograron sintetizar satisfactoriamente zeolitas tipo LTA y FAU a partir de residuos de la industria minera y manufacturera de Antioquia, obteniéndose en su mayoría fases puras y/o combinaciones entre estas zeolitas, y mostrando buenas características texturales y morfológicas apropiadas para procesos de adsorción.
Dichos materiales se utilizaron exitosamente como adsorbentes en pruebas de remoción de Cr3+, determinándose la capacidad de adsorción y el modelo cinético para la remoción de Cr3+ de cada material sintetizado. En general las isotermas experimentales se ajustaron al modelo Langmuir que describe una adsorción monocapa sobre una superficie que contiene un número infinito de sitios idénticos.
Este modelo estuvo correlacionado con el modelo cinético encontrado de pseudo segundo orden, que indica un proceso de quimisorción sobre el adsorbente. Es claro entonces que la adsorción del metal aumenta rápidamente hasta lograr una saturación superficial en la estructura debido a dos fenómenos en particular. En el primero de ellos se sugiere que existe una concentración comparable de especies catiónicas en los centros activos de la zeolita las cuales puedes ser intercambiadas con el metal en cuestión. Por otro lado la presencia de complejos hidroxilados de cromo aumenta la adsorción de la especie metálica en la superficie de la estructura zeolitica.
Particularmente se evidencio que las zeolitas ETR LTA y EA LTA son los materiales que muestran un mayor desempeño en el proceso de remoción de cromo. Este hecho se evidencia por la alta capacidad de adsorción (Qm) determinada en el modelo de Langmuir con valores de 40 y 41 mg/g respectivamente. De igual forma como lo demuestra la constante de velocidad de adsorción en el modelo de pseudo segundo orden los porcentajes de remoción del metal disminuyen debido a la saturación superficial de la zeolita.
Se corroboró de esta manera la utilidad de un subproducto industrial y su transformación a un producto de mayor valor agregado como las zeolitas. Se demostró la capacidad de adsorción y la eficiencia de estos materiales en el proceso de remoción de Cr (III), lo cual nos lleva a pensar en el potencial desarrollo de tecnologías limpias a escala industrial.