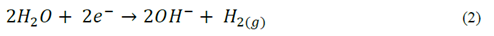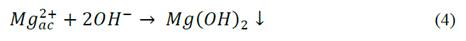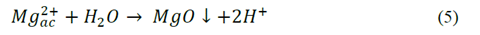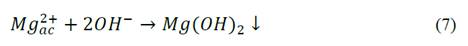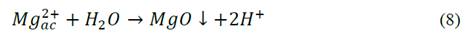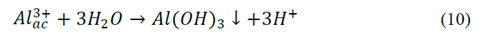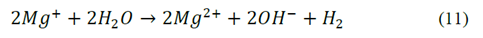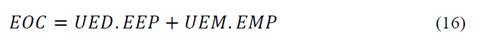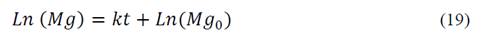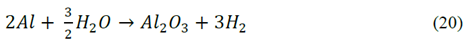1. Introducción
En años recientes se ha incrementado la conciencia ciudadana en relación con la polución de las fuentes de agua por causa de efluentes contaminados con sustancias como fertilizantes, pesticidas, tintes sintéticos, fármacos, entre otros. En particular, la industria textil genera entre 200 y 500 litros de agua residual por tonelada de producto terminado [1,2]; estas aguas se caracterizan por presentar altas fluctuaciones en la magnitud de algunos parámetros como la demanda química de oxígeno (DQO), la demanda biológica de oxígeno (DBO), el pH, el color, la salinidad y, adicionalmente, presentan baja biodegrabilidad.
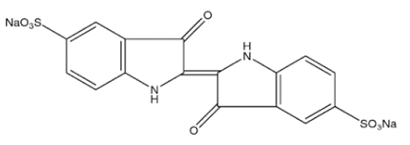
La producción mundial de tintes es alrededor de 700 mil toneladas por año y se estima que 200 mil ton/año se emplean en la industria textil [3,4]. Debido a su alto peso molecular y a sus complejas estructuras químicas los tintes presentan alta resistencia a la degradación [3,5]. Uno de los componentes más contaminantes encontrados en los efluentes textiles es el índigo carmín, un tinte azul oscuro de la clase indigoides ácidos, usado principalmente en la industria del teñido de fibras de poliéster y denim [4,6]. Esta sustancia es clasificada como material peligroso debido a que confiere alta coloración a las aguas lo que perturba la vida acuática; además de ser resistente a la acción de agentes químicos, a la luz y al calor, también se considera una sustancia cancerígena y puede causar irritaciones en la piel, en los ojos y dañar la córnea. La estructura química del índigo carmín se esquematiza en la Fig. 1[7].
Para el tratamiento de aguas residuales de la industria textil se han ensayado diversas alternativas. Han sido empleados agentes como H2O2, O3 y técnicas avanzadas de oxidación; no obstante, aunque estos métodos presentan buenos desempeños, la principal limitación son los altos costos involucrados en su implementación y su operación [1,8]. Asimismo, entre los métodos fisicoquímicos, la coagulación y floculación química ha demostrado ser ineficaz en el tratamiento de algunos tintes como los reactivos y el tipo tina, debido a sus pobres resultados en la disminución de color y a la alta generación de lodos [1]. Mientras la adsorción, especialmente con carbón activado tiene un alto costo operativo asociado a la regeneración del carbón, aunque presenta buenos resultados respecto a la disminución del contenido de una gran variedad de tinte [1,2]. Ramesh & Sreenivasa investigaron la adsorción del colorante índigo carmín en hidróxido de magnesio para pH 6-7 y 12-13 y encontraron que el proceso es endotérmico, espontáneo, sigue una cinética de velocidad de pseudo segundo orden y se favorece a pH 6-7 a temperatura ambiente [9].
En cuanto a los métodos biológicos, se han empleado microorganismos en procesos aerobios, anaerobios y en procesos combinados; aunque estos sistemas son amigables con el medio ambiente, tienen baja producción de lodos, aseguran la mineralización completa y consumen poca agua, requieren una correcta selección de los microorganismos y las enzimas a emplear para lograr buenas eficiencias, además de que suelen requerir prolongados tiempos de operación [1].
Por otra parte, la electrocoagulación (EC) es un método simple en el que, a diferencia de la coagulación química, los cationes metálicos se generan in situ por medio de reacciones electroquímicas. El proceso de EC involucra tres etapas: a) formación de cationes metálicos mediante la electrodisolución de ánodos de sacrificio; b) hidrólisis de los cationes y formación de coágulos y c) la agregación y desestabilización de los coloides a través de la formación de flóculos. En la EC los cationes generados en el ánodo de sacrificio se hidrolizan formando aglomerados amorfos insolubles del metal correspondiente, los cuales proveen superficies activas para la adsorción de coloides presentes en el agua. Por su parte, en el cátodo se descompone electroquímicamente el agua produciendo pequeñas burbujas de hidrógeno, estas burbujas pueden adicionalmente atrapar flóculos y llevarlos a la superficie por efecto de la flotación [2,10].
La reacción catódica correspondiente a un medio ácido y a un medio alcalino es como sigue, eq. (1)-(2), respectivamente:
Existen antecedentes del uso de ánodos de aluminio y de hierro para el tratamiento de soluciones de índigo carmín mediante electrocoagulación [11,12] sin embargo, el aluminio tiene por desventaja generar costos de operación hasta tres veces superiores a los del hierro por kg de DQO removido [13]; mientras que en el caso del hierro, las concentraciones de colorante estudiadas son hasta 18 veces inferiores a las que se reportan en efluentes reales [14]. En este contexto, el uso de electrodos de magnesio en la electrocoagulación de índigo carmín en novedosa.
En el caso ánodos de magnesio se presentan las siguientes reacciones eq.(3)-(5):
Para ánodos de la aleación AZ31 las reacciones son las siguientes eq. (6)-(10):
Además de las reacciones anteriores, los ánodos de magnesio pueden producir hidrógeno durante su polarización. Esto se denomina efecto diferencial negativo y es particular del magnesio [15].
El propósito de la presente investigación fue estudiar el desempeño de la electrocoagulación de soluciones sintéticas de índigo carmín empleando ánodos de magnesio de alta pureza y de aleación AZ31 sobre la disminución de color y COD, teniendo como variables la densidad de corriente, la concentración de tinte, la temperatura y la velocidad de agitación, para una carga eléctrica especifica de 5,000 C/L.
2. Materiales y métodos
Los ánodos se construyeron utilizando láminas de magnesio de alta pureza (99.5% p/p) y de aleación AZ31 (composición en peso: 95.56 % magnesio; 3.0 % aluminio; 1.0 % de zinc; 0.043 % manganeso; 0.01 % de silicio; cobre < 0.01%; níquel <0.001% y 0.003 % de hierro); mientras que para el cátodo se empleó una lámina de acero inoxidable AISI 304. Las dimensiones de todos los electrodos fueron de 9 cm × 8 cm.
Se empleó índigo carmín marca Sigma Aldrich con 85 % de contenido de tinte; asimismo, se empleó cloruro de sodio grado reactivo marca Sigma Aldrich como electrolito. Las soluciones de índigo carmín se prepararon empleando agua purificada obtenida por destilación de agua potable, previamente filtrada (0.45 µm) y empleando adsorción con carbón activado, en un equipo marca Water Pro PS Labconco. Las propiedades del agua purificada fueron: 1 mg/L de carbono orgánico disuelto (COD), conductividad eléctrica (k) de 17.95 µs/cm y pH de 7.83. Para la medición del pH y la conductividad eléctrica estandarizada a 25 °C (mS/cm) se utilizó un sensor multiparamétrico marca Thermo Scientific (Orion Star A329).
Para la determinación del COD (mg/L) se filtraron previamente las muestras utilizando un filtro de 0.45 µm y luego fueron analizadas en un equipo de medición de TOC con el equipo Shimadzu TOC-VCPH. Se realizó una curva de calibración entre 0 y 60 mg/L de COD.
Por espectrofotometría se llevó a cabo la determinación de la concentración de índigo carmín. Se realizó un barrido para hallar la longitud de onda a la cual se tiene la máxima absorbancia (612 nm) y posteriormente se construyó la curva de calibración en un equipo marca Jasco (UV Visible Spectrophotometer V-730).
Para la determinación del magnesio total, primero se ajustó el pH de las muestras a un valor menor a dos con ácido nítrico (HNO4) al 35%. Las muestras se sometieron a digestión suave con adición de ácido clorhídrico. Posteriormente se añadió cloruro de lantano heptahidratado con el fin de eliminar interferencias por ionización del analito. Finalmente se analizaron las muestras mediante absorción atómica con llama de aire-acetileno a una longitud de onda de 253 nm. Se usó un espectrofotómetro de absorción atómica marca Thermo Scientific (ICE 3000 Spectrometer).
2.1. Pretratamiento de electrodos
Previo a cada ensayo se lijaron manualmente las dos caras del ánodo con papel lija grano 100; 200; 400; 600 y 1,200; posteriormente ambos electrodos, ánodo y cátodo, se sumergieron durante 5 minutos en ácido clorhídrico al 10% (v/v), se lavaron varias veces con agua destilada y se secaron a condiciones ambiente.
2.2. Montaje experimental
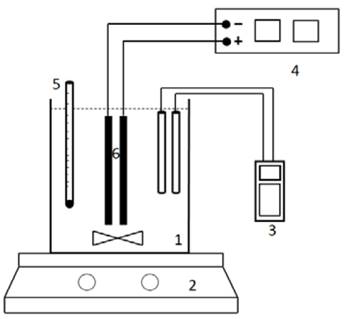
La celda de EC consistió de un vaso de borosilicato de 1000 mL talla alta en el que se ubicaron verticalmente un ánodo y un cátodo separados 0.8 cm, los electrodos se suspendieron por medio de un soporte de polietileno y se conectaron a una fuente de poder de corriente directa marca BK Precisión DC Regulated Power Supply modelo 1665 con un amperaje máximo de 5 A. Para las pruebas con agitación se utilizó un agitador magnético de 3 cm de longitud y 0.5 cm diámetro. Para el calentamiento y la agitación se utilizó una plancha marca Thermo Scientific modelo SP131635Q. El montaje experimental se muestra en la Fig. 2.
2.3. Pruebas experimentales
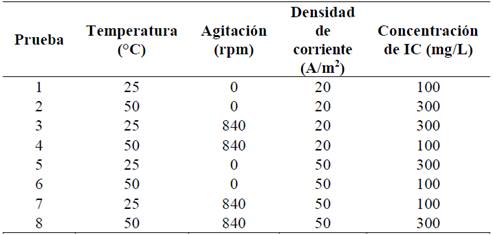
Ensayos de EC fueron realizados variando la densidad de corriente (A/m2), la temperatura (°C), la velocidad de agitación (rpm), la concentración de colorante (mg/L) y se suministró la misma carga eléctrica específica a cada ensayo (5000 culombios por litro equivalente a 0.944 A-h/L). Para cada ensayo se empleó un litro de solución de IC y se adicionó NaCl como electrolito soporte para mejorar la conductividad eléctrica (1,800 mg/L) sin ajustar ni controlar el pH, con base a los resultados obtenidos en pruebas preliminares (datos no mostrados). La celda electrolítica se cubrió con papel aluminio para evitar posibles efectos de fotólisis del IC. Se tomaron seis muestras para cada ensayo de 62; 67; 12; 67; 12 y 67 (ml) correspondientes a los puntos de carga de 250; 900; 1800; 2700; 4050 y 5000 culombios por litro (C/L) respectivamente, equivalentes a 0.063; 0.21; 0.386; 0.569; 0.779 y 0.944 amperio-hora por litro (A-h/L).
Las placas fueron suspendidas, de tal manera que pudieran descender a medida que la altura de la solución disminuía con el objetivo de evitar la pérdida de área sumergida de los electrodos. Además, se realizó una corrección de la carga eléctrica a suministrar para cada punto de muestreo debido al volumen extraído en cada muestra. Las muestras fueron analizadas en términos de COD, absorbancia (color), magnesio total (soluble y precipitado) y consumo eléctrico (kW-h/kg de COD removido); además, durante cada experimento se monitoreo el pH, la conductividad eléctrica, y el contenido de oxígeno disuelto.
Para evaluar el efecto de los cuatro factores y sus interacciones: velocidad de agitación (rpm), temperatura (°C), concentración de colorante (mg/L) y densidad de corriente (A/m2) sobre el desempeño del material del ánodo, se empleó un diseño factorial fraccionado 24-1 [16]. Los factores, sus respectivas interacciones y la significancia de los mismos, se evaluó a través de la metodología de Daniel, donde se evalúan los efectos tanto de los factores como de sus interacciones en un gráfico de probabilidad normal [16]. Los niveles evaluados se presentan en la Tabla 1.
Se utilizaron concentraciones de colorante entre 100 y 300 mg/L y concentraciones de NaCl de 1,800 mg/L considerando abarcar las concentraciones bajas que suelen emplearse en estudios de fotocatálisis o estudios de electrocoagulación con hierro [11,17] y las concentraciones que se reportan para efluentes reales [18].
Por otra parte, las densidades de corriente fueron seleccionadas a través de una polarización potenciostática realizada para AZ31 en una solución de 1022 mg/L de NaCl, donde se evidenció que para densidades de corriente mayores a 50 A/m2, el voltaje del electrodo de trabajo se incrementa en 0.6V vs Ag/AgCl (datos nos mostrados).
2.4. Calculo de parámetros del proceso
La magnitud de la disminución de color se calculó mediante la eq. (12).
Donde C0 es la concentración inicial de índigo carmín (mg/L-1) y C es la concentración de índigo después de cierto tiempo de operación.
La magnitud de la disminución del contenido de carbono orgánico se calculó con la eq. (13).
Donde COD0 (mg/L) es el carbono orgánico disuelto inicial y COD (mg/L) es el carbono orgánico disuelto en el tiempo t de operación.
El consumo específico de energía eléctrica se calculó como sigue, eq. (14).
Donde E es el consumo de energía eléctrica (kW-h/g de COD removido); U es el voltaje (V); I es la corriente (A); t el tiempo de operación (h).
La cantidad teórica de coagulante (magnesio), se calculó a partir de la ley de Faraday, eq. (15).
Donde w es la cantidad de coagulante (g); I es la corriente (A); t tiempo (s); M es el peso molecular (g/mol); F es la constante de Faraday equivalente a 96500 (C/mol); y n es el número de electrones involucrados en la reacción, que para el caso específico es de 2.
Por otro lado, según Secula et al [19] para el cálculo del costo del uso de la electrocoagulación como tecnología para para la disminución de índigo carmín se tienen las eq. (16)-(18):
Donde U es el voltaje de celda (V); I densidad de corriente (A); t tiempo (s); n número de electrones involucrados en la reacción; F constante de Faraday (C/mol); M peso molecular (g/mol); UED unidad de demanda de energía (kWh/kg de COD removido); V volumen de solución tratada (m3); Yt disminución de COD (%); UEM unidad de demanda del material del electrodo (kg/kg COD removido); EOC costo operacional (USD$/kg COD removido); EEP precio de la energía eléctrica (USD$/kW-h), considerado como 0.315 USD$/kW-h; EMP costo del material del electrodo (USD$/kg) estimado de proveedores internacionales como 2.42 USD$/kg para el magnesio de alta pureza y 25 USD$/kg para el AZ31.
2.5. Cinética aparente de electrodisolución.
La cinética de electrodisolución de magnesio para todas las condiciones de proceso, se determinó ajustando los datos de concentración de magnesio vs tiempo a la ecuación (19), según lo reportado por Panaiotova [20]:
Donde k (h-1) es una constante aparente de reacción de primer orden.
3. Resultados y análisis
3.1. Evolución del pH
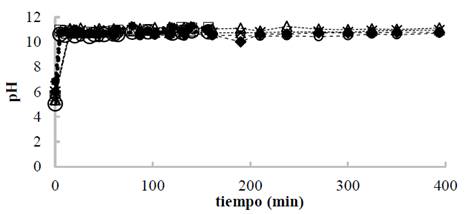
En la Fig. 3, se presenta la evolución del pH en el tiempo para las pruebas realizadas con el ánodo de AZ31, en ella se observa el aumento casi instantáneo del pH hasta un valor de 11 durante los primeros minutos de operación, valor alrededor del cual, el pH se estabilizó. Para el caso del magnesio de alta pureza el comportamiento fue similar (datos no mostrados). De esta figura es posible afirmar que independiente de las condiciones de los ensayos, del tipo de material y del tiempo del proceso, el pH aumentó rápidamente y permaneció constante hasta el final de la prueba. Este comportamiento puede asociarse a que la tasa de acumulación de los OH- entregados al medio fue mayor que el consumo de los mismos para la formación del hidróxido de magnesio Mg (OH)2. Esto, se debe a que los iones hidroxilo (OH-) se entregan al medio a través de dos reacciones, una reacción química en el ánodo eq. (11) y la reacción convencional electroquímica en el cátodo eq. (2); la primera reacción ocurre como consecuencia del efecto diferencial negativo en el que se asume que los ánodos de magnesio entregan magnesio univalente Mg+ además de Mg2+, por lo tanto los hidroxilos entregados al medio son la suma de la reacción anódica y catódica [15]. Si bien no se encontraron reportes para ánodos de magnesio, Secula et al [11] estudiaron ánodos de acero dulce para el tratamiento de soluciones acuosas de IC y encontraron que el pH se incrementó paulatinamente hasta estabilizarse en el mismo valor de 11 para varios pHs iniciales. Chantaraporn, Suprangpag & Warangkana (2010), reportaron el aumento del pH en aproximadamente 10 minutos en efluentes textiles tratados por el método de EC con electrodos de hierro y aluminio [21].
3.2. Pruebas finales
3.2.1. Variables de respuesta del proceso.
La Fig. 4 presenta la disminución de COD para la aleación AZ31 usando concentraciones de IC de 100 y 300 mg/L. la disminución del COD alcanzó un valor entre 70 y 85% para todas las condiciones de proceso después de 150 minutos de tratamiento. De la Fig. 4b, aunque la carga orgánica fue mayor, la disminución de COD fue cercana a 82% para las pruebas realizadas a la mayor densidad de corriente. Estos resultados evidencian que no es necesario tener tiempos de electrolisis tan extensos como los empleados en las pruebas 1, 2, 3 y 4, debido a que a 150 min ya se habían alcanzado disminuciones satisfactorias.
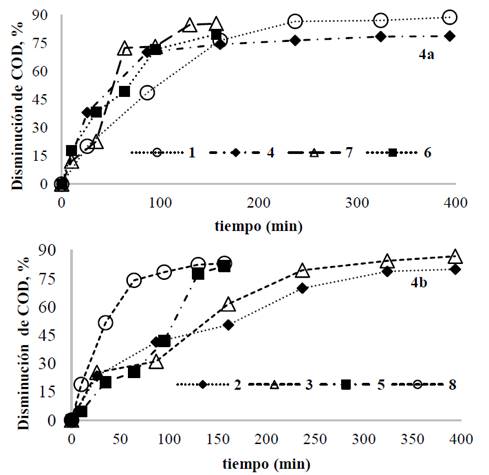
Fuente: Los autores.
Figura 4 Disminución de COD para cada prueba usando la aleación AZ31; a) [IC]=100 mg/L. b) [IC]= 300 mg/L.
Con ánodo de magnesio se alcanzaron disminuciones de COD entre 62 y 83 % para 100 mg/L de IC y, entre 30 y 75%, para 300 mg/L de IC Fig. 5a y 5b. Para las dos concentraciones de IC las disminuciones de COD fueron más favorables para las pruebas que emplearon menores tiempos de operación, es decir a densidad de corriente de 50 A/m2. Este mismo comportamiento se observó al utilizar ánodos de AZ31 y puede atribuirse a que a menores tiempos de operación, es decir, a mayor densidad de corriente, la tasa de generación de burbujas se incrementó y el tamaño de las mismas disminuyó mejorando así la remoción del contaminante [11].
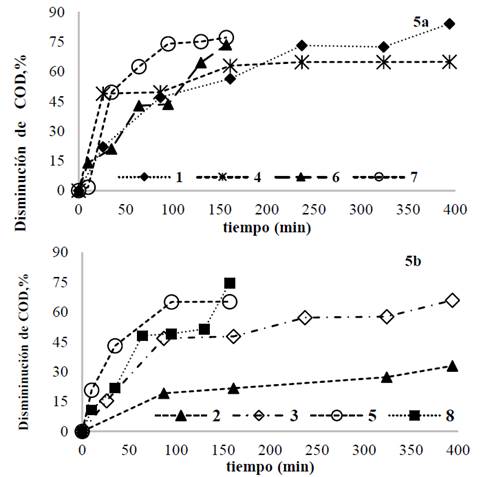
Fuente: Los autores.
Figura 5 Disminución de COD para cada prueba usando magnesio de alta pureza; a) [IC]=100 mg/L. b) [IC]=300 mg/L.
Utilizando el ánodo de AZ31 y 100 mg/L de IC se alcanzaron disminuciones de color hasta del 100% después de 100 min de tratamiento para una densidad de corriente de 50 A/m2; el mismo resultado se obtuvo después de 240 minutos de operación para las pruebas a densidad de corriente de 20 A/m2Fig. 6a. Por otra parte, al incrementar la concentración de IC a 300 mg/L Fig. 6b, fueron necesarios tiempos de operación entre 100 y 150 minutos para obtener disminuciones entre 90 y 98% en color para las pruebas a densidad de corriente de 50 A/m2; en contraste, fueron necesarios tiempos de operación de 300 minutos para alcanzar disminuciones de 90% en color para las pruebas realizadas a densidad de corriente de 20 A/m2.
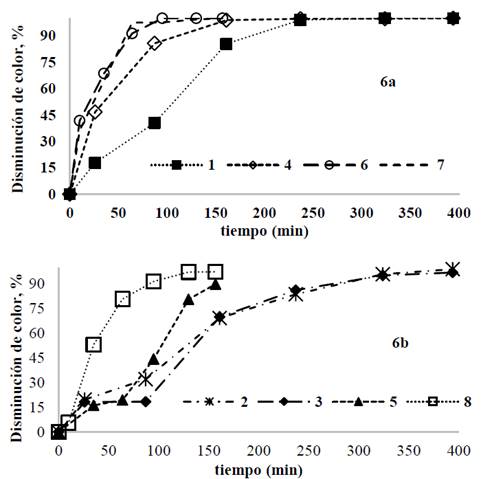
Fuente: Los autores.
Figura 6 Disminución de color para cada prueba usando la aleación AZ31; a) [IC]= 100 mg/L. b) pruebas a concentración de índigo carmín de 300 mg/L.
Para las pruebas con ánodo de magnesio y 100 mg/L de IC Fig. 7a, la disminución de color fue del 100% después de 100 minutos de operación y una densidad de corriente de 50 A/m2 mientras que, con la menor densidad de corriente 20 A/m2, se requirieron 240 minutos de operación para alcanzar el mismo resultado. Para las pruebas a 300 mg/L de IC Fig. 7b, se lograron disminuciones de 90% en el color independientemente de la carga; este mismo comportamiento fue observado para el electrodo de AZ31. Para ambos materiales y para la concentración de 100 mg/L de IC, se lograron disminuciones de 100% en color en tiempos más cortos, es decir, a mayor densidad de corriente, en contraste con las pruebas a la concentración de 300 mg/L de IC que requirió tiempos de operación de aproximadamente 400 minutos para lograr la misma disminución en el color. En comparación con los resultados obtenidos con la aleación AZ31, las disminuciones de color y COD obtenidas al utilizar magnesio de alta pureza fueron menores. Estos resultados pueden atribuirse a la disolución paralela de aluminio cuando se utilizó como ánodo la aleación AZ31. A pH básico los cationes Al3+ pueden formar diferentes complejos poli-nucleares insolubles de hidróxido de aluminio [21].
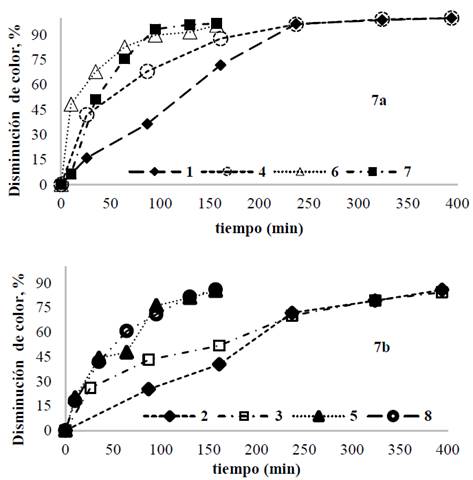
Fuente: Los autores.
Figura 7 Disminución de color para cada prueba usando magnesio de alta pureza; a) [IC]= 100 mg/L. b) [IC]= 300 mg/L.
Además, para el caso de 300 mg/L de IC para ambos materiales la reducción de COD y de color disminuyó respecto a los valores obtenidos para 100 mg/L, probablemente como consecuencia de la disminución de la capacidad de adsorción del colorante sobre la superficie del hidróxido de magnesio. N. Daneshvar et al, estudiaron el tratamiento de tintes ácidos por medio de EC con ánodo de hierro y encontraron que para una concentración de colorante mayor a 80 mg/L, la disminución de color fue relativamente constante, atribuyendo dicho comportamiento al agotamiento de la capacidad de adsorción de los flóculos [22].
Se ha evidenciado que existe una velocidad de agitación apropiada por encima de la cual el desempeño de la electrocoagulación disminuye debido a que ocurre el rompimiento de los coágulos [23]. Khaled, Wided, Béchir et al (2015), estudiaron el efecto de la agitación en el desempeño de la electrocoagulación para remover cadmio empleando electrodos de aluminio y encontraron que la velocidad de agitación adecuada fue de 450 rpm; por encima de esta velocidad el desempeño del proceso disminuyó drásticamente [24]. Aunque en el presente estudio se utilizaron valores de agitación de 0 y 840 rpm, no fue posible demostrar estadísticamente el efecto negativo de la agitación sobre la electrocoagulación que refieren otros autores.
Por otra parte, se obtuvieron disminuciones comparables de COD para ambos materiales tanto a temperatura ambiente como a 50 °C. Son pocos los estudios que evalúan el efecto de la temperatura en la EC; a este respecto, algunos estudios sostienen que la temperatura tiene un efecto positivo al favorecer los fenómenos de transferencia de masa en la capa límite de difusión del electrodo [3]. Sin embargo, VamshiKrishna, Omprakash, & Venkata, afirman que la temperatura puede tener o no un efecto positivo; esto, debido a que a bajas temperaturas puede reducirse la velocidad de disolución anódica, mientras a mayores temperaturas, la formación de flóculos densos que se depositan sobre la superficie de los electrodos puede afectar la disolución [22,25]
En general, usando ánodos de magnesio se alcanzaron disminuciones de 100% en color y hasta 83% en COD; para la aleación AZ31 se obtuvieron disminuciones de 100% en color y hasta 88% en COD, aplicando en ambos casos, los niveles inferiores de los factores estudiados. Esto sugiere que la magnitud de la carga eléctrica empleada en el presente estudio (5,000 C/L) fue superior a la requerida para alcanzar un buen desempeño; además, sugiere que futuros experimentos deberían llevarse a cabo a temperatura ambiente y sin agitación.
Según lo obtenido del diseño experimental, independientemente del material empleado en el ánodo (AZ31 ó Mg) se evidenció que los rangos empleados en las variables independientes no alteraron significativamente el desempeño del proceso ya que los efectos siguieron una distribución aproximadamente normal localizándose en una línea recta sobre el gráfico de probabilidad normal (datos no mostrados).
El consumo eléctrico específico por kilogramo de COD removido para los dos materiales se presenta en la Fig. 8 solamente para las pruebas con el máximo y el mínimo consumo eléctrico, los demás ensayos tuvieron un comportamiento intermedio. Esta variable de respuesta tuvo un comportamiento similar para los dos materiales y aunque con el AZ31 se obtuvo una disminución más alta en color y COD, el consumo eléctrico específico para la mayor densidad de corriente, fue el doble que para el magnesio, alcanzando valores cercanos 10 kW-h/kg COD removido Fig. 8a y Fig 8b; los consumos acumulados alcanzaron valores cercanos a 12 y 6 kW-h/kg COD removido para AZ31 y magnesio respectivamente (datos no mostrados) probablemente debido a la acción del ion cloruro ya que la aleación tiende a pasivarse más en comparación con el electrodo de magnesio de alta pureza [26]. El aluminio que entrega la aleación AZ31 al medio reacciona espontáneamente con el agua o con oxígeno eq.(10), (20) y (21) para formar una capa de óxido; esta capa afectaría el desempeño de la electrocoagulación aumentando el consumo eléctrico [27]; además, a partir de estudios de disolución realizados por Harish & Adka (2017), para la aleación AZ31 y el magnesio de alta pureza en una solución de etilenglicol a diferentes temperaturas y concentraciones de NaCl, se demostró que el electrodo de magnesio de alta pureza y la aleación AZ31 son muy sensibles a crear capas corrosivas en solución con iones cloruro, siendo mayor la corrosión para la aleación AZ31 con lo cual se favorece la formación parcial del complejo Mg(OH)2 que actúa como una capa pasivante sobre el electrodo [28].
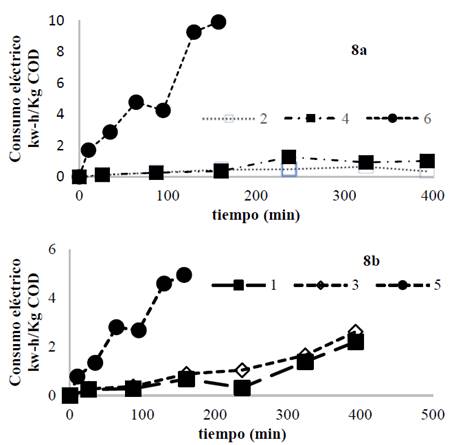
Fuente: Los autores.
Figura 8 Consumo eléctrico específico para cada prueba. a) consumo eléctrico para la aleación AZ31. b) consumo eléctrico, magnesio de alta pureza.
Chantaraporn, Suprangpak & Warangkana (2010), emplearon ánodos de hierro y aluminio para el tratamiento de un efluente textil y encontraron que el consumo eléctrico fue mayor para el electrodo de aluminio debido a que por algunas características de los flóculos formados por la difícil sedimentación de los mismos, estos obstruían el transporte de los iones en el medio, aumentando la resistencia del medio y por ende el consumo eléctrico; lo anterior puede también explicar el comportamiento de la aleación AZ31 debido a que uno de los componentes en mayor proporción es el aluminio [21,28].
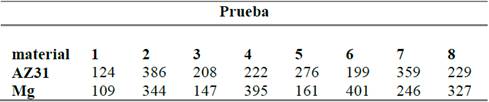
La concentración de magnesio en la solución final después del tratamiento, se presenta en la Fig. 9. El material que presentó mayor disolución de magnesio en algunos casos fue el AZ31 Fig. 9a, obteniéndose concentraciones entre 500 hasta 1,900 mg/L, en comparación con el magnesio Fig. 9b, con el que se alcanzaron concentraciones de magnesio disuelto desde 500 hasta 850 mg/L. Este resultado coincide con las disminuciones de COD y de color obtenidos para cada material, ya que, al entregarse más magnesio al medio en forma de Mg2+ se favoreció la formación del complejo de hidróxido de magnesio mediante la eq. (3), el cual es un material con gran capacidad de adsorción sobre su superficie [23]. Para ambos materiales la eficiencia de corriente eléctrica Tabla 2, en todos los casos, fue mayor a 100%, esto puede ser explicado porque la ley de Faraday solo asume que el magnesio se entrega al medio por disolución electroquímica sin considerar la pérdida de masa del ánodo que ocurren por otros mecanismos como por ejemplo la corrosión química ocasionada por agentes oxidantes como el ion cloruro. Zongo, Amadou, Josep et al (2009), reportaron un valor de 200% para la eficiencia de corriente usando ánodo de aluminio, resultado explicado por disoluciones laterales que no son consideradas por la ley de Faraday [29]. Así mismo, Kobya & Demirbas (2015), reportaron en su estudio de EC con electrodo de aluminio que a mayor densidad de corriente, la ley de Faraday se desvió fuertemente de los resultados experimentales obtenidos, fenómeno atribuido a la corrosión superficial del metal [30,31].
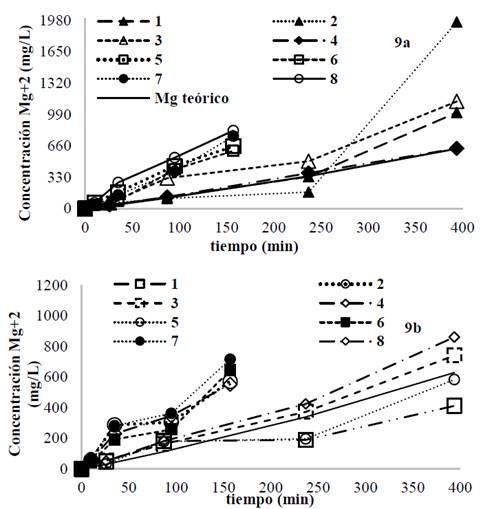
Fuente: Los autores.
Figura 9 Concentración de magnesio total teórico y experimental para cada prueba. a) concentración de magnesio para la aleación AZ31. b) concentración de magnesio total para el electrodo de magnesio de alta pureza.
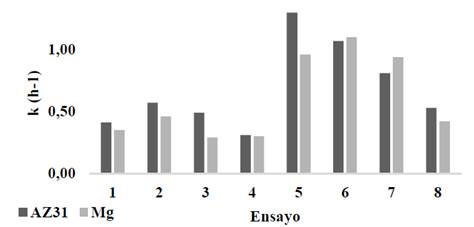
Los resultados de la constante de velocidad aparente k ajustada para una cinética de electrodisolución de primer orden se presentan en la Fig. 10, se observa que las pruebas realizadas a menor densidad de corriente (1, 2, 3,4) presentan un menor valor de la constante de velocidad aparente k, comparado con las pruebas a la mayor densidad de corriente (5, 6, 7, 8), esto es consistente con el incremento de iones metálicos generados al aumentar la corriente aplicada. Balasubramanian, Kojima & Srinivasakannan (2009), reportaron que para la remoción de arsénico por EC con ánodos de aluminio y acero dulce, a densidades de corriente entre 50 y 150 A/m2 la constante de velocidad para aluminio fue dependiente y proporcional a la densidad de corriente [32].
3.3. Costo operacional
Para determinar el costo operacional de la EC con electrodos de magnesio de alta pureza y la aleación AZ31, se utilizó la eq. (16) tomada de Secula et al [19]. El costo promedio operacional para el AZ31, fue de 3,8 USD$/kg de COD removido y para el magnesio de alta pureza fue de 2 USD$/kg de COD removido. Según lo reportado en el artículo citado anteriormente, el costo aproximado de la misma tecnología con electrodos de acero dulce y agregando carbón activado granular para mejorar la eficiencia del proceso fue de 7.25 USD$/ kg de contaminante removido, lo que sugiere que el uso de electrodos de magnesio de alta pureza y de aleación AZ31 sería económicamente viable.
4. Conclusiones
El desempeño de ánodos de magnesio y de aleación AZ31 en la electrocoagulación de soluciones sintéticas de índigo carmín arrojó resultados favorables en relación con la remoción de color y de COD. Empleando ánodos de aleación AZ31 se alcanzaron disminuciones cercanas al 100% en color y 88% en COD; mientras que con ánodos de magnesio se lograron disminuciones de 99 % en color y 84 % en COD. Además, se alcanzó un bajo consumo eléctrico acumulado, cercano a 12 kW-h/kg COD removido para el caso de la aleación AZ31 y 6 kW-h/g COD removido para el magnesio de alta pureza. Asimismo, pudo inferirse que no son necesarios tiempos de operación mayores a 250 minutos operando a las densidades de corrientes empleadas.
Por otra parte, para ambos materiales los valores finales de COD y de color disminuyeron con el incremento de la concentración de índigo carmín posiblemente como consecuencia de la reducción en la capacidad de adsorción del colorante sobre la superficie del hidróxido de magnesio. En general, se alcanzaron mayores disminuciones de COD para las pruebas realizadas a 50 A/m2.
Los resultados evidenciaron la viabilidad técnica del empleo del magnesio y sus aleaciones como ánodo de sacrificio en la electrocoagulación de soluciones de índigo carmín, además, este material a diferencia del aluminio se distribuye de forma natural en el medio ambiente y no representa peligro para los seres vivos.