1. Introducción
En la actualidad, la contaminación de los hábitats acuáticos es un fenómeno universal, el cual es particularmente más serio en los países en desarrollo, debido a la descarga de las aguas residuales industriales sin tratar o parcialmente tratadas dentro de ellos. La relativamente alta toxicidad de las aguas residuales industriales sobre los organismos vivos, especialmente las plantas, es de mayor preocupación ya que estas limpian los sistemas acuáticos [1]. Una sustancia tóxica puede ser introducida al ecosistema acuático afectando la calidad del agua y haciéndola desfavorable para la vida [2]. Aparte de los efectos estéticos negativos en el ecosistema acuático que los recibe, los efluentes que contienen colorantes se han reportado como tóxicos a los organismos acuáticos [3], [4]. A nivel local, en el Valle de Aburrá, se han presentado en los últimos años descargas de colorantes al rio Aburrá-Medellín, que han llamado la atención de los ciudadanos por sus colores fuertes, en varias ocasiones rojo, otras blanco, azules y negro entre otros. De estos eventos surge el interés de adelantar estudios en el tema y se desarrolla esta investigación para conocer las pruebas utilizadas en la evaluación de toxicidad en aguas, con el fin de aportar elementos de decisión a la hora de seleccionar la o las técnicas más adecuadas para evaluar la posible contaminación de las aguas residuales industriales que afectan el rio Aburrá-Medellín en términos de color, y posterior a esto se pretende aplicarlas de forma experimental para obtener resultados reales. Hay varias maneras de clasificar los colorantes: por su estructura química, por su solubilidad o por su aplicación al tipo de fibra. Esta última es la adoptada por el Colour Index. Este sistema consta de un número de cinco dígitos, el nombre y el color. Y comprende las siguientes clases: ácidos, catiónicos o básicos, dispersos, directos, reactivos, solventes, sulfuros y baño [5]. Teniendo en cuenta lo anterior, se seleccionaron nueve sectores productivos considerados como los principales generadores de vertimientos con color al rio Aburrá-Medellín, esto se hizo de acuerdo al ranking de las 500 empresas más grandes de Antioquia del 2011 de la revista RAED de la Cámara de Comercio de Medellín, teniendo en cuenta el índice de participación de cada uno de los sectores en las ventas netas totales reportadas para dicho año, suponiendo que, a mayores ventas, mayor actividad industrial y por ende mayor generación de residuos. Los sectores seleccionados son: textil, químicos, curtiembres, artes gráficas, tratamiento de aguas residuales, papel, cerámicos, metal mecánico y alimentos y bebidas. De los reportes de materias primas y de la caracterización de las aguas de los vertimientos de las industrias seleccionadas, reportadas en bases de datos de la autoridad ambiental, se extrajeron las diez moléculas generadoras de color más frecuentes de manera que abarcaran toda la longitud de onda del espectro visible y los tonos blanco y negro. Los colorantes seleccionados son: índigo carmín, rojo 40, amarillo número 5, sulfato básico de cromo, óxido de hierro negro, dióxido de titanio, óxido de zinc, rodamina, óxido de cobre y óxido de hierro rojo. Sobre estos se aplicarán en fases posteriores, ensayos de toxicidad acuática aguda. La toxicología acuática es el estudio cualitativo y cuantitativo de los efectos adversos o tóxicos de las sustancias químicas u otros materiales antropogénicos y xenobióticos en los organismos acuáticos a varios niveles de organización, desde subcelular, pasando por organismos individuales, hasta comunidades y ecosistemas. La toxicidad en los organismos incluye efectos letales tanto a largo como a corto plazo, y efectos subletales, como cambios en el crecimiento, el desarrollo, la reproducción y el comportamiento. La toxicidad es una propiedad relativa al potencial químico de una sustancia, que tiene un efecto perjudicial en un organismo vivo. Esta es función de la concentración, la composición, las propiedades del químico al cual el organismo es expuesto y de la duración de la exposición. Las pruebas de toxicidad son usadas para evaluar los efectos adversos de un químico en organismos vivos bajo condiciones estandarizadas y reproducibles que permiten la comparación con otros químicos o especies evaluadas. Los efectos tóxicos agudos son los que ocurren rápidamente, como resultado de una exposición a corto plazo, generalmente son severos o mortales. La toxicidad aguda de un compuesto suele determinarse por la concentración letal media (CL50), valor que indica la concentración tóxica suficiente para matar el 50% de los organismos de prueba en un periodo corto de tiempo (96 horas a 14 días). El efecto tóxico crónico puede ocurrir cuando hay exposiciones repetidas o en un largo tiempo, al producto químico. Puede haber un periodo de latencia entre la exposición y los efectos, pero estos pueden llegar a ser letales [2].
Existen varias técnicas de evaluación de toxicidad que utilizan organismos de diferentes niveles tróficos que van desde bacterias, protozoos, crustáceos, hasta animales mayores como ranas, peces, ratas, ratones, células de humanos, etc. De acuerdo con la legislacion colombiana (Resolucion 0062 de 2007) [6], los protocolos válidos para evaluar toxicidad acuática son las pruebas que utilizan Daphnia magna y microalgas (Selenastrum capricornutum o Scenedesmus subspicatus) para evaluación de ecotoxicidad (daño al medio ambiente) y la prueba con la bacteria bioluminiscente Vibrio fischeri se emplea para evaluar toxicidad a la salud humana debido a la similitud de algunas de sus estructuras con las de los mamíferos [7]. Los bioensayos proporcionan información valiosa con respecto a la toxicidad de soluciones mixtas para los organismos vivos. La Daphnia magna es un microcrustáceo que ha sido ampliamente utilizado como un organismo de prueba en estudios de toxicidad aguda y crónica de varios compuestos químicos presentes en los ecosistemas acuáticos. Es la especie más usada en el mundo para las pruebas de toxicidad debido a su sensibilidad a los agentes tóxicos. Este microcrustáceo tiene un ciclo corto y se reproduce por partenogénesis, siendo fácil de manejar en el laboratorio [8]. Vibrio fischeri, es una bacteria marina luminiscente, que rápidamente y con sensibilidad puede detectar una variedad de sustratos tóxicos. Los productos químicos tóxicos pueden interferir con el sistema de transferencia de electrones en la respiración de V. fischeri e inhibir su producción de luz. Este bioensayo se puede utilizar como una advertencia para la toxicidad porque algunas estructuras asociados con V. fischeri son similares a las asociadas con los mamíferos y peces [7], [9]. La prueba de inhibición de la luz a menudo se utiliza para evaluar la biotoxicidad de efluentes. Las microalgas constituyen el primer eslabón de la cadena trófica en los sistemas acuáticos. En su condición de productor primario, el fitoplancton permite la entrada de energía al ecosistema, regula el régimen gaseoso y tiene acción depuradora, por lo que se considera uno de los indicadores más importantes de las alteraciones del medio marino. Se ha verificado su sensibilidad a los efluentes industriales y ha demostrado ser una herramienta válida en el monitoreo y control de los programas de reducción de toxicidad, considerándose un indicador primario de contaminación [10]. La microalga Selenastrum capricornutum es sensible a sustancias tóxicas y por ello se utiliza en pruebas de toxicidad acuáticas. En la presente revisión bibliográfica, se hace un recuento de las diferentes técnicas que se han utilizado en los últimos años como ensayos de medición de toxicidad en medios acuáticos. Como ya se mencionó, se hace énfasis en las que utilizan como organismo de prueba Daphnia magna, Vibrio fischeri o Selenastrum capricornutum porque, son los microorganismos contenidos en los protocolos establecidos por la normativa de Colombia y por tanto, son pruebas con resultados válidos ante la ley para cualquier proceso investigativo o disciplinario.
2. Normativa
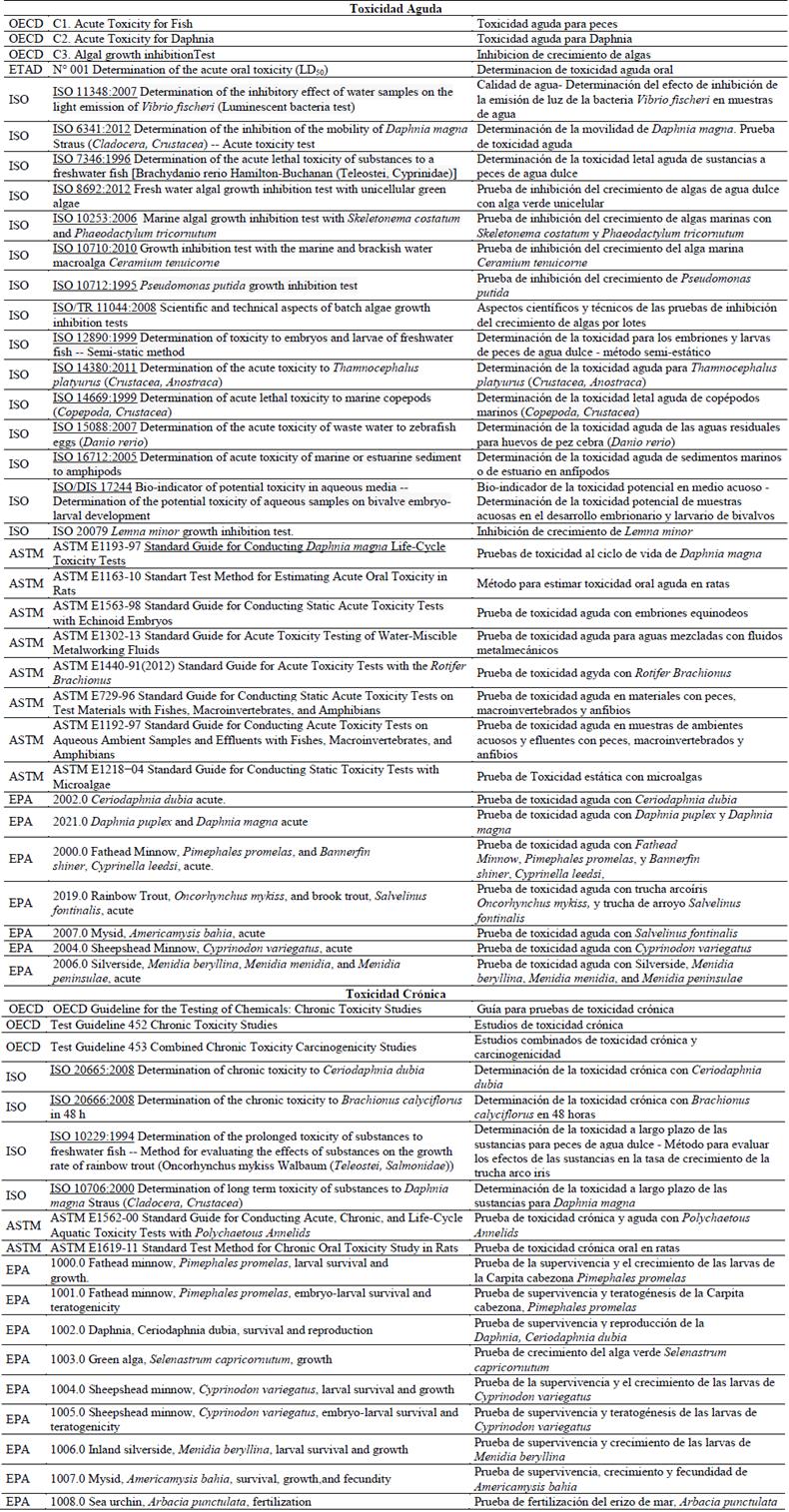
A nivel internacional existen organizaciones con políticas ambientales de sostenibilidad ambiental y manejo de residuos peligrosos, que tienen protocolos estandarizados en técnicas de medición de toxicidad. La OECD (Organization for Economic Cooperation and Development) [53], [54], la ISO (International Organization for Standardization), la ETAD (The Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers) y la ASTM (American Society for Testing and Materials) [45], [46], [47], [48], [49], [50], [51], [52], conformadas por miembros de Europa, América, África y Asia. La PNUMA (Programa de las Naciones Unidas para el Medio Ambiente), la OEA Organización de los Estados Americanos) y la EPA (United States Environmental Protection Agency). En relación con el trabajo de revisión que se está llevando a cabo, se relaciona en la Tabla 1 cada una de las organizaciones, con sus respectivos protocolos. Los protocolos acogidos por la normativa colombiana fueron seleccionados de estas entidades.Las normas colombianas para la protección del medio ambiente fueron inicialmente establecidas en el Decreto Ley 2811 de 1974 (Código Nacional de los Recursos Naturales y de Protección del Medio Ambiente), y su Decreto reglamentario 1594 de 1984 (derogado parcialmente). Sólo hasta la creación del Ministerio del Medio Ambiente con la expedición de la Ley 99 de 1993, se regula de manera articulada toda la gestión ambiental del país. Más tarde el Decreto 4741 de 2005 se expide para reglamentar la gestión integral de residuos peligrosos y la Resolución 0062 de 2007 define los protocolos de laboratorio para análisis ambientales. Respecto a la evaluación de la toxicidad aguda en aguas, están contemplados allí los protocolos metodológicos para toxicidad acuática: Toxicidad aguda para Daphnia, Inhibición de crecimiento de algas (con las microalgas Selenastrum capricornutum o con Scenedesmus subspicatus) y la prueba de bioluminiscencia bacterial (con la bacteria Vibrio fischeri). Según la norma colombiana (Decreto 4741, artículo 6), las características que confieren a un residuo o desecho la calidad de peligroso son: corrosivas, reactivas, explosivas, toxicas, inflamables, infecciosas y radiactivas. Se considera residuo o desecho tóxico aquel que en virtud de su capacidad de provocar efectos biológicos indeseables o adversos puede causar daño a la salud humana o al ambiente. Para este efecto se consideran tóxicos los residuos o desechos que se clasifican de acuerdo con los criterios de toxicidad agudos, crónicos y ecotóxicos [11].
3. Algunas técnicas para el análisis de toxicidad
3.1. Toxicidad aguda para Daphnia
Varios estudios dirigidos al análisis de colorantes se han llevado a cabo con Daphnia magna. Una evaluación de la toxicidad del colorante azul directo 218 indicó que este es muy tóxico para las Daphnias, presentó una LC50 de 3,6 a 6,0 mg/L. Según Bae y Freeman (2007), la toxicidad para las Daphnias es suficiente para sugerir la posibilidad de daños a todos los ecosistemas receptores y evidencia la necesidad del estudio toxicológico de la industria de la síntesis de colorantes [3]. Más adelante, en India, Verma (2008) [12] aplicó la técnica de toxicidad aguda con Daphnia magna a efluentes industriales con contenido de colorantes reactivos remazol green parrot y remazol amarillo y obtuvo valores EC50 de 55,32 y 46,84 mg/L respectivamente. En su estudio, el autor sugirió que el ensayo con Daphnia magna es un excelente método para la evaluación de la toxicidad acuática de tintes y colorantes que contienen los efluentes industriales. El autor utilizó nuevamente este organismo en un estudio de efluentes industriales con contenidos de colorantes. En el estudio se mostró que los colorantes contenidos en los efluentes industriales exhiben varios grados de toxicidad para las Daphnias y se recalca la importancia de los bioensayos en el monitoreo ambiental. En general los efluentes de curtiembres y colorantes mostraron una mayor toxicidad que los de textiles y papel [4]. Dave y Aspegren (2010) investigaron la liberación al agua de los productos químicos tóxicos a partir de diversos tejidos. Utilizaron Daphnia magna para medir la toxicidad de acuerdo con el protocolo estándar de la ISO. Tomaron 52 muestras de textiles y las recortaron en pequeños cuadrados que se sumergen en agua de referencia estándar. El rango total de los EC50 obtenidos fue amplio, oscilando entre 3,7 y 118 g/L para 24 horas y 1 g/L y 182 g/L para 48 horas. No se encontró ningún patrón evidente en relación con el tipo de fibra, la impresión o el etiquetado ecológico. Las diferencias en las relaciones de 24/48 h EC50 podrían sugerir que no sólo las concentraciones de aditivos químicos y las tasas de lixiviación diferían entre los tejidos ensayados, sino también que los diferentes productos químicos eran los responsables de las sustancias tóxicas [13]. Para demostrar la toxicidad aportada por los efluentes textiles, Immich (2009) llevó a cabo la evaluación de la toxicidad de tinte para soluciones del colorante reactivo remazol azul. Todas las muestras analizadas mostraron toxicidad aguda por encima del límite máximo permitido para los efluentes de la industria textil y productos químicos. Esto significa que los valores de concentración de colorante utilizado son considerados muy tóxicos para el medio ambiente acuático y que se requiere la eliminación del color [14]. Una alternativa para el ensayo con Daphnia magna es usar la microscopía de fluorescencia en vivo. Teplova (2010) [15] hizo ensayos de toxicidad tiñendo las Daphnias fluorescentes y probando tres sustancias químicas beauvericina, cereulide, y valinomicina. En el ensayo con las toxinas se murieron las Daphnias y cambió la fluorescencia. El uso del organismo Daphnia magna como especie de prueba para demostrar la potencial toxicidad de los compuestos químicos, en combinación con microscopía de fluorescencia de Daphnia, permite proponer una técnica novedosa para la detección rápida de la contaminación del agua. La técnica desarrollada no sólo proporciona una rápida evaluación en vivo de la toxicidad de los contaminantes químicos y bacterias en las primeras etapas de la exposición, sino que también contribuye a una mejor comprensión de los mecanismos de toxicidad.
Como otra alternativa a las Daphnias, existe el crustáceo, Moina macrocopa, también utilizado en mediciones de toxicidad aguda. Vinitnantharat (2008) [16] analizó el efecto tóxico de los colorantes red14 basic y reactive red 141 tanto en M. macrocopa como en el alga Chlorella. Los resultados globales de este estudio indicaron que las bajas concentraciones de los tintes podrían afectar a estos organismos en agua natural. En la presencia de ácido húmico o materia orgánica natural podría disminuir el efecto de toxicidad para las algas, pero aumentar el efecto de toxicidad para las Moinas. Por tanto, el nivel adecuado para el color de la descarga de aguas residuales debe ser considerado. Una solución modelo similar a las descargas textiles, se preparó para evaluar la oxidación del colorante índigo con tres sistemas diferentes, electro incineración, coagulación y enzimático con lacasa, y sus respectivas toxicidades después del tratamiento. Los valores se reportan en términos de LD50, lo cual significa la concentración que produce un efecto letal en el 50% de los organismos. Los valores de LD50 obtenidos después de los ensayos en Daphnia magna, fueron 82% para la muestra modelo, 55% para la muestra tratada con electro incineración, 19% con coagulación y 20% con el proceso enzimático con lacasa. Los resultados de las pruebas de toxicidad indican que los procesos químicos de coagulación y lacasa pueden acentuar la toxicidad aguda [17]. Confirmando los resultados obtenidos por otros autores, Wiench (2009) [18] estudió el efecto nocivo de partículas de ZnO y TiO2 sobre el crustáceo Daphnia magna y concluyó que independientemente del tamaño de partícula (a escala nanométrica o no), el recubrimiento, el tipo de medio y el tratamiento previo de las dispersiones de ensayo aplicados de TiO2, esta muestra baja toxicidad. Los efectos agudos de ZnO sobre la movilidad de D. magna son probablemente debido a la toxicidad de iones de Zn y no de ZnO. Al igual que con el TiO2, no hubo diferencia significativa en la toxicidad entre las escalas de la partícula en pigmentos de ZnO.
3.2. Bioluminiscencia bacterial
La prueba de inhibición de la luz a menudo se utiliza para evaluar la biotoxicidad de efluentes. En su estudio Wang (2010), empleó un colorante básico, azul de metileno (MB), con el objetivo de determinar la viabilidad de algunos métodos para el tratamiento del color, y determinar la evolución de la toxicidad de la solución de MB durante los diversos tratamientos. A pesar de que el azul de metileno se decolora rápidamente (en 20 min) los productos intermedios tóxicos permanecen en la solución de colorante tratada con oxidación electroquímica. Pero en el proceso de adsorción de cenizas combinado con electroquímico elimina eficazmente el color, la DQO y la toxicidad intermedia de la solución. El proceso combinado es una técnica potencial para la eliminación de azul de metileno [7] y la bacteria es un indicador indispensable en la evaluación de las ventajas de los tratamientos de remoción de color. Este último aspecto es fundamental ya que en algunas investigaciones para remoción de color se reportan datos de toxicidad mayores luego de la aplicación del tratamiento que en el efluente crudo.
Existen equipos que facilitan la aplicación del ensayo de bioluminiscencia con la bacteria Vibrio fischeri, por ejemplo, el Microtox, diseñado con una serie de pozos donde se realizan las diluciones de las suspensiones bacterianas, y un fotómetro para medir la emisión de luz de la bacteria en 0; 5 y 15 minutos después del contacto con la sustancia tóxica. Las lecturas de la luz se comparan con las de las bacterias de control (sanas) para determinar la inhibición de la luminiscencia, y para estimar la EC50 de la muestra. Tezcanli [19] en su análisis de toxicidad de soluciones de colorantes reveló que los tintes reactivos eran no tóxicos, pero los básicos sí eran tóxicos a las concentraciones de ensayo empleadas en el estudio (5 g colorante/L agua). Es bien conocido que los colorantes reactivos utilizados para el sombreado de fibras celulósicas tienen capacidades de agotamiento pobres, mientras que la mayoría de los colorantes básicos utilizados en el sombreado de fibras sintéticas se fijan muy bien en el tejido. El naranja disperso 1 es ampliamente utilizado en la industria textil. Para evaluar su toxicidad, Ferraz (2011) [20], empleó la Daphnia similis, otra especie de Daphnia; y la prueba de bioluminiscencia de Vibrio fischeri. Se llegó a la conclusión que para la Daphnia no se encuentra una toxicidad significativa a la exposición al colorante y para V. fischeri se observó una tendencia a un aumento en el porcentaje de inhibición de la emisión de luz, pero el efecto no fue suficiente para calcular los valores de EC50 ya que con estos no se encontraron efectos tóxicos. Aunque ambos mostraron resultados negativos para toxicidad, se pueden hacer otras pruebas ecotóxicas para confirmar la validez de los resultados.
Çelebi y Sponza (2012) [21] realizaron un estudio comparativo de la eficiencia de la prueba de toxicidad con Vibrio fischeri, Daphnia magna y el pez Lepistes sp. Concluyeron, luego de aplicar el ensayo en aguas residuales contaminadas con el antibiótico amoxicilina, que el organismo más sensible en las pruebas de toxicidad fue V. fischeri, seguido de D. magna y por último el más resistente fue Lepistes sp. Los crustáceos y bacterias como los representantes de los diferentes niveles de la cadena alimenticia son buenos modelos para la predicción de la toxicidad de los productos químicos contaminantes a los ecosistemas. Con este argumento, Heinlaana (2008) [22] desarrolló un caso de estudio para evaluar la toxicidad de tres óxidos metálicos; TiO2, CuO y ZnO; en la bacteria Vibrio fischeri y el crustáceo Daphnia magna. Los resultados de toxicidad aguda a 30 minutos experimentando con V. fischeri indicaron que la partícula más tóxica fue el óxido de zinc, seguida por el óxido de cobre, y finalmente el dióxido de titanio con una toxicidad significativamente más baja. La toxicidad de las partículas nano y CuO para V. fischeri fue casi idéntica cuando las concentraciones de CuO se expresaron como iones de Cu biodisponibles como Cu2+. En las pruebas realizadas con crustáceos hubo similaridad en los niveles tóxicos, siendo el mayor ZnO seguido del CuO, y valores muy bajos de toxicidad para el TiO2. Cabe anotar que para las partículas de nano TiO2 si se presentaron valores de mortalidad más altos en Daphnia magna. Finalmente, los autores concluyeron de su estudio que las partículas de óxido de metal no tienen necesariamente que entrar en las células para causar toxicidad. Mucho más importante parece ser el contacto íntimo entre la célula (pared bacteriana de células o entorno intestinal crustáceo) y las partículas. Esto puede causar cambios en el microambiente del área de contacto entre organismo y partículas o aumentar la solubilización de metales.
3.3. Inhibición de crecimiento de algas
Con el fin de estudiar el tamaño de partículas y la solubilidad de los óxidos de metales, Aruoja y Dubourguiera (2009) [23] compararon la toxicidad de nanopartículas de ZnO, TiO2 y CuO con las mismas partículas en su tamaño corriente, en el alga Pseudokirchneriella subcapitata. Las soluciones acuosas a pesar de ser opacas, no mostraron un efecto significativo en la inhibición del crecimiento de las algas en lo referente al paso de la luz, independientemente de las concentraciones de los óxidos de metales. Tanto las partículas de óxido de zinc grandes como nano, presentaron iguales valores de toxicidad (EC50 a 72 horas para nano ZnO = 0,042 y para ZnO = 0,037 mg/L); los cuales indican una alta toxicidad, la que fue atribuida a los iones de Zinc disueltos. Los resultados son similares a los obtenidos por Franklin, Rogers, y Apte (2007) [24], quienes también realizaron una comparación entre las toxicidades de la molécula de ZnO y su nanopartícula, evaluados en la microalga Pseudokirchneriella subcapitata. Obtuvieron valores de EC50 a 72 horas para nano ZnO = 0,068 y para ZnO = 0,063 mg/L, los cuales, como en el caso anterior, están muy cercanos entre sí.
En el caso del Dióxido de Titanio la toxicidad reportada fue considerablemente menor a los demás óxidos metálicos. Se obtuvieron valores de EC50 a 72 horas para nano TiO2 = 5,8 y para TiO2 = 35,9 mg Ti/L. Ambas soluciones formaban agregados que atrapaban las células de las algas e impedían el paso de la luz y por tanto inhibían su crecimiento. Estos valores indican el mayor grado de toxicidad de las nanopartículas de TiO2, una posible explicación a este efecto puede ser la sugerida por Baveye y Laba (2008) [25] quienes enfocaron su investigación en las implicaciones toxicológicas de los agregados de las nanopartículas de dióxido de titanio ya que pueden resultar en actividades biológicas diferentes. Los autores explicaron el mecanismo de toxicidad de las suspensiones de dichas suspensiones como la generación de radicales hidroxilos debido a la luz visible. Las nanopartículas de TiO2 en combinación con luz Ultravioleta (370 nm) inactivan las algas. Algo similar ocurrió en el caso del Óxido de Cobre donde las nanopartículas resultaron más tóxicas que las demás presentando valores de EC50 a 72 horas para nano CuO = 0,71 y para CuO = 11,55 mg/L. La toxicidad de ZnO y CuO se puede atribuir a los iones metálicos solubles procedentes de las partículas de óxido de metal. En el caso del TiO2, el atrapamiento de las células de algas en los agregados de TiO2 puede jugar un papel importante en la toxicidad para las algas Pseudokirchneriella subcapitata [23]. Sponza (2006) [26] investigó en Turquía la toxicidad aguda de las aguas residuales de la industria de producción de colorantes químicos y destaca la importancia de las pruebas de toxicidad en las normas de descarga de aguas residuales. Utilizó diferentes organismos para representar cuatro niveles tróficos incluyendo bacterias, protozoos, peces y el alga Chlorella vulgaris. Las aguas residuales contenían varios tipos de colorantes y en ellas era muy abundante el azul índigo. Las pruebas de toxicidad aguda con las algas en dichas aguas residuales mostraron valores de EC50 entre 80 y 100% indicando niveles de toxicidad bajos. Generalmente, los resultados de las pruebas de toxicidad aguda se expresan en EC50, lo que significa que esta es la concentración que afecta a 50% de los organismos ensayados en diferentes volúmenes de efluente. Novotny (2005) [27] realizó un estudio sobre algunos colorantes reactivos y dispersos para comparar el uso de tres diferentes pruebas de toxicidad aguda utilizando como organismos la bacteria Vibrio fischeri, la microalga Selenastrum capricornutum y el protozoo Tetrahymena pyriformis. La prueba de bioluminiscencia, aunque determina toxicidad, tiene una sensibilidad baja a los tintes oscuros y necesita más tiempo de aplicación. La prueba de inhibición de crecimiento de algas fue más sensible a los colorantes en comparación con la prueba de bioluminiscencia, y T. pyriformis es un organismo adecuado para medir toxicidad biológica, aunque no tan sensible como las algas. Otros estudios comparativos se han realizado enfocados en la toxicidad de varios colorantes incluyendo los tipo ácido, reactivos, directos y baño que son comúnmente hallados en aguas residuales textiles. En su estudio, Tigini (2011) [28] comparó las técnicas con Daphnia magna, Vibrio fischeri, Pseudokirchneriella subcapitata, la prueba de Ames con Salmonella typhimurium y el Lemna test con Lemna minor. De los resultados concluyó que D. magna fue el organismo más sensible hacia el efluente con colorantes ácidos, el cual tiene formación de espuma, porque de los tensoactivos contenidos en los polvos colorantes y las burbujas podrían dañar seriamente las Daphnias. Por tanto, Daphnia magna es probablemente útil para evaluar el efecto de la "toxicidad física" debido a los tensoactivos no detectables por otros organismos. La bacteria, V. fischeri, fue la única que señaló algunos límites en la evaluación de la toxicidad de los colorantes baños oscuros debido a la interferencia con la medida de la emisión de luz por la bacteria. El alga Pseudokirchneriella subcapitata fue el organismo más sensible a casi todas las aguas residuales simuladas y se sugiere para la evaluación de los textiles y curtiembres. El gobierno mexicano desarrolló un proyecto desde el año 2006 (Ramirez, 2007) [29] para estandarizar las pruebas de toxicidad de las sustancias contaminantes en los ecosistemas acuáticos, con especies estándar como Daphnia magna y Selenastrum capricornutum; y para proponer especies alternativas. Uno de los compuestos utilizados como contaminante fue el Cr6+. La especie Daphnia magna mostró una CL50 igual 0,567 mg/L para el cromo hexavalente, mientras que la especie Daphnia exilis tuvo una CL50 de 0,098 mg/L lo que indica que tiene mayor sensibilidad al compuesto. Las microalgas resultan de mayor utilidad en los ensayos toxicológicos del Cu2+. El Óxido de Zinc y el Dióxido de Titanio son ampliamente utilizados en forma de nanopartículas para la producción de cosméticos, bronceadores, protectores solares y pasta de dientes. Kahru y Dubourguier (2010) [30] evaluaron datos reportados en la literatura de la toxicidad de algunas nanopartículas para determinar cuáles eran las más dañinas y requerían evaluación de riesgo, haciendo énfasis en nano TiO2, nano ZnO y, nano CuO; en grupos de organismos que representan a los principales niveles de la cadena alimentaria (bacterias, algas, crustáceos, ciliados, peces, levaduras y nemátodos). Después de un análisis estadístico de todos los datos encontrados, los autores clasificaron los compuestos así: ZnO extremadamente tóxico; CuO muy tóxico y TiO2 nocivo por ser el menos tóxico. Respecto a los organismos ensayados, los más recomendados eran Daphnia, algas y peces. Para los casos analizados las algas fueron los más sensibles. Se conoce también que las algas son más sensibles al óxido de cobre, óxido de zinc y dióxido de Titanio de tamaño convencional (no a escala nano). Finalmente llegaron a concluir que, aunque las nanopartículas difieren de los productos químicos de mayor tamaño y muestran efectos biológicos y ambientales específicos, la comparación de sus efectos tóxicos mostró algunas tendencias comunes; las especies de relevancia ambiental más sensibles para las sustancias químicas de referencia fueron algas y crustáceos [30].
3.4. Medición de toxicidad con Allium cepa
El Allium cepa es un bioensayo de aberración cromosómica, validado por el Programa Internacional Sobre Seguridad Química (OMS) y el Programa de las Naciones Unidas para el Medio Ambiente, como una prueba eficiente y estándar para la detección de la toxicidad de sustancias del medio ambiente, ya que proporciona una rápida pantalla para los efectos tóxicos de los productos químicos, iones metálicos y para la monitorización de aguas residuales. El efecto tóxico se puede analizar basado en el índice mitótico. Patil y Jadhav (2013) [31] estudiaron el efecto de algunos colorantes reactivos como Reactive Blue 160, Verde HE4B, Metil Orange, Orange TGLL, Remazol naranja y rojo HE7B sobre los bulbos de Allium cepa. El análisis citogenético mostró un fuerte efecto genotóxico de Reactive Blue 160 en las células mitóticas de las raíces de Allium cepa. Se observaron otros tipos de aberraciones cromosómicas como cromosomas rezagados, puentes anafase, pegajosidad y micronúcleos. El efecto de un colorante sobre los cromosomas y la división celular también se evidencia en un bioensayo con A. cepa, cuando Watharkar (2013) [32] estudió la toxicidad del colorante reactivo Navy blue en el cual el análisis citogenético reveló que la solución de colorante NBRX (50 mg/L) provocó fuertes efectos genotóxicos en las células mitóticas. Se ha informado anteriormente que una disminución en el índice mitótico de las células meristemáticas de A. cepa puede servir como un método fiable para verificar la existencia de compuestos citotóxicos en el medio ambiente. Este estudio indica que los colorantes afectan a los cromosomas y la división celular. Después de la fitorremediación del colorante, la muestra obtenida sin color, estaba relacionada con una disminución significativa del porcentaje del total de células mitóticas aberrantes y por lo tanto, se demuestra la reducción aproximada en la toxicidad de la solución de colorante. Poonkuzhali (2011) [33] en su estudio con el colorante azul reactivo 198 sobre la técnica Allium cepa confirma que la inhibición del crecimiento de las raíces es dependiente de la concentración de colorante. Por lo que se ha estudiado, generalmente el ensayo con Allium cepa es aplicado a colorantes reactivos, como es el caso del colorante Reactive red 120 en un estudio llevado a cabo en la India, en donde se pretende decolorar, por medio de bacterias, las aguas contaminadas con dicho tinte y a través de A. cepa se logra concluir la efectividad del tratamiento debido a la reducción de la toxicidad de la muestra después de aplicadas las bacterias [34].
3.5. Medición de toxicidad con Saccharomyces cerevisiae
Han sido publicados varios artículos que consideran el uso de la levadura en los ensayos de toxicidad de agua. Estas pruebas se basan principalmente en la medición de los cambios en la actividad respiratoria de Saccharomyces cerevisiae o la detección de la inhibición de su crecimiento. Las pruebas son en su mayoría menos sensibles y el tiempo necesario para obtener resultados es demasiado largo (1-3 días).
Por las razones mencionadas, Lubomira y Jaroslava (2012) [35] describieron un nuevo ensayo de toxicidad biológica basado en la inhibición de la viabilidad de S. cerevisiae y la comparan con dos ensayos de toxicidad estándar basado en la inmovilización de Daphnia magna y la inhibición de la bioluminiscencia de Vibrio fischeri. El nuevo ensayo biológico, prueba letal de S. cerevisiae, es más barato y 24 veces más rápido que la prueba con D. magna. La velocidad de ensayo es comparable con la prueba de V. fischeri, pero la nueva prueba es más sensible para algunas sustancias. La prueba indica la presencia de todas las sustancias tóxicas utilizadas en el agua en concentraciones que son significativamente más bajas que la concentración en dosis tóxicas o letales para el hombre, por tanto, esta nueva prueba de toxicidad podría ser propuesta para la detección rápida de las sustancias tóxicas en el agua.
3.6. Medición de toxicidad con Hydractinia echinata
Una de las principales preocupaciones de la investigación científica es el desarrollo de nuevos métodos para la evaluación de la toxicidad en el caso de los efluentes orgánicos persistentes, tales como aminas aromáticas y sus tintes relacionados [36]. El desarrollo de un método para la evaluación de la toxicidad sobre la base de pruebas biológicas en colonias del hidrozoo Hydractinia echinata, aparece como una alternativa atractiva y práctica. Tiene grandes ventajas: simplicidad, accesibilidad, reproducibilidad, tiempo y trabajo experimental reducido considerablemente. El sistema de prueba H. echinata es más sensible en comparación con el ensayo de inmovilización de Daphnia, así como para la prueba de crecimiento de inhibición de la lenteja de agua Lemna, que no puede diferenciar la toxicidad de algunos p -nonilfenoles isómeros. Chicu (2011) desarrolló una investigación con el objetivo de determinar la toxicidad de algunos derivados del naftol usando el sistema de prueba biológica H. echinata y la proposición de un posible mecanismo de reacción de hidrólisis de estos compuestos. El desarrollo de evaluación de la toxicidad de precursores de colorantes y tintes, con la participación de las pruebas biológicas sobre colonias de H. echinata constituye una importante contribución a la integración de los nuevos materiales para la mejora de la seguridad y la calidad de vida, mediante la prevención de los efectos nocivos de los efluentes orgánicos persistentes sobre la salud humana y el medio ambiente. El sistema de prueba sobre colonias de H. echinata no implica problemas ambientales, es reproducible, rápido, sencillo, y accesible y representa un método alternativo para investigaciones biomédicas, así como para los ensayos de toxicidad de los compuestos químicos.
3.7. Medición de toxicidad con Drosophila melanogaster
El amplio conocimiento de la genética de Drosophila melanogaster y la larga experiencia experimental con este organismo lo han hecho excepcionalmente útil en la investigación de mutaciones y toxicología genética. Las células de D. melanogaster poseen sistemas que metabolizan xenobióticos similares a los del hígado de los mamíferos. Hay un alto nivel de compatibilidad entre Drosophila y muchos aspectos humanos, no sólo en dominios de proteínas, sino también en complejos enteros, haciendo la prueba de genotoxicidad en moscas de la fruta altamente valiosa. Las manchas del ala en D. melanogaster se ha convertido en un popular ensayo in vivo que detecta agentes genotóxicos y puede detectar un amplio espectro de alteraciones, incluyendo mutaciones puntuales, deleciones, recombinaciones mitóticas, pérdida cromosómica y no disyunción. Esta prueba se basa en el principio de que la pérdida de heterocigosidad de genes marcadores adecuados en las células de los discos imaginales de larvas puede causar la formación de clones de colonias de células mutantes. Más tarde, el efecto mutacional se expresa como manchas en las alas de las moscas adultas. Varios parámetros influyen en la frecuencia y tamaño de los puntos en las alas. Para evaluar el posible riesgo genotóxico para la salud de los trabajadores de tintura de textiles y la genotoxicidad ambiental de los tintes y el efluente teñido, (Dogan, Yesilada, Ozata, y Yologlu (2005) [37] llevaron a cabo estudios de biomonitoreo con la mutación somática y la prueba de recombinación (SMART) de D. melanogaster. Se investigó el potencial de genotoxicidad directa e indirecta de cuatro tintes textiles (Astrazon Negro, Astrazon Amarillo, Astrazon Rojo y Astrazon Azul) y se determinó el efecto genotóxico de los colorantes y su efecto sobre la tasa de supervivencia. Los colorantes azul, negro, amarillo y rojo utilizados en el estudio fueron positivos en el ensayo de SMART. Los resultados anteriores de otros autores que utilizan diferentes sistemas de pruebas han sugerido que algunos de los colorantes textiles son genotóxicos, por tanto, los resultados están de acuerdo con estos hallazgos anteriores. Se deduce entonces que la evaluación de la genotoxicidad de un colorante textil en Drosophila mediante la prueba de SMART puede ser un ensayo sensible, rápido y de bajo costo para identificar el efecto de los contaminantes en el ecosistema.
3.8. Medición de toxicidad con Xenopus laevis
La estimación de los resultados de la contaminación y la predicción de los efectos tóxicos sobre los organismos acuáticos, especialmente en anuros, es importante para la vigilancia del medio ambiente. Debido a que los anuros están en declive en los últimos años gracias a la contaminación del medio ambiente en todo el mundo, es importante comprender la toxicidad de colorante y de sus aguas residuales en anfibios, especialmente en la etapa temprana de su vida, que pueden estar expuestos a los tóxicos a través de diferentes vías. Xenopus laevis, la rana de uñas del sur de África, es uno de los vertebrados anfibios más útiles, con las etapas de desarrollo bien caracterizadas. Las pruebas de toxicología para evaluar la capacidad de envenenamiento de xenobióticos, a menudo se realizan en embriones vivos de X. laevis. La etapa 46 del desarrollo de los renacuajos de X. laevis se utilizó para determinar los efectos adversos de seis colorantes textiles utilizados. Estos colorantes fueron Astrazon Rojo FBL, Azul Astrazon FGRL, Remazol Rojo RR, Remazol Azul Turquesa GA, Cibacron Red FN-3G, y Cibacron Blue FN-R y las LC50 fueron 0,35; 0,13; 112; 7; 359 y 15,8 mg/L respectivamente. En la prueba se analizan la actividad de ciertas enzimas y el deterioro en los procesos de respiración aeróbica. Los hallazgos del estudio sugieren que las enzimas de los biomarcadores seleccionados son útiles en la comprensión de los mecanismos tóxicos de estos colorantes en los renacuajos X. laevis como indicadores de alerta temprana, por tanto, estos biomarcadores seleccionados pueden evaluar el efecto de los factores ambientales, tales como los efluentes textiles colorantes y otros contaminantes industriales, sobre los anfibios en estudios de biomonitoreo [38]. Esta misma técnica con embriones de rana X. laevis la utilizó Birhanli (2005) [39] para evaluar la toxicidad de seis colorantes comerciales textiles. La LC50 para rojo astrazon fue 4,73 mg/L y similar para el astrazon azul. Los potenciales teratogénicos resultaron en este orden: astrazon azul, remazol azul turquesa, astrazon rojo, cibacron azul, cibacron rojo y remazol rojo. Los resultados muestran que todos los colorantes ensayados fueron altamente tóxicos o teratogénicos a los embriones de Xenopus. Los colorantes Astrazon eran los más tóxicos de los seis colorantes ensayados cuando se compararon los resultados de mortalidad LC50 [39].
3.9. Pruebas de toxicidad con peces
Entre la fauna acuática, los peces se ven favorecidos con respecto a otros animales, y su mortalidad es el único criterio para cuantificar la toxicidad de contaminantes. Sharma (2006) informa de una mayor sensibilidad de los glóbulos rojos de pescado y por tanto también puede ser explorado para cuantificar la toxicidad de aguas residuales textiles. Sharma (2007) realizó un estudio comparativo sobre la caracterización de aguas residuales textiles tratada y no tratada y evalúa la toxicidad por medio de pruebas químicas y biológicas. Al final de la investigación encontró las pruebas biológicas más sensibles que las químicas en aguas residuales. Los productos químicos que contribuyen a la toxicidad máxima de las aguas residuales de tinte textil eran ácidos (HCl y H2SO4), álcalis (Na2OSiO2), sales (de NaNO2) y metales pesados (Cu), mientras que los tintes eran relativamente menos tóxicos [1]. La especie de peces Carassius auratus es también utilizada generalmente para evaluar la calidad de ambientes acuáticos y se emplea analizando la acción de la sustancia en las células de hígado. Ying (2012) [40] evaluó 3 colorantes directos con la intención de relacionar su estructura con la toxicidad que presente cada uno. Y concluyó que las alteraciones en las enzimas antioxidantes y LPO potencialmente se pueden utilizar como biomarcadores sensibles para la evaluación del riesgo de colorantes en el medio ambiente y pueden contribuir a la creación de normas de descarga. En un estudio llevado a cabo en China Zhang (2012) [41] evaluó la toxicidad de las muestras de aguas residuales recogidas en diferentes etapas en una fábrica textil y de plantas de tratamiento de aguas residuales. Las muestras de agua residual de blanqueo, lavado y enjabonado de la fábrica textil mostraron alta toxicidad aguda y genotoxicidad. Los componentes coexistentes de compuestos colorantes, como asistentes y oxidantes, parecían causar algún efecto en la respuesta tóxica. Después del tratamiento empleando el proceso aeróbico/anaeróbico se observaron aumentos en la toxicidad aguda y genotoxicidad en el tanque anaeróbico, lo que indica la formación de productos intermedios tóxicos. La toxicidad para el pez cebra es un método eficaz para sugerir posibles daños a los diversos ecosistemas receptores y aumenta la preocupación por la necesidad de reevaluar los métodos de tratamiento de STP para eliminar los riesgos potenciales que plantean los efluentes textiles a los ecosistemas y la salud humana. En la última década, más de 150 líneas celulares de peces han sido establecidas y una serie de bioensayos se han desarrollado en un intento de sustituir los ensayos de toxicidad aguda con peces. Las líneas celulares tales como células de hepatoma PLHC-1 (Poeciliopsis lucida), hepatocitos y células epiteliales de trucha arco iris (Oncorhynchus mykiss) mostraron ser adecuadas para la determinación de los criterios de valoración de citotoxicidad. La toxicidad aguda para los peces, línea celular de hepatoma PLHC-1 y para alevines de trucha arcoíris, se examinó para 18 productos fitosanitarios [42]. El objetivo principal fue explorar si las células hepáticas se podían utilizar para predecir la toxicidad aguda en los peces teniendo en cuenta el modo de acción tóxica y las propiedades del compuesto. La toxicidad aguda para los peces se determinó mediante la prueba OCDE 203 y se compara con el valor inicial previsto de LC50 de toxicidad aguda en los peces calculada con una relación cuantitativa estructura-actividad (QSAR) derivada de peces guppy. Se concluye que la prueba de toxicidad aguda con peces fue más sensible y valiosa para determinar los efectos de los compuestos que actúan específicos. La caracterización de los peligros ecotoxicológicos por los contaminantes acuáticos requiere sistemas de pruebas biológicas que ofrezcan suficiente sensibilidad específica para los modos de acción tóxicos [42].
4. Discusión
Según resultados y comparaciones de los diferentes autores citados, el ensayo con Daphnia magna es un método adecuado para la evaluación de la toxicidad acuática de tintes y colorantes que contienen los efluentes industriales ya que la toxicidad para las Daphnias indica la posibilidad de daños a los ecosistemas receptores. Hay que tener en cuenta que el tamaño de los pigmentos suspendidos en la muestra de agua puede obstruir el tracto respiratorio de estos crustáceos y que en un medio con tensoactivos, la formación de espuma también puede generar su mortalidad, lo cual puede referir a una especie de toxicidad “física”. Respecto a la prueba de bioluminiscencia, algunas estructuras asociadas con la bacteria Vibrio fischeri son similares a las asociadas con mamíferos y peces, aspecto que justifica la validez del ensayo de bioluminiscencia como prueba de medición del impacto de su toxicidad en la salud humana. Este método es eficiente en muchos casos y suele ser más sensible que las Daphnias y las algas, pero tiene restricciones con los colorantes oscuros y con las aguas turbias ya que esto interfiere con la medida de emisión de la luz de las bacterias. En la prueba de algas también influyen la turbidez y la coloración oscura debido a que impiden el paso de la luz inhibiendo su crecimiento y reproducción. Los colorantes de la industria textil como el índigo, por ejemplo, que, aunque no resultó ser muy toxico a las Daphnias, no se puede desconocer que las descargas en los efluentes son de volumen considerable y de un tono tan oscuro que impiden el paso de la luz a través del agua, afectando al ecosistema, y que, además, el colorante suele estar acompañado de solventes tóxicos que pueden destruir la vida acuática. Los óxidos metálicos tuvieron toxicidades más altas. Estos aspectos sugieren la importancia de aplicar tratamientos de remoción de color en donde son de utilidad las pruebas ecotóxicas para evaluar las ventajas de dichos tratamientos. Las cuales también son una herramienta indispensable para normatizar las descargas de los vertimientos a los cuerpos de aguas. Aunque no están contempladas en la legislación colombiana, queda claro en esta revisión que existen otras pruebas igualmente efectivas para evaluación de toxicidad y que, incluso en algunos casos pueden ser más económicas y requerir menos tiempo de ejecución conservando el criterio básico de reproducibilidad, como lo es la prueba con Drosophila melanogaster. Otra buena alternativa es la prueba de fluorescencia con Daphnias, ya que además de cumplir los estándares necesarios, proporciona información adicional que puede permitir entender el mecanismo de acción de las sustancias tóxicas.