1. Introduction
La nanotecnología se ha convertido en un área activa y trascendente de investigación que viene en crecimiento desde finales del siglo XX debido a la capacidad de proveer materiales a nivel atómico, molecular y supramolecular con características excepcionales cuando se comparan con las propiedades físicas y químicas de los materiales en volumen (bulk). [1-3] Los nanomateriales se caracterizan por presentar un tamaño de partícula entre y 1 nm y 100 nm en al menos una dimensión; debido a su tamaño exhiben propiedades fisicoquímicas únicas y características ajustables [3], alta resistencia mecánica, bioactividad y reabsorbilidad mejoradas [3]. A causa de lo anterior, los materiales nanométricos como nanotubos, grafenos, fullerenos, puntos cuánticos, nanoalambres [4], nanopartículas de Ag, Au, Ti, Zn, magnéticas y especialmente las Nanopartículas de Sílice Mesoporosa (MSN) [5], han llevado a diversas industrias como la electrónica, textil, medicina, cosmética, agricultura y de alimentación [6] a rediseñar sus productos [2] de manera novedosa y funcional.
Las MSN son materiales que se forman por condensación de sílice alrededor de micelas orgánicas, creando una matriz ordenada de estructuras porosas con cientos de mesoporos dispuestos a nivel atómico de forma hexagonal [1,7]. En 1990, Yanagisawa et al. [8] reportaron la primera síntesis de MSN obtenidas a partir de un polisilicato en capas llamado Kanemita y años más tarde se reportaron dos tipos de compuestos de estructuras porosas MCM-41 y SBA-15 que son las más usadas en la actualidad [1,7].
Las MSN presentan ventajas sobresalientes, como facilidad de síntesis, alta biocompatibilidad de área específica, alta fase vítrea residual, valores de dureza mejorados, propiedades mecánicas robustas, composición química relativamente inerte [3], alta estabilidad frente a la degradación enzimática [9], alta capacidad de carga [10], biodegradabilidad mejorada [7], gran área de superficie (>1000 m2/g) [1,11] y grandes volúmenes de poros adaptables (1.3-50 nm) [12]. Además, tienen la capacidad de funcionalizarse con diferentes materiales y/o moléculas a través de la ingeniería de superficies, por lo que se emplean en diferentes ámbitos incluido el de la salud [3].
Las MSN son particularmente útiles en una amplia gama de aplicaciones biológicas debido a que su matriz de mesoporos es estable en condiciones biológicas y sus poros protegen las moléculas huéspedes de las condiciones del ambiente externo [7]. Esta funcionalidad ha demostrado ser especialmente beneficiosa en el suministro de fármacos y ha despertado el interés científico por estudiar posibles aplicaciones de las MSN en ingeniería biomédica y nanomedicina. La estructura porosa de las MSN se puede utilizar para cargar moléculas terapéuticas bioactivas permitiendo mejorar varias características farmacológicas de los medicamentos libres, aumentando su eficacia terapéutica [9] y reduciendo los efectos secundarios adversos [13].
La superficie de las MSN puede ser modificada mediante varias estrategias, con grupos funcionales y ligandos para mejorar sus propiedades fisicoquímicas y su respuesta a estímulos magnéticos, térmicos, fotoestímulos, campos magnéticos y eléctricos, pH, agentes redox y ultrasonido [1,7]. Con las funcionalizaciones y/o recubrimientos apropiados, estas nanopartículas mejoran su rendimiento, pueden ser absorbidas por células no fagocíticas y luego pueden liberar moléculas encapsuladas en la ubicación deseada [11,14].
Es de interés científico estudiar los procesos de síntesis, caracterización, recubrimientos, funcionalizaciones y control de la estructura de las MNS para conocer los efectos a largo plazo que tiene la interacción entre nanopartículas, su exposición a los seres humanos y el medio ambiente para apuntar a sus posibles aplicaciones en el campo biomédico.
En la actualidad, las MSN se han utilizado en diferentes aplicaciones biomédicas, que incluyen la liberación controlada de fármacos en áreas de presencia de tejido tumoral [15] y con efecto bactericida[16], fototerapia [17], fluorescencia [18], tomografía por emisión de positrones [19], imágenes de ultrasonido [20], biosensores [21] e ingeniería de tejidos [22]. En esta revisión se discutirán algunos de los métodos y procesos de síntesis de MSN, las funcionalizaciones y/o recubrimientos de este tipo de partículas y sus potenciales aplicaciones en el campo biomédico.
2. Síntesis de nanopartículas de sílice
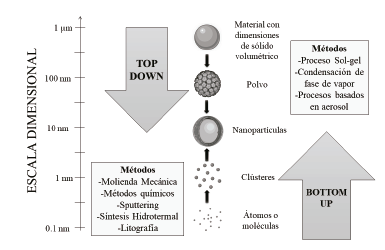
Para la síntesis de nanopartículas se han estudiado distintos métodos que se agrupan en dos categorías (ver Fig.1), las aproximaciones «top-down» que consisten en la división de sólidos másicos en porciones más pequeñas [23], la ventaja más destacable de estos métodos es que se puede obtener nanopartículas de un tamaño mayor a las obtenidas con métodos «bottom-up», algunos métodos son la molienda mecánica de alta energía, métodos químicos como el proceso Stöber, pulverización catódica (sputtering), síntesis hidrotermal [24], litografía y la volatilización de un sólido seguido por la condensación de los componentes volatilizados.
Por otro lado, las aproximaciones «bottom-up» son utilizadas para la fabricación de nanopartículas a través de la condensación de átomos o entidades moleculares en una fase gaseosa o en solución [23], estos métodos son ventajosos porque permiten tener mayor control de las nanopartículas dando como resultado partículas más uniformes y con menos impurezas, algunos métodos son el proceso sol-gel, condensación de fase de vapor y los procesos basados en aerosol.
Las partículas en escala nanométrica deben tener una composición química relativamente inerte, por este motivo no todos los métodos de síntesis de nanopartículas de sílice son válidos cuando se trata de aplicaciones biomédicas como es el caso de la pirólisis de silano o descomposición inducida por láser que debido el uso de disolventes orgánicos no polares producen superficies hidrófobas que no son compatibles con este tipo de aplicaciones [5], por el contrario, métodos como el proceso Sol-gel y el proceso Stöber son ampliamente utilizados para este tipo de aplicaciones.
En el año de 1992, Heath realizó el primer reporte de nanopartículas de sílice sintetizados a partir de una solución [25], se utilizó la técnica de fase líquida basada en la reducción de tetracloruro de silicio (SiCl4 ) y polisilina (RSiCl3, R = H, octilo) por sodio metálico en un disolvente orgánico no polar para preparar cristales individuales de silicio submicrométricos de forma hexagonal con un tamaño de 5 a 3000 nanómetros, en condiciones de altas temperaturas (385 °C) y altas presiones (> 100 atmósferas). La síntesis de nanopartículas basadas en óxido de silicio ( SiO 2 ), se puede realizar partiendo de dos rutas generales que son: el proceso Stöber y el proceso Sol-gel [5]. A continuación, se explicarán algunos de los procesos de síntesis de nanopartículas de sílice (NPs) reportados para aplicaciones biomédicas
2.1. Proceso Stöber
El proceso Stöber se caracteriza por estar formado por una reacción de hidrólisis en su fase inicial y por una reacción de condensación mediada por componentes como el agua y el etanol en su segunda fase, estos componentes actúan como reactivos y productos de reacción logrando una inestabilidad en el sistema dando origen a una reacción autocatalizada [26]. Wei et al. [27] prepararon NPs utilizando metanfetaminas de Stöber previamente modificadas a las cuales se les añadió tetraetilortosilicato (TEOS) como precursor, posteriormente estas NPs se separaron por centrifugación (12,000 r/min) durante 15 minutos y luego se lavaron tres veces con etanol y con agua ultrapura y, además, se dispersaron en solución salina tamponada con fostato (PBS) para el cultivo celular o en etanol para la posterior modificación de la superficie. Se puede obtener nanopartículas preparadas mediante crecimiento anisotrópico basándose en el método Stöber, así lo reportó Cheng et al. [10], en donde se obtuvieron MSN asimétricas tipo piruleta Fe3O4@SiO2&EPMO partiendo de nanoesferas de Fe3O4@SiO2 obtenidas utilizando el método hidrotermal para su uso posterior como portador de fármacos.
Jain et al. [28], utilizaron el proceso Stöber con algunas modificaciones para preparar MSN luminiscentes, optimizaron la relación de APTES (3-aminopropil trietoxisilano) a TEOS obteniendo partículas con un tamaño de ~ 43 nm y una dispersión de tamaño de ~ 12% y estables en función del pH que pueden explorarse para aplicaciones en imágenes diagnósticas y en administración de fármacos. Hadipour et al. [29], sintetizaron NPs utilizando el proceso Stöber a 100 nm para partículas no porosas, a 100 nm y 500 nm para partículas mesoporosas y a 100 nm para partículas huecas que mostraron como resultado diámetros uniformes, los perfiles de degradación de estas nanopartículas se investigaron durante 28 días en fluidos biológicos simulados y agua desionizada mostrándose que las nanopartículas mesoporosas se degradan más rápido a valores de pH más altos, en general las nanopartículas no mostraron citotoxicidad en pruebas con células endoteliales aórticas humanas (HAEC) lo que las hace útiles para aplicaciones en entrega controlada de fármacos.
2.2. Proceso Sol-gel
El proceso Sol-gel es una ruta química que se produce a temperatura ambiente en condiciones tanto ácidas como básicas. Comienza con un precursor de algún tipo de silano como el TEOS o el tetrametil ortosilicato (TMOS) en una solución acuosa [30]. La reacción se produce mediante una reacción de hidrólisis y condensación en presencia de un catalizador ácido o básico como el ácido clorhídrico (HCl) o el amoniaco (NH3). A medida que se produce la reacción, los precursores forman una nanoestructura cristalina. En el caso de una reacción catalizada por un ácido, la hidrólisis es mucho más rápida que la condensación, lo que induce la formación de muchas pequeñas partículas de sílice. Estas pequeñas partículas tienden a formar una estructura similar a un gel. Por el contrario, la reacción catalizada por la base tiene un paso de condensación más rápido que el de hidrólisis, que forma NPs más grandes. La adición de un tensioactivo a la solución permite la formación de MSN debido a que sirve como plantilla para el crecimiento de estructuras de sílice, uno de los agentes tensioactivos más usados es el bromuro de cetiltrimetilamonio (CTAB) ya que puede formar micelas en soluciones acuosas. Es crítico eliminar el tensioactivo una vez obtenida la estructura de MSN porque este es citotóxico, para ello se puede usar el método de calcinación o extracción con solvente [31].
La misma técnica fue reportada por Li et al. [32]reportaron la síntesis de tres tipos de MSN utilizando derivados de aminoácidos (C16-L-histidina, C16-L-prolina y C16-L-triptófano) como plantilla. El uso de TEOS como precursor también fue reportado por Tu et al. [33]. Hou et al. [11], sintetizaron MSN utilizando un proceso de sol-gel catalizado por base con ortosilicato de tetrabutilo (TBOS) y tensioactivo CTAB como precursor de sílice y plantilla, respectivamente. Primero, se disolvieron 2 g de CTAB en 240 ml de agua desionizada (DI), luego se ajustó la temperatura de la solución a 80 ° C durante 30 minutos. A continuación, se añadieron gota a gota 11 mM de 3,53 g de TBOS al tensioactivo con agitación vigorosa a 80 ºC durante 12 h. La solución final de la mezcla se recogió por centrifugación a 12,000 rpm durante 15 min. Luego los productos se lavaron con agua tibia desionizada. El tensioactivo se eliminó mediante extracción en la solución que contenía ácido acético (2 M, 250 ml) y agua desionizada (250 ml) durante 12 h. El producto final de MSN se lavó con agua tibia desionizada y etanol antes de secarlo al vacío, las nanopartículas obtenidas presentaron características como potencial zeta negativo (-31.8 mV) y un tamaño de 148.5 nanómetros lo que indicó gran capacidad de agregación de la glicirrina para mejorar la función hepática.
Liu et al. [34], utilizaron cloruro de hexadeciltrimetilamonio (CTAC) y trietanolamina (TEA) para la obtención de MSN. Estos compuestos químicos se añadieron secuencialmente en 20 mL de agua. La solución acuosa se agitó a 80 °C durante 1 h antes de la adición gota a gota de 1,5 mL de TEOS. Después de la agitación durante 1 h, la mezcla obtenida se centrifugó. Las nanopartículas resultantes se lavaron a fondo con etanol. El producto obtenido se colocó entonces en una solución de cloruro de sodio (NaCl) en metanol (1 wt%) durante 3 h para eliminar el CTAC. Las MSN se obtuvieron después de repetir el procedimiento por tres veces, las MSN obtenidas mostraron un tamaño uniforme de alrededor de 100 nm, forma esférica notable, buena monodispersidad de partículas y una estructura mesoporosa estable. Lu et al. [35], sintetizaron MSN para aplicación en liberación controlada de fármacos a través de un proceso Sol-gel modificado haciendo uso de CTAT y TEOS. Chiu et al. [36] reportó el uso de este método usando CTAT y TEA como plantillas para obtención de MSN debido a la alta estabilidad de los poros para ser utilizadas como transportadores de proteínas y fármacos respectivamente.
2.3. Otros procesos de síntesis de nanopartículas de sílice
He et al. [22] sintetizaron MSN a través del montaje S°I° (S° es una amina tensioactiva neutra, I° es un precursor inorgánico neutro) que consiste en el uso de rutas de ensamblaje neutro y que proporcionan productos calcinados con el mejor orden de largo alcance. Se añadió TEOS a una solución agitada vigorosamente de dodecilamina (DDA) en etanol (EtOH) y agua desionizada, proporcionando una mezcla de reacción de la siguiente composición molar: TEOS: DDA: EtOH: H2O, 1,0: 0,27: 9,09: 29,6. La mezcla de reacción se envejeció a temperatura ambiente durante 18 h, y la plantilla se eliminó usando EtOH caliente a 45 °C y 80 °C durante 1 h. Luego, el producto final se secó en un horno a 90 °C durante 1 h.
Farooq et al. [14] y Hu et al. [37], reportaron las síntesis de MSN utilizando el método dirigido por la plantilla tensioactiva seguido de la eliminación de la plantilla CTAB. Guo et al. [38], sintetizaron MSN dopados con estroncio (Sr) mediante un método de plantilla mediado por CTAB. Se añadió TEOS gota a gota a una solución que contiene CTAB e hidróxido de sodio (NaOH) con agitación a 80 °C durante 5 h. La relación de TEOS / CTAB / NaOH / agua desionizada fue de 2 ml/0,4 g/ 0,112 g/192 ml. Después de agitar, el precipitado se recogió por centrifugación, se lavó con agua desionizada y metanol, se secó por liofilización y se calcinó a 550 ° C durante 5 h. Los Sr-MSN se obtuvieron mediante un método similar en el que la adición de TEOS se siguió inmediatamente agregando 1 ml de solución de 𝑆𝑟 𝐶𝑙 2 · 6𝐻 2 𝑂. Gounani et al. en sus trabajos de investigación del año 2018 [13] y 2019 [12], reportaron también el uso de CTAB, TEOS y NaOH para la obtención de MSN. Bhavsar et al. [39], utilizaron además de CTAB, silicato de sodio (Na2 SiO3) como fuente económica de sílice para obtener NPs. El sólido blanco resultante se separó por filtración y se lavó varias veces con agua desionizada y metanol, secándose a temperatura ambiente. El surfactante se eliminó por calcinación a 540 °C durante 5 h en el aire a una velocidad de calentamiento de 1 °C/min.
3. Funcionalizaciones y recubrimientos de las nanopartículas de sílice mesoporosa
La toxicidad asociada a la sílice se debe a los grupos de superficie [31] principalmente a los grupos silanol que pueden interactuar con los componentes de la membrana celular, lo que conduce a la lisis de las células y, por consiguiente, a la fuga de los componentes celulares [40]. Para mejorar la biocompatibilidad de este tipo de nanopartículas se requiere de un recubrimiento que garantice carga superficial neutra, puesto que las nanopartículas cargadas fuertemente positivas o negativas se consideran una "señal de alerta" y el sistema reticuloendotelial (RES) las elimina rápidamente. En condiciones biológicas, la superficie de la sílice se carga negativamente debido a los grupos hidroxilo en masa en las MSN después de la hidrólisis de TEOS durante el procedimiento sintético. Así, los medicamentos con carga positiva solubles en agua prefieren ser adsorbidos en los poros y superficies con carga negativa de las MSN para formar un complejo estable de MSN/medicamento [41]. Las MSN se pueden modificar covalentemente con grupos funcionales orgánicos e inorgánicos [7] incluidos los hidruros [5] que mejoran la entrega selectiva [3], biodistribución [31] y la adsorción electrostática de medicamentos con diferentes cargas en MSN [41] al impedir las interacciones indeseables entre las nanopartículas y el medio ambiente [42]. Estos grupos funcionales incluyen pequeños fosfatos orgánicos como el fosfoenolpiruvato, tioles, polímeros que contienen amino como la polietilenimina (PEI), dendrímeros, polietilenglicol (PEG), fosfolípidos o sulfhidrilo [42,43]. Además, se puede modificar la superficie de las MSN a través de la hidrólisis de silanos usando estrategias como la condensación conjunta [7], la hidrólisis-condensación, las reacciones post-sintéticas y el post-injerto.
Poostforooshan et al. [9], modificaron químicamente la superficie de las MSN a través de dos estrategias, la primera utiliza interacciones electrostáticas, a través del proceso capa por capa (LbL) con polímeros de Poliamida y Alginato para formar diferentes números de capas de polielectrolitos, la segunda implica la formación de enlaces covalentes a través del injerto de quitosano. La técnica de LbL, fue reportada en otro estudio por Hu et al. [37] donde se usaron MSN para su uso en entrega de fármaco. Tu et al. [33], recubrieron MSN con una bicapa lipídica actuando como barrera física para aumentar la estabilidad coloidal en condiciones fisiológicas y biocompatibilidad en su uso como portadores de hemoglobina. El uso de bicapa lipídica representa una clase potencialmente transformadora de vehículo de suministro terapéutico y teranóstico [44].
Se pueden usar diferentes factores como la temperatura, el tiempo de reacción, el tipo de disolvente y el tipo de precursor de organoalcoxisilano (OAS) para controlar las propiedades de los materiales injertados [7]. Huang et al. [45], reportaron MSN funcionalizadas utilizando un enlazador de disulfuro fotorreactivo de fenilazida (SPA) como estímulo sensible, la proteína modelo (avidina) se cargó con éxito tras la irradiación de luz y se liberó cuando se expuso a glutatión (GSH), lo que demuestra que el SPA-MSN es un excelente nanoportador. Park et al. [46], funcionalizaron la superficie de MSN con amida citracónica, que tiene una propiedad de inversión de carga sensible al pH lo que facilita la liberación de proteínas dentro de las células al responder al pH endosómico intracelular. Deodhar et al. [7], utilizaron APTES para funcionalizar MSN lo que le dio a la superficie una carga neta positiva. Lu et al. [35], también reportó el uso de APTES para funcionalizar las MSN. Zaharudin et al. [47], funcionalizaron las MSN con líquido iónico de piridinio, con carboxilo, amina y tiol para mejorar la biocompatibilidad para su uso como transportadores de fármaco para terapia contra el cáncer. Gounani et al. [13], [11], utilizaron MSN funcionalizadas con amina y carboxilo para mejorar la aceptación en aplicaciones bactericidas. Los recubrimientos con quitosano también son útiles como cubierta adecuada que responde al pH para la orientación celular, así lo reportaron Hou et al. [11], donde desarrollaron un portador de entrega dirigido a hepatocitos con MSN recubiertas.
Para los recubrimientos de NPs también se usan oligoelementos esenciales, los cuales están presentes en la sangre, que es el primer fluido biológico con el que entran en contacto las nanopartículas al ser suministradas por vía intravenosa, así lo reportaron Guo et al. [38] donde se utilizó MNS recubiertas con estroncio debido al papel crucial que desempeña en la prevención de la osteoporosis. Tsamesidis et al. [3], doparon NPs con iones como Ca, Mg y Cu para mejorar la biocompatibilidad, los resultados mostraron que las tasas de hemolisis disminuyeron lo que sugiere un efecto protector de los SN dopados con iones en la membrana de los eritrocitos en comparación con las NPs puras. Farooq et al. [14], utilizaron Titania usando la técnica de deposición física de vapor de pulverización reactiva con magnetrón para mejorar la y dinámica de liberación de un fármaco vasodilatador cargado en MSN.
Debido a la composición química relativamente inerte [3] de las NPs y a su capacidad de carga [48], estas han sido útiles para mejorar propiedades de biocompatibilidad en otras nanopartículas como por ejemplo las nanopartículas magnéticas (MNP) [43], así lo muestran Khanna et al. [49] en donde se sintetizaron nanopartículas magnéticas por medio del proceso Sol-gel que fueron recubiertas con NPs como estabilizador para mejorar el comportamiento de las MNP en el entorno biológico, se observó que la viabilidad celular aumentó con el recubrimiento de NPs lo que refleja su biocompatibilidad mejorada. Jia et al. [50], también usaron nanopartículas magnéticas con recubrimiento de sílice y observaron que hubo aceleración en la regeneración ósea lo que a su vez aumentó la biocompatibilidad y funcionalización del compuesto. Adicionalmente a los recubrimientos con amina (AMSN) y carboxilo (CMSN), Hasany et al. [51], sintetizaron MSN recubiertas por polimérica (PMSN) para estudiar su impacto en la morfología de células madre mesenquimales en cultivos 2D y 3D. Se obtuvo que tanto para las nanopartículas puras (BMSN) como para las AMSN la biocompatibilidad mejoró mientras que para las PSMN se evidenciaron efectos citotóxicos significativos. Wu et al. [52], recubrieron núcleos de cobalto con una doble capa de sílice a través de ensamblaje capa por capa. La primera capa (interna) tiene un revestimiento denso de NPs y la segunda capa (externa) se recubrió con MSN lo que dio como resultado un compuesto (Co@Silica@meso-Silica) altamente biocompatible. Moreira et al. [48] también utilizaron la sílice como recubrimiento dando como resultado nanopartículas de sílice con núcleo de oro para aplicarlos principalmente en imagenología.
4. Aplicaciones biomédicas de las nanopartículas de sílice mesoporosa
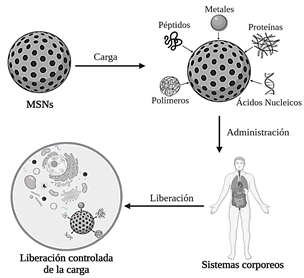
El uso de nanopartículas basadas en sílice ha estado aumentando en las últimas décadas debido a las ventajas que proporcionan sus propiedades tales como su alta biocompatibilidad, facilidad de síntesis y en general sus propiedades químicas y físicas mejoradas permitiendo usarse en aplicaciones como aditivos alimentarios y en plásticos, pigmentos, aislantes térmicos, pesticidas, administración de medicamentos, terapia génica, imágenes moleculares entre otras aplicaciones [6]. En este artículo se hace énfasis en las potenciales aplicaciones biomédicas de este tipo de partículas, para ello se abordarán las aplicaciones biomédicas en 3 incisos; el primer inciso consta de las nanopartículas de sílice mesoporosa como liberador fármacos de manera controlable (ver Fig. 2) en áreas de presencia de tejido tumoral, el segundo inciso es la liberación controlada de fármacos con efecto bactericida y el tercero reúne otras aplicaciones importantes en el ámbito biomédico tales como: fototerapia, fluorescencia, tomografía por emisión de positrones, imágenes de ultrasonido, biosensores basados en MSN y la aplicación de MSN en ingeniería de tejidos. En la Tabla 1 se presenta un resumen de las potenciales aplicaciones biomédicas de las nanopartículas de sílice mesoporosas.
Fuente: Los Autores.
Figura 2 Liberación controlada de carga de nanopartículas de sílice mesoporosas.
Tabla 1 Resumen de potenciales aplicaciones biomédicas de nanopartículas de sílice mesoporosa referenciadas en este artículo.
Fuente: Los Autores.
4.1. Liberación controlada de fármacos en áreas de presencia de tejido tumoral
Para entender la importancia de las MSN en aplicaciones como liberación controlada de fármacos, inicialmente es necesario saber que las MSN fueron inventadas a principio de los años 90 por dos grupos de investigación independientes [8,53], pero no fue sino hasta la última década que floreció el desarrollo de la nanotecnología de las MSN proporcionando enfoques prometedores para superar el cáncer debido a las propiedades únicas que poseen los nanomateriales [41]. En el caso específico de las MSN utilizadas para el tratamiento de células cancerígenas, contribuyen a aumentar la biodisponibilidad de los medicamentos y reducir los efectos secundarios. En cuanto a las nano plataformas se es deseable que estas cumplan el tamaño, la carga, y la biocompatibilidad apropiados para hacer uso de estas en medios de tejido tumoral es por esto que las NPs son un tipo de biomaterial muy prometedor como vehículos de administración de fármacos debido a la buena bioseguridad, la alta capacidad de carga de fármacos, el tamaño y la estructura de poros fácilmente sintonizables distribución de tamaño uniforme, la síntesis conveniente, el [54]-[56], además de esto, las MSN han recibido la aceptación por parte de los químicos y biólogos por su baja toxicidad, alta biocompatibilidad, mesoporos uniformes, fácil carga de medicamentos, alta capacidad de carga y capacidad para liberar el huésped encapsulado bajo diferentes estímulos externos [57-59], siendo estos estímulos en este caso particular el cambio de pH debido a la presencia de tejido tumoral. Para el mundo de la investigación esta forma de entrega pasiva sigue siendo el método más utilizado en el campo de la nanomedicina.
Uno de los principales desafíos de la administración de medicamentos basada en los nanoportadores es desarrollar sistemas específicos de administración de medicamentos que puedan transportar reactivos de quimioterapia a los lugares objetivo sin afectar a ninguna célula normal [15] y esto es debido a que sustancias quimioterapéuticas como Taxol, Doxorubicina, Camptothecin, entre otras, son muy tóxicas para células sanas [60]. Cabe destacar que los sistemas de nano-entrega basados en sílice son considerados generalmente como seguros por la Food and Drug Administration (FDA) [60]. Es por esto que este artículo aborda una revisión sistemática de artículos de investigación con el fin de poder conocer cómo fue la síntesis, la funcionalización y la correcta ejecución de las MSN en su aplicación como liberadoras controladas de fármacos en áreas de presencia de tejido tumoral.
Liu et al. [34] fabricaron un núcleo sencillo con estructura de nanopartícula para el tratamiento focalizado de tumores en cáncer de próstata, con la unión de un núcleo de sílice mesoporosa de tamaño nanométrico, conjunto al fármaco de alta eficiencia doxorrubicina y con un recubrimiento de un biomineral de carbonato de calcio (CaCO3 ), este tratamiento localizado de tumores da como resultado una excelente biocompatibilidad capaz de realizar una liberación controlada de fármacos en áreas de presencia de tejido tumoral, se evidenció en la investigación un importante retraso en el crecimiento del tumor, la destrucción de las células tumorales, así como la reducción de la proliferación de las células tumorales, demostrando así, como es de satisfactorio la liberación localizada del fármaco y presentado cualidad de biocompatibilidad y citotoxicidad in vitro.
El uso de doxorrubicina fue reportado también en el estudio de Adhikari et al. [61], los cuales sintetizaron MSN y nanopartículas huecas de sílice mesoporosa (HMSN) para administrar este prominente fármaco anticanceroso bajo estímulos externos. Demostraron que las MSN y las HMSN no muestran ninguna citotoxicidad hacia las células HeLa hasta 350 μg/ml ni ningún cambio morfológico en el núcleo de las células, cubriendo este silicato de hierro con óxido de hierro se logró una liberación controlada (accionada con cambios de pH) de fármaco anticanceroso, manifestando así la efectividad como portador y liberador de doxorrubicina. Por otra parte, para que las MSN puedan hacer su entrega en las áreas destinadas se debe de estudiar la forma en que estas viajan por el torrente sanguíneo.
Guimarãesa et al. [62] realizaron un revisión sistemática sobre las NPs conjunta a materiales orgánicos y de cómo estos pueden crear una sinergia perfecta para la liberación controlada de fármacos respondiendo al medio exterior mediante estímulos, accionando así su sistema de entrega, además describen los enfoques prácticos y los mecanismo de control de la liberación controlada de fármacos y las modificaciones de la superficie de las nanopartículas organosilíceas destinadas a aumentar el tiempo de circulación de la sangre y el objetivo del tumor. Wang et al. [43], muestran en diversas investigaciones como las NPs pueden proporcionar una mayor eficacia terapéutica en el tratamiento del cáncer mediante la acumulación en un lugar específico, la administración de medicamento y la liberación estimulada de los mismos. Conjuntamente, afirman que las MSN son un excelente vehículo para la liberación de fármacos; cabe destacar que en el artículo se hace hincapié en la importancia de la homogeneidad de las nanopartículas en cuanto a su tamaño de poro para poder realizar su función de manera adecuada.
Al mismo tiempo que se ve el uso de las MSN para la entrega localizada de fármacos, estudios como el de Du et. al [63] mostraron que el benceno cargado con DOX&- tioéter-HMONs tenía una mejor eficacia terapéutica para la entrega/quimioterapia in vivo en el xenoinjerto de metástasis espontánea de tumor mamario ortotópico 4T1 que el DOX libre mediante inyección intravenosa y Li et al. [41] desarrollaron un portador de MSN recubierto con bicapa lipídica para administrar conjuntamente gemcitabina (GEM) y PTX para la terapia del cáncer de páncreas. La administración conjunta de PTX / GEM mostró una mayor eficiencia en la supresión del volumen del estroma del cáncer de páncreas y el tamaño del tumor, superando a las mezclas de medicamentos o monoterapias en modelos animales xenotransplantes y ortotópicos, lo que indica el potencial de las MSN para administrar medicamentos poco solubles que mejoren la eficacia antitumoral. Adicionalmente, las MSN son excelentes candidatos para la terapia del cáncer [42] y al combinarlas con otros materiales pueden mejorar su eficacia terapéutica y la supresión del volumen de las áreas afectadas por el cáncer.
Debido a los importantes resultados que se han obtenido con el uso de nanopartículas aplicadas a la liberación controlada de fármacos en terapia contra el cáncer, Ma et al. [15] hacen énfasis en la comunidad científica para seguir con la investigación de liberación controlada de fármacos para el tratamiento efectivo y focalizado de tumores.
4.2. Liberación controlada de fármaco con efectos bactericidas
En los últimos años y de manera progresiva, las bacterias se han vuelto resistentes a los antibióticos debido al uso descontrolado de ellos y a las malas prácticas de salud pública por parte de la población mundial, esto implica que los efectos ocasionados por las bacterias en el ser humano sean cada más adversos y nocivos, aumentando los casos clínicos de infecciones graves [64]. Por esta razón es importante el desarrollo de nuevas investigaciones de tecnologías y métodos para la generación de nuevas cepas de agentes bacterianos especialmente considerando el número decreciente de nuevos medicamentos antibióticos que están en camino [65], [66]. Es por esto que es de vital importancia que se realicen estudios relacionados con la creación de nuevas tecnologías para el desarrollo de agentes bacterianos como es el caso del uso de nanopartículas mesoporosas o huecas.
Chang et al. [16] emplearon MSN de plata Janus para entregar CTAB a las bacterias, y demostramos el efecto antibacteriano sinérgico de la plata y el CTAB, Estas nanopartículas con forma de bala tenían una cabeza de plata (80 nm de diámetro) unida a una varilla de sílice mesoporosa (200-300 nm de longitud). La pieza proporcionó una nanoplataforma de una sola partícula con un efecto sinérgico contra las bacterias Gram-positivas y Gram-negativas (E. coli y S. Aureus). Además, estas nanobalas podrían ser empleadas como portadoras para cargar antibióticos con una forma de liberación que responda al pH, conduciendo a un efecto antibacteriano selectivo y sinérgico. Wang et al. [67], demostraron que una nanoplataforma de nanovehículos de sílice mesoporosa cargada con clorhidrato de levofloxacina (LEVO) e incrustada con núcleo de plata (Ag@MSNs@LEVO) es un agente antibacteriano sinérgico para el tratamiento de infecciones resistentes a los medicamentos tanto in vitro como in vivo. La capa de sílice mesoporosa actúa como depósito para cargar LEVO y como pasaje para su liberación. Aunque todos los resultados indican claramente el extraordinario efecto terapéutico del Ag@MSNs@LEVO en las infecciones resistentes a los medicamentos, también debe preocuparse la bioseguridad in vivo de esta nanoplataforma, no se observa ningún efecto adverso en las dosis normales durante 5 días a la dosis aplicada, por consiguiente muestra una excelente biocompatibilidad en la evaluación a corto plazo, pero los riesgos potenciales de la toxicidad a largo plazo aún deben ser cuidadosamente investigados en el futuro. Este estudio indica claramente un prometedor potencial de la Ag@MSNs@LEVO como herramienta terapéutica sinérgica y segura para las infecciones clínicas resistentes a los medicamentos.
En otro estudio, Poostforooshan et al. [9] investigaron la aplicación de partículas de Microesferas huecas de sílice mesoporosa sintetizadas en aerosol en la administración controlada de fármacos mediante la carga de amoxicilina como un compuesto antibiótico con alta eficiencia de atrapamiento (hasta 46%). Las partículas cargadas con amoxicilina funcionalizadas se evaluaron con bacterias E. Coli e indicaron la inhibición bacteriana hasta el 90% en menos de 2 h.
Gounani et al. [12] estudiaron los efectos de la polimixina B y la vancomicina contra Staphylococcus aureus (DSM20231), Escherichia coli (K12 DSM498-0714-001), Pseudomonas aeruginosa (PAO1 DSM 19880), Klebsiella oxytoca (DSM 5175) y Acinetobacter Baumann cargadas en B-MSN (MSN desnudas) y C-MSN (MSN funcionalizadas con carboxilo). Tanto las B-MSN como las C-MSN cargadas con antibióticos fueron efectivas contra las bacterias Gram-negativas y Gram-positivas. Los antibióticos tuvieron interacciones sinérgicas contra las bacterias Gram negativas, y la eficacia antimicrobiana fue mayor para los C-MSN cargados con antibióticos en comparación con los antibióticos libres en la misma concentración, aunque la citotoxicidad fue menor. Finalmente, la unión de las MSN con medicamentos y nanopartículas inorgánicas aumentan la eficiencia significativamente del rendimiento anticancerígeno y antibacterial [10], esto siendo de beneficencia para el mundo biomédico pero aun así se deben de tener más estudios sobre los efectos futuros y la interacción de las NPs en contacto continuo con los sistemas corporales.
4.3. Otras aplicaciones biomédicas de las nanopartículas de sílice mesoporosa
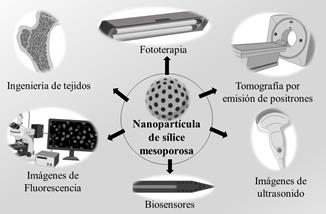
La administración de fármacos, como se evidenció en la sección anterior es una de las aplicaciones que más se ha venido trabajando en los últimos años, sin embargo, las NPs se han utilizado también como agentes de bioimágen debido a la superficie hidrofílica de las MSN, sus estructuras se disuelven en solución acuosa, además, debido a su alta área superficial y el volumen de poro pueden proporcionar depósitos compartimentales para múltiples funcionalidades, lo que constituye las MSN como opciones prometedoras para diversas aplicaciones de imágenes médicas [40] como por ejemplo imágenes de tomografía de emisión de positrones (PET), imágenes de ultrasonido, imágenes de fluorescencia en tiempo real [68], e imágenes de resonancia magnética [31],69] y otras aplicaciones como biosensores, fototerapia e ingeniería de tejidos (ver Fig. 3). Estudios previos han revelado que las propiedades ópticas de las NPs se atribuyen al efecto de confinamiento cuántico de las agrupaciones de silicio y a defectos intrínsecos como los centros de los agujeros de oxígeno no puenteados, el dioxasilirano, silileno, y silanona [18].
Fuente: Los Autores.
Figura 3 Aplicaciones biomédicas de las nanopartículas de sílice mesoporosa en imágenes diagnósticas, biosensores e ingeniería de tejidos.
4.3.1. Fototerapia
La fototerapia es una técnica que utiliza luz ultravioleta para tratar enfermedades relacionadas con la piel, recientemente, las MSN se han diseñado como nanoportadores para dos tipos de fototerapia, la terapia fototérmica (PTT) y la terapia fotodinámica (PDT) o su combinación, las cuales han sido ampliamente utilizadas para tratamientos contra el cáncer utilizando fotosensibilizadores y agentes fototérmicos respectivamente [41]. Dependiendo de los tipos de carga, los nanotransportadores basados en MSN pueden ser utilizados para varios propósitos. Por ejemplo, los colorantes fluorescentes o los fotosensibilizantes han sido atrapados físicamente dentro de los nanocanales o unidos químicamente a la superficie de los nanoportadores basados en MSN para la bioimagen y la terapia fotodinámica en el tratamiento del cáncer [15]. Una estrategia para preparar un sistema PDT/PTT basado en MSN multifuncionales fue desarrollada por Lv et al. [17] utilizando nanopartículas de GdOF: Ln luminiscentes fuertes de conversión ascendente (UCL) como núcleos y recubriéndolos con sílice mesoporosa. La emisión roja marcadamente mejorada de Yb / Er / Mn codopado en GdOF podría transferir energía de manera eficiente al agente de PDT conjugado (ZnPc) que a su vez producía oxígeno singlete (1O2) alto. El sistema demostró una eficacia terapéutica significativamente mejorada contra el crecimiento tumoral tanto in vitro como in vivo [41]. El dopaje de NPs también ha sido utilizado para fototerapia, Custodio et al. [77] doparon NPs con bengala rosa (RB) y ácido 9,10-antraquinona-2- carboxílico (OCAq) para aplicarlas en terapia fotodinámica (PDT) contra líneas celulares de cáncer de pulmón mostrando como resultado que después de 15 minutos existía una supervivencia celular del 20 al 30% para ambos materiales, y que la concentración de OCAq fue la mitad del nanomaterial RB.
4.3.2. Imágenes de fluorescencia
Se han desarrollado varias estrategias para conjugar una variedad de colorantes en los poros o en las superficies de las MSN para formar MSN de fluorescencia (FMSN) [71], iniciando por diferentes técnicas de síntesis, Chang et al. [18] sintetizaron nanopartículas fluorescentes con formas y tamaños controlados mediante el uso de SiCl4, estas nanopartículas exhibieron fluorescencia cerca de 2.95 eV (420 nm), originada a partir de defectos ópticamente activos de silanona y dioxasilyrano, y se posteriormente fueron aplicadas a la bioimagen in vitro de células de carcinoma epitelial pulmonar (A549) donde se dio un resultado sin citotoxicidad. La funcionalización de nanopartículas con otros elementos también ha dado resultados favorables hacia la fluorescencia, Araichimani et al. [69] investigaron las NPs integradas con europio las cuales mostraron una fuerte capacidad de imagen de fluorescencia roja que se atribuyó a 5 D 0 → 7 F 1y transiciones 5 D 0 → 7 F 2 de iones de europio en la matriz huésped de sílice. Igualmente Du et al. [63] funcionalizaron nanopartículas con estructura de silosquioxano con doble fluoróforo puenteado en células HeLa, las cuales son un tipo particular de células de cultivo celular, donde se exhibieron fuertes emisiones de doble fluorescencia verde y roja en las células bajo una excitación de una sola longitud de onda, y liberación síncrona o asíncrona de diferentes fármacos, lo que sugiere su potencial como portador de fármacos fluorescentemente rastreables y agente de bioimagen.
4.3.3. Tomografía por emission de positrones
La tomografía por emisión de positrones o PET (positron emission tomography) se basa en la obtención de imágenes tomográficas de la distribución 3D en el organismo de algunos radiofármacos emisores de positrones, los cuales representan determinados procesos bioquímicos in vivo, una de las limitaciones de esta técnica es la penetración de la luz en el tejido, lo que genera una disminución del contraste de la imagen, para superar esta limitación se han utilizado los poros de las MSN para cargarlos con radionúclidos como el zirconio, arsénico, cobre, tecnecio, titanio, flúor o carbono [31] el efecto de las nanopartículas en esta técnica es aumentar tanto selectividad de los tejidos como la resolución debido a las señales generales más altas. También se han utilizado nanopartículas con núcleos metálicos como las nanopartículas esféricas de sílice con núcleo de oro (AuMSS) [48], el núcleo de oro tiene la capacidad de mejorar el contraste de la imagen en las modalidades de imágenes estructurales, esto fue estudiado por Kobayashi et al. [19] donde prepararon una solución coloidal de nanopartículas de oro con núcleo de sílice con un núcleo de oro de 17 nm y un tamaño total de partícula de 136 nm para ser usada como agente de contraste para tomografía computarizada. En su trabajo, los autores demostraron que la capacidad de atenuación de las nanopartículas AuMSS era casi siete veces mayor que la de Iopamiron®, un agente de contraste de rayos X comercial basado en el yodo.
4.3.4. Imágenes de ultrasonido
El ultrasonido es una técnica de toma de imágenes aprobada por la FDA la cual utiliza ondas sonoras de alta frecuencia para reflejar los órganos y estructuras dentro del cuerpo, una de las ventajas de esta técnica es que no utiliza radiaciones ionizantes, sin embargo, su limitación radica en la mala resolución. Una forma de mejorar la resolución es utilizar agentes de realce que pueden ampliar el sitio del tejido y mejorar la imagen [72]. Este agrandamiento del tejido se hace a menudo mediante la formación de burbujas; Wang et al. [20] en su investigación añadieron burbujas a los tejidos a través de la entrega de MSN huecos y así pudieron mejorar la resolución de las imágenes. Por otro lado, Liu et al. [73] utilizaron esferas huecas de quitosano donde se incluye la funcionalización de la superficie de NPs, la reacción del quitosano a las NPs funcionales, la reticulación de la capa de revestimiento del quitosano y la eliminación de los núcleos de sílice con hidrofluoruro para ser utilizados como sistemas de burbujas para la mejorar de la resolución del ultrasonido, en este caso se empleó el perfluoropentano, el cual es un gas de imagen que se llena en las esferas huecas de quitosano. Las imágenes inducidas por ultrasonido que aparecieron con las esferas huecas de quitosano confirman que las nanoesferas huecas de quitosano atrapan el gas perfluoropentano y que las mismas con infusión de gas podrían demostrar la propiedad de las imágenes por ultrasonido.
4.3.5. Biosensores
Los biosensores son instrumentos que se usan para medir parámetros biológicos o químicos. Las MSN poseen dos características principales que las hace excelentes para aplicaciones de biosensores, la primera es su alta porosidad la cual proporciona áreas para inmovilizar los agentes de detección tanto en la superficie exterior como en el interior de los poros, lo que conduce a respuestas rápidas y también a límites de detección bajos, y la segunda es la transparencia óptica la cual permite la detección óptica a través de las capas de materiales [40]. Debido a estas propiedades únicas, hasta ahora se ha diseñado e investigado una amplia variedad de estructuras basadas en MSN para la generación de biosensores, Huang et al. [21] desarrollaron un biosensor microfluídico sensible al ácido que utiliza curcumina (CUR) como indicador de señal y MSN con óxido de cinc ( ZnO) para amplificación de señal para la detección sensible y rápida de Salmonella en modal colorimétrico y fluorescente.
Los biosensores también se han utilizado para la identificación de contituyentes vitales de las proteínas como la L-tirosina la cual establece un balance de nitrógeno positivo, Mohseni et al. [74] diseñaron un nuevo y sencillo método para la determinación electroquímica de la L-tirosina utilizando NPs funcionalizadas de 3-mercaptopropil trimetoxisilano donde el biosensor mostró una respuesta lineal para la L-tirosina en el amplio rango de concentración de 0,05-600 μM y un bajo límite de detección de alrededor de 0,02 μM debido al efecto co-catalítico de la enzima y las nanopartículas. Adicionalmente las nanopartículas también se han utilizado para amplificar señales de biomarcadores, Jiménez et al. [75] utilizaron MSN para amplificar la detección del antígeno carcinoembrionario (CEA), un biomarcador de cáncer relevante al ser cargadas con la sonda redox azul de metileno y cubiertas con un conjunto similar a una puerta de respuesta a estímulo de avidina / imminobiotina, esta amplificación de la señal también se puede dar por medio de la intensificación de fluorescencia.
Yun et al. [76] prepararon una plataforma de biosensores de fluorescencia mejorada con metal (MEF) sobre sustratos fibrosos utilizando una capa de sílice que actuó como espaciador entre las nanopartículas de plata y las moléculas fluorescentes para optimizar el efecto MEF. En cuento a bacterias patógenas su detección es de importancia crítica para cuestiones de salud y seguridad en el diagnóstico clínico, la industria alimentaria, la calidad del agua y el medio ambiente, así como la lucha contra el posible bioterrorismo [77], Guinlet et al. [78] presentaron resultados sobre el diseño de un biosensor electroquímico, en el que la presencia de NPs, funcionalizados con anticuerpos policlonales específicos (Abs), se utiliza para apuntar y unirse a la bacteria E. coli para su detección y cuantificación.
4.3.6. Ingeniería de tejidos
La ingeniería de tejidos es un campo interdisciplinario emergente que tiene como objetivo reparar o regenerar los tejidos dañados o faltantes en el cuerpo. Actualmente las investigaciones sobre ingeniería de tejidos se centran principalmente en la búsqueda de andamiajes poliméricos apropiados que sirvan como plantillas tridimensionales para la adhesión, proliferación, diferenciación y formación de tejidos [79]. Las MSN están diseñadas para la captación dirigida a las células y la administración de varias clases de fármacos controlados temporal y espacialmente, debido a su alta flexibilidad química. La incorporación de tales vehículos de entrega de drogas refinados en andamios de células madre ofrece la posibilidad de entrega dirigida y controlada de señales biológicas.
La aplicación de MSN en la ingeniería de tejidos permitirá el desarrollo de tecnologías avanzadas para rastrear, guiar trasplantes (diagnóstico / imagen) y obtener la entrega controlada y dirigida de señales de células madre (terapia) [80]. La mayor parte de la investigación sobre MSN en ingeniería de tejidos se ha centrado en la diferenciación osteogénica y la formación de tejido óseo, como el desarrollo de andamios a partir de biomateriales disponibles naturalmente para la ingeniería del tejido óseo [81]. Las nanopartículas son generalmente funcionalizadas para aumentar su biocompatibilidad, He et al. [22] realizaron una investigación para determinar el efecto sinérgico de las MSN funcionalizadas con nanohidroxiapatita (nHA) y ácido poli (DL-láctico-co-glicólico) (PLGA) como compuesto para la ingeniería de tejido óseo; encontrando así en este compuesto buenas características en cuanto a la microestructura, resistencia mecánica y humectabilidad, además de una mayor adhesión y proliferación aumentando los niveles de factores osteogenéticos.
Complementando las MSN en la ingeniería de tejidos, Mehrasa et al. [93] evaluaron las características mecánicas, químicas y biológicas de los andamios de PLGA alineados que contienen gelatina y MSN. Se emplearon células PCl2 derivadas de la feocromocitoma de rata para evaluar las ventajas de los andamiajes compuestos antes mencionados. Los resultados mostraron una morfología, hidrofilicidad, propiedades mecánicas y degradación más adecuadas con respecto a las aplicaciones de ingeniería del tejido nervioso. Además, la disposición de las células en una arquitectura controlada es útil para la proliferación celular, especialmente para la regeneración de los nervios.
En esta revisión bibliográfica se mostraron las aplicaciones de las nanopartículas de sílice mesoporosa en el campo de la ingeniería biomédica, debido a sus propiedades estas nanopartículas son prometedoras para la mejora de la calidad de vida de las personas, ya que las diferentes aplicaciones abarcan desde la liberación controlada de fármacos hasta el desarrollo de nuevas tecnologías como son los biosensores y la ingeniería de tejidos.
Como el campo de la bionanotecnología y el desarrollo de nanomateriales es un área reciente, se requieren continuar con investigaciones y estudios enfocados en el desarrollo de nuevas tecnologías, que permitan entender y evaluar los efectos secundarios de la sílice como biomaterial, ya que no son claros los efectos nanotóxicos de este tipo de nanomateriales.
5. Conclusiones
Como se pudo evidenciar en esta revisión, el método más usado para la síntesis de nanopartículas de sílice es el método de Sol-gel. La síntesis es un proceso importante para obtener un biomaterial con un determinado tamaño de poro, estructura estable, biocompatible y con baja toxicidad. Por otra parte, el recubrimiento y la funcionalización de las nanopartículas de sílice mejora la biocompatibilidad de las nanopartículas, estos recubrimientos se realizan con sustancias como grupos funcionales (carboxilo, tioles, polímeros, fosfolípidos, entre otros) u oligoelementos entre los que están el Cu, Fe y el Mg los cuales favorecen las interacciones de las nanopartículas con entornos biológicos y con fluidos donde se encuentran presentes naturalmente estas sustancias como la sangre. Adicionalmente la sílice se puede usar como recubrimiento debido a su baja citotoxicidad y alta biocompatibilidad principalmente al recubrir nanopartículas metálicas. En cuanto al transporte de fármacos, los recubrimientos se utilizan de modo que sirvan como agentes liberadores del medicamento al responder a estímulos como cambios en el pH, temperatura y la presencia de campos magnéticos externos para liberar su carga en la zona deseada y así disminuir efectos tóxicos que algunos medicamentos o tratamientos invasivos para terapia de enfermedades como el cáncer generan sobre las células sanas.
Debido a las características de estas nanopartículas, otras potenciales aplicaciones incluyen el área de bioimagen, donde las nanopartículas de sílice contribuyen en la selectividad de los tejidos, la mejora del realce y la resolución de las imágenes; en cuanto a la fototerapia las nanopartículas de sílice son utilizadas para mejorar la recepción de luz; las imágenes de fluorescencia, los agentes fluorescentes rastreables se cargan en los poros de las nanopartículas. Para los biosensores la alta porosidad de la sílice proporciona grandes áreas para inmovilizar agentes de detección y por último la ingeniería de tejidos donde se usa la sílice por favorecer la osteogénesis en andamios creados a partir de nanopartículas.