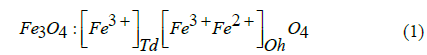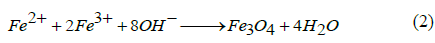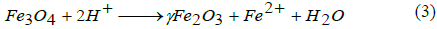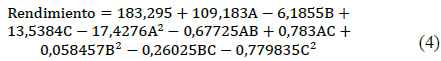1. Introducción
La nanotecnología hace referencia a la investigación y desarrollo tecnológico a nivel atómico, molecular o macromolecular, en el rango de 1 a 100 nm, para proporcionar una comprensión fundamental de los fenómenos y materiales a nanoescala y por otra parte crear y usar estructuras, dispositivos y sistemas con propiedades y funciones novedosas debido a sus tamaños en comparación con los materiales en tamaño en bulk [1].
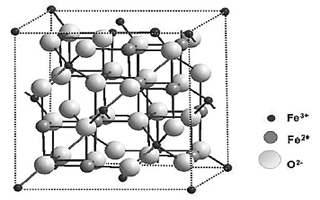
En los últimos años el interés en el uso de nanopartículas magnéticas ha ido aumentando debido al gran rango de aplicaciones que poseen, yendo desde aplicaciones en biomedicina, construcción nanotecnológica de ADN, desarrollo de dispositivos electrónicos, incluso tratamientos de remediación medioambiental [1-3]. Entre las nanopartículas que se han estudiado se encuentran las de hierro dadas sus propiedades tales como la magnetita (Fe3O4) o la maghemita (γ-Fe2O3) [4-7]. Su estructura de nanoferrita se caracteriza por tener una estructura cristalina de espinela (Fig. 1), en la cual los iones oxígeno forman el empaquetamiento cúbico compacto y los iones de hierro se sitúan en los intersticios tetraédricos (Td) y octaédricos (Oh). La ec. (1) muestra la fórmula de la magnetita, en la cual los cationes Fe2+ ocupan únicamente posiciones Oh, mientras los iones Fe3+ se distribuyen entre las posiciones Td y Oh [8].
La magnetización de las nanopartículas de Fe3O4 surge del acoplamiento antiferromagnético entre los iones Fe3+ en los intersticios Oh y Td, dejando momentos magnéticos de los iones Fe2+, en posiciones Oh, como los responsables de la magnetización de la celda unidad [8,9].
Existen muchos métodos que pueden ser usados para la síntesis de nanopartículas, algunos de estos métodos se clasifican como métodos mecánico-químicos consistentes en un sistema de arriba hacia abajo, es decir un método consistente en la división de un sólido de mayor tamaño para irlo reduciendo a porciones más pequeñas del mismo, aunque lamentablemente este método no es recomendable cuando se busca una síntesis homogénea ya que tiende a formar partículas desiguales y amorfas unas de otras [10]. Otros métodos se clasifican como métodos químico-físicos y se denominan sistema bottom-up (de abajo hacia arriba), que consiste en la fabricación de nanopartículas a través de la condensación de átomos, moléculas o entidades moleculares en fase gaseosa o en solución, siendo este tipo de síntesis más popular en la obtención de nanopartículas [1,3,10-12]. En este último caso, las condiciones tales como la temperatura de trabajo, solvente usado o agentes estabilizantes y la reproducibilidad son dos aspectos muy importantes a tener en cuenta a la hora de elegir el método adecuado, siendo el más usado o común para la síntesis de nanopartículas de óxido de hierro el método de coprecipitación química [1], que es quizás el método más simple y eficiente químicamente para obtener nanopartículas de óxido de hierro (Fe3O4 o γ-Fe2O3), los cuales se preparan generalmente por una mezcla estequiométrica entre sales ferrosas y férricas en medio acuoso [1]. La ecuación 2 muestra la reacción química que se lleva a cabo para la formación de Fe3O4.
De acuerdo con la termodinámica de esta reacción, la completa precipitación de Fe3O4 se consigue con un pH entre 8 y 14, con una relación estequiométrica de 2:1 (Fe3+/Fe2+) en un ambiente libre de oxígeno para evitar la oxidación del hierro [11]. Sin embargo, la magnetita (Fe3O4) no es muy estable al ambiente y es sensible a la oxidación. Por ello en presencia de oxígeno, se transforma en maghemita (γ-Fe2O3) tal como lo muestra la ecuación 3 [11].
La oxidación con el aire no solo produce la transformación de magnetita (Fe3O4) en maghemita (γ-Fe2O3), también transfiere varios electrones o iones, dependiendo del pH que presenta la solución, como se muestra en la ecuación 3. Bajo condiciones ácidas y anaerobias, la superficie de los iones Fe2+ forma complejos hexa-aqua en solución, mientras que, bajo condiciones básicas, la oxidación de la magnetita involucra reacciones de óxido-reducción en la superficie de esta. La principal ventaja de este método es la gran cantidad de nanopartículas que se pueden sintetizar, sin embargo, el control del tamaño de distribución de la partícula es limitado debido a que son factores cinéticos los que controlan el crecimiento del cristal [11]. Es así que el tamaño y la forma de las nanopartículas puede controlarse con relativo éxito ajustando parámetros como el pH, la fuerza iónica, temperatura, naturaleza de las sales usadas (percloratos, cloruros, sulfatos y nitratos) o la relación de concentración de las especies Fe2+/Fe3+. Además, la adición de aniones orgánicos quelantes (carboxilatos o iones α hidoxi carboxilatos como los ácidos, cítrico, glucónico u oleico) o polímeros superficiales como agentes complejantes (dextrano, carboxidextrano o alcohol polivinílico) durante la formación de la magnetita puede ayudar a controlar el tamaño de la partícula [11,13].
Del mismo modo se ha trabajado la síntesis de nanopartículas por medio del uso de extractos acuosos vegetales tomados en algunos casos como el de Stan, et al., 2017 empleando el extracto de las cascaras de uva o limón, el caso de Robles, et al., 2019 empleando extracto de cascara de papaya o el caso de Awwad y Salem, 2013 de plantas como la algarroba, también el caso como el de Ahmed, et al., 2013 donde usaron citrato con el fin de lograr la síntesis de estos materiales reduciendo el costo de fabricación, la necesidad de utilizar muchos reactivos ya que estos extractos cumplen varias funciones durante el proceso, además de la reducción en los residuos peligrosos al usarse este tipo de extractos [4-6,14].
Este trabajo se lleva a cabo con el propósito de probar la efectividad de un extracto de eucalipto en la síntesis de nanopartículas de óxido de hierro, que pueden ser usadas en procesos para la captación de metales pesados como el mercurio o el selenio, o en procesos para la degradación de moléculas orgánicas presentes en medios acuosos [3,15].
2. Materiales y métodos
2.1 Lugar de recolección y tratamiento de la muestra
La muestra de follaje de Eucalyptus grandis fue obtenida del vivero forestal de la Cooperativa Agroforestal del Cauca (COOTRAFORC), ubicada en la Vereda Gonzales del municipio de Popayán, departamento del Cauca, coordenadas 2°28’34.9” N 76°34’03.2” W. El estudio se llevó a cabo en las instalaciones del Laboratorio del Grupo de Investigación en Química Analítica Ambiental (GIQA) y la Unidad de Análisis Industrial del Programa de Química de la Universidad del Cauca.
Dado que solo se usarían las hojas la muestra se sometió a una previa clasificación y limpieza manual con el fin de separar el follaje de polvo, ramas o semillas que pudiesen interferir más adelante con el desarrollo de la investigación. Posteriormente la muestra húmeda se deja secar por alrededor de 2 semanas para eliminar el exceso de humedad moviendo las hojas de manera periódica para evitar la retención de la humedad en algunas de las hojas que puedan generar pérdidas de material, obteniéndose una biomasa seca lista para ser molida. Posteriormente se molió la muestra completamente por medio de un molino convencional y luego se clasificó por tamaño con el fin de lograr un tamaño de partícula pequeño de biomasa por medio de un tamizado a través de un tamiz de malla No. 18 de 2 mm de espesor, obteniéndose de esta manera una biomasa de tamaño de partícula muy fino de alrededor de 2 mm, finalmente se almacena la muestra tamizada a temperatura ambiente.
2.2 Obtención del extracto acuoso de Eucalyptus grandis
Para la preparación del extracto vegetal acuoso, se usa una relación entre el material vegetal y el solvente de 1:5 peso/volumen respectivamente [4], por lo cual se prepara el extracto partiendo del uso del material vegetal en este caso de follaje de la especie Eucalyptus grandis en el solvente en este caso agua desionizada, calentándose a una temperatura de 80°C por 5 minutos, posteriormente se filtra al vacío y se centrifuga a 1250 rpm por 5 minutos, se utiliza agua desionizada con el fin de completar el volumen total del extracto y se almacena a temperatura ambiente para su posterior uso [5].
2.3 Preparación de las nanopartículas de magnetita
En una ejecución típica, se usa el método de coprecipitación donde se usan dos sales de hierro siendo en este caso cloruro de hierro (II) tetrahidratado (FeCl2∙4H2O) y cloruro de hierro (III) hexahidratado (FeCl3∙6H2O) usando una relación 1:2 en peso respectivamente, se calienta por 10 minutos con agitación constante, tras los cuales se adiciona un volumen del extracto de eucalipto preparado previamente tornándose la solución ligeramente marrón y finalmente luego de 5 minutos se le adiciona 20 mL de una solución de hidróxido de sodio (NaOH) de concentración conocida, obteniéndose una solución de coloración negra, tras este proceso dado que la partícula obtenida es insoluble en el agua se deja precipitar, se filtra y se seca en el horno a 50°C por 24 horas, finalmente con la partícula seca se macera y se almacena en un lugar seco, fresco y a temperatura ambiente [4,5]. Las condiciones tanto de temperatura de trabajo, volumen del extracto usado y concentración de hidróxido se optimizaron para encontrar el punto de máximo rendimiento de la síntesis.
2.4 Análisis estadístico de la síntesis
Para el análisis del diseño y optimización de la síntesis, se usó el programa estadístico STATGRAPHICS CENTURION XVII.II, con el cual se llevó a cabo un diseño experimental compuesto central con puntos estrella 23, la Tabla 1 presenta las variables tomadas en consideración para el diseño y se siguió el procedimiento seguido por Awwad y Salem, 2013 para la obtención de nanopartículas de magnetita [5], de tal manera que por medio de este diseño experimental se logren establecer los mejores parámetros de síntesis tanto para la temperatura, el volumen de extracto usado y la concentración de la base y así alcanzar el mayor rendimiento en el proceso de obtención de las nanopartículas de magnetita.
2.5 Caracterización de las nanopartículas
La caracterización de las nanopartículas se realizó mediante análisis instrumental mediante las técnicas de Microscopía Electrónica de Transmisión (TEM), espectroscopía FT-IR por pastilla de KBr y análisis del área superficial por medio de la técnica de BET.
2.5.1 Microscopía electrónica de transmisión (TEM)
Para la obtención de la respectiva micrografía de la magnetita sintetizada, se usó un microscopio electrónico de transmisión JEOL JEM 1200-EX en el laboratorio de microscopía de la Universidad del Cauca, dispersando las nanopartículas por ultrasonido, midiendo con una resolución de la micrografía de 4 nm y usando el programa de procesamiento de imágenes Image-Pro Plus 3.0.
2.5.2 Espectroscopía infrarroja
Los espectros fueron medidos en un espectrofotómetro marca Thermo® IR-NICOLET iS10 con accesorio iTR (ATR), mediante el método de análisis con pastilla de KBr. En este caso se tomaron por esta técnica tanto los espectros infrarrojos para el extracto acuoso y la nanopartícula de magnetita sintetizada.
2.5.3 Análisis BET
Para determinar el área superficial estimada de la nanopartícula de magnetita se realizó un análisis BET en la Universidad del Valle en un equipo Nova 1000e, Quantachrome Instruments, usando nitrógeno (N2) grado 5.0 como adsorbato, un rango de corrida entre 0.05 a 0.3 P/P0 para una adquisición de 11 puntos, tolerancia en la presión de 0.100 mm Hg, tiempo de equilibrio de 60 segundos, tiempo de tolerancia de 240 segundos y una temperatura del N2 líquido de 77 K.
3. Resultados y discusión
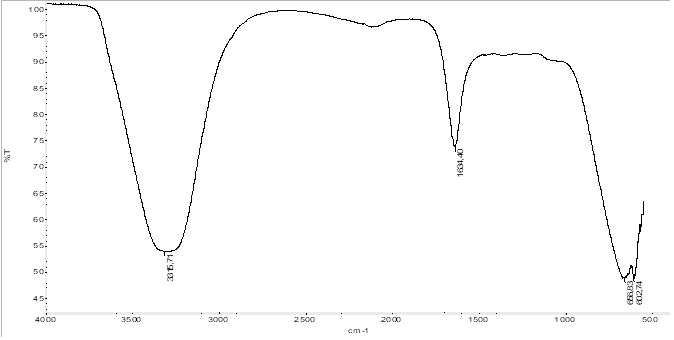
El extracto acuoso del follaje de Eucalyptus grandis obtenido presentaba una coloración ligeramente marrón el cual fue analizado por medio de espectrometría infrarroja (Fig. 2), encontrándose una banda a 3319.61 cm-1 la cual es indicativo de los grupos hidroxilo (-OH) de los polifenoles que se encuentran en el extracto, también se observa una banda a 1634.74 cm-1 la cual representa el grupo carbonilo (-CO), lo cual junto al grupo hidroxilo, expresa la presencia de grupos carboxílicos (-COOH) dentro del extracto de Eucalyptus grandis.
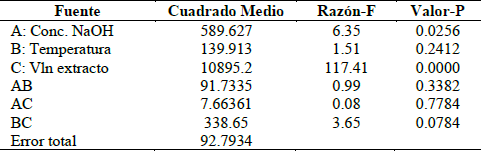
En la Tabla 2 se muestran los resultados obtenidos del análisis de varianza (ANOVA), realizado con ayuda del software STATGRAPHICS CENTURION XVII.II. Llevado a cabo para determinar la significancia estadística de cada efecto comparando su cuadrado medio contra un estimado del error experimental; de esta manera se obtienen los valores de los parámetros significativos en el proceso de rendimiento de las nanopartículas obtenidas con extracto de Eucalyptus grandis. Para el rendimiento de la síntesis, se estableció un nivel de confianza del 95% (error máximo permisible 5%) y, por lo tanto, se aceptan como significativos aquellos efectos o parámetros que tengan un error (valor P), menor que 0.05.
La Tabla ANOVA particiona la variabilidad del porcentaje de síntesis de nanopartículas en piezas separadas para cada uno de los efectos. Probando la significancia estadística de cada efecto, comparando su cuadrado medio con un estimado del error experimental. Se comparó el valor-P de los respectivos experimentos con un nivel de significancia α= 0.05 y se observa que los factores A (Concentración de NaOH) y C (Volumen del extracto) rechazan la hipótesis nula debido a que presenta un valor-P menor a 0.05, lo que indica que son significativamente diferentes de cero con un nivel de confianza del 95%, es decir que los efectos A y C si presentan influencia en el proceso de síntesis de las nanopartículas. El factor B (Temperatura) presenta un valor-P mayor a 0.05 por lo tanto se acepta la hipótesis nula y se concluye que no tiene efecto en el porcentaje de síntesis, del mismo modo se establece que el coeficiente de correlación obtenido para este experimento alcanzo el 91.67% ajustado para el rendimiento de la síntesis.
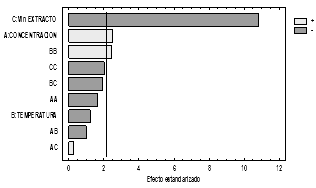
Analizando el diagrama de Pareto (Fig. 3), el cual presenta de manera decreciente de importancia cada uno de los efectos estudiados, la longitud de cada barra es proporcional al efecto estandarizado, el cual hace alusión al efecto estimado entre su error estándar. La línea vertical que se presenta es utilizada para juzgar cuales son los efectos estadísticamente significativos, de modo que cualquier barra que se extienda más allá de dicha línea vertical corresponde a efectos que son estadísticamente significativos a un nivel de confianza del 95% [16].
Fuente: Los Autores.
Figura 3 Diagrama de Pareto para el rendimiento de la síntesis de nanopartículas.
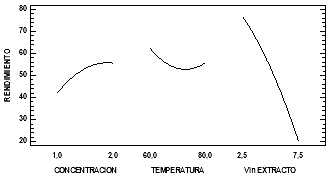
Como tal, en este caso los factores que sobrepasan la línea de significancia, son A y C, es decir la concentración de NaOH y el volumen de extracto respectivamente y que por tanto son efectos que influyen significativamente en el proceso de síntesis de la nanopartícula, resultados que pueden ser corroborados con el análisis de la varianza. Según el signo presentado, los efectos pueden ser tanto positivos como negativos, por lo tanto, en el caso del factor A, se indica que habrá un mayor porcentaje de síntesis a mayores concentraciones de NaOH, mientras que del otro lado en el caso del factor C, se tiene que habrá un menor porcentaje de síntesis con volúmenes más elevados de extracto de eucalipto. El ANOVA permitió observar los efectos de los factores estudiados, a continuación, la Fig. 4, presenta los efectos principales para el rendimiento, este análisis permite establecer los puntos óptimos para la síntesis de las nanopartículas.
Se observa entonces que como se dijo anteriormente en el caso del factor A (Concentración de NaOH) y C (Volumen del extracto), a mayor concentración de NaOH el rendimiento mejora pues el grupo -OH de la base interactúa con el núcleo de la partícula en formación generando hidróxidos de hierro los cuales por deshidratación permiten formar los cristales del óxido de hierro de interés (Fe3O4), mientras que conforme se da el aumento en el volumen del extracto usado el rendimiento decae en gran medida, esto debido a que un mayor número de moléculas orgánicas entraran en contacto con los iones de hierro aumentando el impedimento de la base de interaccionar con el núcleo de la partícula en formación [5]. Por otra parte, en el caso de la temperatura los valores comienzan altos, van descendiendo hasta un punto mínimo y al final suben, pero hasta un valor que es menor. Esta tendencia presumiblemente se debe a que después de cierta temperatura, los compuestos en el extracto de eucalipto se degradan, reduciendo la proporción de ellos presente durante la síntesis, sin embargo, el rendimiento de la síntesis de la partícula se mantiene por encima del 50% en este caso.
Con base a estos resultados se genera la ecuación 4 que modela el comportamiento del rendimiento de la síntesis en base a los tres parámetros previamente estipulados.
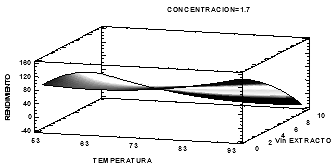
La función condujo a un gráfico estimado de superficie de respuesta [16], el cual se muestra en la Fig. 5. Se observa que con una concentración de NaOH de 1.7 M, con temperaturas desde 87 °C, con un volumen de extracto cercano a 1 mL, se obtiene un % de rendimiento de aproximadamente 96%. Al finalizar el diseño experimental y teniendo los valores para la optimización de la síntesis de partículas, se realizaron ensayos por triplicado de esos puntos, obteniéndose en promedio un rendimiento de 98.99%±0.21, resultados que se asemejan a los expresados por Alvear et al., 2017 quienes reportaron rendimientos en la síntesis de nanopartículas de magnetita del 94% y superan los resultados expresados por Robles et al., 2019 cuyos rendimientos en la síntesis alcanzaron un máximo del 35.03% [14,17].
Fuente: Los Autores.
Figura 5 Gráfico de superficie de respuesta estimada de la síntesis de las nanopartículas.
Para la determinación del tamaño de la nanopartícula se empleó la microscopía electrónica de transmisión (TEM) y usando el software de análisis de imágenes Image-Pro Plus 3.0 con el cual se obtiene que el tamaño promedio de las nanopartículas es de aproximadamente 8.97 nm, el cual es un tamaño promedio cercano al expuesto por Alvear et al., 2017 de 7 nm y el de Awwad y Salem, 2013 de 8nm [5,17], la Fig. 6 muestra la micrografía obtenida para la partícula sintetizada en el rango de los nanómetros.
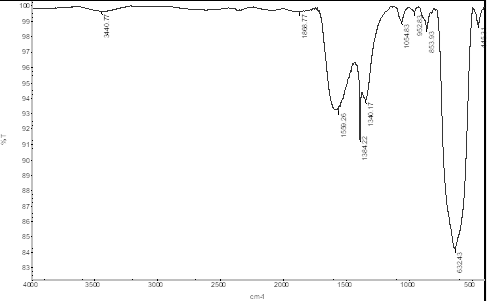
Para determinar los grupos funcionales presentes en la nanopartícula sintetizada de magnetita, se realizó un análisis por la técnica de espectroscopía de infrarrojo (IR), esta técnica se puede aplicar para la identificación de los grupos funcionales superficiales, lo cual es importante para tener una idea general de la estructura química de las posibles biomoléculas que son responsables del recubrimiento y estabilidad de la nanopartícula [5]. En este caso se encuentran diversos grupos funcionales sobre la partícula, en la Fig. 6, vemos el espectro IR de la nanopartícula sintetizada el cual muestra que alrededor de los 3440.77 cm-1 se encuentra una banda de estiramiento del grupo hidroxilo (-OH), aunque en este caso la banda se encuentra bastante atenuada, del mismo modo se puede ver una banda a 1559.26 cm-1, la cual hace referencia al estiramiento del enlace del grupo carbonilo (-CO). La presencia de las nanopartículas de magnetita puede verse por la aparición de una banda a los 445.31 cm-1, la cual corresponde a la banda de estiramiento del enlace Fe-O del núcleo de la magnetita [5].
Con estos resultados se puede establecer que el carboxilo (-COO-) ha interactuado con el núcleo enlazándose en la superficie de las nanopartículas de magnetita. De esto podemos decir que los polifenoles del extracto de eucalipto han interactuado con la partícula actuando como agente reductor y estabilizador para las nanopartículas de magnetita.
También se realiza una comparación entre los espectros del extracto de hojas de eucalipto (Eucalyptus grandis) (Fig. 2) y la magnetita sintetizada (Fig. 7), con el fin de comparar las bandas entre ambos espectros encontrándose que la banda de los grupos hidroxilos permanece alrededor de 3440.77 cm-1, aunque en el caso del espectro de la magnetita esta banda como ya se dijo se ve grandemente atenuada, hecho que también se presenta en los estudios realizados por Awwad y Salem, 2013 para la síntesis de partículas magnéticas [5], además se puede observar como la banda perteneciente al carboxilo también se presenta en ambos espectros aunque ligeramente desplazada, hecho que podría atribuirse a las mismas propiedades magnéticas de las nanopartícula que generan este hecho. El análisis de BET proporcionó un área superficial de 131.9 m2/g para las nanopartículas de magnetita sintetizada, valores que se verifican por medio de los estudios realizados por Stan et al., 2017, donde se obtienen valores de área superficial de 137.4 m2/g en sus experimentos de síntesis de nanopartículas con extractos vegetales acuosos [4].
4. Conclusiones
Se logró sintetizar la nanopartícula de magnetita con el extracto acuoso de follaje de Euclayptus grandis con un porcentaje de síntesis del 98.99% y con el diseño experimental se establecieron las condiciones óptimas para la reacción de síntesis (solución de NaOH 1.7 M, volumen de extracto 0.8 mL, temperatura 87 °C), mejorando las características de las nanopartículas.
A partir de los resultados obtenidos se concluye que la nanopartícula de óxido de hierro preparada a partir de un extracto acuoso del follaje de Eucalyptus grandis, debido a su estabilidad química, así como la naturaleza de la biomasa y su bajo costo, además de su gran área superficial estimada, se presenta como una alternativa para la obtención de este tipo de materiales teniendo en cuenta los lineamientos de la química verde.