1. Introducción
El agua es un componente indispensable para la supervivencia de todos los organismos vivos, y preservar su calidad es la preocupación más importante de la humanidad, ya que influye directamente en el bienestar general de la población [1]. La única fuente de agua potable para muchas comunidades rurales es el agua subterránea, alrededor del 50% de la población mundial depende del agua subterránea para beber [2]. El agua subterránea se encuentra en el subsuelo y en los espacios porosos del suelo y roca contenida en formaciones geológicas conocidas como acuiferos, acuicludos, acuitardos y acuifugos, siendo los acuiferos los más explotados debido al gran volumen de agua que contienen, a diferencia del agua superficial presentan una gran capacidad de protegerse de varios agentes contaminantes, sin embargo, una vez contaminados su regeneración es muy lenta y dificultosa [3].
Las aguas subterráneas se contaminan por razones como la urbanización inadecuada, actividades industriales como la mineria, prácticas agricolas y la mala disposición de residuos sólidos [2]. La principal causa natural de contaminación del suelo y agua subterránea por As, es la meteorización de rocas que contienen As; mientras que las fuentes o causas antropogénicas son combustión de carbón, actividades como la fundición de minerales de metales básicos, la aplicación de pesticidas a base de As, el arseniato de cobre cromatado (CCA) que se usa en la preservación de madera y actividades mineras, entre otras. Una razón natural adicional puede ser la tendencia del As a movilizarse en el medio ambiente, un fenómeno influenciado por aguas superficiales, aguas subterráneas y suelos agricolas convirtiéndose en un problema ambiental importante, la contaminación de aguas subterráneas ha sido reportada en paises de todos los continentes excepto en la Antártida [4].
En el agua el As se presenta en dos estados de oxidación: As (V), As (III); el arsenito es más peligroso que el arseniato [5]. Se ha reportado la presencia de arsénico en aguas subterráneas por ejemplo en grandes áreas del oeste de Bengala (India) y Bangladesh [6,7], en Vietnam [8,9], en el este de África [10] y en América del sur [11-16]. En el Perú se han reportado investigaciones que demuestran la presencia de As en aguas subterráneas de la zona amazónica [17] y en la zona andina también, precisamente en la zona rural de Pelipeline y Jallamilla [18], en Huata y Carancas [19]. A la vez se ha demostrado la presencia de arsénico hasta 500 µg/L. en los distritos de Juliaca y Caracoto, el 6% de las muestras de agua subterránea superan los limites permisibles de 10 ug/L [20].
A nivel mundial se riegan aproximadamente 112.9 millones de hectáreas (Mha) con 545 km3/ha por afio de agua subterránea, lo que representa un 43 % del total de agua usada en irrigaciones, siendo paises asiáticos como China e India los que riegan más área con agua subterránea, mientras que en América del sur se riegan 1.71 Mha con aguas subterráneas y la zona andina especificamente riega 660 447 ha con aguas subterráneas [21]. El uso agricola de aguas subterráneas con alto contenido de arsénico trae consigo la bioacumulación de As en las raices de diversos cultivos, el As atraviesa la membrana plasmática de las células endodérmicas de la raiz, probablemente a través de la acción de una bomba de membrana o puede ingresar al apoplasto radicular a través del espacio entre las celdas, las plantas pueden acumular tanto arsenito como arseniato a través de diferentes mecanismos. El arseniato y el fosfato comparten la misma via de transporte en plantas superiores a través del transportador de fosfato, el mecanismo de absorción implica el co-transporte de fosfato o arseniato y protones [22].
As y fosforo (P) son elementos quimicos análogos, y se propone que tengan comportamientos quimicos similares en los sistemas ambientales. Sin embargo, algunas propiedades quimicas de As y P son distintas, como las reacciones redox, que hacen que el comportamiento biogeoquimico de estos dos elementos difiera. En el medio ambiente, As se produce como oxianiones As (V) o As (III) como, AsO43- o AsO33-. En contraste, P ocurre predominantemente con estado de oxidación (V+); más comúnmente como el ión ortofosfato (PO43-). Se sabe que el arseniato afecta a la fosforilación oxidativa, porque compite con el fosfato. En condiciones en las cuales la concentración de fosfato es alta, la toxicidad del arseniato para la biota es generalmente reducida [23]. Como el arseniato es análogo al fosfato, los organismos que viven en presencia de una concentración elevada de arseniato deben adquirir el fósforo nutritivo, pero evitando la toxicidad del arsénico [24].
La capacidad de adsorción de un suelo está afectada por su textura, contenido de sesquióxidos de hierro, aluminio y por la presencia de otros elementos que puedan interferir en el proceso de adsorción. Las fracciones areno limosa muestran una capacidad de adsorción bastante reducida debido su baja área superficial y a la predominancia de cuarzo, mientras que la arcilla es el principal adsorbente [25]. En suelo agricola, los compuestos inorgánicos de arsénico permanecen retenidos en forma indefinida, la alcalización del suelo contribuye en aumentar la movilidad del arsénico [26].
El arsénico está presente en el medio ambiente tanto en formas inorgánicas y orgánicas, siendo el As inorgánico el más tóxico, al As se le conoce como un elemento no esencial en la biota y su presencia en el cuerpo humano puede causar intoxicación que incluye trastornos de la piel, debilidad, languidez, anorexia, náuseas, vómitos con diarrea o estrefiimiento, pigmentación de la piel, melanosis arsenical e hiperqueratosis, agrandamiento del higado, enfermedades respiratorias y cáncer de piel [22].
El presente articulo cientifico es importante debido a que el arsénico es un metal pesado contaminante y su presencia en aguas subterránea y suelo agricola origina riesgos en muchos entornos sobre todo en la salud humana, los suelos son receptores de muchos elementos y estos a su vez soportan la vida de las plantas, animales y por ende el desarrollo humano. La cuenca de rio Callacame, se caracteriza por albergar dos tipos de rocas de mayor ocurrencia como son la presencia de rocas metasedimentarias del Grupo Puno, la formación Maure y la presencia de rocas volcánicas cenozoicas como: Senca, Capillune, Barroso y depósitos fluviales y aluviales. El arsénico está presente en las rocas volcánicas ácidas y en rocas con presencia de mineralización hidrotermal Ag-Pb-Zn con contenidos de As, los minerales más comunes son arsenopirita (FeAsS), enargita (Cu3AsS4) y tenantita (Cu12As4S13), rejalgar (AsS), Oropimente-Stibnita (As2S3), por lo tanto, el As en sistemas acuosos proviene en parte de la disolución de estos minerales, la erosión y desintegración de rocas y por deposición en la cuenca [27]. El objetivo de la presente investigación fue determinar la presencia de arsénico en aguas subterráneas de la cuenca del rio Callacame y dar a conocer los posibles impactos en los suelos agricolas en Desaguadero - Perú.
2. Material y métodos
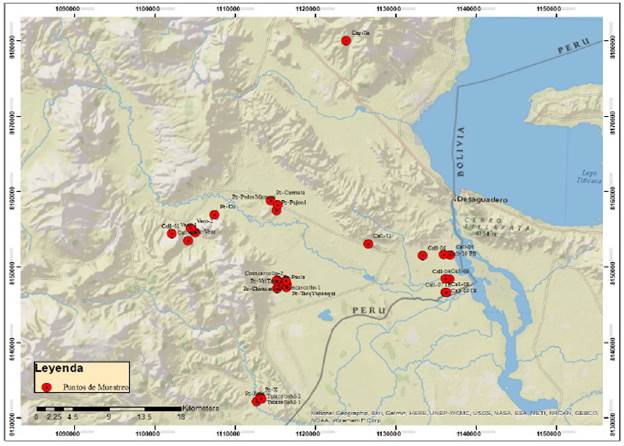
El estudio se realizó en la cuenca del rio Callacame tributario del rio Desaguadero, provincia Chucuito, región Puno, al sur de Perú, a una altitud de 3,820 a 3,850 msnm, con una extensión de 84.1 hectáreas (ha), enmarcadas dentro de las coordenadas UTM 460 000 - 489 500 E y 8 155 000 - 8 173 000 N. Ver mapa en la Fig. 1.
2.2 Obtención de muestras de agua subterrànea y suelo
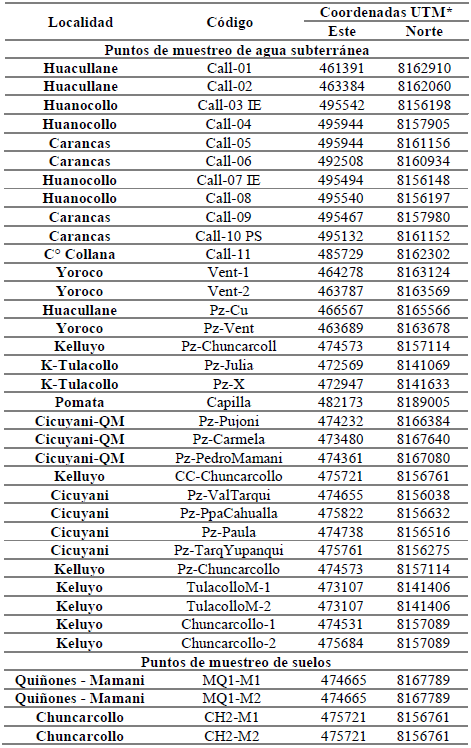
Se establecieron 32 puntos para la toma de muestras de aguas subterráneas, dichos puntos son lugares estratégicos en los cuales existen afloramientos naturales de aguas subterráneas, las muestras de suelo fueron tomadas alrededor de los puntos. En la Tabla 1 se presenta la localidad, código y coordenadas UTM de cada punto considerado, los puntos se pueden visualizar también en la Fig. 1.
Tabla 1 Puntos de muestreo enclavados en el área de estudio.
*hemisferio sur, zona 19.
Fuente: Elaboración propia
Las muestras de aguas subterráneas y suelos fueron obtenidas de las comunidades de Quiiones - Mamani (QM), Chuncarcollo, Huacullane, Huanocollo, Kelluyo y Cicuyani del distrito de Desaguadero, en los meses de junio-agosto de los afios 2015, 2016 y 2018.
Las muestras de agua subterránea fueron tomadas de 32 pozos cuya ubicación puede apreciarse en la Fig. 1. Las muestras de suelos se tomaron en zonas cercanas a los pozos surgentes de agua subterránea en un área de 2 y 10 m2. Se utilizó un barreno muestreador saca testigo, de un diámetro de 3 pulgadas para extraer de una profundidad de 30 a 40 cm. En cada punto de muestreo, se realizó limpieza de material orgánico presente, la muestra fue de 1 Kg. aproximadamente y fue almacenada en bolsas de polietileno. Las perforaciones se realizaron en las comunidades de Quiiones - Mamani y Chuncarcollo.
2.3 Preparación de muestras
La preparación de muestra se realizó por el método EPA-3051 [28]; se sometió a secado y trituración al tamaio de malla de 2 mm para su digestión en un digestor de microondas, por un tiempo de 10 minutos a una temperatura de 175°C, los reactivos utilizados fueron 10 ml de hN03 y 3 ml de HCl.
2.4 Análisis de muestras
El análisis de arsénico en aguas subterráneas se hizo basándose en el método EPA 6020 [29] utilizando un ICP-MS. Los parámetros fisicoquimicos se tomaron con un multiparámetro de forma directa en caso de la muestra de agua subterráneas y en caso de suelo con una solución al 50% Agua/Suelo.
3. Resultados
3.1 Caracterización fisicoquímica de aguas subterráneas
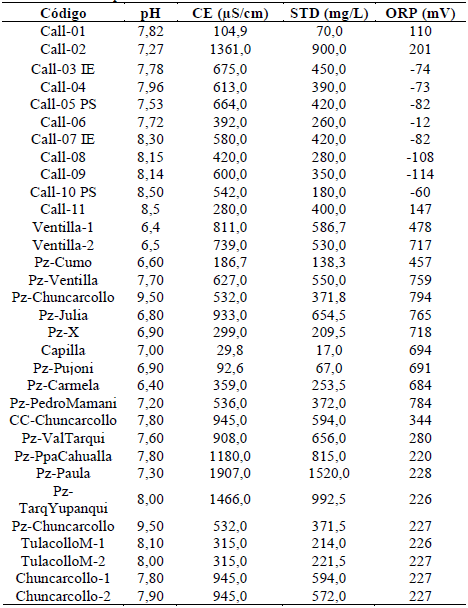
A continuación, se presentan los resultados de los parámetros fisicoquimicos tomados in situ, en cada punto de muestreo. En la Tabla 2 se aprecia la codificación de cada punto y el respectivo valor de cada parámetro evaluado.
3.2 Presencia de Arsénico en agua subterránea
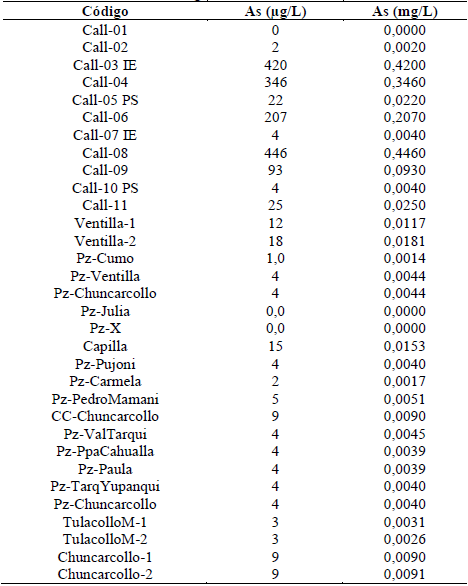
Los resultados de la presencia de la As en las muestras se detallan en la Tabla 3, reportando resultados en microgramos por litro (µg/L) y miligramos por litro (mg/L).
Al realizar la composición quimica de As en aguas subterráneas, en 32 muestras, se obtuvo valores entre 3 y 446 ug/L.
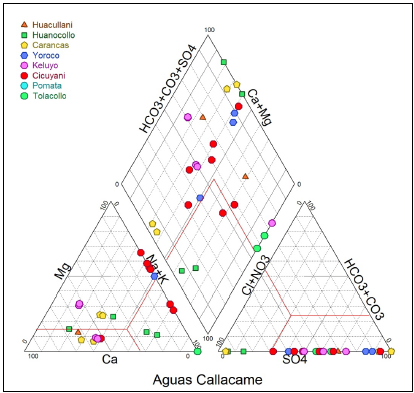
Para analizar la calidad de las aguas subterráneas los datos fueron ploteados en el diagrama Piper (Fig. 2) para 32 muestras
El diagrama indica que son aguas calcoalcalinas sulfatadas que son provenientes de minerales constituyentes de rocas félsicas, así mismo los parámetros fisicoquímicos indican un pH de 6,4 a 9,5; CE (uS/cm) 29, 8 a 1,907. STD 17 a 1520, ORP (mV) -114 a 794, Alk (mg/L) -98 a 681.
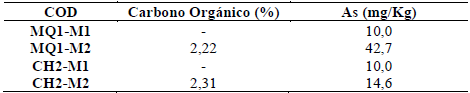
3.3 Presencia de Arsénico en suelos
Los análisis químicos en las muestras de suelos dieron los siguientes valores de As en suelos (Tabla 4).
Las especies de arsénico presentes en las aguas subterráneas de la cuenca del río Callacame son arseniato en ambientes oxidantes y arsenito en ambientes reductores, los suelos alrededor de pozos del sector de Chuncarcollo tienen alto contenido de carbono orgánico y alto As, por lo tanto, la especie presente es el arsenito.
Las especies de arseniato son estables a altos valores de Eh y pH neutrales, mientras el arsenito es estable en condiciones reductoras. Las muestras de aguas nos indican una variabilidad en el potencial redox de -114 a + 794 (mV) estas aguas son divididas en dos grupos basados por el contenido de ORP: negativos y positivos. La correlación Fe-As positiva indica que el As está presente con óxidos e hidróxidos de hierro en ambiente oxidante.
4. Discusiones
La química natural de las aguas subterráneas está influenciada principalmente por la composición química de las rocas y del subsuelo por las que el agua fluye sobre o en los intersticios, lo cual podría relacionarse con los resultados fisicoquímicos de las muestras.
La ocurrencia de un elemento en diferentes formas químicas, estados de oxidación y fases minerales es conocida como especiación. La especiación de un elemento puede representar su toxicidad y biodisponibilidad en el suelo. Hoy en día, es bien sabido que la especiación metálica indica mejor su comportamiento biogeoquímico en comparación con el contenido total de metales [30]. El diagrama de Piper (Fig. 2) nos sugiere con el triángulo de la parte inferior izquierda que no hay un dominio catiónico único, sino indica dominios mixtos siendo similar a lo reportado por Ahmed et al. [31], en el triángulo de la parte inferior derecha nos indica que todas las muestras se colocan en la región de SO4 y algunas muestras comparten dominio de Cl- y HCO3, agrupando a las aguas dentro un solo grupo denominado calcoalcalinas, lo que sugiere procesos de meteorización en su evolución hidrogeoquímica.
Con respecto a los resultados de arsénico en agua subterránea según Smedley y Kinniburg [6], en el río amazonas es superior a 300 ug/L. mientras que el promedio de los valores encontrados fue de 64 ug/L. La normativa del país de origen de las muestras nos senala un estándar de calidad ambiental con una concentración máxima 200 ug/L, enmarcado en la categoría 3 (Riego y bebida de animales) [32]. Según los resultados encontramos cuatro puntos de muestreo donde la concentración de arsénico supera este estándar de calidad ambiental en algunos casos en más del doble de la concentración permitida, lo cual podría implicar un riesgo ambiental, sin embargo estas concentraciones fueron halladas en pozos de 30 a 40 metros de profundidad que aún no son de acceso a la población, requiriendo una vigilancia y manejo especial puesto que en un futuro pueden ser motivo directo de riesgo ambiental y a la salud. Autores como Strawn, D. [23] mencionan que los riesgos ambientales sufren influencia por parte del manejo de suelos, sedimentos, aguas subterráneas y superficiales, debido al ciclo biogeoquímico del Arsénico, para lo cual es necesario conocer su especiación y concentración para reducir riesgos de contaminación en ecosistemas naturales.
El arsénico tanto en su forma inorgánica como orgánica tienen presencia en suelos [33]. Según los estándares de calidad ambiental planteados por la normativa del país de origen de las muestras son permitidas concentración de hasta 50 mg/Kg, por lo que los resultados obtenidos están dentro de lo permitido. Esto puede deberse a la composición de los horizontes en los suelos de los sectores de de Huacullane, Huanocollo, Kelluyo y Cicuyani que presentan texturas franco limosas por lo que no permiten una adsorción significativa del arsénico proveniente de las aguas residuales, sin embargo sectores como Quinones - Mamani presentan horizontes arcillosos con abundante presencia de materia orgánica, en este sector precisamente es donde se encontraron las concentraciones más altas de arsénico en suelo acercándose al estándar de calidad ambiental. En caso se produjeran procesos de bioacumulación en un futuro estas concentraciones podrían sobrepasar los estándares teniendo un impacto directo en la cadena alimenticia ya que las plantas pueden absorben arsénico siendo un riesgo para los cultivos y pastizales naturales en la zona, que luego podrían desencadenar en una biomagnificación [34].
Las muestras comprendidas en el sector de Huacullani corresponden a un suelo contaminado por la actividad minera, investigaciones afirman que los suelos contaminados por la actividad minera pueden contener entre 45-2600 mg/Kg de arsénico, mientras que un suelo agrícola no contaminados contienen entre 1-20 mg/Kg de arsénico [35], en los resultados del sector de Huacullani entre 10 y 14 mg/Kg por lo que sus concentraciones serian aun adecuadas para un uso agrícola, sin embargo si se efectúa un riesgo con aguas subterráneas contaminadas por arsénico esto puede promover una aparición de altas concentraciones
5. Conclusiones
La concentración de As en las aguas subterráneas en el área de estudio se encuentra entre los 3 y 446 µg/L, sobrepasando en 4 de los 32 puntos de muestreo el estándar de calidad ambiental de 100 µg/L.
El diagrama de Piper elaborado indica que las aguas subterráneas pertenecen al grupo de las calcoalcalinas sulfatadas provenientes de minerales constituyentes de rocas félsicas, con parámetros fisicoquímicos en rangos de pH de 6,4 a 9,5; C.E 29,8 - 1907 y ORP de -114 a 794.
Las concentraciones de arsénico en suelos están dentro de los estándares de calidad ambiental y actualmente no representan un riesgo para la salud y el ambiente, sin embargo, si se efectúa el riego de estos suelos con aguas subterráneas puede dar pie a procesos de bioacumulación y biomagnificación que implicarían un riesgo para los ecosistemas de la zona de estudio.