Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.35 no.1 Bogotá Jan./June 2006
Artículo de investigación
Biodesulfurización de queroseno con células inmovilizadas de Pseudomonas sp. No. 6 (aislado nativo) en unnovedoso biorreactor de lecho detubos con recirculación
Kerosenebiodesulfurization by immobilized cells pseudomonas sp. No. 6 (native isolated) at a new bioreactor of pipe bed with recirculation
Edelberto Silva1, Luis Caicedo2, PaulaPulido e Iván Lentijo
1 Departamento de Farmacia, UniversidadNacional de Colombia, A.A. 14490, Bogotá D.C., Colombia. Correo electrónico:esilvag@unal.edu.co
2 Departamentode Ingeniería Química, Universidad Nacional de Colombia, A.A. 14490, BogotáD.C., Colombia.
Recibido para evaluación: julio 26 de 2005 Aceptado para publicación: marzo 17 de 2006
RESUMEN
En este trabajo se realizó la biodesulfurización de querosenocon células inmovilizadas de Pseudomonas sp. ATCC 39327, en un sistemaemulsionado, W/O 30/70 (v/v), con medio mínimo de sales (MMS) como fasedispersa. El sistema de inmovilización consta de dos paneles de 60 tubos cadauno. Los tubos de alta alúmina tienen 140 mm de largo, 6,6 mm de diámetro externo y3,2 mmde diámetro interno, con una porosidad del 43% y capacidad de retención de 9,5x109células/g de soporte, colocados dentro de una columna de vidrio enchaquetada,de 80 por 400 mmde zona de reacción, conectada a un tanque de recirculación, y el fluido semueve con aire a razón de 8,8 pies3/h. Después de 120 horas deproceso a 30 ºCy presión atmosférica se obtuvo una remoción del contenido de azufre de 43% yuna pérdida calórica menor del 2%.
Palabras clave: biodesulfurizacion, inmovilización celular, Pseudomonas
SUMMARY
In this work, the kerosene biodesulfurization was developed by immobilized cells of Pseudomonas spp. ATCC 39327, in an emulsioned system W/O 30/70 (v/v) with sales minimal medium as disperse phase. The immobilization system has two panels of 60 pipes each one. The Alta Alumina pipes has 140 mm long, 6,6 mm of external diameter and internal diameter 3,2 mm, with 43% porosity and retention capacity of 9,5x109 cells/g of support, put into jacked column, with a reaction zone of 80 by 400 mm of reaction zone, connected to recirculation tank, and the fluid is moved by air at 8,8 feet 3 /h. The process rendered a sulfur removal of 43% with a caloric lost of less than 2,0%, after 120 hours of treatment at 30 ºC and normal pressure.
Key words: biodesulfurization, immobilized cell, Pseudomonas.
INTRODUCCIÓN
Olor desagradable, toxicidad,disminución de la estabilidad de los productos del "cracking", reducción delnúmero de octano, corrosión (1) y aspectos ambientales como la generación delluvia ácida y material particulado (PM10) (2) son algunos de losprincipales problemas relacionados con el contenido de azufre en loscombustibles fósiles.
Para hacer frente a estaproblemática global la legislación ambiental a nivel mundial ha estipuladodiversas normas, cada vez más estrictas, referentes al uso de los combustiblesfósiles, las emisiones atmosféricas, la protección de la calidad del aire y elcontenido de azufre entre otras (3). En general, de acuerdo con la legislacióncolombiana, el contenido máximo de azufre permitido para las gasolinas debe serinferior al 0,05% hasta enero 1 de 2006, fecha desde la cual debe disminuir a0,03%. Para el diésel-ACPM la concentración permitida es de 0,05% desde enero 1de 2002.
Existen diversas técnicas queincluyen tratamientos con ácido sulfúrico, soda cáustica, hipoclorito, cobre ysulfuro de plomo; por extracción con solvente e hidrogenación catalítica: hydrocracking,"hydroforming" e "hydrofining". Este último proceso es el más usado en laindustria del petróleo, el cual emplea catalizadores de óxidos metálicos,presiones y temperaturas altas y aún así no alcanzan a desulfurizar lostiofenos y benzotiofenos (4).
Un método alternativo ocomplementario a la hidrodesulfurización es la biodesulfurización, que remuevecompuestos recalcitrantes empleando biocatalizadores; se espera que estatécnica ayude de manera efectiva en cuestión de costos y que pueda cumplir conlas regulaciones de contenido de azufre. Importantes investigadores como Malik,Maliyants, Knetcht, Kodama, Labarde y Gibson han encontrado bacteriassulfatoreductoras y sus rutas metabólicas en la degradación de DBT,representativo de los compuestos organoazufrados (3).
Con el propósito de cumplir losrequisitos exigidos, se considera la posibilidad de implantar la biodesulfurización (BDS) como un procesoalternativo y/o complementario a la hidrodesulfurización (HDS), con el que selogren remover los compuestos azufrados recalcitrantes (4-8). La BDS no requiere altatemperatura, presión o procesos colaterales, reduciendo significativamente losrequerimientos energéticos, el capital y los costos de operación. Con ella sepueden lograr estándares ambientales mejorados a menor costo, no se altera significativamenteel valor del calor de combustión y no degrada el octano.
La BDS es un proceso que actualmente se encuentra enfase de investigación, con estudios que abarcan el aislamiento y lacaracterización de microorganismos desulfurizadores, los tratamientos con gas,carbón, petróleo y destilados del petróleo, así como el desarrollo de procesoscon células libres e inmovilizadas en pequeña escala (9-11). Con miras adesarrollar un proceso que facilite el escalado, el presente estudio evalúa unnuevo sistema de inmovilización celular por adsorción y un nuevo reactor.
MATERIALES Y MÉTODOS
Microorganismo: Pseudomonas sp.No. 6. aislado nativo.
Medios de cultivo: medio mínimo desales (MMS) (NaCl 1 g/L; NH4Cl 2 g/L; CaCl2×H2O0,01 g/L; FeCl3×6H2O 0,5 g/L; extracto de levadura 0,5 g/L.; aguadestilada c.s.p. 1 litro).Caldo Luria (NaCl 5 g/L; extracto de levadura 5 g/L; peptona de caseínaobtenida por digestión pancreática 10 g/L.; agua destilada c.s.p 1 litro).
Reactivos: queroseno (Ecopetrol), K2HPO4,KH2PO4, nitrógeno.
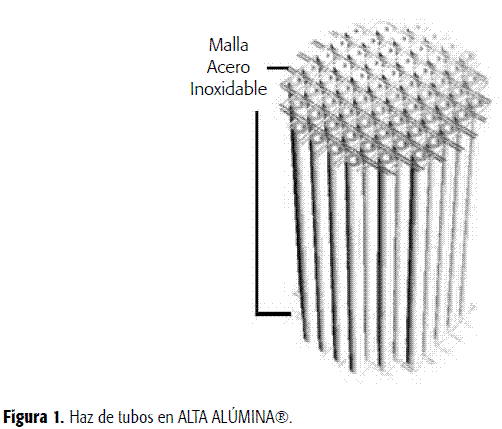
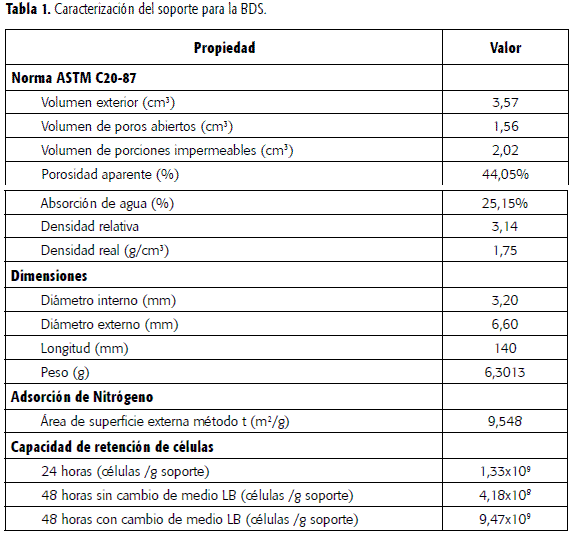
Soporte: es un haz de tubos de 140 mm de longitud, 5 mm de diámetro externo y 3 mm de diámetro interno,fabricado en ALTA ALÚMINA® (Figura 1). Fue caracterizado de acuerdo con la norma ASTM C20-87. Sedeterminó el tamaño del poro y el área superficial disponible para lainmovilización, por medio de una prueba de adsorción física en el SortómetroAutosorb Quantachrome del Laboratorio Instrumental de los Laboratorios deIngeniería Química (LIQ) de la Universidad Nacional de Colombia. Se evaluó laresistencia térmica sometiendo los tubos de alúmina a presión de 20 psi ytemperatura 121 ºCdurante 15 minutos en autoclave con el fin de determinar su comportamiento bajolas condiciones propias del proceso de esterilización. Se determinó la cantidadde células retenidas por unidad de peso del soporte por desprendimiento yrecuento directo en cámara de Neubauer. Muestras de soporte de 2 cm de longitud previamentesecadas y pesadas fueron colocadas en 27 mL de caldo LB y esterilizadas a 121 ºC durante 15 minutos.Inoculado el medio se dejó por 24 horas a 30 ºC, al final se retiraron los soportes y secolocaron de nuevo en 27 mL de medio fresco por 24 horas. Terminada lafermentación, se retiraron los soportes, se colocaron en 20 mL de aguadestilada y se sometieron a agitación a 180 rpm por 30 minutos. Las célulasliberadas, que se consideraron iguales a las células inmovilizadas, sedeterminaron empleando el método de la cámara de Neubauer.
Diseño del reactor: se diseñó bajo la perspectiva que permitierala recirculación de una emulsión compuesta por un medio mínimo de sales (MMS)en queroseno a través de una zona en la que se encuentren los tubos de alúminacon las células inmovilizadas de Pseudomonas sp. (zona de reacción).Para ello se empleó un sistema neumático de agitación mediante inyección deaire a la zona de reacción. Se determinó su tiempo de mezcla (3) y elcoeficiente de transferencia de oxígeno.
Biodesulfurización: activar la cepa de Pseudomonas sp. No. 6 en Agar CASO suplementado con cristal violeta y nitrofurantoína,incubando a 30 °Cpor 24 horas. Tomar una colonia y repicarla en 200 mL de caldo Luria e incubaren baño termostatado agitado (30 °C por 8 horas). El reactor que tiene caldo Luriaestéril es inoculado con el cultivo anterior y se da inicio a inyección de airea un flujo de ft3/h, permitiendo el crecimiento celular durante 24horas; transcurrido este tiempo el reactor es vaciado y cargado nuevamente concaldo Luria fresco y estéril y se permitió de nuevo el crecimiento por 24 horasadicionales. Finalmente se descargó el medio desgastado. Una vez finalizado elproceso de inmovilización, inmediatamente se llevó a cabo la carga de laemulsión que se desea trabajar, sin suspender la aireación. La emulsión, 19 litros en relaciónvolumétrica O/W 70/30, se preparó en un tanque plástico con capacidad para 60 litros. Al tanque se añadió el queroseno, elMMS esterilizado con pH 8,0 y finalmente el oleato de etanolamina (6.380 ppm),y se agitó a 400 rpm durante 5 minutos para lograr la dispersión de loscomponentes. Una vez cargada la emulsión se inició la agitación mecánica en eltanque de recirculación (200 rpm). Finalmente se adecuaron las condiciones deoperación, temperatura (30 ºC),flujo de aire (8,8 ft3/h) y agitación mecánica. El proceso debiodesulfurización se llevó a cabo durante 120 horas, y se le realizó unseguimiento de pH y oxígeno disuelto.
Antes y después de labiodesulfurización el queroseno fue evaluado con bomba calorimétrica paradeterminar su contenido total de azufre y su calor específico de combustión.
RESULTADOS Y DISCUSIÓN
El soporte desarrollado para llevara cabo el proceso de BDS consta de dos haces de 60 tubos arreglados en cuadradocon un claro de 2 mm(Figura 1). De acuerdo con las características exhibidas por el soporte (Tabla1) este es un material apropiado para los propósitos de un proceso con célulasinmovilizadas,
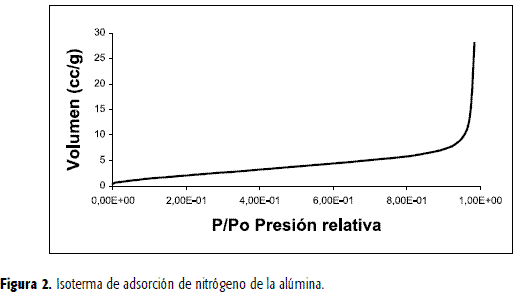
A partir del ensayo de adsorción denitrógeno se logró obtener que el tamaño de poro del material es 32,78 Å, cuyovalor lo ubica dentro de los materiales denominados mesoporosos (~20-200 Å). Laisoterma (Figura 2) obtenida por medio del ensayo de adsorción de nitrógeno esde tipo II, y por tanto caracteriza la alúmina, empleada como soporte para lascélulas, como un sólido mesoporoso alto.
Para el cálculo del área desuperficial se empleó el método t, dado que el método DR sólo es aplicable consólidos microporosos. El valor obtenido del área superficial fue de 9,548 m2/g,que es inferior al calculado por la expresión de Langmuir: 11,15 m2/g.Esto se presenta debido a que el cálculo por el modelo de Langmuir posee mayorvalidez para materiales que presenten isotermas del tipo I y para materialesmás porosos que la alúmina. El tamaño de poro obtenido es menor al tamañopromedio de una bacteria de Pseudomona, lo que indica que la inmovilizaciónse efectuó sobre la superficie del soporte, favorecida por la rugosidad del material.
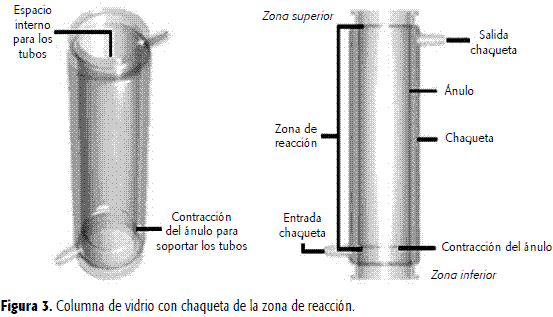
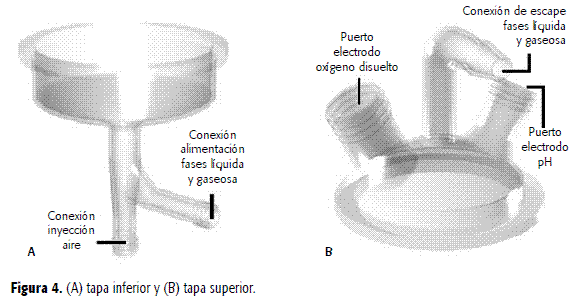
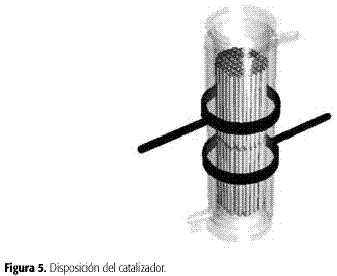
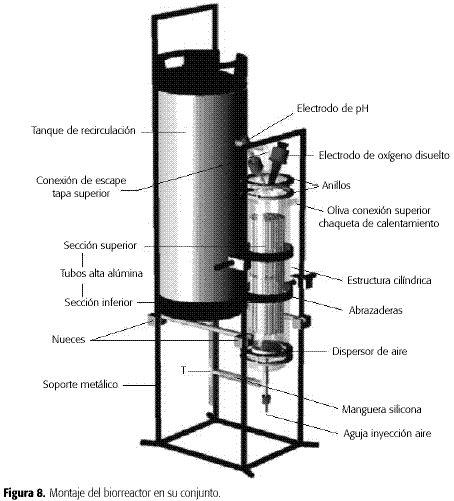
En el sector designado la Zona de reacción está constituida por una columnade vidrio con chaqueta (Figura 3) que contiene dos unidades catalizadoras (Figura 1), con las siguientesdimensiones: diámetro externo, 106 mm; diámetro interno, 80 mm; diámetro de lacontracción, 76 mm;longitud total 40 cm;longitud de la zona de reacción es de 33 cm. La columna está flanqueada por dos tapasde vidrio. La tapa inferior (Figura 4A) tiene diámetro interno de la conexiónde alimentación de la fase líquida de 8,55 mm; longitud de la conexión dealimentación de la fase líquida, 50 mm; diámetro interno de la conexión de alimentación deaire de 8.55 mm;longitud de la conexión de alimentación de aire de 70 mm y una longitud total de115 mm.La tapa superior (Figura 4B) con diámetro interno conexión escape fases líquiday gaseosa de 8,55 mm,longitud conexión de escape de las fases líquida y gaseosa de 105 mm, diámetro interno delpuerto de oxígeno disuelto de 23,3 mm, diámetro interno del puerto de pH de 17,2 mm y una altura totalde 95 mm.Las unidades catalizadoras constan de 60 tubos arreglados en cuadros soportadospor mallas de acero inoxidable, y estáncolocadas verticalmente al interior del reactor de vidrio (Figura 5).
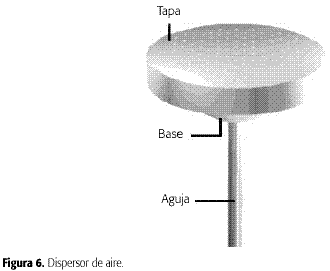
El dispersor de aire se encuentra compuesto por una base enteflón (diámetro mayor 65 mm,diámetro menor 22 mm,altura 21 mmy diámetro del orificio de conexión de la aguja 6 mm), una tapa de teflón(diámetro externo 71 mm,diámetro interno 65 mmy altura de 11 mm)y una aguja de acero inoxidable (diámetro externo 6 mm, diámetro interno 1 mm y longitud de 145 mm) como se ve en la Figura 6.
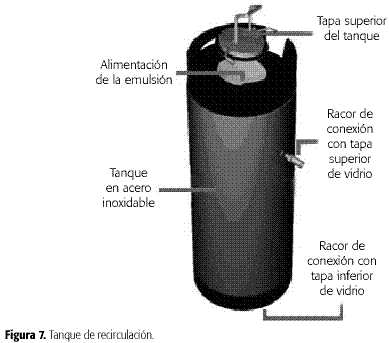
Tanque de recirculación: esta sección (Figura 7) se monta paragenerar un reciclo de la emulsión y por tanto posee dos entradas. La primera seencuentra en la parte inferior del tanque. La segunda entrada (lateral) serealizó a una altura tal que por encima de ésta el volumen del tanque fuera un20% del total, con el fin de permitir un espacio libre para la salida del airedel equipo y la posible formación de espuma por parte de la emulsión. Elmaterial del tanque es acero inoxidable y tiene las siguientes dimensiones:diámetro externo 22 cm;altura, 62 cm;diámetro interno racor de conexión, 12 mm y diámetro interno conexión del fondo, 12 mm.
Montaje y operación delreactor: el equipo construido y empleado en los ensayos se denominó Biorreactorde lecho de tubos con recirculación (BLTR) (Figura 8). El equipofinalmente montado (Figura 8) presentó el comportamiento esperado durante lascorridas realizadas con agua, así como durante los ensayos con la emulsiónutilizada durante el proceso. La recirculación de los fluidos involucrados enel proceso se debe básicamente a la inyección de aire, la cual al disminuir ladensidad de la emulsión por expansión del volumen de la emulsión al interior dela zona de reacción genera el desplazamiento ascendente de ésta.
Caracterización del reactor
Para caracterizar el equipo se empleó agua, a fin de evaluar sucomportamiento y la capacidad de transferencia de oxígeno, al interior delreactor.
Tiempos medios de mezclado (TMM): estos se obtuvieron de lanormalización de los perfiles de pH medidos experimentalmente en el laboratorio(3). El tiempo medio de mezclado es el tiempo en el cual se ha alcanzado un 95% del valor de estabilidad.
De las tablas 2 y 3 vemos que los TMMdel trazador ácido son menores que los TMM del trazador básico en ambos flujos,cuando la aplicación del trazador se realiza a la entrada de la zona dereacción. Tal comportamiento se debe posiblemente a la concentración de CO2(proveniente del aire) en aquella zona del equipo. Una reacción entre el CO2hidratado y la base facilitaría laestabilización más rápida del pH.
Cuando la inyección se realiza en el tanque de recirculación losTMM, para ambos trazadores y para ambos flujos, presentan poca diferencia yesto se debe a que hay una mayor distancia entre el punto de aplicación y elpunto de medición del pH, lo cual permite que el volumen de trazador tenga mástiempo para mezclarse con el volumen de agua del sistema. En la inyección a laentrada de la zona de reacción, la distancia entre el punto de aplicación deltrazador y el punto de medición del pH es menor, y se requerirá mayor tiempopara que el volumen de trazador se mezcle con el agua. Una cantidad pequeña detrazador toma más tiempo en llegar a un estado estacionario, que el requeridopor una cantidad alta de ácido o base.
Transferencia de oxígeno: los resultados calculados en agua a 18 ºC, para dos flujosdiferentes de aire. Para 1,98 ft3/h el KLa fue de 0,0032 s-1; y para 8,77 ft3/h el KLa fue de 0,0044 s-1.
De lo anterior podemos concluir que es un reactor de graneficiencia de mezclado y transferencia de oxígeno, lo cual es apropiado para unproceso en cuestión.
Biodesulfurización
Primero se procedió a realizar la inmovilización delmicroorganismo colocando caldo Luria solamente en la zona de reacción, el cual setempera a 30 °Cy luego es inoculado y aireado con ayuda del dispersor. Esta etapa duró 24horas, luego del cual el caldo fermentado y con células es retirado. Aquípodemos apreciar la colonización del soporte debido a la tonalidad rojiza quetoma, que no es propia del microorganismo utilizado, y que puede deberse a lascondiciones del proceso. Adicionalmente, el microorganismo lo podemos veradherido a otros elementos del biorreactor.
En el tanque de recirculación se han colocado 19 litros de emulsión dequeroseno: MMS pH 8,0 (70:30), estabilizada con 6.500 ppm de oleato deetanolamina. Esta emulsión se le permite su acceso a la zona de reacción unavez ha removido el caldo Luria fermentado.
El sistema comienza a operarse con un; flujo de aire de 8,77 ft3/h. Enestas condiciones la concentración inicial de oxígeno disuelto en la emulsiónfue de 16,22 ppm. Este valor disminuyó levemente durante las primeras 24 horasde proceso hasta alcanzar un valor de 16,06 ppm. A partir de este momento laconcentración de oxígeno aumentó hasta las 20 ppm y se mantuvo en este valordurante el resto de la operación.
El valor inicial de pH fue de 8,0, y transcurridas 21 horas delproceso, el pH disminuyó a 7,57, lo que ocasionó el rompimiento de la emulsión.El descenso del pH se contrarrestó utilizando K2HPO4 1 M; elevando de nuevo el pH aun valor cercano a 8,0 mejorando la estabilidad de la emulsión.
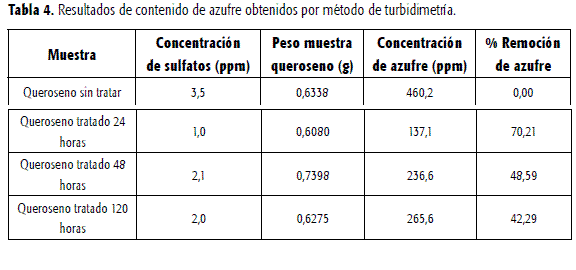
Para estudiar la biodesulfurización, las concentraciones deazufre de cada una de las muestras tomadas durante el proceso se calcularon apartir de los resultados expresados como concentración de sulfatos, obtenidosdespués de analizar éstas en la bomba calorimétrica.
De acuerdo con los resultados de la tabla 4 se logró una remoción de azufre del 42,29% para un proceso que duró 120horas. Adicionalmente se pudo observar que el proceso no afecta la viabilidadcelular pues en el reactor se presentó un gran crecimiento del microorganismolo cual indica que parte del queroseno pudo ser utilizado como fuente decarbono y energía.
Los valores de calor de combustión (tabla 5) no presentandiferencias significativas antes y después del tratamiento, lo que quiere decirque el proceso no interfiere con la calidad del producto, más bien tiende a unapequeña mejoría que se podría tratar como una especie de "biocraking", que esaltamente benéfico para el combustible.
En este punto, se puede afirmar que seha desarrollado un sistema de biodesulfurización de queroseno que no ataca elcombustible y que tiene un gran potencial de desarrollo para la industria delpetróleo en Colombia. Este proceso se podría desarrollar a escala piloto con elfin de obtener combustibles más limpios y amigables con el medio ambiente acostos razonables.
AGRADECIMIENTOS
A todas las personas del Departamento de Farmacia, delDepartamento de Ingeniería Química y del Departamento de Física quecontribuyeron a la realización del estudio.
BIBLIOGRAFÍA
1. Instituteof Petroleum London, ";Moderna Tecnología del Petróleo", London, 1963, p. 734. [ Links ]
2. N. DeNevers, ";Air Pollution ControlEngineering", McGraw-Hill, New York, 2000. [ Links ]
3. J.C. Cruz,y J.D. Valderrama, "Diseño, montaje y puesta en marcha de un proceso biológicoa escala banco para estudiar la factibilidad técnica de la desulfurización deun combustible líquido modelo", trabajo de grado, Departamento de IngenieríaQuímica, Universidad Nacional de Colombia, Bogotá, 2002. [ Links ]
4. J. Konishi, Y. Ishii, K. Okumura y M.Suzuki, High temperature desulfurization by microorganisms. United StatesPatent 5,925,560 (2000). [ Links ]
5. Y.K. Chang., J.H Chang., H.W. Ryu y H.N.Chang, Desulfurization of model and diesel oils by resting cells of Gordona sp. Biotechnology Letters, 22, 193 (2000). [ Links ]
6. Y.K. Chang, J.H Chang, H.W. Ryu y H.N.Chang, Desulfurization of light gas oil in immobilized cell systems of Gordonasp. CYKS1 and Nocardia sp. CYKS2. Microbiology Letters, 182,309 (2000). [ Links ]
7. G.J. Olson, Microbial catalyst fordesulfurization of fossil fuels. United States Patent 6,124,130 (2000). [ Links ]
8. T. Ohshiro y Y. Izumi, Microbialdesulfurization of organic sulfur compounds in petroleum, Biotechnol.Biochem., 63, 1 (1993) [ Links ]
9. C. Squires, J. Wan, L. Xi, B. Ortego, O.Pogrebinsky, K. Gray y J. Childs, Method of desulfurization of fossil fuel withflavoprotein. United States Patent 5,985,650 (1999). [ Links ]
10. A. Darzins y G.T. Mrachko, Sphingomonas biodesulfurization catalyst. United States Patent 6,133,016 (2000). [ Links ]
11. J.D. Monticello, Riding the fossil fuelbiodesulfurization wave, Chemtech., 28, 38 (1998). [ Links ]