Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.36 no.1 Bogotá Jan./June 2007
Artículo de investigación
Cuantificación por citometría de flujo de esplenocitos CD4+, CD8+, CD19+ y CD14+ obtenidos de cuatro especies murinas empleadas en estudios de inmunotoxicología
Quantification by flow cytometry of CD4+, CD8+, CD19+ and CD14+ mouse splenocytes, obtained from four species used in Immunotoxicology´s studies
Erica Salguero1,2, David Plaza1,3, Angélica Mariño1,4 y Gabriela Delgado1,5
1 Grupo de Investigación en Inmunotoxicología, Departamento de Farmacia, Universidad Nacional de Colombia. A.A. 14490. Bogotá, D.C. Colombia.
2 Universidad de los Andes. Facultad de Ciencias. Departamento de Ciencias Biológicas.
3 Fundación Instituto de Inmunología de Colombia (FIDIC).
4 Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Biología.
Recibido para evaluación: 14 de noviembre de 2006 Aceptado para publicación: 19 de marzo de 2007
RESUMEN
Los modelos experimentales, en particular el modelo murino, se han utilizado ampliamente en el estudio del potencial inmunotóxico de fármacos, especialidad hoy conocida como inmunotoxicología (IMT). La caracterización de los componentes, su función, sus interacciones y sus mecanismos efectores, es fundamental al estudiar la capacidad inmunomoduladora de cualquier molécula. Dentro de los elementos celulares responsables de la función efectora adaptativa y asociados con buena parte de los efectos adversos que sobre el sistema inmune pueden inducir los fármacos están los linfocitos T ayudadores, citotóxicos y B; al igual que los monocitos, los cuales pueden ser monitoreados por citometría de flujo utilizando anticuerpos fluoromarcados que reconocen las subpoblaciones CD4+, CD8+, CD19+ y CD14+, respectivamente. Se establecieron intervalos de referencia para estas poblaciones celulares obtenidas del bazo de ratones CFW, Suizos, ICR y Balb/C, como algunas de las especies más utilizadas en pruebas de IMT. Aunque hoy se sabe que la caracterización de rasgos fenotípicos de una población, debe siempre acompañarse se estudios funcionales, para algunos casos clínicos de inmunosupresión secundaria a la administración de fármacos, el simple estudio fenotípico puede ser concluyente. Por esta razón, los valores de referencia aquí establecidos, son un referente preliminar importante que permite establecer el perfil inmunosupresor de una molécula con potencial farmacéutico, estudiada en el concepto integral de seguridad.
Palabras clave: Inmunotoxicología, esplenocitos CD4+, CD8+, CD19+, CD14+, modelo murino, citometría de flujo, valores de referencia.
SUMMARY
The experimental models, especially the murine model, have been widely used in the study of the immunotoxic effect of drugs (Immunotoxicology [IMT]). The characterization of the components, function, interactions and action mechanisms, is fundamental at moment to study the immunomodulator capacity of any molecule. Inside the cellular elements associated with generation of adverse effects on the immune system are the T helper, T cytotoxic and B lymphocytes, and monocytes, which can be quantitatively analyzed by flow cytometry using fluoro-labelling antibodies that recognize the sub-populations CD4+, CD8+, CD19+ y CD14+, respectivelly. We established reference intervals for these cellular populations obtained of mice spleen CFW, Swisses, ICR and BALB/c, some of the species most used in IMT's tests. Though the characterization of surface marker profile on a cellular population should be complemented with functional test, in some clinical cases of immunsuppression secondary to administration of drugs, only the fenotiping study can be conclusive. For this reason, the references values here described, are a preliminary important parameter that allows to establish the immunosuppressor profile of a molecule with pharmaceutical potential, studied in the integral concept of safety.
Key words: Inmunotoxicology, splenocytes CD4+, CD8+, CD19+, CD14+, murine model, flow cytometry, reference's values.
INTRODUCCIÓN
Como parte fundamental de los estudios para la evaluación del potencial efecto adverso que los fármacos u otro tipo de compuestos puedan causar al sistema inmune (SI) (Inmunotoxicología [IMT]), los modelos animales, y en particular el ratón, han sido ampliamente utilizados; incluso, a pesar de los grandes debates generados en torno a la dificultad de extrapolar los resultados hallados en el modelo animal a los humanos, por su fácil manipulación, relativo bajo costo y reproducibilidad, el ratón continúa siendo el sistema de evaluación preclínica de elección. Múltiples ensayos para describir la modulación del SI como parte fundamental de la IMT, han sido diseñados empleando ratones adultos (1, 2). Sin embargo, el uso de ratones en otros estadios de desarrollo o especies mutadas (3, 4), ha permitido estudios específicos; por ejemplo, en el plano de genotoxicidad o teratogenia. Aunque no se ha logrado un consenso internacional sobre cuales pruebas se deben aplicar para determinar la inmunotoxicidad de un compuesto, existen parámetros comunes que a juicio de los expertos resultan fundamentales para el inicio del tamizaje inmunomodulador de las moléculas de interés (5).
Estos análisis tienen como objetivo encontrar la potencial asociación entre el fármaco administrado y la generación de efectos adversos sobre el SI, los cuales de forma general han sido agrupados en cuatro categorías: (i) Inmunosupresión: efectos sobre el sistema inmune que inducen una disminución en la función del sistema (6).; (ii) Inmunogenicidad: reacciones inmunes provocadas por fármacos o sus metabolitos (7).; (iii) Hipersensibilidad: sensibilización del sistema inmune generada por fármacos o sus metabolitos (1), y (iv) Autoinmunidad: reacciones del sistema inmune frente a antígenos propios resultado de la exposición a fármacos o sus metabolitos (8). Para establecer las bases científicas del uso de métodos para la evaluación de la inmunotoxicidad en ensayos de identificación riesgo/seguridad de fármacos, autoridades en el tema, en cooperación con la industria farmacéutica, han realizado la validación de múltiples análisis en ratas y ratones (9). Estos estudios han aportado al conocimiento relacionado con la confiabilidad, reproducibilidad y sensibilidad de las pruebas funcionales y no funcionales con valor predictivo. Dentro de estos parámetros, los estudios histopatológicos representan una herramienta muy sensible para la detección de los efectos sobre el SI en ensayos de rutina, con un mayor alcance si se acompañan de la determinación del peso de los órganos linfoides (10). Sin embargo, en los análisis a desarrollar principalmente cuando un efecto inmunomodulador ha sido detectado, se propone en primera instancia la fenotipificación de subpoblaciones celulares por técnicas como la citometría de flujo (CF) o los análisis inmunohistoquímicos (11).
La caracterización de los antígenos de superficie se puede realizar en células obtenidas de diversos especímenes, por ejemplo, esplenocitos, timocitos, médula ósea, nódulos linfoides o sangre periférica. Las poblaciones más frecuentemente estudiadas incluyen linfocitos T ayudadores o helper (CD4+), linfocitos T citotóxicos (CD8+), linfocitos B (CD19+) y monocitos o macrófagos (CD14+), poblaciones que hacen parte esencial de la respuesta efectora adaptativa o adquirida. No obstante, la simple determinación de los rasgos fenotípicos de las poblaciones posiblemente afectadas por los fármacos, por técnicas como CF, sólo podría ser útil como un indicador de inmunosupresión: (i) cuando los cambios fenotípicos en las subpoblaciones celulares se hayan correlacionado con una disminución de la resistencia de los hospederos contra patógenos o frente a la aparición de neoplasias (12), y (ii) cuando los efectos adversos se hayan demostrado en ensayos clínicos, y donde la fenotipificación se constituye en una prueba confirmatoria de supresión (13, 14). Las demás categorías de efectos adversos deben ser estudiadas complementando los análisis fenotípicos con pruebas funcionales, las cuales son desarrolladas utilizando órganos o tejidos obtenidos del ratón. Como parte de la gran variedad de protocolos y debido a su facilidad relativa en la manipulación y por su alta densidad celular representativa de los demás órganos linfoides y de sangre periférica, se encuentra el bazo; por consiguiente, el análisis de las subpoblaciones de esplenocitos se constituye en parámetro fundamental al determinar el potencial inmunosupresor de una molécula.
Se resalta que el uso de ratones ha permitido establecer lineamientos de seguridad para muchos medicamentos en las fases preclínicas de desarrollo, empleando determinadas especies acorde con el tipo de análisis que se quiera realizar. Por ejemplo, estudios en los que se utiliza la especie BALB/c, se han desarrollado no sólo para evaluar candidatos a fármacos, sino también para determinar el potencial inmunotóxico de sustancias como herbicidas, que alteran la función de linfocitos T (15) u otras formulaciones que contienen metales y están asociados con alergias y enfermedades autoinmunes (16). La especie ICR también es común en análisis de fármacos, de metales y de compuestos que pueden estar incluidos en la dieta, como el 3-acetildeoxinivalenol (17). Aunque el empleo de la cepa CFW es menos común en ensayos preclínicos de IMT, animales de este linaje se han empleado en el estudio del humo y, principalmente, en algunos de sus componentes (18). Finalmente, los ratones Suizos hacen parte de un amplio espectro de pruebas, las cuales buscan determinar el potencial inmunotóxico de sustancias inmunomoduladoras extraídas de plantas (19, 20), asociadas al metabolismo de timerosal (y más específicamente del mercurio) (21), y relacionadas con la hipersensibilidad a los alérgenos (22).
Como es suficiente, en instancias preliminares, la disminución de poblaciones celulares efectoras de la respuesta inmune para emprender el estudio de la inducción de una inmunomodulación secundaria a la administración de fármacos, resulta muy útil establecer los valores de referencia para subpoblaciones celulares, en los distintos modelos experimentales, en particular en el modelo murino. A este nivel, son pocos los resultados que reportan valores normales para dichas subpoblaciones celulares principalmente en órganos linfoides, razón por la cual en este estudio, se decidió establecer los valores de referencia para células CD4+, CD8+, CD14+ y CD19+ obtenidas del bazo de cuatro especies murinas muy utilizadas en estudios de IMT (ratones BALB/c, ICR, Suizos y CFW). La cuantificación de estas poblaciones esplénicas se determinó mediante CF; una técnica cuantitativa, reproducible y económica, que se ha constituido en una valiosa herramienta en el estudio del potencial inmunomodulador de productos farmacéuticos.
MATERIALES Y MÉTODOS
Ratones
Se utilizaron para este estudio diecinueve ratones ICR (Bioterio: Departamento de Farmacia, y Bioterio Central: Facultad de Veterinaria, Universidad Nacional de Colombia), veintiún BALB/c (Bioterio: Instituto Nacional de Salud, y Bioterio Central: Facultad de Veterinaria, Universidad Nacional de Colombia), seis ratones CFW (Bioterio: Facultad de Ciencias, Universidad de los Andes) y seis ratones Suizos (Bioterio: Facultad de Ciencias, Universidad de los Andes). Todos los ratones empleados fueron hembras de cuatro semanas, los cuales se manipularon de acuerdo a los procedimientos establecidos por el Bioterio del Departamento de Farmacia y sujetos a los protocolos emanados por el Ministerio de la Protección Social de Colombia para el manejo de animales (resolución 008430 de 1993).
Obtención de esplenocitos
El sacrificio de los ratones se efectuó por dislocación cervical (conforme a las normas para manipular animales del Bioterio del Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia). La extracción de los bazos se hizo bajo condiciones de esterilidad empleando cabina de flujo laminar. El órgano se depositó en caja de Petri con medio RPMI 1640 (GIBCO, Scotland, UK), suplementado con suero fetal bovino (SFB, GIBCO) al 10%. La perfusión de los bazos se realizó con jeringa y en condiciones de esterilidad hasta obtener más del 90% del contenido celular. Los esplenocitos mononucleares se separaron con gradiente de densidad Ficoll-hypaque (1,077 density) (ICN Biomedical Inc., Ohio, EE.UU.).
Citometría de flujo
Los esplenocitos obtenidos inmediatamente después de la perfusión de los bazos se marcaron con anticuerpos específicos para los correceptores CD4 (Anti-mouse CD4-Isotiocianato de fluoresceína [FITC]), CD8 (Anti-mouse CD8-Ficoeritrina [PE]), CD14 (Anti-mouse CD14-FITC) y CD19 (Anti-mouse CD19-FITC) (DAKO Corp., Carpintería, CA). Como marcador de viabilidad se empleó el 7-amino-actinomycin D (7AAD) (Pharmingen, San Diego, EE.UU.). La expresión de estos marcadores se monitoreó por citometría de flujo (FACScan-Becton Dickinson, San José, CA); se adquirieron 30.000 eventos y se analizó el comportamiento de la población celular en R1.
Análisis estadístico de resultados
Los resultados se analizaron con la plantilla creada en el programa Cell-Quest (Becton Dickinson) para cada una de las subpoblaciones. Se realizó un Anova para establecer la diferencia entre los tratamientos, utilizando las herramientas de Microsoft Excel y de Statistix 8.1 (Analytical Software, Tallahassee, FL) (análisis de poblaciones CD4, CD8, CD14 y CD19). La prueba estadística de Shapiro-Wilk se usó para establecer normalidad en los datos y la de Tukey se aplicó para hacer comparaciones múltiples y establecer entre cuáles subpoblaciones restringidas a especie se encuentra la diferencia significativa.
RESULTADOS Y DISCUSIÓN
Cuantificación de subpoblaciones celulares en esplenocitos murinos
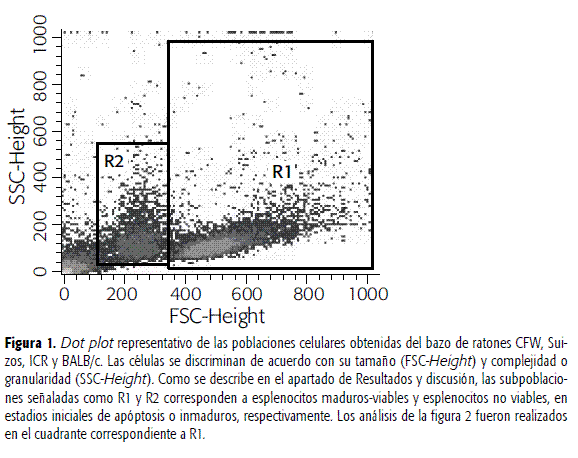
Los análisis se realizaron en la denominada población R1 (Figura 1), que de acuerdo con lo reportado por Pheng et al., pertenece a los esplenocitos maduros y viables (23). En contraste con lo reportado, donde la denominada ventana R2 la relacionan con esplenocitos no viables, se sugiere que esta población más bien podría tratarse de células inmaduras o en estadios iniciales de apóptosis, ya que la viabilidad analizada en el presente estudio y por medio de la tinción con 7AAD en cada una de las poblaciones, no alcanza más del 5% del total de las células. Finalmente, los resultados se obtuvieron excluyendo las células muertas coloreadas con el 7AAD en el canal FL-3 de fluorescencia.
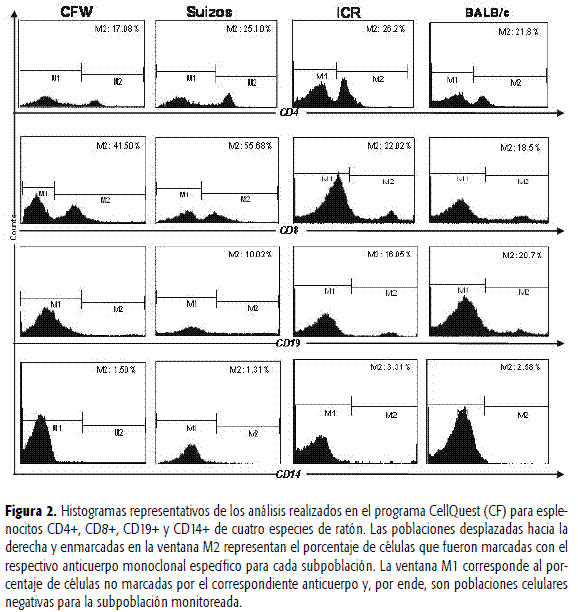
Los porcentajes reportados para cada uno de los marcadores corresponden a la ventana M2 de los histogramas presentados en la Figura 2. Cada histograma muestra poblaciones variables de M1 y M2, las cuales se ajustaron de acuerdo con el espectro de las células sin marcar, adquiridas y captadas en los canales FL-1 y FL-2. M2 corresponde al porcentaje de células positivas para cada marcador y M1 al remanente de células no reconocidas por el respectivo anticuerpo fluoromarcado. Es de resaltar que en los diagramas flourocitométricos, el grado o porcentaje de positividad celular se visualiza por un desplazamiento de las poblaciones hacia la derecha, el cual corresponde a la ventana M2 de todos los histogramas. La Figura 2 muestra gráficos representativos seleccionados al azar de animales de cada especie. Se destaca que por cada muestra se adquirieron tres réplicas y que los porcentajes iniciales corresponden al promedio de los tres resultados (desviaciones estándar promedio 0,069).
Obtención de los valores de referencia para esplenocitos CD4+, CD8+, CD19+ y CD14+
Para establecer los valores de referencia, se determinó, en primer lugar, si los datos (para cada marcador) tenían una distribución normal. Este análisis se realizó por medio de la prueba de Shapiro-Wilk. Posteriormente, se efectuó un análisis de varianza (Anova), para determinar diferencias entre especies para cada marcador. En aquellos donde se encontraron diferencias, se aplicó una prueba de Tukey para establecer entre cuáles especies se presentaba la variabilidad para cada antígeno de superficie celular. El valor P asociado con el grado de significancia fue considerado al obtener valores menores a 0,05. Según lo anterior, al analizar la variabilidad del marcador CD4 para las cuatro especies, se encontró un valor P = 0,1670, lo que permite concluir que no hay diferencias estadísticamente significativas entre los cuatro grupos de animales. Para el antígeno CD8 se halló un valor P = 0,0003, que señala que la especie CFW difiere en el porcentaje de células citotóxicas de los ratones Suizos y éstos, a su vez, manejan niveles no comparables de esta subpoblación cuando se comparan con las especies ICR y BALB/c. Para las células CD19+ se obtuvo un valor P = 0,0022, que permitió establecer que los niveles de linfocitos B de los ratones CFW, Suizos e ICR son diferentes a los que maneja la especie BALB/c. Finalmente, para las células CD14+ no se encontraron diferencias significativas entre los valores obtenidos para esta población celular proveniente de ratones CFW, Suizos e ICR. Tampoco fueron diferentes los valores detectados para BALB/c e ICR. Las diferencias significativas se obtuvieron al comparar los datos de los ratones CFW y Suizos con los de los ratones BALB/c (el valor P establecido fue de 0,0021). A su vez, los niveles determinados en ICR no resultaron diferentes a los hallados para las otras tres especies.
Para establecer los intervalos de referencia es importante tener un número de datos significativo (o lo más alto posible); las cepas que no presentaron diferencias se agruparon para establecer los intervalos para el respectivo marcador. En la Tabla 1 se muestran los valores de referencia propuestos en el presente estudio para los marcadores monitoreados.

Se concluye que al haber establecido los valores de referencia para las poblaciones celulares fundamentales en la respuesta inmune adaptativa (linfocitos ayudadores o helper [CD4+], linfocitos T citotóxicos [CD8+], linfocitos B [CD19+] y monocitos [CD14+]) y en un modelo tan utilizado como el ratón para el estudio de efectos inmunotóxicos secundarios a la administración de fármacos, resulta un valioso aporte para el desarrollo de la IMT como parte esencial en el diseño y producción de nuevas moléculas con potencial farmacéutico.
AGRADECIMIENTOS
Expresamos nuestros más sinceros agradecimientos al Departamento de Farmacia de la Universidad Nacional de Colombia, al Instituto Nacional de Salud y a la Universidad de los Andes, por habernos proporcionado los animales empleados en este estudio. También agradecemos a la Fundación Instituto de Inmunología de Colombia (FIDIC), por facilitarnos las instalaciones del Grupo Funcional de Inmunología Molecular para el desarrollo experimental de la propuesta. Finalmente, agradecemos a las compañías Becton Dickinson y Equimed por habernos donado los anticuerpos fluoromarcados fundamentales para el desarrollo de este proyecto.
BIBLIOGRAFÍA
1. S. Nierkens y R. Pieters, Murine models of drug hypersensitivity, Curr. Opin. Allergy Clin. Immunol., 5, 331 (2005). [ Links ]
2. S.D. Holladay y B.L. Blaylock, The mouse as a model for developmental immunotoxicology, Hum. Exp. Toxicol., 21, 525 (2002). [ Links ]
3. M. Lovik, Mutant and transgenic mice in immunotoxicology: An introduction, Toxicology, 119, 65 (1997). [ Links ]
4. J.K. Lee, J.A. Byun, S.H. Park, H.S. Kim, J.H. Park, J.H. Eom y H.Y. Oh, Evaluation of the potential immunotoxicity of 3-monochloro-1,2-propanediol in Balb/c mice. I. Effect on antibody forming cell, mitogen-stimulated lymphocyte proliferation, splenic subset, and natural killer cell activity, Toxicology, 204, 1 (2004). [ Links ]
5. A. Schulte y C. Ruehl-Fehlert, Regulatory aspects of immunotoxicology, Exp. Toxicol. Pathol., 57, 385 (2006). [ Links ]
6. J. Descotes, Immunotoxicology: Role in the safety assessment of drugs, Drug Saf., 28, 127 (2005). [ Links ]
7. J. Descotes, Methods of evaluating immunotoxicity, Expert Opin. Drug Metab. Toxicol., 2, 249 (2006). [ Links ]
8. R. Pieters y R. Albers, Screening tests for autoimmune-related immunotoxicity, Environ. Health Perspect., 107 Suppl. 5:673 (1999). [ Links ]
9. G.S. Ladics, R.E. Chapin, K.L. Hastings, M.P. Holsapple, S.L. Makris, L.P. Sheets, M.R Woolhiser y L.A. Burns-Naas, Developmental toxicology evaluations-issues with including neurotoxicology and immunotoxicology assessments in reproductive toxicology studies, Toxicol. Sci., 88, 24 (2005). [ Links ]
10. C.F. Kuper, J.H. Harleman, H.B. Richter-Reichelm y J.G. Vos, Histopathologic approaches to detect changes indicative of immunotoxicity, Toxicol. Pathol., 28, 454 (2002). [ Links ]
11. K.A. Gossett, P.K. Narayanan, D.M. Williams, E.R. Gore, D.J. Herzyk, T.K. Hart y T.S. Sellers, Flow cytometry in the preclinical development of biopharmaceuticals, Toxicol. Pathol., 27, 32 (1999). [ Links ]
12. M.I. Luster, C. Portier, D.G. Pait, G.J. Rosenthal, D.R. Germolec, E. Corsini, B.L. Blaylock, P. Pollock, Y. Kouchi y W. Craig. Risk assessment in immunotoxicology. II. Relationships between immune and host resistance tests, Fundam. Appl. Toxicol., 21, 71 (1993). [ Links ]
13. M.K. Selgrade, K.D. Cooper, R.B. Devlin, H. van Loveren, R.E. Biagini y M.I. Luster, Immunotoxicity bridging the gap between animal research and human health effects, Fundam. Appl. Toxicol., 24, 13 (1995). [ Links ]
14. S.W. Burchiel, The effects of environmental and other chemicals on the human immune system: the emergence of immunotoxicology, Clin. Immunol., 90, 285 (1999). [ Links ]
15. J.M. Sheil, M.A. Frankenberry, T.D. Schell, K.M. Brundage y J.B. Barnett, Propanil exposure induces delayed but sustained abrogation of cell-mediated immunity through direct interference with cytotoxic T-lymphocyte effectors, Environ. Health Perspect., 114, 1059 (2006). [ Links ]
16. P.E. Bigazzi, Metals and Kidney Autoimmunity, Environ. Health Perspect., 7, 753 (1999). [ Links ]
17. O.B. Kasali, H.B. Schiefer, D.S. Hancock, B.R. Blakley, R.S. Tomar y R. Greenhalgh, Subacute toxicity of dDietary 3-acetyldeoxynivalenol in mice, Can. J. Comp. Med., 49, 319 (1985). [ Links ]
18. K.F. Keller y R.J. Doyle, A mechanism for tobacco smoke-induced allergy, J. Allergy Clin. Immunol., 57, 278 (1976). [ Links ]
19. D.O. Freier, K. Wright, K. Klein, D. Voll, K. Dabiri, K. Cosulich y R. George, Enhancement of the humoral immune response by Echinacea purpurea in female Swiss mice, Immunopharmacology and Immunotoxicology, 25, 551 (2003). [ Links ]
20. R.N.M. Guerra, H.A.W. Pereira, L.M.S Silveira y R.S.G. Olea, Immunomodulatory properties of Alternanthera tenella Colla aqueous extracts in mice, Braz. J. Med. Biol. Research, 36, 1215 (2003). [ Links ]
21. S. Havarinasaba, B. Hggqvista, E. Bjfrnb, K.M. Pollardc y P. Hultman, Immunosuppressive and autoimmune effects of thimerosal in mice, Toxicol. Appl. Pharmacol., 204, 109 (2005). [ Links ]
22. C. de Haar, I. Hassing, M. Bol, R. Bleumink y R. Pieters, Ultrafine but not fine particulate matter causes airway inflammation and allergic airway sensitization to co-administered antigen in mice, Clin. Exp. Allergy, 36, 1469 (2006). [ Links ]
23. S.R. Pheng, C. Auger, S. Chakrabarti, E. Massicotte y L. Lamontagne, Sensitivity to methylmercury-induced autoimmune disease in mice correlates with resistance to apoptosis of activated CD4+ lymphocytes, J. Autoimmun., 20, 147 (2003). [ Links ]














