Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.36 no.2 Bogotá July/Dec. 2007
Artículo de Investigación
Triterpenos e flavonóides isolados de flores de Laseguea erecta (Apocynaceae)
Triterpenes and flavonoids isolate from the flowers of Laseguea erecta (Apocynaceae)
Mario Geraldo de Carvalho1, Maritza A. Rojas Cardozo1, Virginia Claudia da Silva1 e Alceni Augusta Werle2
1 Departamento de Química, ICE, Universidade Federal Rural do Rio de Janeiro, Seropédica-RJ, Brasil, CEP: 23890-000. Correio eletronico: mgeraldo@ufrrj.br
2 Departamento de Química, ICEB, Universidade Federal de Ouro Preto, 35400-000, Ouro Preto-MG, Brasil.
Recibido para evaluación: 2 de mayo de 2007 Aceptado para publicación: 20 de agosto de 2007
RESUMO
Das flores de Laseguea erecta isolaram-se o lupeol, ácido ursólico e os flavonóides quercetina (3,5,7,3',4'-pentaidroxiflavona) e 3-O-α-L-arabinopiranosil quercetina. Esta é o primeiro estudo sobre metabólitos especiais em flores desse gênero. As estruturas foram determinadas através da análise dos dados espectrais de IV, RMN de 1H e 13C (1D e 2D) e comparação com valores registrados na literatura.
Palavras chave: Laseguea erecta, Apocynaceae, flavonóides, acido ursólico, quercetina.
SUMMARY
From the flowers of Laseguea erecta were isolated the lupeol, ursolic acid, quercetin (3,5,7,3',4'-pentahydroxyflavone) and 3-O-α-L-arabinopyranosylquercetin. This is the first phytochemical study of this genera flowers'. The structures were established by the IR, 1H and 13C NMR (1D, 2D) spectral data analysis and by comparison with literature data.
Key words: Laseguea erecta, Apocynaceae, flavonoids, ursolic acid, quercetin.
Introdução
A família Apocynaceae esta composta por 2 subfamílias, Plumieroideae e Apocynoideae, que são constituídas por 250 gêneros com cerca de 2000 espécies, sendo encontradas com frequência nos trópicos e sub-trópicos. As espécies mais conhecidas quanto a composição química e atividade biológica pertencem aos gêneros Plumeria, Vinca, Rauwolfia e Strophantus (1).
Como exemplo de constituintes ativos obtidos de espécies de Apocynaceae podemos citar os alcalóides vincristina e vimblastina usados no tratamento de diferentes tipos de câncer, isolados de Catharantus roseus, glicosideos cardiotônicos isolados de Strophanthus spp (1) e os ácidos ursólico e oleanólico com diversas atividades farmacológicas (2-4) isolados de várias espécies desta família (5-7). Além da grande frequência de alcalóides (1, 8), têm sido encontrados constituintes químicos de diferentes classes de metabólitos especiais em diversas espécies desta família, como por exemplo, glicosídeos cianogenênicos, leucoantocianidinas, saponinas, taninos, cumarinas, ácidos fenólicos, triterpenos e iridóides (1, 5-7). Os flavonóides têm sido encontrados com menor frequência (7) em espécies desta família. Por outro lado, em se tratando de flores, em muitos casos a variedade de cores esta relacionada com alguns tipos de flavonóides. Os flavonóides luteolina e quercetina, entre outros, são frequêntes nas flores brancas ou claras, como o caso da espécie relacionada nesse trabalho. A variedade de cor azul-vermelho está relacionada principalmente ao acúmulo de diferentes estruturas de antocianinas glicosiladas, amarela pelas chalconas e auronas, etc.. Alem dessas propriedades, os flavonóides expressam outras funções especiais nas diferentes partes das plantas como influência na polinização e defesa (9, 10).
A diversidade química desta família e a existência de espécie cuja química ainda é desconhecida tem gerado interesse sobre o estudo químico e avaliação de atividade farmacológica de diversas espécies desta família. Nesse sentido, em trabalhos anteriores divulgamos o isolamento e identificação de metabólitos especiais de espécies de Himatanthus articulata (6), Dipladenia martiana (7), Parahancornia amapa (11) e Laseguea erecta (12) cuja parte dos resultados está sendo descrita nesse trabalho. O estudo químico do caule dessa espécie conduziu ao isolamento e identificação do lupeol, a cumarina escopoletina, o lignóide pinoresinol além do a-L-tevetosil-digitoxigenina (13).
Dando continuidade ao estudo de L. erecta (Apocynaceae) descrevemos nesse trabalho o primeiro estudo fitoquímico das flores desta espécie que conduziu ao isolamento e identificação de dois triterpenos e dois flavonóides.
Material e Métodos
Procedimentos gerais
Os pontos de fusão foram determinados sem correção de valores em aparelho MEL-TEMP II, Laboratory Devices USA utilizando capilar. Os espectros de infravermelho foram registrados em espectrofotômetro Perkin-Elmer 1600/1605 FT-IR em discos de KBr. Os espectros de Ressonância Magnética Nuclear 1H e 13C (incluindo experimentos 2D) foram obtidos em espectrômetro Bruker AC-200 [200 MHz (1H) e 50 MHz (13C)] usando CDCl3 ou DMSO-d6 como solvente e tetrametilsilano como referência interna. Os deslocamentos químicos (d) foram obtidos em parte por milhão (ppm) e as constantes de acoplamento (J) em Hertz.
Os solventes usados foram PA da Vetec®. No fracionamento cromatográfico utilizaram-se colunas de gel de sílica (0,05-0,2 mm) ou Sephadex LH-20 da Aldrich®. Nas análises das frações utilizaram-se placas em camada fina de sílica em alumínio (CCDA), da Sorbent®, e foram reveladas com UV (254-266 nm), reagentes de Liebrmann-Burchard, cloreto de alumínio em etanol (1%) e vapor de iodo.
Material vegetal
O material vegetal da espécie Laseguea erecta foi coletado pelo técnico Jorge L. Silva, no Morro de São Sebastião, Ouro Preto, Minas Gerais, Brasil. Foi identificado pela curadora do herbário Professora Maria Cristina Trivelato Messias, através de comparação com a exsicata desta espécie (no 6732) que está depositada no Herbário OUPR-UFOP, Instituto de Ciências Exatas e Biológicas da Universidade Federal de Ouro Preto, Ouro Preto-MG, Brasil.
Extracão e isolamento de metabólitos especiais
As flores de Laseguea erecta (32,4 g) foram moídas e submetidas à extração com metanol através de maceração a frio. O resíduo do extrato metanólico obtido, após retirada do solvente através de destilação sob vácuo, LEFM (13,9 g) foi fracionado através de filtração sobre gel de sílica com solventes em polaridades crescentes. Obteve-se com CHCl3 a fração denominada LEFMC (3,6 g), com AcOEt LEFMA (1,8 g) e com MeOH a fração LEFMM (7,5 g).
O resíduo LEFMC foi submetido a fracionamento em coluna de gel de sílica, eluída com misturas de CHCl3 e MeOH até metanol 100%. Foram coletadas 28 frações de 25 mL. As frações foram analisadas por CCDA e reunidas em um total de 11 frações. Da fração 2 foi obtida, por recristalização em metanol, a substância 1 (Figura 1) que apresentou-se como um sólido branco (47,0 mg) de PF 180-182 oC. As frações 3-6 foram reunidas e filtradas através de gel de sílica, eluída inicialmente com CHCl3 e finalizando com CHCl3:MeOH (8:2). Dessa filtração, as frações 2-3 apresentaram um precipitado branco de PF 250-252 °C, que foi identificado como 2 (ácido ursólico, 195,0 mg) (Figura 1).
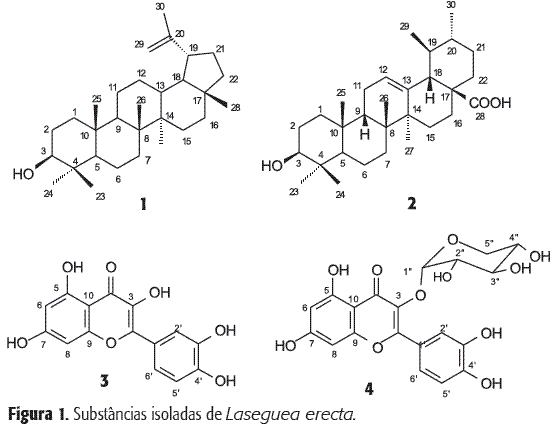
O resíduo acetato de etila, LEFMA, foi eluído com misturas de CHCl3/MeOH em polaridade crescente em coluna de gel de sílica e foram coletadas 31 frações de 25 mL. Estas frações foram reunidas com base em CCDA em 15 novas frações. As frações 2-4 foram filtradas em Sephadex LH-20 usando como solvente uma mistura de CHCl3/MeOH 8:2 fornecendo a substância 3 (Figura 1) (3,5 mg) que se apresentou como um sólido de cor amarelo (PF. 312-314 °C). As frações 7-8 foram igualmente filtradas em Sephadex LH-20 usando CHCl3/MeOH 7:3 conduzindo a purificação da substância 4 (Figura 1) (5,2 mg, sólido amorfo). A análise cromatográfica e reagentes cromógenos de frações obtidas do resíduo LEFMM permitiu identificar mistura de flavonóides e carboidratos.
Resultados e discussão
A substância 1 deu teste positivo para terpenos em CCDA com Lieberman-Burchard. O espectro de IV de (1) revelou sinais de absorção em nmáx (cm-1): 3332 (nO-H) 3069 (n=C-H de vinila), 2943 e 2871 (nC-H, de CH2 e CH3), 1649 (nC=C de vinila) entre outras absorções que confirmaram o esqueleto do terpeno contendo o álcool secundário e o grupo vinila. O espectro de RMN de 1H (200 MHz, CDCl3) apresentou sinais entre 0,70 e 1,23 ppm correspondentes a sinais de metilas terciárias além do sinal em dH 1,67 (1H, s, H-30) que corresponde á freqüência de hidrogênios de metila ligada a C-sp2. Os sinais em dH 4,67 singleto largo (1H, sl, H-29a) e dH 4,55 (1H, sl, H-29b) foram atribuídos aos hidrogênios vinílicos e o sinal em dH 3,15 (1-H, s, H-3) foi identificado como representante do hidrogênio do carbono carbinólico metínico. O espectro de RMN 13C (50,3 MHz, CDCl3) mostrou sinais em dC 150,9 e dCH2 109,3 dos carbonos olefínicos C-20 e C-29, respectivamente. O valor do dCH em 78,9 é compatível com o deslocamento químico do carbono carbinólico C-3 de um triterpeno contendo duas metilas no carbono 4. A comparação dos dados de 1 com valores registrados na literatura (11) permitiu identificar essa substância como o Lupeol. Essa substância foi identifica anteriormente no caule dessa planta (12).
O espectro IV de 2 apresentou entre outros sinais uma banda larga com máximo em 3421 cm-1 (nO-H de ácido), 2926 cm-1 e 2870 cm-1 (nC-H de CH2 e CH3) e 1693 cm-1 (nC=O de ácido carboxílico). O espectro de RMN 1H (200 MHz, CDCl3/DMSO-d6), mostrou sinal em dH 5,10 (1H, t) de hidrogênio olefínico atribuído ao H-12; o sinal em dH 3,01 (1H, t) que foi atribuído ao H-3 e o dupleto em dH 2,06 (1H, d, J=12,0 Hz) foi atribuído ao hidrogênio metínico H-18, esse sinal é característico de triterpenos da série urseno. A análise dos espectros de RMN 13C (50,3 MHz, CDCl3/DMSO-d6) (BBD e DEPT 135° e 90°) permitiu confirmar as funções identificadas no IV [dC 179,8 (ácido carboxílico), dCH 78,2 (álcool secundário), dCH 125,7 e dC 139,0 (dupla trissubstituída)] e identificar 6 sinais de carbonos quaternários, 7 sinais de C-H, 9 sinais de CH2 e 7 sinais de CH3. Esta análise e comparação com valores relatados na literatura (13) permitiram confirmar a estrutura proposta para 2 como o ácido ursólico, isolado com freqüência de espécies de Apocynaceae (5-7).
A quercetina (3) foi identificada como um flavonóide com revelação em CCDA. O espectro de IV mostrou uma intensa absorção em 3410 e 3333 cm-1 (nO-H), 1666 cm-1 (nC=O conjugada) além de outros sinais que justificam sistema aromático e função fenol. O espectro de RMN de 1H (200 MHz, DMSO-d6) apresentou um sinal em 12,5 (1 H, s) de OH quelada e 5 sinais na região de deslocamento de hidrogênios em anéis aromáticos. Os valores dos deslocamentos químicos permitiram propor a estrutura de flavonóide com oxigenação em 3, 5, 7, 3' e 4'. Os sinais em dH 7,67 (1H, sl), 7,54 (1H, d, J=9Hz) e 7,88 (1H, dl, J=9Hz) permitiram propor um anel B trisubstituído e foram atribuídos aos hidrogênios H-2', H-5' e H-6', respectivamente. Os sinais em dH 6,40 (1H, sl) e dH 6,18 (1H, sl) foram assinalados como representantes do H-6 e H-8 do anel A. A ausência do sinal de H-3 conduziu à proposta do flavonol conhecido como quercetina, confirmada pela comparação com dados de RMN 1H e PF da literatura (14). Esta substância tem sido encontrada com freqüência em espécies vegetais, mas é o primeiro registro em Laseguea.
O sólido amorfo de cor amarelo escuro (4) apresentou teste positivo para flavonóide e espectros de RMN 1H, na região de absorção de núcleos de sistemas aromáticos semelhantes à substância 3. O espectro de IV apresentou sinais semelhantes aos de 3. A análise do espectro de RMN 1H (200 MHz, DMSO-d6) permitiu identificar, além dos sinais do HO-5 (dH 12,5 ppm), H-2', 5' e 6' [dH 7,50 (1H, sl), 6,82(1H, d, J=8,3 Hz), 7,64 (1H, dl, J=8,3 Hz), respectivamente], H-6 e 8 [dH 6,17 (1H, sl), 6,37 (1H, sl)], um dupleto em 5,26 (1H, d, J=4,7 Hz, H-1") e um multipleto em 3,19-3,75 (4H, m, H-2''-5'') que foram atribuidos a uma unidade de açúcar. O espectro de 13C (50,3 MHz, DMSO-d6) mostrou, além do sinal em dC 177,46 (C-4), sinais de carbonos quaternários e metínicos compatíveis com o 5,7,3',4' tetraidroxiflavonol. Os sinais em 133,70 (C-3) e 101,4 (CH-1") justificam a proposta do carboidrato em 3. Os sinais em d 71,69; 70,75, 66,1 (CH) e 64,3 (CH2) permitiram propor a unidade de carboidrato com 5 carbonos. O valor da constante de acoplamento do H-1" (1H, d, J=4,7 Hz) e a comparação dos deslocamentos químicos dos carbonos do carboidrato com valores da literatura permitiu propor a α-L-arabinopiranosil para o grupo ligado no carbono 3 desse flavonol. Esses dados foram comparados com os da literatura (15, 16) para a 3-O-α-L-arabinopiranosil quercertina. Esse glicosídeo é conhecido como guaijaverina, isolada de Hypericum brasiliense (16) e obtido como produto de síntese (17).
Os resultados obtidos neste estudo fornecem novas informações sobre química do gênero Laseguea e permite indicar as espécies desse gênero como fonte de constituintes farmacológicamente ativos. Como revelado em trabalhos anteriores com espécies de Dipladenia e Himatanthus (5-7). O ácido ursólico é o constituinte majoritário nessa parte da planta, e a quantidade de trabalhos relacionados às propriedades biológicas desse triterpeno revela a importância dessa espécie como fonte desse constituinte com inúmeras atividades biológicas. Como exemplo podese citar alguns trabalhos recentes relacionados a essa substância (2-4).
Agradecimentos
Ao Convenio PEC-PG-CNPq, Brasil-Colômbia, pela bolsa de M.A.R. Cardozo e a CAPES, CNPq e FAPERJ pelos auxílios e demais bolsas concedidas.
Referências
1. W. C. Evans, Trease and Evans: Pharmacognosy, Editora W. B., Edinburgh, 15 ed. Saunders, 2002, p. 32. [ Links ]
2. J. Liu, Oleanolic acid and ursolic acid: research perspectives, J. Ethnopharmacol., 100, 92 (2005). [ Links ]
3. M. A. L. Vasconcelos, V. A. Royo, D. S. Ferreira, A. E. M. Crotti, M. L. Andrade e Silva, J. C. T. Carvalho, J. K. Bastos, W. R. Cunha, In vivo analgesic and anti-inflammatory activities of ursolic acid and oleanoic acid from Miconia albicans (Melastomaceae), J. Biosciences, 61, 477 (2006). [ Links ]
4. Y. Meng, Y. Chen, A. Wang, D. Liu, Research advance of ursolic acid, Zhongguo Xinyao Zazhi, 16, 25 (2007). [ Links ]
5. M. F. Vanderlei, M. S. Silva, H. E. Gottlieb, R. Braz-filho, Iridoids and triterpenes from Himatanthus phagadaenica, The complete assignment of the 1H and 13C NMR spectra of two Iridoids glycosides, J. Braz. Chem. Soc., 2, 51 (1991). [ Links ]
6. A. S. Barreto, M. G. Carvalho, I. A. Nery, L. Gonzaga, M. A. C. Kaplan, Chemical constituents from Himatanthus articulate, J. Braz. Chem. Soc., 9, 430 (1998). [ Links ]
7. M. G. de Carvalho, D. D. Cranchi, D. G. I. Kingston, A. A. Werle, Proposed active constituents of Dipladenia martiana, Phytother. Res., 15, 715 (2001). [ Links ]
8. S. F. Carvalhaes, D. L. Costa, J. L. Mazzei, L. E. M. Taddei, L. A. D'avida, Alternative extraction of alkaloid anticarcinogens from Brazilian "Vinca rósea" using long exchange chromatography, Revista Brasileira de Farmacognosia, 12, 83 (2002). [ Links ]
9. R. Brouillard, O. Dangles, Flavonoids and flower colour, in The Flavonoids Advances in Research since 1986, J.B. Harborne, Dhapman & Hall, N.Y., 1994, pp. 565-618. [ Links ]
10. K. Kazima, N. Noda, M. Suziki, Flavonoid Composition related to petal color in different lines of Clitoria ternatea, Phytochemistry, 64, 1133 (2003). [ Links ]
11. M. G. Carvalho, C. R. X. Velloso, R. Braz-filho, W. F. Costa, Acyl-lupeol esters from Parahancornia amapa (Apocynaceae), J. Braz. Chem. Soc., 12, 556 (2001). [ Links ]
12. M. G. Carvalho, C. C. F. Alves, A. A Werle; R. Braz-filho, Metabólitos especiais isolados de Laseguea erecta (Apocynaceae), Revista Brasileira de Farmacognosia, 16, 497 (2006). [ Links ]
13. R. Kriwacki, T. P. Pitner, Current aspects of practical two-dimensional (2D) nuclear magnetic resonance (NMR) spectroscopy: applications to structure elucidation, Pharm. Res., 6, 531 (1989). [ Links ]
14. M. Miyazawa, M. Hisama, Antimutagenic activity of flavonoids from Chrysantemum morifolium, Biosci. Biotech., Bioch., 67, 2091 (2003). [ Links ]
15. P. K. Agrawal, M. L. Bansal, Flavonoids glycosides in "Carbon-13 NMR of Flavonoids", P. K. Agrawal (ed.), Elsevier, Amsterdam, 1989, p. 287. [ Links ]
16. L. Rocha, A. Marston, O. Potterat, M. A. C. Kaplan, H. Stoeckli-Evans, K. Hostettmann, Antibacterial phloroglucinols and flavonoids from Hypericum brasiliense, Phytochemistry, 40, 1447 (1995). [ Links ]
17. Z. Chen, Y. Hu, H. Wu, H. Jiang, Synthesis and biological evaluation of flavonoids as vasorelaxant agents, Bioorg. Med. Chem. Lett., 14, 3949 (2004). [ Links ]














