Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.37 no.2 Bogotá July/Dec. 2008
Artículo de Revisión
Mecanismos generales de cesión de principios activos a partir de matrices monolíticas hidrofílicas preparadas con éteres de celulosa
Overall mechanisms that rule the active pharmaceutical ingredient´s delivery process from hydrophilic matrices elaborated with ether cellulose
Plinio A. Sandoval H.1, Yolima Baena, Marcela Aragón, Jaiver E. Rosas2 y Luisa F. Ponce D´León3
1 Colorcon Sucursal de Colombia, E-mail:psandoval@colorcon.com
2 Departamento de Farmacia, Universidad Nacional de Colombia, A.A. 14490, Bogotá, D.C., Colombia.
3 Correo electrónico: lfponced@unal.edu.co
Recibido para evaluación: enero 21 de 2008 Aceptado para publicación: abril 14 de 2008
RESUMEN
Las matrices hidrofílicas son uno de los sistemas de liberación controlados más empleados a escala mundial. El reconocido éxito global de este tipo de sistemas está ligado a su manufactura por medio de tecnología convencional para la obtención de comprimidos, además de su bajo costo. Estos sistemas han sido objeto de investigación desde hace ya algunas décadas, mediante el uso de técnicas como la creación de imágenes a partir de resonancia magnética, calorimetría de barrido diferencial y la espectroscopia dieléctrica de baja frecuencia, entre otras. Varios autores han estudiado los diferentes estados del agua dentro de una matriz, así como el estado y los cambios en los estados de los materiales en el tiempo, con el fin de estudiar los mecanismos de cesión de los activos a partir de las matrices, así como para buscar modelos matemáticos que describan la evolución de la concentración en el tiempo. En la actualidad se cuenta con modelos matemáticos de gran utilidad que permiten identificar dichos mecanismos a partir de un análisis de los parámetros de los modelos y que conducen finalmente a predecir la velocidad de liberación a partir de estos sistemas.
Palabras clave: matriz hidrofílica, HPMC, difusión, erosión, hinchamiento, modelamiento matemático.
ABSTRACT
The hydrophilic matrices are one of the most used controlled delivery systems in the world, due to the simple technology and low cost. A number of publications, over the last decades, have reported investigations in regard with the mechanisms of drug release from hydrophilic matrices. Nevertheless, the mechanisms of drug release from these systems continue to be a matter of debate. Differential scanning calorimetry, low frequency dielectric spectroscopy and nuclear magnetic resonance have been used to examine the distribution of water within ether cellulose matrices, as well as to describe the state of the materials inside the device. The objective is to study the release and hydration rate of hydrophilic matrices in order to contribute to the rationalization of the design of these controlled release systems through mathematical modeling and to obtain a better knowledge of the processes that occur during the release of the drug.
Key words: hydrophilic matrix, HPMC, diffusion, erosion, swelling, mathematical modeling
INTRODUCCIÓN
La mayoría de los sistemas actuales de entrega de un Ingrediente Farmacéutico Activo (IFA) de liberación extendida están basados en matrices de diferentes características, entre las cuales están las matrices hinchables, que son sistemas monolíticos elaborados a partir de la compresión de una mezcla de polvos conformada por un polímero hidrofílico, el IFA y los demás componentes del excipiente. El éxito global evidente de este tipo de sistemas está ligado a su manufactura por medio de tecnología convencional para la obtención de comprimidos. Los sistemas hinchables, basados en polímeros hidrofílicos tipo HPMC, están bien diferenciados en la literatura referente a las formas farmacéuticas de entrega controlada de los sistemas de entrega verdaderamente hinchables o hidrogeles (1, 2). Estos últimos se pueden caracterizar por aspectos generales, como son los formulados a partir de polímeros naturales o sintéticos de carácter hidrofílico, que incorporan como mínimo entre 10 y 20 veces (o incluso algunos miles de veces) su peso seco en agua. Son biodegradables, exhiben comportamientos de desintegración y disolución y son considerados redes que se mantienen juntas debido a interacciones de tipo iónico, puentes de hidrógeno y fuerzas hidrofóbicas. En la literatura (2) se encuentran disponibles descripciones más pormenorizadas de los hidrogeles.
Las publicaciones disponibles en todo el mundo en torno al tema muestran gran interés por parte de investigadores y centros de investigación, bien sean de carácter académico o industrial, debido a las grandes ventajas que ofrecen los sistemas basados en matrices hidrofílicas para el cuidado de la salud humana. Este tipo de producto ofrece numerosas ventajas en comparación con los sistemas de entrega convencionales, como eficacia mejorada, toxicidad reducida y mayor cumplimiento de la terapia por parte de los pacientes. Por lo general, los sistemas de liberación controlada apuntan a mejorar la efectividad de las terapias. Esta ventaja se ve cristalizada al incrementar la actividad terapéutica en comparación con la intensidad de los efectos adversos; al reducir el número de dosis requeridas durante el tratamiento o al eliminar la necesidad de administraciones del activo de manera especializada como es el caso de la administración de dosis múltiples por vía IV repetidas (3).
Éteres de celulosa
La celulosa es un polímero lineal de unidades de β-anhidro glucosa, cada una de las cuales contiene tres grupos hidroxilo. Los éteres de celulosa son derivados obtenidos a partir de la eterificación de los grupos hidroxilo disponibles y entre los más conocidos tenemos: hidroxipropil metil celulosa (HPMC), hidroxipropil celulosa (HPC), carboximetil celulosa sódica (CMC Na), metil celulosa (MC), etil celulosa (EC) y celulosa acetato ftalato. Los éteres de celulosa son polímeros hidrofílicos ampliamente utilizados en el desarrollo de sistemas de liberación controlada, siendo biológicamente compatibles y no tóxicos. Además de estas ventajas, también son: altamente compresibles, se hidratan rápidamente a la temperatura del cuerpo humano y pueden estar presentes en bajas cantidades como agentes conformadores de matriz. En forma comprimida soportan cantidades elevadas de IFA y los perfiles de liberación no son impactados de manera significativa por los diferentes procesos disponibles convencionalmente para la obtención de tabletas por compresión. El empleo de éteres de celulosa y sus aplicaciones en sistemas de entrega ha sido revisado en forma pormenorizada y reportado por algunos autores (4, 5).
Mecanismo general de la cesión del principio activo desde matrices hidrofilicas
La HPMC es el polímero hidrofílico más empleado en la preparación de sistemas de liberación controlada. Una de sus características más importantes es el alto grado de hinchamiento, el que tiene un efecto significativo en la cinética de liberación del IFA a partir del comprimido. Una vez la matriz entra en contacto con el agua o con los fluidos biológicos, el agua se difunde hacia el interior del dispositivo, cuyo resultado es una relajación de la cadena del polímero con una posterior expansión de volumen. La temperatura de transición vítrea (Tg) es una característica importante de los polímeros y en particular es de gran interés en la aplicación de éstos en el diseño de sistemas de liberación modificada (6). Por debajo de la temperatura de transición vítrea, la movilidad de las macromoléculas es muy baja. El polímero está en su estado vítreo (glassy state) y presenta una velocidad de difusión muy baja. En contraste, por encima de la temperatura de transición vítrea, la movilidad de las cadenas del polímero se ve notablemente incrementada, pues el polímero se encuentra en un estado parecido al de la goma (rubbery state), conduciendo así a una velocidad mucho mayor de transferencia de masa y agua. Las diferentes publicaciones disponibles (6-8) que plantean un análisis del proceso de liberación del IFA a partir de una matriz hidrofílica permite resumir el proceso en la secuencia siguiente:
-
Al contacto del comprimido con el medio acuoso (in vivo o in vitro), existe una interacción alta en la interfase agua/polímero, que conduce a un alto grado de imbibición del agua hacia el interior de la matriz. El agua actúa como un plastificante y reduce la temperatura de transición vítrea del sistema. Una vez la Tg iguala la temperatura del sistema, las cadenas de polímero sufren un cambio pasando del estado vítreo a un estado parecido al de la goma. Concomitantemente, el principio activo que yace en la superficie del comprimido matricial se libera de manera inmediata (dosis de carga inicial).
-
Debido a la imbibición del agua, la HPMC se hincha, dando como resultado un cambio dramático tanto en la concentración del polímero como del activo e incrementando las dimensiones del soporte. La interacción agua/polímero que promueve el cambio del hidrocoloide al estado parecido al de la goma, ocasiona el fenómeno de la coalescencia (o unificación) de las diferentes partículas de polímero que se están hidratando sobre la superficie en la capa inferior adyacente de la matriz. Como resultado final de este proceso se tiene la formación de una capa de gel a través de la cual se difunden las moléculas del IFA y de agua, ya sea hacia el interior del comprimido (medio de disolución o fluido biológico) o hacia el exterior (fármaco y excipientes solubles) del sistema.
-
A través de la capa gel conformada, continuamente se difunde agua hacia el interior del comprimido, la que en contacto con el IFA ocasiona dos fenómenos: 1. disolución del activo y saturación alrededor del cristal del fármaco, y 2. posterior difusión (impulsada por presión osmótica o gradiente de concentración generado alrededor de los cristales del fármaco) desde el interior (a través del gel) hacia el exterior del gel.
-
Al incrementarse la concentración de agua, el coeficiente de difusión del activo se incrementa sustancialmente.
-
En el caso de activos de baja solubilidad, las formas disueltas y no disueltas coexisten dentro de la matriz, donde la forma no disuelta no está disponible para el proceso de difusión.
-
En el caso de que el activo represente una alta proporción del sistema de entrega, la estructura interna de la matriz cambia significativamente durante la liberación del activo, llegando a ser más porosa y menos restrictiva para el proceso de difusión.
-
Dependiendo de la longitud de la cadena y del grado de sustitución de la HPMC empleada, el polímero se disuelve por sí mismo en forma más o menos rápida, proceso que se describe en la literatura como "erosión". Para fármacos muy solubles en agua, este fenómeno es irrelevante, pues todo el activo se ha liberado antes de que la disolución del polímero se vuelva el factor limitante. Para principios activos de baja solubilidad, no es posible diseñar un sistema donde el control de la liberación del IFA se ejerza sólo por difusión y es allí donde se hace importante el efecto de "erosión". Narasimhan and Peppas (6, 8) plantearon un mecanismo que explica los procesos físicos a los que está sujeto el polímero durante su interacción con el solvente; estos procesos corresponden a la hidratación, relajación y erosión. La Figura 1-A muestra una interpretación de estos planteamientos (8).
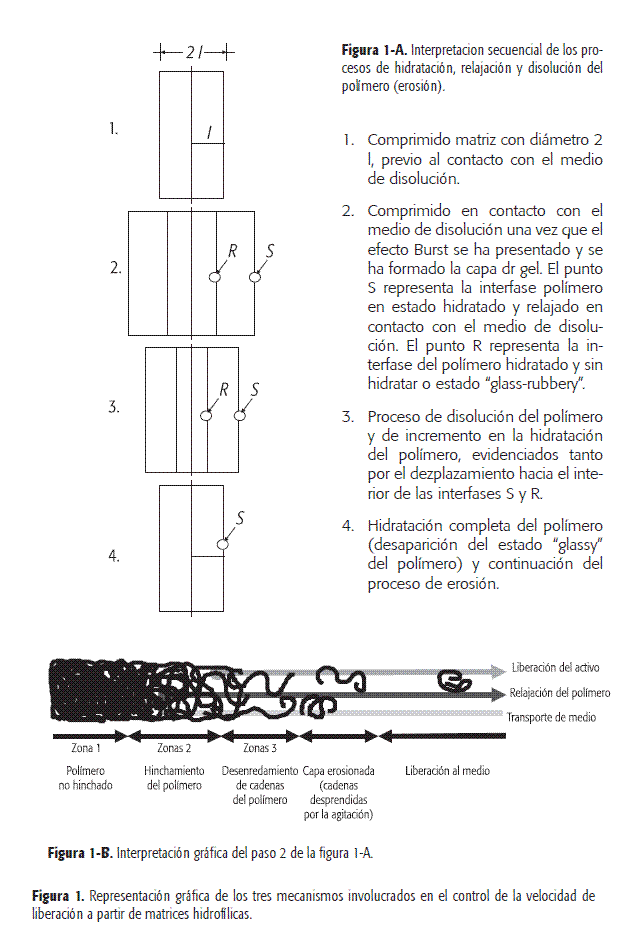
A partir de los procesos planteados anteriormente, se aceptan tres mecanismos como los más importantes, involucrados en el control de la velocidad de liberación del activo desde las matrices hidrofílicas, como son: la difusión, el hinchamiento y la erosión (6).
En la literatura (10-12) se encuentran diferentes descripciones relacionadas con estos tres fenómenos. A su vez, en la Figuras 1 y 2 se muestra la tendencia actual en relación a la representación de los tres fenómenos involucrados.
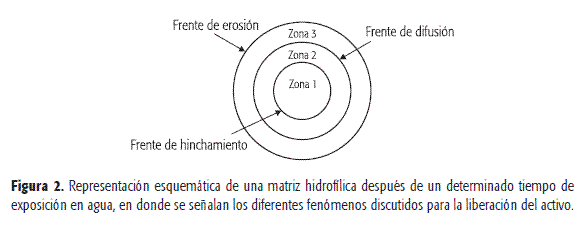
-
La zona 1 representa los estados sólidos de todos los materiales del comprimido, incluidos el activo y el polímero hidrofílico. A partir de la zona 1 se encuentra el frente de hinchamiento, donde comienza la hidratación del polímero. En este punto comienza la interacción polímero-agua. La Tg del polímero es igual a la del sistema y por tal razón se da la relajación del polímero, dando lugar al cambio en las dimensiones del dispositivo, así como a la conformación de la capa de gel originada por la coalescencia de las partículas hidratadas del polímero.
-
La zona 2 se caracteriza por los siguientes estados: estado hinchado del polímero y estado sólido del principio activo. En esta zona, el activo no está en estado molecular, hecho por el cual no se da el proceso de difusión.
-
La zona 3 contiene al polímero hidratado y en estado de gel y representa el punto en el que el activo se disuelve; por tal razón, las zonas 2 y 3 están delimitadas por el frente de difusión. Debido a que en este punto el activo se disuelve, se genera el gradiente de concentración que impulsa la difusión del activo, a través del gel, hacia el exterior del dispositivo. El último frente es el de erosión, en el que se produce la disolución de polímero.
Narasimhan (7) presenta un resumen de las diferentes técnicas experimentales empleadas para estudiar los mecanismos anteriormente mencionados, en los que se incluye el comportamiento de la disolución de los polímeros. Diversos autores han dilucidado diferentes ecuaciones matemáticas, con las cuales pretenden describir los procesos de difusión, hinchamiento y erosión, desde el punto de vista matemático (10, 11).
Interacciones moleculares entre el agua y las matrices de HPMC
El tipo de interacción y las diferentes formas en que se encuentran las moléculas del agua dentro de las tres zonas planteadas anteriormente ha sido tema de estudio y discusión. Aún se debate en relación con la cantidad exacta de agua y a la forma como se encuentra dentro de los geles poliméricos (2, 13). A la hora de optimizar y predecir la liberación del IFA a partir de estas matrices (13), es fundamental disponer de un conocimiento detallado en relación con la capa gel, y más específicamente con las formas como se puede encontrar el agua dentro del mismo. En una matriz hidrofílica, al entrar en contacto con el agua, las primeras moléculas de ésta hidrataran los grupos más polares, conduciendo a la llamada agua ligada primaria (2), la que se encuentra fuertemente unida a los grupos hidrofílicos (13). A medida que los grupos polares se hidratan, se lleva a cabo la relajación de las cadenas del polímero, los grupos hidrofóbicos se exponen y se obtiene así, el agua hidrofóbicamente ligada o agua ligada secundaria. Los tipos de agua ligada primaria y secundaria son casi siempre referidos como agua ligada total (2). Después de que los sitios polares y no polares del polímero hidrofílico han interactuado y ligado con las moléculas de agua, el gel absorbe agua adicional, conducida por la fuerza osmótica de las cadenas de polímero del gel hasta alcanzar la dilución infinita. Como resultado de esto se logra un hinchamiento adicional que conduce a una relajación aún mayor de las cadenas del polímero, dependiendo del peso molecular y de la concentración en la tableta, hasta su posterior erosión. A este efecto se opone la consistencia alcanzada por el gel, razón por la cual el gel llegará a un nivel de hinchamiento de equilibrio. El agua de hinchamiento adicional, que es imbibida después de que los grupos iónicos, polares e hidrofóbicos se saturan con agua ligada, es llamada agua libre (2).
Varios métodos se han empleado para estudiar los diferentes ordenamientos del agua al interior de los geles poliméricos. Estos incluyen: resonancia magnética nuclear (NMR), calorimetría de barrido diferencial (DSC), análisis térmico diferencial (DTA), análisis termogravimétrico (TG), dilatometría y exclusión de soluto (13).
Los estudios de DSC se basan en el supuesto de que únicamente el agua libre puede ser congelada, de manera que el pico endotérmico medido al calentar el gel congelado corresponde a la fusión del agua libre. Además, el valor hallado indica la cantidad de agua libre del gel evaluado. En consecuencia, el agua ligada se obtiene por diferencia entre el contenido de agua total y el agua libre. A manera de ejemplo, Rajabi-Siahboomi y col. encontraron que dos o más eventos térmicos (en el rango de −15°C a 0°C del termograma DSC, Figura 3) antecedían a la señal correspondiente a la temperatura de fusión endotérmica de los geles preparados con HPMC K15M a una concentración entre el 20 y el 35% p/p.
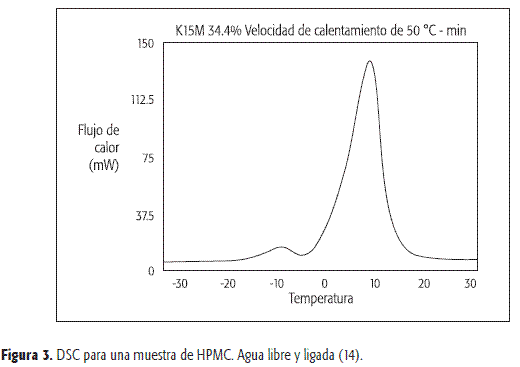
Estos resultados sugirieron la presencia de diferentes tipos de asociación del agua en los geles (14). Es así como la entalpía de transición y la forma del pico en DSC para el agua libre, es igual a la del agua pura. El agua ligada secundaria se caracteriza por tener una temperatura de transición de fase más baja que la del agua pura, debido a la débil interacción con las cadenas del polímero (14).
La naturaleza de estos eventos térmicos, junto con la temperatura más baja del evento endotérmico principal (agua libre), confirman la presencia de más de un estado de agua dentro del gel (15). Se informó que la naturaleza de los eventos térmicos mencionados, diferenciables del evento térmico principal, era dependiente del peso molecular, del tipo de sustitución y de la concentración del polímero, así como de la adición de activo (14).
La espectroscopia dieléctrica de baja frecuencia (LFDS), en apoyo a la técnica de DSC (14), ha sido empleada de igual forma para establecer los diferentes tipos de agua existentes en el polímero. La LFDS involucra la medición del comportamiento dieléctrico en un rango de frecuencia de 10−4 a 107 Hz. De manera simple, esta técnica se puede considerar como una evaluación de las propiedades eléctricas de un material, de cuyos resultados se puede obtener información concerniente a la estructura y elucidar el comportamiento (14). La mayoría de los sistemas farmacéuticos se pueden considerar dieléctricos puesto que con frecuencia están presentes dipolos. La muestra se somete a un campo eléctrico oscilante, de tal forma que los dipolos tratan de reorientarse por sí mismos para mantener la neutralidad. Durante la aplicación del campo oscilante se presenta un espacio de tiempo entre el campo y la polarización de las moléculas del sistema, a medida que se presentan los cambios en la dirección del campo. En la práctica diaria, las respuestas se registran como capacitancia, conductancia y frecuencia. Varios sistemas tipo gel han sido previamente caracterizados empleando LFDS (Binns et al., 1992; Craig et al., 1992, 1994) y el comportamiento del agua en algunos sistemas poliméricos ha sido previamente estudiado mediante el análisis de la respuesta dieléctrica (Pathmanathan and Johari, 1994; Kyritsis et al., 1995).>
El análisis de las respuestas de capacitancia y dieléctrico, a diferentes frecuencias, permite obtener información relacionada con la estructura de la muestra en estudio (14). Por ejemplo, McCrystal y col. encontraron que los espectros de LFDS, de geles de HPMC evaluados a temperaturas entre los −30°C y +20°C, mostraron varias transiciones de fase, como resultado de procesos de fusión que comenzaron a temperaturas cercanas a los 22°C comparadas con agua desionizada a 0°C. Estos eventos fueron relacionados con la presencia de diferentes tipos de agua, fundiendo a distintas temperaturas al interior del gel (14).
La técnica de creación de imágenes por medio de resonancia magnética (MRI) ha sido tal vez una de las de más reciente aplicación para estudiar los procesos de transporte a través de polímeros hidrofílicos hidratados. La NMR ofrece un método poderoso, no-invasivo, para describir gráficamente eventos dentro de formas de liberación controlada. Nos permite observar, seguir y medir procesos importantes como la hidratación y la difusión, que pueden contribuir directamente al proceso de liberación del activo del IFA. Las imágenes se forman a partir de señales de resonancia magnética nuclear generadas por ciertos núcleos (por ejemplo: 1H, 19F, 31P y 13C) al ser expuestos a un campo magnético constante de alta intensidad y a otro campo electromagnético alternante, el cual tiene la característica de tener una radiofrecuencia. Estos núcleos tienen un momento magnético (spin ≠0) y como consecuencia de esto tienden a linearse con el campo magnético aplicado. Posteriormente, al aplicar otro campo electromagnético de radiofrecuencia en sentido ortogonal, se ocasiona una perturbación del alineamiento de los núcleos que hace que absorban cierta energía, la cual es liberada posteriormente una vez se interrumpe el campo electromagnético. Esta liberación de energía es detectada y cuantificada como un voltaje que corresponde a la señal de resonancia magnética nuclear (16), que mediante posterior transformación se plasma en imágenes. Estudios en matrices hidrofílicas por medio de la aplicación de la técnica de MRI han permitido caracterizar y medir:
-
El frente de penetración de agua (17): donde fue posible observar la velocidad del frente de penetración sin que se haya podido correlacionar con la velocidad de liberación del IFA desde la matriz.
-
La distribución espacial y el coeficiente de autodifusión del agua (CAD) (18), donde el CAD es un indicador del movimiento browniano en ausencia de un gradiente de concentración. Estos estudios permitieron concluir que hay un gradiente del valor de CAD que se incrementa progresivamente al alejarse del interior del núcleo seco, encontrándose el valor más alto en la parte más externa de la capa gel donde el valor fue similar al del agua libre. La existencia del gradiente también permitió corroborar el efecto del peso molecular del polímero hidrofílico en la velocidad de liberación del IFA.
-
El hinchamiento del polímero (18), analizando la formación de la capa gel e identificando que ésta tiene un crecimiento significativamente mayor en sentido axial que radial, presumiblemente debido a la liberación de la fuerza de compresión de la tableta. En este estudio tampoco fue posible establecer una relación entre el espesor de la capa gel y la constante de velocidad de liberación del IFA.
La información que arrojaron los estudios con esta técnica permitirá una solución más rápida y efectiva de los problemas asociados a estas formas de liberación, así como a mejorar las estrategias en relación a la formulación de estos sistemas de entrega (16-18).
Modelos matemáticos que estudian la cinética de liberación
Debido a lo anteriormente expuesto y a la alta complejidad de los fenómenos físicos y químicos involucrados, es obvio que no hay un mecanismo de liberación universal que sea valido para toda clase de sistemas basados en HPMC. En atención a esto, en la literatura se han propuesto diferentes modelos para analizar el comportamiento de los perfiles de disolución y tratar de explicarlos, asociándolos a los cambios físicos que presenta el sistema.
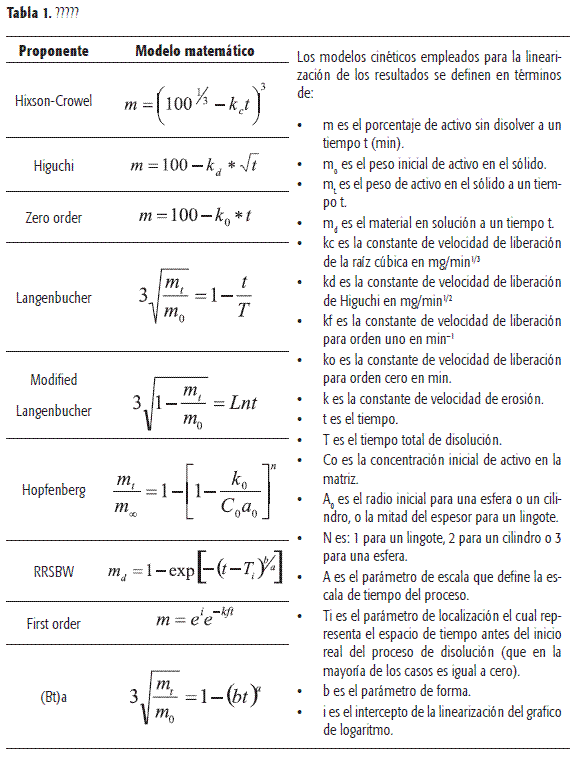
En 1931, Hixson-Crowel presentaron un modelo cinético conocido hoy día como el modelo de la raíz cúbica, para la linearización de los resultados de una disolución in vitro. Luego se presentaron otros modelos como los de Higuchi (basado en la linearización de la raíz cuadrada del tiempo), el modelo de orden cero, el de Langenbucher, el de Hopfenberg, el RRSBW (Rosin-Rammer-Sperling-Bennet-Weibull); también se desarrollaron los modelos de primer orden y de (Bt)a. De acuerdo con Ertan y col. (15), se han obtenido buenas correlaciones in vitro - in vivo, cuando se analizan los datos de liberación del IFA utilizando algunos de los modelos matemáticos planteados por diferentes autores y que se resumen en la Tabla 1.
El modelo de la ley del exponente, presentado en la ecuación 1 y propuesto por Ritger y Peppas (19), permite determinar si tiene lugar o no un proceso de difusión que obedezca a la ley de Fick:

Donde Mt es la cantidad de activo liberado a un tiempo t; Minf es la cantidad de activo liberado después de un tiempo infinito; k es la constante cinética que involucra el análisis de características estructurales y geométricas de la tableta; n es el exponente difusional que depende del mecanismo de liberación del activo y de la forma del dispositivo, bajo prueba matriz hinchable (Ritger y Peppas, 1987).
Para una tableta del tipo matriz hidrofílica (19), los valores de n se explican de la siguiente manera:
-
Valores de n cercanos a 0.5, indican un control en la liberación mediante difusión, denominada liberación Fickiana en la literatura para denotar que sigue la ley de Fick.
-
Valores entre 0.5 < n < 1.0 indican, de acuerdo con este modelo planteado, un transporte anómalo. Esta liberación es denominada no Fickiana, debido a que tanto los procesos físicos de difusión (del soluto en el estado molecular) y relajación- erosión (del polímero) participan activamente en la liberación.
-
Valores de n = 1.0 indican un caso tipo II (relajación-erosión), donde resulta lógico, a partir de la ecuación, que si el exponente es 1 la liberación siga una cinética de orden cero.
Se debe tener presente que los valores extremos de 0.5 y 1.0 son validos para dispositivos que posean una geometría de tipo barra. Los valores correspondientes a geometrías como el cilindro y la esfera se presentan en la Tabla 2. Infortunadamente este hecho no siempre se tiene en cuenta, lo que conduce a una interpretación errónea de los resultados experimentales (6).
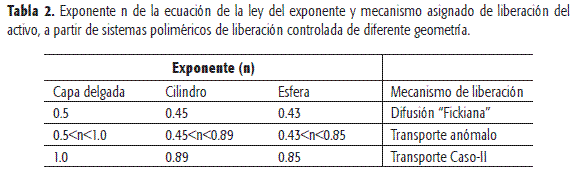
Los valores de n y k se relacionan de manera inversamente proporcional. Un valor muy elevado de k podría indicar un efecto de liberación sin control inicial en la cesión (Burst effect) (21).
Por ejemplo, Rajabi-Siahboomi y col. (22) emplearon el modelo de la ley del exponente para estudiar los procesos de liberación de la clorfeniramina y de la teofilina a partir de matrices hidrofílicas elaboradas con HPMC, que a su vez iban combinadas con: celulosa microcristalina, lactosa spray dried o almidón parcialmente pregelatinizado (PPS). Los resultados mostraron que las diferencias en la liberación de los activos entre tabletas que contenían excipientes conformados por HPMC con lactosa y celulosa microcristalina podían ser atribuidas principalmente a la solubilidad de los excipientes. Se encontraron valores de n que variaron entre 0.54 y 0.81 indicando un transporte anómalo, correspondiente a un control en la liberación por medio de mecanismos de difusión, erosión e hinchamiento. Las matrices que contenían HPMC / lactosa mostraron una liberación de activo más aproximada a un proceso por medio de difusión, comparada con tabletas que contenían HPMC / celulosa microcristalina o HPMC / PPS. Las liberaciones mas retardadas, desde matrices que contenían HPMC / PPS, podían deberse a una penetración más lenta del frente de agua hacia el interior del núcleo de la matriz, de tal manera que las matrices con restricciones de hinchamiento, como ésas, mostraron comportamientos de liberación más aproximados a una erosión. Las tabletas con HPMC / PPS dieron lugar a la formación de geles más concentrados y tortuosos, de tal manera que el camino difusional es más robusto y así, la velocidad de liberación decrece. La existencia de una mayor tortuosidad y un retardo en la penetración del frente de agua se ven reflejados en un valor menor de la constante k para tabletas fabricadas con HPMC / PPS. De acuerdo con la literatura (21), se encontró que efectivamente los valores de n y k se relacionan de manera inversa, y que un valor elevado de k explica una liberación inicial rápida, sin control, apoyando la afirmación de un efecto de liberación masiva sin control inicial (Burst effect).
Otro modelo interesante se presenta en la Ecuación 2, desarrollado por Peppas y Sahlin, quienes consideran de manera aditiva dos fenómenos que controlan la liberación a partir de las matrices hinchables (20).
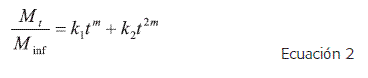
En el modelo de Peppas-Sahlin, el primer término corresponde a la contribución por el fenómeno de difusión, explicada por la ley de Fick, y el segundo término corresponde a la contribución por relajación o caso II. La Ecuación 3 corresponde al acoplamiento de la contribución Fickiana con la no-Fickiana, de una manera lineal, de tal forma que m es el exponente difusional, k1 es la constante difusional y k2 es la constante de relajación. De manera similar a la ley del exponente, la constante m depende de la forma geométrica del dispositivo de liberación.

La Ecuación 3 ha permitido calcular los promedios de ambas contribuciones: la Fickiana (F), correspondiente a la del primer término del lado derecho de la Ecuación 3, y la obtenida por el mecanismo de relajación (R) o del caso II. Por ejemplo, Bettini y col. (23) estudiaron el efecto del peso molecular de la HPMC y la adición de una película de cubierta semipermeable sobre tabletas del tipo matriz hidrofílica de HPMC, que contenían fosfato de piridoxal buflomedil. Los resultados permitieron concluir que el empleo de HPMC de diferentes grados de viscosidad no mostraba efecto alguno en el cálculo de las relaciones R / F, mientras que la presencia de una película semipermeable afectaba de manera significativa el mecanismo predominante en la liberación. Las tabletas no recubiertas mostraron promedios de R / F relativamente bajos, mientras que las tabletas con películas semipermeables exhibieron valores promedios altos, por lo que se demostró que la contribución por relajación es dominante en las matrices hidrofílicas de HPMC.
CONCLUSIONES
De acuerdo con encuestas realizadas desde el año 2000, la tendencia dominante dentro de la industria farmacéutica de innovación para el desarrollo de productos de liberación modificada es el diseño de matrices monolíticas. La HPMC, derivado semisintético de la celulosa, ha sido el vehículo hidrofílico dominante en el diseño de este tipo de forma farmacéutica, debido a su naturaleza no tóxica, a la facilidad de compresión y a la capacidad para acomodar altos niveles de activo.
El modelamiento matemático de los procesos de liberación de los sistemas de liberación modificada contribuye a establecer una base científica para comprender los mecanismos de transporte de masa involucrados en el control de la cesión. Se ha demostrado que si se logra establecer un modelo matemático para un sistema farmacéutico en particular, éste puede ser empleado para simular el efecto de los parámetros del diseño del dispositivo (geometría y composición, entre otros), en la cinética de liberación resultante. En los casos ideales se pueden predecir los parámetros específicos del sistema de liberación controlada, requeridos para alcanzar un perfil de liberación deseado. De esta manera, el modelamiento matemático puede facilitar de manera significativa el mejoramiento de los sistemas de liberación modificada ya existentes o el desarrollo de nuevos.
En la interpretación de datos de liberación modificada no existe un modelo matemático general único que describa todos los procesos físicos y químicos que pueden ocurrir, de tal manera que es crucial identificar o desarrollar una función físico-matemática adecuada para cada sistema de entrega.
Cuando se desarrollan nuevos sistemas de liberación controlada basados en HPMC o se elucidan los mecanismos de liberación a partir de estos sistemas, la elección del modelo matemático apropiado depende en gran medida de, entre otros:
-
Las características del principio activo (solubilidad y dosis).
-
El tipo de excipientes.
-
Clase de diluyente empleado y sus características (excipientes solubles, insolubles e insolubles hidrofílicos).
-
Tipo de HPMC empleada como agente formador de matriz (peso molecular, naturaleza, tamaño de partícula).
-
Proporción activo/polímero.
Se han encontrado y empleado varios mecanismos como efectos osmóticos, magnéticos o eléctricos para el control de la liberación de un IFA en algunos tipos de productos; sin embargo, la difusión, relajación y erosión son los más importantes.
BIBLIOGRAFIA
1. N.V. Majeti N. V. Ravi Kumar and Neeraj Kumar. Polymeric Controlled Drug-Delivery Systems: Perspective Issues and Opportunities. Review article. En: Drug Development and Industrial Pharmacy. 27 No. 1; 1 (2001). [ Links ]
2. A. S. Hoffman. Hydrogels for biomedical applications. En: Advance drug delivery reviews. 43; 3 (2002). [ Links ]
3. C. Kim. Controlled release dosage forms. CRC press 2002. [ Links ]
4. The DOW company. A Bibliography of Pharmaceutical and Medical Uses of Methocel. http://www.colorcon.com [ Links ]
5. D.A. Alderman. A review of cellulose ethers in hydrophilic matrices for oral controlled- release dosage forms. En: International Journal of Pharmaceutical Technology and Product Manufacture. 5, No. 3 (1984). [ Links ]
6. J. Siepmanna, N.A. Peppas. Modeling of drug release from delivery systems based on hydroxypropyl methylcellulose (HPMC). En: Advanced Drug Delivery Reviews. 48; 139 (2001). [ Links ]
7. B. Narasimhan. Mathematical models describing polymer dissolution: consequences for drug delivery. En: Advanced Drug Delivery Reviews. 48; 195 (2001). [ Links ]
8. B. Narasimhan, N.A. Peppas. On the importance of chain reptation in models of dissolution of glassy polymers. En: Macromolecules 29 (1996) 3283-3291. [ Links ]
9. M. Grassi, G. Grassi. Mathematical modelling and controlled drug delivery: Matrix Systems. En: Current Drug Delivery. 2; 97 (2005). [ Links ]
10. P. Colomboa, R. Bettinia, N.A. Peppas. Observation of swelling process and diffusion front position during swelling in hydroxypropyl methyl cellulose (HPMC) matrices containing a soluble drug. En: Journal of Controlled Release. 61; 83 (1999). [ Links ]
11. S. Kiil, K. Dam-Johansen. Controlled drug delivery from swellable hydroxypropylmethylcellulose matrices: model-based analysis of observed radial front movements. En: Journal of Controlled Release. 90; 1 (2003). [ Links ]
12. P. Colombo, R. Bettini, P. Santi, N.A. Peppas. Swellable matrices for controlled drug delivery: gel-layer behaviour, mechanisms and optimal performance. En: PSTT reviews research focus. 3, No. 6 (2000). [ Links ]
13. C.B. McCrystal, J.L. Ford, A. Rajabi-Siahboomi. A study on the interaction of water and cellulose ethers using differential scanning calorimetry. En: Thermochimica, Acta. 294; 91 (1997). [ Links ]
14. C.B. McCrystal, J.L. Ford, R. He b, D.Q.M. Craig b, A. Rajabi-Siahboomi. Characterisation of water behaviour in cellulose ether polymers using low frequency dielectric spectroscopy. En: International Journal of Pharmaceutics. 243, 57 (2002). [ Links ]
15. G. Ertan, H.Y. Karasulu, E. Karasulu, M.A. Ege, T. Kö se, and T. Gü neri. A new in vitro / In vivo kinetic correlation method for nitrofurantoin matrix tablet formulations. En: Drug Development and Industrial Pharmacy, 26, No. 7, 737 (2000). [ Links ]
16. J.C. Richardson, R.W. Bowtell, K. Mader, C.D. Melia. Pharmaceutical applications of magnetic resonance imaging (MRI). En: Advanced Drug Delivery Reviews 57 (2005) 1191- 1209. [ Links ]
17. M. Ashraf, V.L. Iuorno, D. Coffin-Beach, C.A. Evans, L.L. Augsburger. A novel nuclear magnetic resonance (NMR) imaging method for measuring the water front penetration rate in hydrophilic polymer matrix capsule plugs and its role in drug release. En: Pharm. Res. 11 (1994) 733-737. [ Links ]
18. A.R. Rajabi-Siahboomi, R.W. Bowtell, P. Mansfield, M.C. Davies, C.D. Melia. Structure and behavior in hydrophilic matrix sustained release dosage forms: 4. Studies of water mobility and diffusion coefficients in the gel layer of HPMC tablets using NMR imaging. En: Pharm. Res. 13 (1996) 376-380. [ Links ]
19. R.W. Korsmeyer, R. Gurny, E. Doelker, P. Buri, N.A. Peppas, Mechanisms of solute release from porous hydrophilic polymers. En: International Journal of Pharmaceutics. 15; 25 (1983). [ Links ]
20. N.A. Peppas, J.J. Sahlin. A simple equation for the description of solute release: III. Coupling of diffusion and relaxation. En: International Journal of Pharmaceutics. 57; 169 (1989). [ Links ]
21. N.K. Ebube, A. Hikal, C.M. Wyandt, D.C. Beer, L.G. Miller, A.B. Jones. Sustained release of acetaminophen from heterogeneous matrix tablets: Influence of polymer ratio, polymer loading, and co-active on drug release. En: Pharmaceutical Development Technology. 2; 161(1997). [ Links ]
22. M. Levina, A. Rajabi-siahboomi. The influence of excipients on drug release from hydroxypropyl methylcellulose matrices. En: Journal Of Pharmaceutical Sciences, 93, No. 11 (2004). [ Links ]
23. R. Bettini, P. Colombo, G. Massimo, P.L. Catellani, T. Vitali. Swelling and drug release in hydrogel matrices: polymer viscosity and matrix porosity effects. En: European Journal of Pharmaceutical Sciences. 2 ; 213 (1994). [ Links ]














