Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Químico - Farmacéuticas
versão impressa ISSN 0034-7418versão On-line ISSN 1909-6356
Rev. colomb. cienc. quim. farm. v.37 n.2 Bogotá jul./dez. 2008
Artículo Técnico
Evaluación microbiológica de la desinfección en unidades odontológicas (estudio piloto)
Microbiological evaluation of the disinfection in dental units (pilot study)
Sonia J. Gutiérrez C.1, Diana C. Dussán1, Silvia C. Leal B.1, Adriana Sánchez G.1
1 Dirección Nacional de Investigaciones, Universidad Antonio Nariño, Universidad Nacional de Colombia, Universidad Colegio Mayor de Cundinamarca. Correo electrónico: sjgutierrezc@unal.edu.co; sjgutierrezc@gmail.com
Recibido para evaluación: junio 16 de 2008 Aceptado para publicación: septiembre 22 de 2008
RESUMEN
La presente investigación, de interés en salud pública en el área de Odontología, evaluó la acción de tres desinfectantes (glutaraldehído, hipoclorito de sodio y cloruro de benzalconio) frente a superficies susceptibles con mayor contaminación bacteriana en unidades dentales de uso continuo, comparando la población bacteriana antes y después de la desinfección. Se seleccionaron tres superficies (jeringa triple, testera de la silla, escupidera) por medio de cuestionarios al personal de las clínicas odontológicas de la Universidad Antonio Nariño - Sede Sur. Los microorganismos encontrados fueron similares para todas las unidades dentales, con prevalencia de Gram negativos no fermentadores en mayor proporción, seguido de fermentadores, Gram positivos y esporulados. Se logró la mayor eliminación de microorganismos por el protocolo de desinfección con glutaraldehído al 2%, seguido de hipoclorito de sodio al 0,5 % y cloruro de benzalconio al 1%.
Palabras clave: contaminación bacteriana, desinfectantes, consulta dental.
ABSTRACT
The present research evaluated the action of three disinfectants (glutaraldehyde, sodium hypochlorite and benzalconic chloride) in front of susceptible surfaces with more bacterial contamination in dental units of continuous use, comparing the bacterial population before and after the disinfection, of interest in health publishes in the area of Dentistry. Three surfaces were selected (it squirts triple, front of the seat, spittoon) by means of questionnaires to the personnel of the clinical dentistry of the University Antonio Nariño South Headquarters. The microorganisms found were similar for all dental units, with prevalence of Gram negative not fermentadors in greater proportion, followed by fermentadors, Gram positive and sporulade. There was the largest removal of microorganisms by the protocol of disinfection with glutaraldehyde to 2%, followed by sodium hipochloride to 0.5% and benzalconic chloride to 1%.
Key words: bacterial contamination, disinfectants, dental surgeries.
INTRODUCCIÓN
El riesgo de infección para el paciente y el personal de salud siempre está presente en la práctica clínica, en especial en la consulta odontológica, dado que muchas de las infecciones pueden ser transmitidas por sangre o saliva en forma directa o indirecta, por medio de gotas, aerosoles, instrumentos y equipos contaminados. Se sabe que muchos agentes infecciosos, si se presentan en alto número, pueden sobrevivir durante varios días cuando se encuentran asociados con fluidos biológicos que contienen proteínas (1, 2). La infección cruzada es, en particular, el mayor riesgo de infección para todos los que laboran allí en caso de presentar lesiones o heridas abiertas en la superficie corporal, especialmente para aquellos pacientes que se encuentran inmunosuprimidos. Para el control de este tipo de infecciones existen entidades mundiales como: Occupational Safety and Health Administration (OSHA), Enviromental Protection Agency (EPA), Center for Disease Control and Prevention (CDC), American Dental Association (ADA) y Office Safety and Asepsis Procedure Research Foundation (OSAP), que hacen las recomendaciones necesarias y normatizan los procesos que se involucran en odontología (3, 4, 20, 44, 45, 47).
En equipos como las unidades dentales existen zonas de mayor susceptibilidad a contaminación continua. Estas zonas pueden estar hechas de moléculas orgánicas e inorgánicas que conforman sistemas que pueden alojar poblaciones heterogéneas de microorganismos, algunos de ellos patógenos oportunistas para el humano (2, 7, 17-20).
Si estos microorganismos no se remueven o eliminan, pueden llegar a formar biopelículas en las superficies de equipos dentales y líneas de agua, como parte de su estrategia de supervivencia y adaptación al medio ambiente, adhiriéndose y colonizando dichas superficies (5-16). La presencia de biopelículas en la práctica dental ha sido relacionada años atrás con infecciones de tipo nosocomial (2, 14). Existen procedimientos que al ser utilizados adecuadamente garantizarían una reducción o eliminación de los microorganismos presentes en las superficies. La desinfección es uno de ellos y su finalidad es la destrucción de microorganismos que permanecen en las superficies después de la limpieza. El proceso de desinfección requiere el empleo de sustancias activas químicamente que causen inhibición o muerte de las células microbianas. En el campo de la odontología se utilizan con frecuencia desinfectantes como los compuestos clorados, los fenoles, las sales de amonio cuaternario y los aldehídos, entre otros (21).
Esta variedad de agentes químicos se encuentran descritos como desinfectantes de superficies y sólo los productos registrados como desinfectantes hospitalarios por la Agencia para la Protección Ambiental de los Estados Unidos (United States Environmental Protection Agency, EPA) son seleccionados para los protocolos de desinfección en la operatoria dental (22). Un desinfectante ideal se caracteriza por poseer amplio espectro de acción antimicrobiana en poco tiempo, presentar mínima toxicidad, no dañar las superficies sobre las cuales se aplica, tener efecto residual, funcionar en superficies con restos de carga biológica, ser de uso fácil, presentar poco olor y ser de bajo costo (21, 23).
El presente trabajo tuvo como objetivo evaluar la acción de tres desinfectantes odontológicos (glutaraldehído, hipoclorito de sodio y cloruro de benzalconio) frente a superficies susceptibles con mayor contaminación microbiana en unidades dentales de uso continuo en las clínicas odontológicas de la sede sur de la Universidad Antonio Nariño.
METOLOGÍA
Población y sitio de estudio. El estudio se llevó a cabo en las clínicas odontológicas de la Universidad Antonio Nariño (sede sur) en la ciudad de Bogotá, las cuales cuentan con 26 unidades dentales en total, todas en uso continuo. Para la recolección de las muestras en las unidades dentales se tomaron los siguientes criterios de selección: 26 unidades dentales de las clínicas odontológicas de la Universidad Antonio Nariño (sede sur), seleccionando aleatoriamente por el método de tómbola o balotas, 9 de estas unidades, lo que corresponde al 30%, realizada los días martes y viernes en la jornada de la mañana. La población atendida en las clínicas correspondió a pacientes adultos.
Entrevistas con el personal de salud. A estudiantes de odontología, funcionarios que laboran en el aseo, desinfección y esterilización de las clínicas se les sometió a un cuestionario con el fin de identificar los protocolos de limpieza, desinfección y esterilización que se manejaban, por medio del cual se identificaron las superficies de las unidades dentales donde se encuentra mayor riesgo de contaminación según el criterio de los encuestados. De los cuestionarios se analizaron los siguientes parámetros: materiales e instrumentos utilizados para el proceso de limpieza y desinfección dentro de las clínicas, sistemas de protección en bioseguridad, frecuencias de desinfección durante el trabajo en las clínicas, procedimientos realizados y técnicasusadas para el proceso de limpieza, desinfección y esterilización, superficies más susceptibles a contaminación.
Superficies de las unidades dentales (UD) seleccionadas. Como resultado de las entrevistas realizadas al personal que labora en las clínicas odontológicas, y a criterio de ellos, se identificaron tres áreas o superficies con mayor susceptibilidad a contaminación durante los procedimientos odontológicos, las cuales fueron: la escupidera, la jeringa triple y la parte superior del sillón de la unidad dental (testera).
Agentes antimicrobianos a evaluar, características y uso. Los desinfectantes seleccionados fueron: glutaraldehído al 2% pH ácido, lote ≠612018, marca comercial Glutfar®, tiempo de exposición para realizar el proceso de desinfección: cinco minutos, cuya fecha de vencimiento era diciembre de 2010; hipoclorito de sodio al 5%, lote ≠ 612022, marca comercial Zonifar® - 5, tiempo de exposición para realizar el protocolo de desinfección: cinco minutos, preparándolo al 0,5%, con fecha de vencimiento en diciembre de 2009; y cloruro de benzalconio al 1% USP, amonio cuaternario, lote ≠ 609052, marca comercial Benclofar®, tiempo de exposición para realizar el protocolo de desinfección: cinco minutos, con fecha de vencimiento en diciembre del año 2010. Se realizó el protocolo de desinfección durante tres meses, dos veces por semana (martes y viernes). La forma de aplicación fue por aspersión y frotación. Todos estos agentes químicos fueron suministrados por Laboratorios Eufar S.A. de Bogotá, adquiridos en forma comercial y preparados de acuerdo con las recomendaciones del distribuidor. En las unidades dentales de las clínicas el personal de aseo realizó el proceso de limpieza en el cual los investigadores no participaron.
Selección de la muestra. Se tomaron 26 unidades dentales de las clínicas odontológicas de la Universidad Antonio Nariño (sede sur) y se incluyeron aleatoriamente nueve de ellas por el método de tómbola o balotas, lo cual corresponde al 30% de las unidades. La toma de las muestras para procesamiento microbiológico se llevó a cabo los días martes y jueves en horas de la mañana. También de manera aleatoria se seleccionaron 3 unidades dentales para evaluar cada desinfectante, así: para el desinfectante 1 (amonio cuaternario al 1%) se seleccionaron las unidades enumeradas con los números 07, 09 y 10; para el desinfectante 2 (hipoclorito de sodio al 0,5%), las unidades identificadas con los números 01, 02 y 05, y para el desinfectante 3 (glutaraldehído al 2%) las unidades numeradas con los números 14, 17 y 25.
Recolección y procesamiento de muestras. En las 9 unidades seleccionadas se tomaron muestras de las superficies ya mencionadas, antes y después de la desinfección con el agente químico seleccionado para cada unidad dental. Las muestras fueron tomadas del centro a la periferia de la superficie con hisopos estériles humedecidos con caldo infusión cerebro corazón con 6% Tween 80 v/v como agente neutralizante (BHI) (55), almacenadas y transportadas a 4°C en tubos de tapa rosca siguiendo las recomendaciones de Tuttlebee C., M. et al, 2002 (18). Las muestras se preincubaron a 37 °C durante 24 horas. El crecimiento o turbidez en cada uno de los tubos fue determinado al tomar la densidad óptica (DO) por espectrofotómetro, a una longitud de onda de 625 nm. La DO obtenida fue comparada con la escala de MacFarland a la dilución # 5 equivalente a 1X108 UFC/ml. Las muestras fueron diluidas seriadamente, tomando 10-5 y 10-6, sembradas en placas de agar BHI por duplicado e incubadas a 37° C durante 48 horas para realizar el recuento de microorganismos expresado en unidades formadoras de colonia (UFC). Para este procedimiento se utilizó contador de colonias digital.
Aislamiento e identificación de la población microbiana. Las colonias recuperadas y contadas en agar BHI fueron descritas por su morfología macroscópica, realizando coloración de Gram. Posteriormente fueron resembradas en agar sangre, agar MacConkey, agar BHI, agar Sabouraud e incubadas a 37° C durante 48 horas en aerobiosis. Se efectuó prueba de catalasa, oxidasa y determinación del patrón de hemólisis. Una vez caracterizadas de esta forma, se identificaron por pruebas bioquímicas automatizadas (Crystal Gram positivos, Crystal Gram negativos fermentadores y no fermentadores de Becton Dickinson®).
Test del coeficiente fenólico y CMI. A los desinfectantes se les realizó el test de coeficiente fenólico, en el cual se observó la actividad microbiológica comparada con la del fenol al 5% frente a cuatro cepas de referencia Staphylococcus aureus, Salmonella sp, Pseudomonas aeruginosa y Bacillus cereus, y se determinó su concentración mínima inhibitoria (CMI), capaz de impedir la multiplicación de cada microorganismo in vitro (66).
Análisis estadístico. La presente investigación fue desarrollada bajo un diseño estadístico multivariado de medidas repetitivas y análisis de datos longitudinal. El análisis estadístico se realizó en los programas SPSS 12.1® y el Minitab 14® usado para presentar los cálculos, las pruebas de distribución normal y varianzas. El total de las unidades dentales en las clínicas odontológicas de la sede fueron 26, las cuales cumplían con los criterios de inclusión para intervenir en el estudio. De ellas se tomaron 9 unidades que representan un 34,61% de la población total.
Aspectos éticos. El presente estudio fue presentado y avalado ante el Comité de ética y la Dirección Nacional de Investigaciones de la Universidad Antonio Nariño. La investigación utilizó superficies de las unidades dentales en las cuales se hizo un proceso de desinfección sin modificar las condiciones de las mismas ni poner en riesgo la integridad de los pacientes que se atendieron allí. Se obtuvieron muestras de tres superficies de las unidades para recuperar la carga microbiana que se encontrara presente antes y después del protocolo de desinfección; por tanto, se clasificó como de no riesgo para la salud e integridad del ser humano.
La investigación involucró procedimientos con microorganismos patógenos, para lo cual se contó con adecuada infraestructura, normas y procedimientos según lo reglamentado, garantizando un manejo seguro de estos patógenos y cumpliendo con lo descrito por la resolución número 8430 del 4 de octubre de 1993, artículos 11 y 63, por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud.
RESULTADOS Y DISCUSIÓN
Encuestas. De acuerdo con la población interrogada por medio del cuestionario, las superficies susceptibles a mayor contaminación de las unidades dentales en las clínicas odontológicas de la Universidad Antonio Nariño (sede sur) fueron: jeringa triple (37%), escupidera (32,6%), testera (18,4%) y otras superficies (12%).
Microorganismos hallados antes y después del protocolo de desinfección. Los microorganismos hallados en las superficies antes y después del protocolo de desinfección se representan en las Figuras 1 y 2.
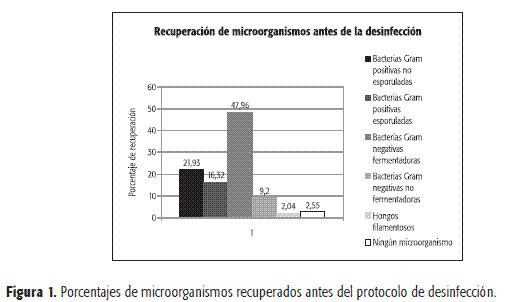
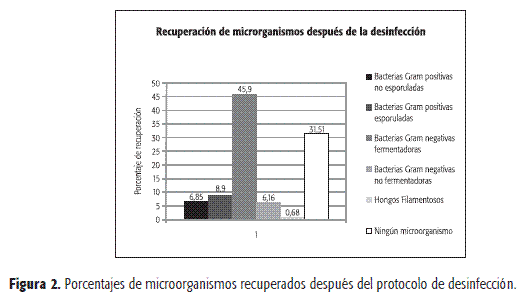
Para establecer las diferencias estadísticas entre los tres desinfectantes se utilizó la prueba de Kruskall-Wallis. Al realizar esta prueba se concluyó que hay diferencias entre los desinfectantes con una significancia del 50,007. En la Figura 3 se evidencia que el desinfectante que manifestó una mejor acción antimicrobiana fue el 3 (glutaraldehído al 2%), contrario con el desinfectante 1(cloruro de benzalconio al 1%), el cual no disminuyó significativamente a los microorganismos.
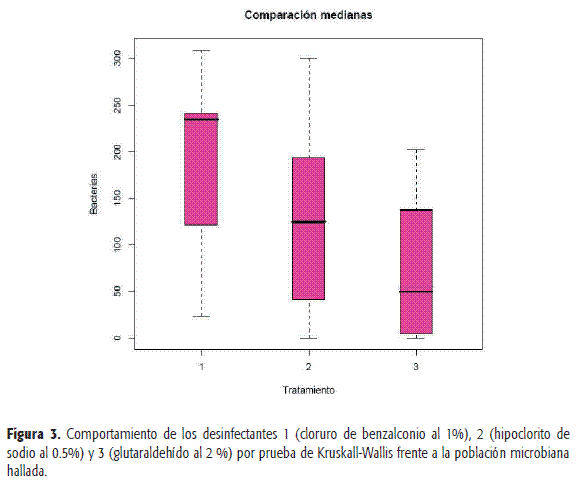
A continuación se presentan los resultados de acuerdo con las superficies (testera, jeringa triple y escupidera) de las unidades dentales evaluadas y la acción de los desinfectantes 1, 2 y 3 sobre los microorganismos encontrados (Figura 4: a, b y c).

En general, los desinfectantes ejercen su acción disminuyendo la carga microbiana. Por superficie, en la escupidera y la testera el desinfectante o tratamiento 3 ejerce una mayor acción respecto a los otros dos desinfectantes; en la jeringa, el tratamiento 1 es el que mejor se comporta. Sin embargo, el desinfectante 3, después de su aplicación, resalta su baja variabilidad en el conteo.
Análisis de medidas repetitivas
Dado que el experimento se realizó durante cinco semanas (medidas en el tiempo), se realizó un modelo multivariado en donde se evaluó si el efecto del desinfectante es significativo en este período, para lo cual se tomó la diferencia del número de microorganismos antes y después de aplicado el desinfectante. Se observó que al transcurrir el tiempo no se encontraba un conteo similar de microorganismos. Para validar este resultado se probó el supuesto de homocedasticidad mediante la prueba de box (Tabla 1).
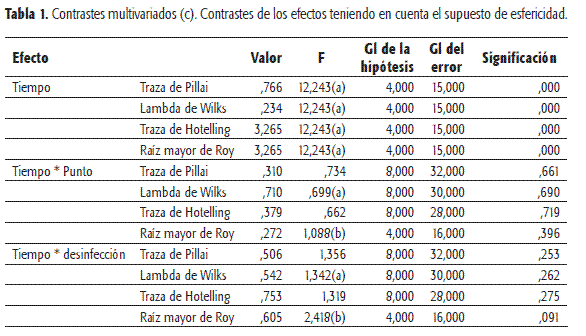
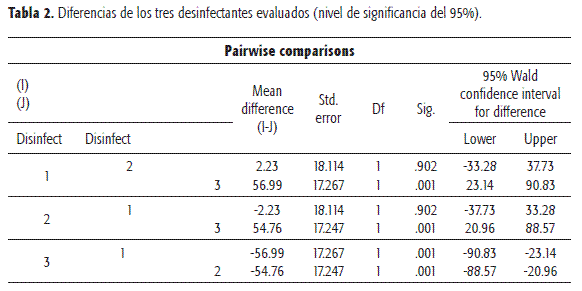
Dado que no se tiene normalidad en los datos, se llevó a cabo un análisis de datos longitudinales por medio de las ecuaciones de estimación generalizada (GEE), utilizando como variable respuesta la distribución Poisson. Se realizaron las comparaciones (dos a dos) de los desinfectantes, mostrando que no hay diferencias significativas entre los desinfectantes 1 y 2, caso contrario al desinfectante 3 observado en la Tabla 2.
Coeficiente fenólico. Los resultados de la prueba de coeficiente fenólico indican que tanto el glutaraldehído al 2%, el hipoclorito de sodio al 5% y el cloruro de benzalconio al 1% muestran un índice fenólico menor o igual a 1.
Concentración mínima inhibitoria (CMI). La CMI del glutaraldehído al 2% frente a S. aureus fue de 3,9 mg/l; Salmonella spp., 3,9 mg/l; Pseudomonas aeruginosa, 7,8 mg/l; Bacillus cereus, 7,8 mg/l.
La CMI del hipoclorito de sodio al 5% frente a S. aureus fue de 4,8 mg/l; Salmonella spp., 4,8 mg/l; Pseudomonas aeruginosa, 19,53 mg/l; Bacillus cereus, 4,88 mg/l.
La CMI del cloruro de benzalconio al 1% frente a S. aureus fue de 1,9 mg/l; Salmonella spp., 1,9 mg/l; Pseudomonas aeruginosa, 3,9 mg/l; Bacillus cereus, 1,9 mg/l.
DISCUSIÓN
De acuerdo con los resultados del presente estudio, se comprobó que el glutaraldehído al 2% fue el desinfectante que mostró la mejor acción. En cuanto al comportamiento de los desinfectantes, el cloruro de benzalconio al 1% y el hipoclorito de sodio al 0.5% fue muy similar.
Al analizar la acción de cada desinfectante por superficie frente a los microorganismos encontrados, se tiene que el glutaraldehído al 2% (dialdehído desinfectante de alto nivel) tiene la propiedad que a temperatura ambiente es esterilizante y desinfectante con un amplio espectro de acción y no inactivado por la materia orgánica (57, 63), lo cual confirma su comportamiento en este estudio. Se observó que el glutaraldehído al 2% en general disminuyó a todos los microorganismos presentes, pero el mayor efecto lo ejerció frente a las bacterias Gram positivas no esporuladas, independiente de la superficie. McDonnell y Col 1999 (56), en su estudio sobre los mecanismos de acción de varios antisépticos y desinfectantes, argumentan que el glutaraldehído es altamente efectivo sobre bacterias Gram positivas y Gram negativas. En el presente estudio se demuestra su eficiencia frente a las Gram positivas más que en Gram negativas, sin olvidar que es el desinfectante más efectivo de los aquí evaluados. Así mismo, como el hipoclorito de sodio, este desinfectante es más efectivo en condiciones óptimas de limpieza, evitando el deterioro del material de la superficie (55), razón que podría justificar su baja acción frente a los otros microorganismos existentes en estas superficies. Los datos brindados por la CMI en el caso del glutaraldehídoal 2% muestran que, dependiente del tipo de microorganismos y de sus factores de virulencia, sigue mostrándose como un muy buen desinfectante. El hipoclorito de sodio al 0,5% muestra la segunda mejor opción en desinfección.
Frente a superficies como la escupidera y la jeringa, disminuyó la carga microbiana de bacterias Gram positivas y eliminando totalmente a las bacterias Gram negativas no fermentadoras. Con estos resultados se evidencia que aunque no fue tan alta su eficiencia, es un buen desinfectante. Su baja acción en este estudio se podría justificar porque este desinfectante puede perder su efecto a pH bajo y frente a superficies con presencia de materia orgánica y otros compuestos interferentes (56). Los datos arrojados por la CMI confirman que su acción a diferentes microorganismos es menor que la del glutaraldehído a los cinco minutos de exposición, siendo necesario utilizarlo a un tiempo al aquí evaluado.
En cuanto al cloruro de benzalconio al 1%, compuesto de amonio cuaternario fácilmente neutralizado por la materia orgánica, jabón y agua dura, se describe que carece de actividad esporicida y que se puede contaminar con micobacterias (57-58, 60-61, 63), razones por las cuales no se recomienda su uso para desinfectar instrumental quirúrgico. En el presente estudio, este desinfectante reveló un comportamiento variable dependiente de la superficie y del microorganismo. Frente a las bacterias Gram positivas tiene un acción aceptable, pero no lo suficientemente efectiva para eliminar por completo estos microorganismos. La acción contra las bacterias Gram negativas es la menor entre los tres desinfectantes evaluados. Rueda y Col en 2003 (59) compararon la actividad antimicrobiana del cloruro de benzalconio con otros compuestos de amonio cuaternario, determinando que estos desinfectantes presentan una mayor acción frente a microorganismos Gram positivos que a Gram negativos, coincidiendo con lo hallado.
Se ha encontrado que algunas especies Gram negativas son más sensibles que otras frente a los amonios cuaternarios; es así como la E. coli es mucho más sensible que la P. Aeruginosa (56). En la testera, el cloruro de benzalconio mostró una buena eliminación de microorganismos Gram positivos. En la CMI mostró una acción aceptable in vitro, lo cual hace necesario que se reevalúe su actividad frente a los Gram negativos por otras técnicas para aclarar lo expuesto.
Al analizar cada desinfectante se puede deducir que su efectividad dependerá de posibles factores que pueden interferir en su objetivo, entre los que se encuentran: la limpieza, factor crucial, ya que remueve carga microbiana y materia orgánica disminuyendo su cantidad (55, 57, 58, 60-63); el tiempo de exposición para con cada uno de los desinfectantes: aquí fue de cinco minutos, tiempo que recomienda la casa comercial que los provee y el que usan en las clínicas, que podría ser más prolongado para una mayor eficiencia; el número de microorganismos encontrados en diferentes superficies, condición que estaría dificultando su eliminación en la presente investigación, también descrito por Prince J et al en 1975 y Gordon AM; la concentración utilizada podría aumentar como en el caso del hipoclorito de sodio, que según la presente investigación no muestra la mayor eficiencia pero no se descartaría su utilización, sino que se recomendaría utilizar a una concentración mayor; y por ultimo, el tipo de material de la superficie que interfiere en la acción de los desinfectantes.
Respecto a la población microbiana, se observa que la contaminación fue heterogénea en todas las superficies. Algunos de los microorganismos también fueron identificados por otros autores, que incluyeron en sus estudios unidades dentales y sus fuentes de agua (1, 2, 7, 14-16). A la luz de los resultados, se aprecia que al realizar el protocolo de desinfección se evidenció una mayor eliminación de cocos Gram positivos tipo Staphylococcus sp. y Streptococcus oralis, y bacilos esporulados tipo Bacillus spp., en muy bajo porcentaje de cocobacilos y bacilos Gram negativos fermentadores, no fermentadores y hongos. Esta contaminación microbiana podría atribuirse a la contaminación ambiental en las clínicas, previamente descrita (2, 46).
Además de esto, es importante tener en cuenta los mecanismos de resistencia y los procesos de adaptación fisiológica que exponen los microorganismos, conllevando la formación de biopelículas que pueden dificultar el acceso y, por ende, la acción de los desinfectantes (57). Lo descrito por Tachikawa M. et al. en 2005 en su estudio acerca de la resistencia de las biopelículas frente a la acción de los biocidas o desinfectantes dependerá del porcentaje de viabilidad celular dentro de éstos (26). Así mismo, la densidad del complejo celular dentro de los biopelículas causadas por los nutrientes y las toxinas dentro de éstos, no permite el paso de los desinfectantes (27). Es importante resaltar que todos los microorganismos necesariamente forman biopelículas sobre superficies específicas y que en algunas de estas superficies se pueden encontrar sustancias que pueden actuar como neutralizantes de los desinfectantes (57).
En la presente investigación se identificaron también microorganismos esporulados. Esta forma bacteriana es una barrera permeable para algunos compuestos e indestructible para algunos desinfectantes. Otros organismos hallados, como los hongos filamentosos, poseen resistencia intrínseca a algunos compuestos de amonio cuaternario debido a que su pared celular dificulta el acceso de estos compuestos al sitio blanco.
En conclusión, este estudio demuestra que no son eficientes los procesos que se llevan a cabo actualmente, por lo que se recomendaría la utilización de los desinfectantes glutaraldehído e hipoclorito de sodio a una mayor concentración y tiempo de contacto que los evaluados.
El glutaraldehído, que demostró la mayor eficiencia en el estudio y como se describe en la mayoría de las investigaciones en las que involucran a este compuesto, es un eficaz desinfectante y esterilizante, por lo cual se propone su uso con las debidas precauciones para su manipulación. En cuanto al cloruro de benzalconio, no se puede recomendar su uso puesto que no reduce a los Gram negativos, en su mayoría microorganismos nosocomiales, lo que representa un riesgo para el personal de salud y los pacientes.
AGRADECIMIENTOS
A la Dirección Nacional de Investigaciones de la Universidad Antonio Nariño y la Facultad de Odontología, por el soporte financiero y de infraestructura para el desarrollo del presente trabajo; a los profesores Dr. Milton Crosby y Dra. Pilar Meléndez, de la Facultad de Ciencias, Departamento de Farmacia de la Universidad Nacional de Colombia; Dra. Angélica Knudson, docente de Microbiología de la Universidad Nacional de Colombia; al Dr. Julián Gallón, coordinador de Ciencias Básicas de la Universidad Antonio Nariño, y a Wilmer Martínez, estudiante de Maestría de Estadística de la Universidad Nacional de Colombia por sus asesorías y apoyo.
BIBLIOGRAFÍA
1. M. Matsuyama, T. Usami, K. Masuda, N. Niimi, M. Ohta y M. Ueda. "Prevention of infection in dental procedures". J of Hospital infection. 1997; 35: 17-25. [ Links ]
2. S. Monarca, M. Grottolo, D. Renzi, C. Paganelli, P. Sapelli, I. Zerbini y G. Nardi. "Evaluation of environmental bacterial contamination and procedures to control cross infection in a sample of italian dental surgeries". Occup Environ Med 2000; 52: 721-726. [ Links ]
3. M. Ozcan, Y. Kulak y E. Kazazoglu. "The effect of disinfectant agents in eliminating the contamination of dental unit water". J Oral Rehabilitation. 2003; 30: 290-294. [ Links ]
4. Y. Toshiaki, S. Imazato y S. Emisu. "Inhibitory effect of PVDF tubes on Biofilm formation in dental unit waterlines. Dent Materials. 2005; 21: 780-786. [ Links ]
5. I. Lasa, J. Del Pozo, J. Penades y J. Leiva. "Biofilms bacterianos e infección". An Sist Sanit.Navar. 2005; 28 (2): 163-175. [ Links ]
6. Jefferson K. "What drives bacteria to produce a biofilm? FEMS Microbiology Letters. 2004: 236; 163-173. [ Links ]
7. J. Walker y P. Marsh. "A review of biofilms and their role in microbial contamination of dental unit water systems (DUWS)". International Biodeterioration & Biodegradation. 2004; 54: 87- 98. [ Links ]
8. P. Overman. "Biofilm: A new view of plaque". J Contemporary Dent Practice. 2000; 1(3): 1-8. [ Links ]
9. L. Prescott, J. Harley y D. Klein. Microbiología. Ed. McGraw-Hill Interamericana, Madrid, 2004, 5a. edición, 1240 p. [ Links ]
10. G. O´Toole. "Biofilm formation: as microbial development". Annu. Rev. Microbiol. 2000. 54:49-79. [ Links ]
11. R. Donlan. "Role of biofilm in antimicrobial resistance". ASAIO J 2000; 46: S47- S52. [ Links ]
12. D. Steinberg y S. Eyal. "Initial biofilm formation of Streptococcus sobrinus on varius orthodontics appliances". J Oral Rehabilitation 2004; 31: 1041-1045. [ Links ]
13. K. Jefferson. Op. cit. [ Links ]
14. T. Meiller, L. Depaola, J. Kelley, A. Baqui, B. Turng y J. Falkler. "Dental units waterlines: biofilms, disinfection and recurrence". JADA 1999: 130; 65-72. [ Links ]
15. S. Mills. The dental unit waterline controversy: defusing the myths, defining the solutions". JADA 2000: 131; 1427-1440. [ Links ]
16. B. Rowland y N. Voomeesville. Bacterial contamination of dental unit waterlines. What your dentist spraying into your mouth? Clin Microbiol Newsletter. 2003; 25 (10)73-77. [ Links ]
17. L. Montebugnoli, S. Chersoni, C. Prati y G. Dolci. "A between patient disinfection method to control water line contamination and biofilm inside dental units". J hospital infection. 2004; 56: 297-304. [ Links ]
18. C. Tuttlebee, M. O´Donnell, C. Keane, R. Rusell, D. Sullivan, F. Falkiner y D. Coleman. "Effective control of dental chair unit waterline biofilm and marked reduction of bacterial contamination of output water using two peroxide based disinfectants". J Hospital Infection 2002: 52; 192-205. [ Links ]
19. J. McDowell, D. Paulson y J. Mitchel. "A simulated use evaluation of a strategy for preventing biofilm formation in dental unit´s waterlines". JADA 2004; 135: 799-805. [ Links ]
20. J. Barbeau, M. Gauthier y P. Payment. "Biofilms, infectious agents and dental unit waterlines: a review". Canadian J Microbiol 1998; 44(11): Health & Medical Complete 1019-1029. [ Links ]
21. R. Bebermeyer, S. Dickinson y L. Thomas. "Personnel health elements of infection control in dental health care setting a review". Dent Assist 2006 75 (6): 37-38, 42 43 passim. [ Links ]
22. C. Palenik. Control de la infección y manejo de materiales peligrosos para el equipo de profesionales de la salud dental. Ed. Mosby, 2a. Edición. Pub. Harcourt, 2000, pp. 83-192. [ Links ]
23. Surface disinfectant reference chart 2008. URL: http://www.osap.org/displaycommon [ Links ]
24. M. Conde. Esterilización en Odontología, 2005. URL: http://www.mpsp.org/mpsp/Documentos/Esteriliz/Odonto.pdf. [ Links ]
25. El método correcto para el tratamiento del instrumental en la práctica odontológico, Alemania, 3a. edición, 2005. URL: http://www.a-k-i.org/pdf/gbes05.pdf. [ Links ]
26. M. Tachikawa, M. Tesuka, M. Morita, K. Isogai y S. Okada. "Evaluation of some halogen biocides using a microbial biofilm system". Water Research ,2005: 39; 4126-4132. [ Links ]
27. J. Chapman. "Disinfectant resistance mechanisms, cross resistance, and co-resistance". Internacional Biodeterioration Biodegradation, 2003:51; 271-276. [ Links ]
28. M. Gordon. "Observations on a new disinfectant". J Clin Path 1969; 22:496-500. [ Links ]
29. L. Jatzwauk y B. Reitemeier. "A pilot study of three methods for reduction of bacterial contamination of dental unit water systems in routine use". Int J Environ Health 2002: 204; 303-308. [ Links ]
30. S. Chambers, B. Peddie y A. Pithie. "Ethanol disinfection of plastic-adherent microorganism". J Hosp Inf 2006; 63:193-196. [ Links ]
31. A. Smith, J Baqq y J Hood. "Use of chlorine dioxide to disinfect dental unit waterlines". J Hosp Inf, 2001, 49: 285-288. [ Links ]
32. N. Porteus, S. Redding y J. Jorgenseng. "Isolation of non TBC mycobacteria in treated dental unit waterlines". Oral surg Oral Med Oral Pathol Oral Radiol Endod, 2004; 98: 40-44. [ Links ]
33. A. Acosta, J. Rueda y L Sanchez. "Sporocidal activity in liquid chemical products to sterlilize or high level disinfectant medical and dental instruments". American J Infect Control 2005: 33 (5): 307-309. [ Links ]
34. L. Henoun, H. Becker, J. Harno, M. Bientz y O. Menuier. "Effect of paracetic acid and aldehyde disinfectants on biofilm". J Hosp infection, 2004 58:151-154. [ Links ]
35. Valoración de desinfectantes. Evaluación de actividad bacteriostática. 2007. URL: www. edicion-micro.usal.es/web/educativo/m-especial/15bprincipal.htm,2007. [ Links ]
36. S. Henao, C. Sierra y J. Gaitán. "Actividad bactericida del ácido hipocloroso". Rev Facultad de Medicina Universidad Nacional de Colombia, 2003; 51(3): 136- 142. [ Links ]
37. D. Adams, M Quayum, T. Worthington, P. Lambert y T. Elliot. "Evaluation of 2% chlorhexidine gluconate in 70% isopropyl alcohol skin disinfectant". J Hospital Infection, 2005: 61; 287-290. [ Links ]
38. E. Emmanuel, K. Hanna, C. Bazin, G. Keck, B. Clement y Y. Perrodin. "Fate of glutaraldehyde in hospital wastewater and combined effects of glutaraldehyde and surfactants on aquatic organisms". Environment International, 2005: 31; 399-406. [ Links ]
39. A. álvarez, E. Espigares y R. Gálvez. "Valoración de desinfectantes. Método de dilución-neutralización". Higiene y sanidad ambiental, 2001; 1: 1-5. [ Links ]
40. Secretaria Distrital de Salud de Bogotá. Guías para la prevención, control y vigilancia epidemiológica de infecciones intrahospitalarias. Bogotá, Esfera Editores, junio de 2000. [ Links ]
41. Enciclopedia de Tecnología Química. Ed. Hispanoamericana, México D.F, tomo IV, 1962. [ Links ]
42. G. Remington. Farmacia, tomo 2, Ed. Médica Panamericana, Madrid, España, 19a. edición, 1995, 1500 p. [ Links ]
43. L. Vidal. Sociedad Venezolana de Microbiología, Capítulo Sucre, XXIX Jornadas Venezolanas de Microbiología. Cumaná, Venezuela, 2005. [ Links ]
44. W. Rutala y D. Weber. "Healthcare infection control practices advisory committee". Guideline for disinfection and sterilization in healthcare facilities: recommendations of CDC. MMWR. In Press. [ Links ]
45. JADA. "Infection control and recommendations for the dental office and dental laboratory". Council on Scientific Affairs and ADA Council dental office and the dental laboratory. ADA J Am Dent Assoc., 1996; 127; 672-680. [ Links ]
46. I. Garrido, B. Hernández y N. Torres. Análisis microbiológico del aire y del ambiente de la clínica odontológica de la Universidad Antonio Nariño sede circunvalar. Tesis de grado, Universidad Antonio Nariño, Odontología, 2006, 78 p. [ Links ]
47. Guidelines for infection control in dental health-care, Setting-2003. CDC. MMWR 2003; 52 (No. RR-17). URL: http://www.cdc.gov/oralhealth/infectioncontrol/guidelines/index.htm. [ Links ]
48. C. Estrela y C. Estrela. Control de infección en Odontología. Artes Médicas Ltda., Sao Paulo, 2005. 19a. Edición. [ Links ]
49. W. Hugo y A. Russell. Pharmaceutical Microbiology, 6th Edition, Washington, 1998, Ed. Blackwell Science, p 226. [ Links ]
50. W. Hugo y A. Russell. Op. cit. [ Links ]
51. R. Schulze-Robbecke, C. Feldamn, R. Fischeder, B. Janning, M. Exner y G. Wahl. "Dentals units: an environmental study of sources of potentially pathogenic". Tubercle lung Dis, 1995; 76:318-323. [ Links ]
52. Ministerio de Salud. Manual de normas técnicas, científicas y administrativas para el laboratorio clínico. República de Colombia, 2000. [ Links ]
53. G. Remington. Farmacia. Op. cit. [ Links ]
54. J. Otero. Manual de bioseguridad en Odontología. Perú, 2002. [ Links ]
55. M. Vizcaíno, R. Herruzo y M. Fernández. "Comparison of the disinfectant efficacy of Perasafe and 2% Glutaraldehyde in vitro tests". Journal of Hospital Infection, 2003: 53; 124-128. [ Links ]
56. G. McDonnell y A. Russell. "Antiseptics and disinfectants: activity, action and resistence". Clinical Microbiology Reviews, 1999, 12 (1). 147-179. [ Links ]
57. Fernández A. Aportaciones al estudio de la actividad antimicrobiana de los antisépticos y desinfectantes. Tesis doctoral en Biología. Universidad Autónoma de Barcelona, Facultad de Ciencias, Departamento de Genética y Microbiología, 2006, p. 10-76. [ Links ]
58. L. Galán. Desarrollo de métodos rápidos para verificar la eficacia fungicida de sustancias desinfectantes. Tesis pregrado, Facultad de Veterinaria, Universidad Autónoma de Barcelona, 2003. 229 p. [ Links ]
59. J. Rueda, J. Amigo y J. Ducha. "Evaluación de desinfectantes de amonio cuaternario sobre cepas bacterianas de origen animal". Revista sci. Tech, 2003. 22(3). 1097-1104. [ Links ]
60. T. Bello, I. Rivera y I. De Waard. "Inactivación de micobacterias con desinfectantes registrados como tuberculocidas". Enfermedades Infecciosas en Microbiología Clínica, 2000, 24 (5): 319-321. [ Links ]
61. E. Acosta, A. Herrero y V. Mata. "El cloruro de benzalconio: inaceptable para esterilizar o desinfectar instrumental médico o dental". Salud Pública de México, 43 (6):570-573, 2001. [ Links ]
62. G. Williams, S. Denyer, Honsein, D. Hill y J. Maillard. "The development of a new three step protocol to determine the efficacy of disinfectant wipes on surfaces contaminated with Staphylococcus aureus". J Hosp infection, 2007: 67; 329-335. [ Links ]
63. L. Echeverri, G. Cifuentes, J. Granados, J. Arias y C. Fernández. "Cinética de desinfección para cinco desinfectantes utilizados en industria farmacéutica". Revista Cubana de Farmacia, 2007; 41(2). [ Links ]
64. A. Concetta et al. "Hepatic antioxidant enzymes and total glutathione of Cyprinus carpio exposed to three disinfectants, chlorine dioxide, sodium hypochlorite and peracetic acid, for superficial water potabilization". Chemosphere, 2006, article in press. [ Links ]














