Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.37 no.2 Bogotá July/Dec. 2008
Artículo Técnico
Validación de una metodología analítica por HPLC para la cuantificación de sulfadiazina de plata en crema
Validation of an analytical methodology by HPLC for the quantification of silver sulfadiazine in cream
Nataly Trejos C1 y Myriam E. Tello2
1 Correo electrónico: metelloc@unal.edu.co
2Universidad Nacional de Colombia, Departamento de Farmacia, Bogotá, Colombia.
Recibido para evaluación: agosto 11 de 2008 Aceptado para publicación: noviembre 10 de 2008
RESUMEN
El método oficial en la farmacopea de los Estados Unidos (USP 30), por cromatografía líquida de alta eficiencia (HPLC), para la cuantificación de sulfadiazina de plata, se estandarizó y validó para una formulación en crema al 1%. La validación indica que la metodología analítica es específica frente a los auxiliares de la formulación y productos de descomposición, y lineal en un rango de concentraciones de 12 a 20 µg/mL. La repetibilidad y precisión intermedia presentan coeficientes de variación menores al 1,1%, en tanto que la exactitud medida a través del porcentaje de recuperación es de 87,4% y, por tanto, puede ser aplicada con confiabilidad en el control de calidad del producto.
Palabras clave: sulfadiazina de plata, HPLC, validación, crema.
ABSTRACT
High performance liquid chromatographic method (HPLC) has been standardized and validated for the quantification of silver sulfadiazine 1% in a cream formulation, which is based on the official method mentioned in United States Pharmacopoeia (USP 30). The report of validation indicates that the HPLC analytical methodology has specificity, linearity (12 - 20 µg/mL), precision (CV < 1.1%), and accuracy (%R> 87.4) and it can be applied in quality control with reliability .
Key words:silver sufadiazine, HPLC, validation, cream.
INTRODUCCIÓN
La sulfadiazina de plata (SDP) pertenece al grupo de las sulfas (Figura 1) y se usa terapéuticamente en humanos mediante administración por vía tópica.
La sulfadiazina de plata inhibe la síntesis de ácido fólico y sus coenzimas, requeridas para la síntesis de precursores de ARN y ADN (purina y pirimidinas), y destruye a la bacteria por interferencia con la pared celular. Se formula principalmente como crema hidrosoluble blanca para ser usada como antiséptico en el tratamiento inmediato de emergencia en quemaduras térmicas y químicas, y en el desbridamiento de quemaduras. Es bactericida para un amplio rango de bacterias grampositivas y la mayoría de gramnegativas, incluidas las Pseudomonas aeruginosa y S. aureus (1).
En presencia de agua, la SDP experimenta hidrólisis con la formación de sulfadiazina libre (HSD) (3). El presente trabajo consiste en la estandarización y validación de una metodología HPLC con base en el método de la USP 30 (2) para la cuantificación de la sulfadiazina de plata en una formulación en crema al 1%, que emplea como estándar interno la sulfamerazina (SMR). La intención del trabajo es emplear este método para evaluar el contenido de principio activo en la práctica regular del control de calidad del producto.
PARTE EXPERIMENTAL
Equipos
Cromatógrafo Hitachi Merck, Elite LaChrom, equipado con bomba L-2130, automuestreador L-2200, horno para columna l-2300 y detector de arreglo de diodos L-2450. Columna para HPLC RP-18. 250 x 4.0 mm 5 µm, precolumna RP-18 (5 µm).
Reactivos
Sulfadiazina de plata (estándar primario USP), sulfamerazina (R.A. Sigma, estándar primario USP), acetonitrilo (grado HPLC, J.T. Baker), ácido fosfórico al 85% (calidad R.A. MOL LABS), solución de hidróxido de sodio (grado R.A. Merck), metanol (grado R.A. y grado HPLC Sigma Aldrich y Merck), etanol (R.A. Merck) y agua (HPLC).
Sistema cromatográfico
Por medio del diseño experimental de cambiar un factor cada vez, mediante la utilización de la resolución como variable, se optimizaron las condiciones cromatográficas las cuales quedaron establecidas así: Columna RP-18: dimensiones 250 x 4,0 mm 5 µm; fase móvil constituida por agua acidulada con ácido fosfórico a pH 2 y acetonitrilo (90:10) v/v; flujo 1 mL/min; temperatura de la columna 30°C; volumen de inyección: 20µL; longitud de onda de la cuantificación: 265 nm.
RESULTADOS Y DISCUSIÓN
Cromatografía
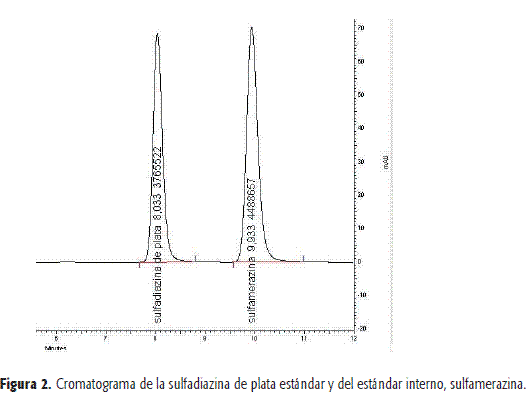
Al realizar el análisis cromatográfico a la mezcla de sulfadiazina de plata y sulfamerazina, según las condiciones establecidas, se observa (Figura 2) que cumple con los parámetros de idoneidad, por cuanto: la resolución entre picos es 5,21; la asimetría para el pico de SDP es 1,16 y para SMR 1,21; el factor de capacidad para SDP es 2,36 y para SMR 3,24; y el número de platos teóricos es 7831 para SDP y 9050 para SMR. Estos parámetros cumplen con los criterios de aceptación propuestos en la USP 30, en los que se establece que la resolución debe ser mayor que 2, la asimetría menor que 2, el factor de capacidad para dos picos de 2 a 10 y el número de platos teóricos mayor que 2000 (2,5). Los tiempos de retención establecidos luego de promediar los datos obtenidos en el ensayo de repetibilidad son 8.02 s con S: 0.121 y 10.14 s con S: 0.333 para la SDP y SMR, respectivamente.
Estandarización del método para la extracción de la muestra que se va a analizar
Igual que en el caso del sistema cromatográfico, a partir de la metodología de extracción que da la USP 30 se realizaron modificaciones con el fin de obtener mayor recuperación y menor variabilidad. Las condiciones definitivas fueron:
Transferir 1,0 g de placebo enriquecido de sulfadiazina de plata al 1% (equivalente a 10 mg de sulfadiazina de plata) a un tubo de centrífuga. Agregar aproximadamente 12 mL de metanol, sellar el tubo herméticamente y mezclar con un mezclador de vórtice durante 15 segundos. Centrifugar durante 15 minutos y desechar el metanol con precaución para no aspirar el residuo. Agregar 10 mL de etanol, sellar el tubo y mezclar. Calentar en baño de agua a 60°C, mezclando periódicamente durante 15 minutos para fundir y dispersar la crema. Cuando la mezcla esté aún caliente, transferir el contenido a un balón aforado de 50 mL que contiene 10 mL de hidróxido de amonio al 10% y 5 mL de solución de estándar interno de 2 mg/mL. Mezclar, lavar varias veces el tubo con etanol. Cuando la solución esté a temperatura ambiente, completar a volumen. Transferir 2,0 mL de esta solución, medidos con pipeta aforada, a un balón aforado de 25 mL; llevar a volumen con fase móvil, mezclar y filtrar, para una concentración final de 16 µg/mL de sulfadiazina de plata y de estándar interno.
Selectividad
Se determinó por medio de la comparación de muestras que contenían estándar de sulfadiazina de plata de 100% (16 µg/mL), placebo solo y placebo cargado al 100% con estándar de sulfadiazina de plata. También se sometieron las muestras de sulfadiazina de plata y placebo enriquecido a condiciones extremas de degradación, como hidrólisis ácida, básica, oxidación con peróxido de hidrógeno y exposición a la luz UV, con el fin de establecer si se presentaban interferencias provocadas por productos de degradación que se podrían presentar por manipulación de la muestra durante la determinación del analito.
Se concluyó que ni los componentes de la matriz ni los subproductos de degradación causan interferencia en la determinación del analito, ya que para las condiciones establecidas en la metodología no se observan picos en los mismos tiempos de retención del analito de estudio ni del estándar interno.
Linealidad del sistema y del método
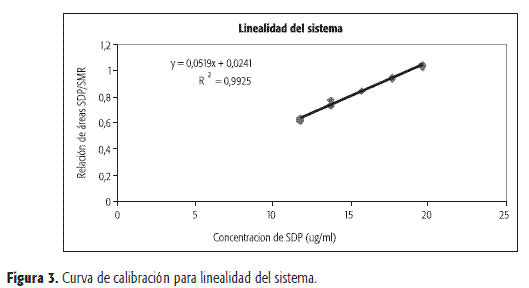
La linealidad del sistema se estudió a 5 niveles de concentración, cada uno de los cuales con tres réplicas, de acuerdo con los lineamientos de las ICH (7). Las concentraciones empleadas se situaron entre 12 y 20 µg/ml para sulfadiazina de plata y 16 µg/ml para el estándar interno en todos los casos. Dentro del intervalo de concentraciones empleadas se obtuvo un comportamiento lineal con correlación de 0,9925. Las pruebas de t para ntercepto y pendiente indicaron regresiones significativas e interceptos estadísticamente no diferentes de cero. Igualmente, el análisis de varianza de la regresión mediante un test F, indica regresión significativa y desvíos no significativos de la linealidad.
En cuanto a la linealidad del método, se analizaron muestras de placebo enriquecido de sulfadiazina de plata de acuerdo con la formulación del producto, a las cuales se les realizó el correspondiente proceso de extracción. Se obtuvieron tres réplicas con los mismos niveles de concentración que para la linealidad del sistema. De nuevo la regresión fue significativa y los puntos alrededor de la recta de calibración no se alejaron significativamente de la linealidad.
Las curvas de calibración se presentan en las Figuras 3 y 4 y los respectivos análisis de estadísticos en las Tablas 1 y 2.
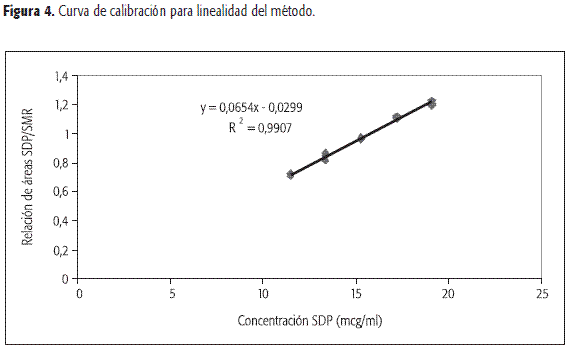
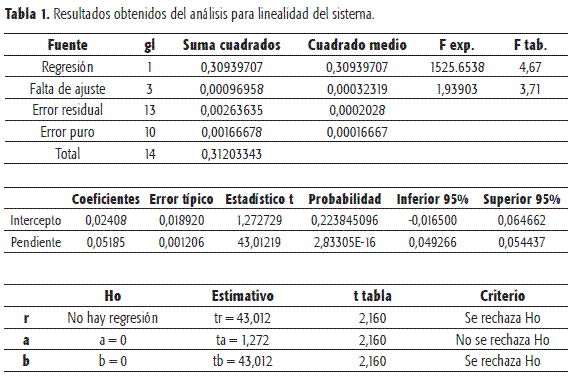
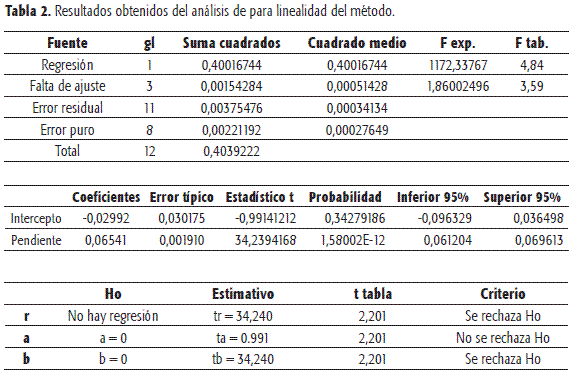
En esta curva de calibración se presentaron dos puntos con residuales más grandes que los permitidos para una probabilidad de error del 5%. Lo mismo se observó al determinar el valor de la pendiente para cada punto y al definir límites de confianza. Estos criterios se tuvieron en cuenta para considerar estos datos como anómalos.
Precisión del sistema y del método
En la determinación de la repetibilidad, los coeficientes de variación calculados para el sistema y para el método se determinaron en un solo nivel de concentración (16 µg/ml), mediante el empleo de 6 determinaciones. En ambos casos los valores no fueron superiores al 1% (0.284 y 0.593, respectivamente), valor inferior al aceptado como máximo para métodos cromatográficos (2%) (4), lo cual indica una adecuada repetibilidad.
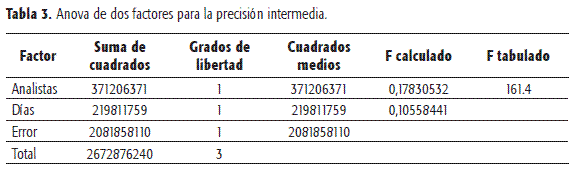
La precisión intermedia se evaluó para 2 analistas en diferentes días, con seis inyecciones. La relación de área para las seis inyecciones se promedió teniendo en cuenta que el coeficiente de variación en cada caso fue menor que el obtenido para repetibilidad. Para el total de las determinaciones, el coeficiente de variación fue de 1.056. El análisis de varianza mediante un test F indica que no existen diferencias significativas en los resultados al cambiar el analista o el día del ensayo.
Exactitud de la metodología
La evaluación de este parámetro se llevó a cabo mediante la determinación del porcentaje de recuperación del principio activo. Se estudiaron tres niveles de concentración correspondientes al 75%, 100% y 125%, cada uno de ellos con tres réplicas. Los valores encontrados para la sulfadiazina de plata indican que la recuperación promedio es del 87,4%, lo cual es ocasionado principalmente por el hecho de tener que realizar pasos sucesivos en la extracción de la sulfadiazina de la muestra. El coeficiente de variación medio en los tres niveles de concentración estudiados fue de 1.795 y la prueba de Cochran indica que el nivel de concentración no afecta los resultados.
Robustez
Para el estudio de la robustez del método, inicialmente se analizó el efecto al cambiar el pH del agua acidulada que compone la fase móvil a un valor de 3. Se observó que se trata de un parámetro crítico, pues con este valor de pH o mayor, los picos cromatográficos sufren deformaciones que afectan significativamente los parámetros de idoneidad del sistema.
Adicionalmente, se efectuaron pequeños cambios a nivel del sistema cromatográfico y de la extracción. Por medio de 8 experimentos se analizó la influencia del cambio de 7 factores al hacer variaciones factibles durante la realización rutinaria de la metodología. En la Tabla 4 se observan los cambios realizados sobre el método inicialmente desarrollado.

El análisis de los resultados se efectuó según lo propuesto por Youden-Steiner y Burman (4-6), encontrándose que el método no se afecta por los cambios realizados, ya que en todos los casos el valor obtenido al calcular el efecto es menor a la expresión s√2, donde s es la desviación estándar obtenida del ensayo de repetibilidad del método.
CONCLUSIONES
Se optimizó y validó una metodología para la cuantificación de sulfadiazina de plata en crema por HPLC en fase reversa, con base en el método oficial de la USP 30.
Bajo las condiciones de validación, el sistema cromatográfico cumple con los parámetros de idoneidad, como resolución entre picos mayores que 2, asimetría menor que 2, factor de capacidad para dos picos, entre 2 y 10, platos teóricos mayores que 2000 y tiempos de retención de 8,0 y 10,1 para la sulfadiazina de plata y el estándar interno, respectivamente.
Con esta validación se determinó que el método propuesto es selectivo frente a posibles interferencias que puedan estar presentes en la muestra de análisis, incluidos productos de degradación por hidrólisis ácida, básica, oxidación con peróxido de hidrógeno y fotólisis.
Tanto el sistema como el método presentan linealidad, buena correlación y convergencia al origen, en un rango entre 12 y 20 µg/mL para la sulfadiazina de plata, y de 16µg/mL para el estándar interno.
El método presenta repetibilidad y precisión intermedia con coeficientes de variación menores que 1.1%.
El promedio del porcentaje de recuperación del analito es del 87,38% y debido a la alta precisión de la metodología es posible aplicar un factor de corrección para la cuantificación del analito.
La metodología analítica es robusta al soportar ciertos cambios, tanto en la metodología de preparación de las muestras, como en el sistema cromatográfico, entre los que se incluyen temperatura de la columna, tiempo transcurrido entre la preparación de las muestras y la inyección, tiempo de centrifugación, forma de mezcla de los solventes de la fase móvil, filtración de la muestra para inyectar, número de veces para lavar el tubo con etanol después de la centrifugación y tiempo de preparación de la fase móvil.
BIBLIOGRAFÍA
1. E. Sáenz-Anduaga, L. Sánchez-Saldaña. Antibióticos tópicos. Educación médica continua. Dermatología Peruana, 2005; Vol. 15: No 1. pp.12-13. [ Links ]
2. USP 30 NF 25. Farmacopea de los Estados Unidos de América. Volumen 3, 2007. [ Links ]
3. H. Kunkely, Vogler A. Photoproperties of silver sulfadiazine. Inorganic Chemistry Communications 10, 2007, pp. 226-228. [ Links ]
4. Validación de Métodos Analíticos. Asociación Española de Farmacéuticos de la Industria, AEFI, 2001. [ Links ]
5. C. M. Riley y T. W. Rosanske Development and validation of analytical methods. Riley and Fell Editors. Elsevier Science Ltd., New York, 1996. [ Links ]
6. O. Quattrocchi, S. Abelaira, R. Laba. Introducción a la HPLC. Aplicación y práctica. Edit. Artes Gráficas Farro S.A., Argentina, 1992 [ Links ]
7. Validation of Analytical Procedures: Text and Methodology Q2 (R1) ICH 2006. [ Links ]














