Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.37 no.2 Bogotá July/Dec. 2008
Artículo Técnico
Diseño de liposomas para el transporte de diclofenac sódico
Design of liposomes as carriers for sodium diclofenac
Gabriela Navarro1, Pablo Cabral2, Antonio Malanga3, Eduardo Savio4.
1 Cátedra de Farmacotecnia, Facultad de Química, Universidad de la República, Laboratorio Farmacéutico D.N.S.FF.AA. Uruguay, fax: 005982 4876666 int. 1669. Correo electónico: gnavarro@fq.edu.uy
2 CIN, Facultad de Ciencias, Universidad de la República, Laboratorio Farmacéutico D.N.S.FF.AA. Uruguay. Correo electónico: pcabral@cin.edu.uy
3 Cátedra de Farmacotecnia, Facultad de Química, Universidad de la República, Uruguay. Correo electónico: amalanga@fq.edu.uy
4 Cátedra de Radioquímica, Facultad de Química, Universidad de la República, Uruguay. Correo electónico: esavio@fq.edu.uy
Recibido para evaluación: agosto 19 de 2008 Aceptado para publicación: noviembre 18 de 2008
RESUMEN
El objetivo de este trabajo es diseñar y preparar liposomas convencionales que contengan un fármaco anfifílico. Para ello, se diseñó una formulación de este tipo de liposomas preparados mediante el método de agitación manual. La optimización de la distribución de tamaño liposomal se realizó por dos métodos: sonicación y extrusión. Este último generó liposomas de menor diámetro medio y menor rango de diámetros, siendo el de elección para obtener liposomas de un fármaco anfifílico modelo (diclofenac sódico). Su incorporación se realizó en la membrana lipídica y en el volumen acuoso de los liposomas, y en cada caso se compararon los porcentajes de captura y distribución de tamaños. Ambas determinaciones resultaron similares para los dos tipos de liposomas. También se determinó la cesión de ambos tipos de diclofenac liposomal y se compararon entre ellas con una solución del fármaco libre. Las cesiones de los dos tipos de diclofenac liposomal fueron comparables mientras que ambas difirieron significativamente de la del fármaco libre.
Palabras clave: nanotecnología, liposomas, extrusión, sonicación, encapsulación, cesión.
ABSTRACT
The goal of this work is to design and prepare conventional liposomes containing an amphiphillic drug. Conventional liposomes were prepared by hand shaken method. The liposomal distribution size was optimized by sonication and extrusion. Extrusion produced the lower mean diameter and the lower diameter range, so it was chosen for the preparation of liposomes containing a model amphiphilic drug (sodium diclofenac). The drug encapsulation was performed in the liposomes lipidic bilayer and in the aqueous volume. The capture percentage and size distribution were compared for each case. Both determinations were similar for both kinds of liposomes. The cession was determined for each kind of liposomes containing diclofenac and compared between them and a solution of free drug. The cessions were similar for both liposomal formulation and they were very different from free drug cession.
Key words:nanotechonology, liposomes, extrusion, sonication, encapsulation, cession.
INTRODUCCIÓN
La farmacoterapia está evolucionando hacia lo que se denomina terapia dirigida. Se estima que a mediano plazo no se utilizarán fármacos que se absorban y distribuyan actuando en todo el organismo, sino que se liberarán y actuarán específicamente en el sitio afectado. Esto es aplicable tanto para diagnóstico como para tratamiento de distintas patologías, entre las cuales se destacan en particular las oncológicas.
En la administración de fármacos, el aspecto clave es lograr que estos medicamentos lleguen al sitio que lo requiere en la concentración adecuada. En la actualidad, las modificaciones de la estructura química de los fármacos han logrado muy poco sobre el objetivo que como resultado de dicha modificación debe alcanzar el fármaco. Los fármacos deben atravesar una serie de compartimentos, entornos hostiles y barreras tridimensionales para ejercer su acción, y muchas veces su ineficacia o toxicidad es resultado de su estructura química, poco adecuada para transitar correctamente.
La nanotecnología explota propiedades del sistema en la nanoescala de tamaños y puede ser utilizada como herramienta de diseño para la liberación controlada de fármacos. Esta tecnología ofrece la posibilidad única de preparar nanosistemas de liberación controlada (nanonaves) capaces de circular en sangre o de atravesar la piel, anclarse a atravesar mucosas o atravesarlas para ingresar a determinados grupos celulares en forma selectiva. Frente señales del entorno inmediato (pH, fuerza iónica, temperatura) o externas (radiofrecuencia, ultrasonido), las nanonaves responden descargando el fármaco en un sitio en particular, o induciendo una respuesta celular determinada. Mediante esta acción, es posible conseguir: a) aumento de selectividad; b) protección frente a la metabolización /eliminación innecesaria; c) bloqueo de acceso a tejidos donde no es requerido; d) disminución de dosis sistémicas, y e) liberación masiva de fármaco en el lugar elegido. En otras palabras, es posible aumentar el índice terapéutico del fármaco original o conseguir determinadas respuestas del sistema inmune.
Las nanonaves pueden ser agregados supramoleculares o productos de síntesis cíclica, obtenidos a partir de bloques de átomos de carbono, oro, péptidos, lípidos (liposomas, arqueosomas, nanopartículas lipídicas sólidas), etilendiamina o alquilacrilatos (dendrímeros), en un proceso denominado bottom-up, es decir, construcción desde lo más pequeño hasta lo de mayor tamaño. La selección adecuada de los componentes y la técnica de preparación permiten controlar con exactitud el tamaño, la forma, las propiedades superficiales y la capacidad de respuesta frente a condiciones ambientales o señales externas (1).
Los liposomas son estructuras micro o nanoscópicas consistentes en una o varias esferas concéntricas de bicapas fosfolipídicas o lamelares que encierran compartimentos acuosos. El carácter anfifílico de los lípidos que los componen les proveen atributos únicos que los convierten en vehículos adecuados de fármacos tanto hidrofílicos como lipofílicos. Las sustancias lipofílicas y anfifílicas en general son encapsuladas en las bicapas de los liposomas, mientras que las hidrofílicas lo son en el compartimento acuoso interior. Debido a sus constituyentes, los liposomas tienen baja toxicidad intrínseca y brindan protección al fármaco de la degradación sistémica.
Se trata, entonces, de reservorios de fármaco que lo conducen al interior del organismo. A nivel sistémico, sólo son reconocidos los liposomas y no la molécula activa libre, de modo que el perfil farmacocinético del principio activo lo determinan las propiedades fisicoquímicas de los liposomas. Los sistemas liposomales pueden ser modificados en su composición para ajustar su afinidad por determinado sitio blanco. De este modo se aumenta allí la tasa de liberación del principio activo, disminuyendo los efectos secundarios ocasionados por la escasa liberación en otros tejidos. Este direccionamiento puede llevarse a cabo por procesos como la conjugación de anticuerpos o el diseño de liposomas con características particulares, como sensibilidad al pH.
Una vez inyectados por vía endovenosa, los liposomas en circulación sanguínea son capturados principalmente por células del sistema retículo-endotelial (SRE). A diferencia de otros macrófagos fijos (peritoneales, bazo, médula ósea), la ubicación especial de las células de Kupffer (CK), intercaladas en el endotelio de los sinusoides hepáticos, poseen óptima accesibilidad a los liposomas que circulan en el torrente sanguíneo. Por tanto, los órganos con mayor tasa de acumulación de liposomas, en términos de captura total y captura por gramo de tejido, son el hígado y el bazo. La abundancia de macrófagos (80-90% de los macrófagos fijos del cuerpo se hallan en el hígado y son las CK), su rica fuente de circulación sistémica y su accesibilidad son los motivos de la gran acumulación de liposomas en estos órganos (2, 3). Al aumentar la dosis administrada, la acumulación puede ser dirigida al bazo, la médula ósea y los pulmones, en este orden.
El tamaño y la deformabilidad de los liposomas desempeñan un papel crítico en su eliminación en los sinusoides esplénicos. Los liposomas circulantes deben ser lo más pequeños posible, así como lo suficientemente deformables para evadir el proceso de filtración en el bazo, que ocurre en las aberturas interendoteliales (AIE), situadas en las paredes de los sinusoides venosos (4-6). Las AIE de los sinusoides del bazo presentan una malla reticular y raramente exceden los 200-500 nm de ancho, incluso cuando se trata de un eritrocito en tránsito (7). Por tanto, la retención de las células sanguíneas y las partículas derivadas de la sangre en las AIE depende de sus propiedades en solución, como tamaño y deformabilidad.
Cuando los liposomas acceden a su órgano blanco, las interacciones que se establecen con las células pueden clasificarse en cuatro categorías: a) intercambio de lípidos o proteínas con las membranas celulares; b) adsorción o unión (esto ocurrirá sólo después que el liposoma se una a la superficie celular); c) luego de la unión, la membrana del liposoma puede fusionarse con la membrana celular, y d) internalización por endocitosis o fagocitosis, siendo estas últimas las interacciones celulares más importantes que los liposomas entablan in vivo. Estas interacciones dependen fundamentalmente de la composición lipídica liposomal, el tipo celular y la presencia de receptores específicos, entre otros parámetros. La ruta intracelular seguida por los liposomas, luego de ingresar tanto por fagocitosis como por endocitosis, es la endolisosomal (8).
Los liposomas convencionales típicamente están compuestos de fosfolípidos (neutros y/o con carga neta negativa) y/o colesterol. Pueden variar en tamaño, composición lipídica, carga superficial y número y fluidez de las bicapas fosfolipídicas. De acuerdo con su tamaño y lamelaridad, los liposomas a su vez se clasifican en vesículas multilamerales, unilamelares, grandes unilamelares y unilamelares de tamaño intermedio, cuyas propiedades características los hacen adecuados para distintas aplicaciones. Las vesículas multilamelares (MLV), cuyo tamaño oscila entre 0,5 µm y 5 µm, consisten en varias lamelas concéntricas entre las cuales se encuentran los volúmenes acuosos. Son apropiadas para la incorporación de material lipídico no sólo por estar constituidas por varias capas de fase lipídica, sino porque liberan de manera gradual y sostenida el material, ya que sus membranas concéntricas pueden ser lentamente degradadas en el sitio blanco. Las vesículas unilamelares (SUV) son aquellos liposomas en el límite inferior de tamaño posible (30-40 nm). Este tipo de vesícula presenta anormalidades en el empaquetamiento de lípidos por su alta curvatura, siendo especialmente susceptibles a la transferencia y degradación en presencia de moléculas biológicas. Las vesículas grandes unilamelares (LUV) tienen un tamaño de 1000 nm, mientras que las vesículas unilamelares de tamaño intermedio (IUV) alcanzan alrededor de 100 nm (9).
Las IUV y LUV son adecuadas para moléculas hidrosolubles, donde la meta es lograr un alto valor en la relación volumen de atrapamiento - lípido. Una desventaja de los liposomas muy grandes es la debilidad mecánica de su única membrana, que puede llevar a su ruptura y pérdida parcial de material, así como representar una tenue barrera para compuestos hidrosolubles aunque estén intactos. Como se explicó anteriormente, la cinética y el direccionamiento de los liposomas dependerá de su composición y de su tamaño.
Por otro lado, a fin de lograr el vehículo adecuado en cuanto a porcentaje de incorporación, estabilidad, biodistribución y liberación del principio activo, según el objetivo propuesto, la formulación y el proceso de preparación deben ser diseñados y optimizados específicamente para cada fármaco, es decir, que no son extrapolables entre diferentes sistemas liposomales. En el presente trabajo se utiliza como modelo un fármaco anfifílico (diclofenac sódico) con el objetivo de obtener diclofenac liposomal (10). Por tanto, el objetivo general fue diseñar liposomas convencionales portadores de un fármaco anfifílico, mientras que los objetivos específicos fueron formular y obtener liposomas convencionales, optimizar el proceso de obtención, incorporar un fármaco anfifílico (diclofenac sódico) y evaluar la cesión del fármaco desde los liposomas.
METODOLOGÍA
Preparación de liposomas convencionales. Optimización del proceso de obtención.
Se realizó la técnica de rehidratación manual (hand-shaken), que consiste en el siguiente proceso: a partir de una solución de fosfatidilcolina de huevo (Epikuron 200) y colesterol (Sigma) (10:4 p/p) en mezcla de cloroformo: metanol (9:1v/v), se elimina la fase orgánica por rotaevaporación (Rotavapor Büchi 461) a 50 °C y se seca al vacío durante 12 horas (estufa de vacío Lab Line duo-vac oven). Se obtiene un film delgado de fosfolípidos que se hidrata con buffer fosfato pH 7.4 a 50 °C para obtener una suspensión primaria multilamelar de liposomas. La etapa de reducción de tamaño se realizó mediante 2 procesos diferentes: ultrasonido (sonicador Cole- Parmer 8854) y extrusión (miniextrusor Avanti Polar Lipids inc). La reducción de tamaño mediante ultrasonido se llevó a cabo tomando muestras a 5, 10, 15 y 20 minutos, en tanto que la determinación de la distribución de tamaño de las vesículas se realizó mediante difracción de luz láser (Coulter LS 230). Se evaluó la reproducibilidad del método de obtención en cuanto a tamaño de vesícula realizándolo para n=2. La variación del tamaño de liposomas con el tiempo se realizó dejando la suspensión liposomal una semana a 4 °C y determinando la distribución de tamaño cumplido ese plazo para muestras sonicadas 10, 15 y 20 minutos. La extrusión se realizó cinco veces a través de dos membranas contiguas, de tamaño de poro 400 nm y 100 nm, determinándose la distribución de tamaño de partícula por difracción de luz láser.
Preparación de diclofenac liposomal
El diclofenac liposomal se preparó mediante el método hand shaken, compuesto por fosfatidilcolina de huevo y colesterol (72:28 p/p), a los que se les incorporó 7% p/p de diclofenac sódico. La incorporación del diclofenac sódico se realizó de dos maneras: disuelto en el buffer acuoso en la solución de hidratación del film lipídico (F 1) y co-disuelto en los solventes orgánicos durante la preparación del film (F 2). La reducción de tamaños se realizó mediante extrusión a través de dos membranas contiguas de 400 y 100 nm, cinco veces. El porcentaje de incorporación del fármaco para cada proceso se determinó incubando la dispersión liposomal durante 4 horas en membrana de diálisis contra solución de buffer fosfato pH 7,4 a 4 °C. Posteriormente se realizó la determinación de diclofenac sódico libre en el dializado mediante espectrofotometría UV a λ=272 nm (espectrofotómetro Spectronic 1201), para así calcular el porcentaje de fármaco encapsulado en los liposomas. La determinación de la distribución de tamaño del diclofenac liposomal se realizó mediante difracción de luz láser.
Evaluación de cesión del fármaco
Se evaluó la cesión del fármaco desde los liposomas que lo contenían en la membrana lipídica, en la solución de hidratación, y desde una solución de fármaco libre. Esto se llevó a cabo a través de una membrana de diálisis (14000 D), contra solución de buffer fosfato pH 7,4 durante cuatro horas. La determinación del fármaco cedido se realizó por dosificación del diclofenac en el dializado mediante espectrofotometría UV a λ=272 nm.
RESULTADOS Y DISCUSIÓN
Preparación de liposomas convencionales. Optimización del proceso de obtención.
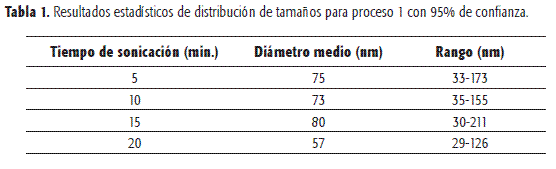
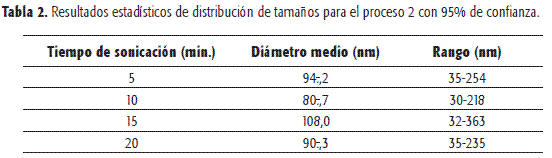
En las Figuras 1 y 2 se muestran las distribuciones de tamaños de vesículas obtenidas por ultrasonido a distintos tiempos, y en las Tablas 1 y 2 se presentan los resultados estadísticos de dichos ensayos. Se observa que el aumento de la sonicación por encima de cinco minutos no disminuye de manera significativa los tamaños medios de los liposomas ni en rango de tamaños. Se constata la reproducibilidad del método de obtención en cuanto al tamaño vesicular (n=2).
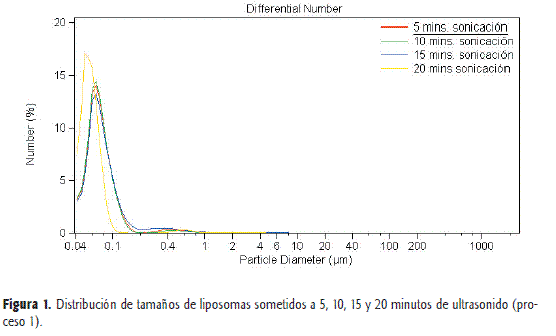
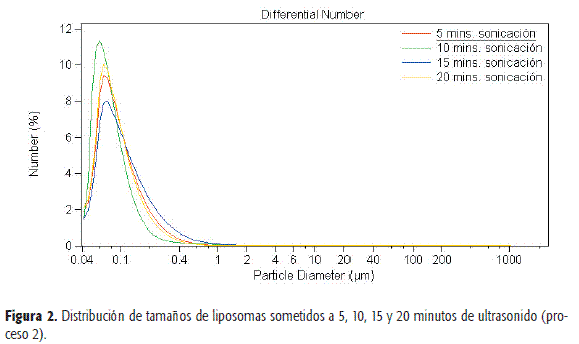
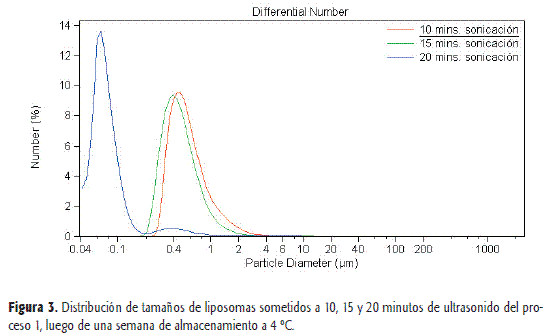
En la Figura 3 se muestra la distribución de tamaños de liposomas obtenidos en el proceso 1 y almacenados a 4 °C durante 7 días. Del estudio de estabilidad en la distribución de tamaños realizado a t=7 días de los liposomas obtenidos en el proceso 1, con tiempos de sonicación de 10, 15 y 20 minutos se puede observar en la Figura 3 y la Tabla 3 un crecimiento de las vesículas.

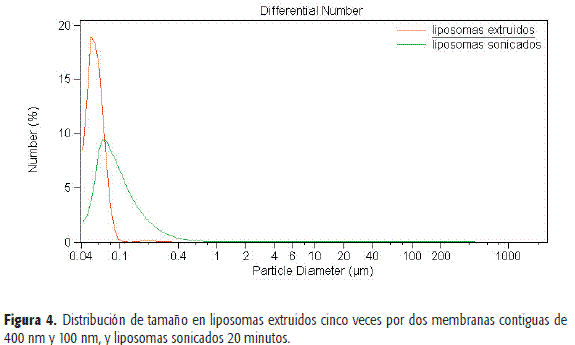
En la Figura 4 y la Tabla 4 se observan las distribuciones de tamaños para liposomas cinco veces extruidos a través de dos membranas contiguas de 400 y 100 nm, y liposomas sonicados 20 minutos. Al comparar los diámetros medios liposomales se observa que los liposomas extruidos son de menor tamaño y el rango de diámetros en que aparecen es más estrecho que para los obtenidos mediante ultrasonido.

Preparación de diclofenac liposomal
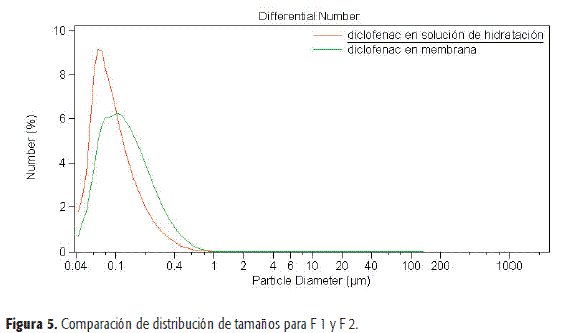
El porcentaje de captura de diclofenac sódico en la membrana fue de 74,6 ± 5,8 % y en la fase acuosa fue de 72,5 ± 2,3 %. (n=3). En la Figura 5 y la Tabla 5 se muestran las distribuciones de tamaños de los liposomas que contienen diclofenac en membrana, y en la solución de hidratación se observa que los mismos presentan dimensiones comparables.

Evaluación de cesión del fármaco
En la Figura 6 se muestran las cesiones en función del tiempo desde las dos preparaciones de diclofenac liposomal (F 1 y F 2) y desde una solución de diclofenac sódico.
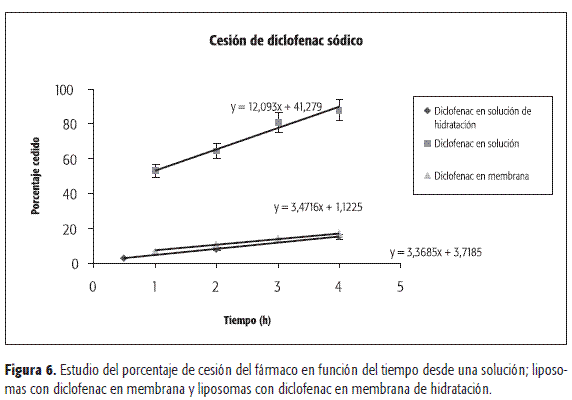
Se observa que las cesiones del fármaco fueron similares para ambas formulaciones liposomales, cuyas constantes fueron: 3,37 ± 0,30 h-1 para F 1 y 3,47 ± 0,25 h-1 para F 2. Por otro lado, dichas cesiones son marcadamente diferentes de la de la solución de diclofenac libre, la cual posee una constante de valor 12,09 ± 0,21 h-1. Mediante los procesos propuestos se pueden obtener liposomas convencionales en forma reproducible. La distribución de tamaños óptima se obtuvo con el proceso de extrusión. Las dos formulaciones de diclofenac liposomal desarrolladas incorporaron similares cantidades del fármaco, siendo adecuada para su posible producción industrial. Con respecto a los parámetros distribución de tamaño vesicular y cesión del fármaco, no presentan estas formulaciones diferencias significativas entre sí. La encapsulación del fármaco produce una liberación controlada que sugiere una forma de vehiculización alternativa a aplicar en diferentes formas farmacéuticas.
BIBLIOGRAFÍA
1. M.J. Morilla. Encapsulación de drogas antichagásicas en liposomas, tesis doctoral, Universidad Nacional de Quilmes, Buenos Aires, Argentina, 2003 cap. 1, pp. 2-4. [ Links ]
2. G.L. Sherphof. Handbook of Experimental Pharmacology, Springer-Verlag, Berlin, Heidelberg, 1991. Vol. 100, p. 285. [ Links ]
3. G.L. Scherphof, D.J.A. Crommelin. Cells involved in removing liposomes from the circulation: why are they so special? J. Liposome Res., 6, 19 (1996). [ Links ]
4. G. Navarro, V. Trindade, M. Cabrera, P. Cabral, M. Fernández, A. López, M.J. Morilla, E. Romero y E. Savio, H. Balter. Marcado de liposomas convencionales con 99mTc por vía directa y estudio centellográfico en ratones portadores de tumor, Alasbimn Journal, Year 10, Number 39, January, 2008. Publicación on line: http://www.alasbimnjournal.cl/alasbimn/ [ Links ]
5. L.T. Chen y L. Weiss. The role of the sinus wall in the passage of erythrocytes through the spleen, Blood, 41, 529 (1973). [ Links ]
6. S.M. Moghimi y A.R Rajabi-Siahboomi. Advanced colloid-based systems for efficient delivery of drugs and diagnostic agents to the lymphatic tissues. Prog. Biophys. Mol. Biol., 65, 221 (1996). [ Links ]
7. D. Drenckhahn y J. Wagner. Stress fibers in the splenic sinus endothelium in situ: molecular structure, relationship to the extracellular matrix and contradictibility, Int. J. Pharm., 29, 195 (1986). [ Links ]
8. G. Gregoriadis. Drug and vaccine delivery systems. World Markets Series Business Briefing Pharma Tech., 2001. p. 172 [ Links ]
9. R.R.G. New. "Liposomes: a practical approach", Oxford University Press, 1990. p. 23. [ Links ]
10. S.M.B. Souza, O.N. Oliveira, Jr., M.V. Scarpa y A.G. Oliveira. Study of the diclofenac/phospholipid interactions with liposomes and monolayers. Colloids and Surfaces B: Biointerfaces, 36, 13 (2004). [ Links ]














