Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.38 no.1 Bogotá Jan./June 2009
Artículo de Investigación
Efecto antinociceptivo de Critoniella acuminata, Physalis peruviana y Salvia rubescens
Antinociceptive effect of Critoniella acuminata, Physalis peruviana and Salvia rubescens
Carol E. Muñoz, Nadezdha E. Vergel, Pablo Cabral, Diana Marcela Aragón, Luis Fernando Ospina*
Departamento de Farmacia, Universidad Nacional de Colombia, Bogotá, Colombia.
*Correo electrónico: lfospinag@unal.edu.co
Recibido para evaluación: octubre 18 de 2008. Aceptado para publicación: enero 19 de 2009.
RESUMEN
Se evaluó el efecto antinociceptivo de extractos, fracciones y compuestos de Critoniella acuminata, Physalis peruviana y Salvia rubescens mediante los métodos de placa caliente, contorsiones abdominales inducidas por ácido acético y ensayo de la formalina.
La fracción de Critoniella acuminata en dosis de 100 mg/kg p.o. presentó actividad antinociceptiva al aumentar el tiempo de reacción del animal ante la aplicación de un estímulo térmico (método de la placa caliente), mientras que la fracción de Physalis peruviana, en una dosis de 100 mg/kg p. o., ejerce un efecto antinociceptivo frente al dolor generado por estímulos químicos (dolor visceral agudo) al inhibir en un 40% las contorsiones abdominales inducidas por ácido acético y el número de lamidos durante la fase II (dolor inflamatorio agudo) en el ensayo de formalina. Estos resultados sugieren que la ayapina y la fracción de Physalis peruviana estudiadas tienen actividad antinociceptiva, con posibles mecanismos de tipo opioide y aine, respectivamente.
Palabras clave: Placa caliente, formalina, contorsiones abdominales, Critoniella acuminata, Physalis peruviana, Salvia rubescens.
ABSTRACT
The antinociceptive effect of extracts, fractions and compounds of Critoniella acuminata, Physalis peruviana and Salvia rubescens were evaluated by the follow methods: Hot Plate test, acetic acid induced abdominal writhing and Formalin test. The fraction of Critoniella acuminata at doses of 100mg/kg p.o. exhibited antinociceptive effect in the hot plate test; while Physalis peruviana fraction at doses of 100 mg/kg p.o., showed an antinociceptive effect against the pain chemically induced. This fraction produced 40% inhibition of the acetic acid induced writhing (acute visceral nociception) and the licks during phase II (acute inflammatory nociception) of the formalin test. The findings of this experimental study suggest that fractions of Critoniella acuminata and Physalis peruviana possess antinociceptive activity with opioid and nsaid-like mechanisms respectively.
Key words: Hot Plate, Acetic acid induced writhing, Formalin Test, Physalis peruviana, Critoniella acuminata, Salvia rubescens.
INTRODUCCIÓN
El uso de plantas medicinales ha tenido gran auge en los últimos años. Estudios científicos sobre los usos populares dados a las plantas medicinales buscan corroborar su efectividad, mostrando en algunos casos cierta eficacia clínica para varias enfermedades o condiciones patológicas (1, 2). Tal es el caso de Critoniella acuminata, Physalis peruviana y Salvia rubescens, para las cuales algunos autores ya han reportado actividad antiinflamatoria en ensayos preclínicos (3, 4, 5).
Con el fin de continuar con el estudio de la actividad farmacológica de estas plantas, en este trabajo se evaluó su posible efecto antinociceptivo teniendo en cuenta el efecto antiinflamatorio ya reportado y el uso etnomédico que se les da.
Critoniella acuminata (Compositae), conocida comúnmente como "apio de monte" o "patinegra", se usa tradicionalmente como desinfectante, diaforético, febrífugo, cicatrizante y antiprotozoario. Contiene flavonoides, feniletilamidas, derivados del farneseno, ayapina y carbinol. De estos compuestos, se ha demostrado que ayapina tiene actividad antiinflamatoria evaluada en el modelo de edema auricular inducido por aceite de croton en ratón (5).
Physalis peruviana (Solanaceae), comúnmente conocida como "uchuva", es una planta originaria de los Andes suramericanos y es una de las especies más conocidas de este género por su uso alimenticio (4). Ha sido ampliamente utilizada como anticancerígeno, antimicrobiano, antipirético, antileucémico, inmunomodulador y para el tratamiento de enfermedades como malaria, asma, hepatitis y dermatitis; se emplea como cataplasma antiinflamatorio sobre contusiones, torceduras y dislocaciones óseas (6,7). Los frutos se usan en el tratamiento de la estomatitis, faringitis, diabetes, como descongestionante ocular y diurético. Los estudios realizados han reportado la presencia de witanólidos en hojas, frutos y cálices, responsables de la actividad citostática (8).
Salvia rubescens (Labiatae), comúnmente conocida como "salvia colombiana", crece en la zona central de la cordillera Oriental de los Andes colombianos; es una planta de sabor muy amargo a causa de la presencia de amarisólido. Se ha empleado como planta medicinal para el tratamiento de infecciones microbianas, hepatitis viral, enfermedades cardiacas, desórdenes menstruales, hemorragias y otras anormalidades sanguíneas. Se encontró que el extracto total de Salvia rubescens logró inhibir el edema en oreja de ratón (3). De las partes aéreas de esta planta se ha aislado el amarisólido, un neoclerodano (9) con actividad antiinflamatoria (10) y efecto sobre la desgranulación leucocitaria demostrados (11).
MATERIALES Y MÉTODOS
Material vegetal, extractos y fracciones
Los extractos y fracciones utilizados en este trabajo fueron suministrados por otros investigadores de nuestro grupo (4,10). A continuación se describe brevemente cómo se obtuvieron.
Salvia rubescens (col 434050)
Las partes áreas, con flores, de Salvia rubescens Kunth subsp. Rubescens se recolectaron en la parte baja del cerro de La Conejera, en la sabana de Bogotá (2.600 m. s. n. m. / 14 °C) en septiembre de 2005. Luego se seleccionaron las hojas, las cuales se secaron en una estufa con recirculación de aire a 40-45 °C durante 48 horas. Con posterioridad al secado, el material vegetal se molió en un molino de cuchillas. El polvo obtenido se desengrasó con éter de petróleo por percolación durante 24 horas a temperatura ambiente. El marco residuo se sometió a una nueva extracción por percolación con etanol al 96%. El extracto resultante fue posteriormente fraccionado con diclorometano; la fracción soluble se denominó FSR.
FSR fue purificado por cromatografía en columna (fase estacionaria: aerosil-celita 5:1 y fase móvil: en su orden diclorometano, acetato de isopropilo, acetato de etilo, acetona y metanol). De las fracciones resultantes después del uso de acetato de etilo y acetona se obtuvieron cristales de amarisólido con una pureza cercana al 95% (10).
Critoniella acuminata (col 311090)
Las partes áreas, con flores, de Critoniella acuminata, se recolectaron en el kilómetro 15 de la vía Bogotá-Mesitas del Colegio (2.000 m.s.n.m. / 15 °C) en noviembre de 2005. Luego la planta completa se secó en una estufa con recirculación de aire a 40-45 °C durante 48 horas. Tras el secado, el material vegetal se molió en un molino de cuchillas. A continuación, el polvo se sometió a percolación con etanol al 96% hasta agotamiento del material vegetal. Los extractos se filtraron y se concentraron hasta sequedad en un rotaevaporador, los cuales constituyeron el extracto etanólico total. Después se hizo un fraccionamiento en diclorometano; la fracción soluble en diclorometano se denominó fca y se utilizó en este estudio.
A la fracción fca se le adicionó metanol induciendo la precipitación de un compuesto el cual fue purificado por cromatografía en columna (fase estacionara: sílica gel 0040- 0,063 mm y fase móvil: hexano-cloroformo en polaridad creciente). Dicho compuesto corresponde a la cumarina ayapina (10).
Physalis peruviana (col 512200)
Los cálices de Physalis peruviana fueron recolectados directamente por los comerciantes del fruto, en los cultivos situados en La Mesa (Cundinamarca) (1.198 m. s. n. m. / 20 °C).
El material vegetal seco y pulverizado se sometió a extracción por percolación con éter de petróleo hasta agotamiento. El extracto obtenido (EPP) se concentró en rotaevaporador utilizando calentamiento suave (25-30 °C) y presión reducida. Posteriormente epp se fraccionó con una mezcla de metanol y agua 50:50. Luego se fraccionó por cromatografía en columna (fase estacionaria: sílica gel 0,063-0,200 mm y fase móvil: en su orden éter de petróleo, diclorometano, acetato de etilo y etanol). Se obtuvieron 38 fracciones; la número 28 fue la evaluada en este estudio (FPP). Esta fracción contiene, en un 82%, una mezcla de dos compuestos de tipo glicósidos de ésteres alifáticos de ácidos de cadena corta (4).
Animales de experimentación
En cada experimento se emplearon ratones machos o hembras, ICR, de 25 a 35 g de peso y 10-12 semanas de edad, criados y mantenidos en condiciones controladas: ciclos 12h luz/12h oscuridad, temperatura 21 °C, agua y comida ad libitum. Los ensayos se realizaron en el bioterio de experimentación del Departamento de Farmacia de la Universidad Nacional de Colombia. Para minimizar la variabilidad circadiana y también posibles variaciones en la sensibilidad al dolor por factores rítmicos endógenos, se trabajó siempre en la misma franja horaria.
Todos los experimentos fueron realizados siguiendo consideraciones éticas en cuanto al cuidado y uso de animales de experimentación (12).
Ensayos de actividad antinociceptiva
Para evaluar el posible efecto antinociceptivo de Critoniella acuminata, Physalis peruviana y Salvia rubescens, se utilizaron tres modelos experimentales: placa caliente (13, 14, 15), ensayo de la formalina (16) y contorsiones abdominales inducidas por ácido acético (13, 17).
FCA, EPPP y FSR se evaluaron en dosis de 500 mg/kg (p. o.), FPP, ayapina y amarisólido en dosis de 100 mg/kg (p. o.); como sustancias de referencia se emplearon morfina 5 mg/ kg (s. c.) y ASA 200 mg/kg (p.o.). El grupo control recibió el vehículo en el cual se prepararon los extractos y fracciones: agua destilada, glicerina y propilenglicol (80:10:10), 0,1 mL/10 g de peso corporal.
Ensayo de placa caliente
Se siguió el ensayo descrito por Eddy y Leimbach (15), con pequeñas modificaciones. Se empleó una placa UGO Basile con temperatura ajustada en 55 ± 0,5 °C. Se situó cada animal individualmente dentro del cilindro sobre la placa caliente hasta obtener la respuesta de aquél al dolor inducido (salto fuera del cilindro). Se registró el tiempo (segundos) que tomó cada ratón en saltar fuera del cilindro; cada animal sirvió como su propio control.
Se realizó una preselección de los animales aceptando únicamente aquellos que reaccionaron dentro del rango 5-30 segundos. Luego se pusieron de nuevo sobre la placa caliente; la media de dos determinaciones constituyó "el tiempo de reacción inicial" y se administró (p. o.) a cada uno de los ratones el tratamiento correspondiente: vehículo, morfina, extracto o fracción de las diferentes plantas. Se evaluó de nuevo el tiempo de reacción 30, 60 y 90 minutos después.
Ensayo de la formalina
Se realizó de acuerdo con lo descrito por Hunskaar y Hole (16), con algunas modificaciones. Una hora después de la administración del extracto o fracción, se inyectó formalina al 4% (50 µl, s. c.) en la superficie plantar de la pata izquierda. De inmediato se introdujo el animal en un recipiente transparente para observar su comportamiento.
El efecto antinociceptivo se determinó midiendo el número de lamidos durante las dos fases: 0-5 minutos (fase I) y 15-30 minutos (fase II).
Contorsiones abdominales inducidas por ácido acético
Este ensayo fue descrito por Collier y colaboradores en 1968 (17). En resumen: todos los animales recibieron ácido acético 1% intraperitoneal (0,1 mL/10 g), para inducir contorsiones abdominales. Una hora antes de la inyección de ácido acético cada grupo recibió el tratamiento asignado. El número de contorsiones se midió durante 20 minutos. Una reducción significativa en el número de contorsiones comparada con el grupo control se consideró una respuesta antinociceptiva positiva. El porcentaje de inhibición de contorsiones se calculó así: ecu1
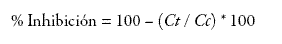
Donde Ct: contorsiones del grupo tratado.
Cc: contorsiones del grupo control.
Análisis estadístico
Los resultados de la evaluación de la actividad antinociceptiva se expresaron como la media aritmética de los valores ± desviación estándar de la media y se analizaron estadísticamente mediante anova de una vía; seguido de una prueba de Tukey para comparaciones múltiples. Se consideró significativa (*) la diferencia entre los grupos tratados y el grupo de control cuando p < 0,05.
RESULTADOS Y DISCUSIÓN
Ensayo de la placa caliente
En este ensayo (Tabla 1), el tiempo de reacción no se aumentó ni a los 30 ni a los 90 minutos después de administrados los tratamientos; mientras que 60 minutos después únicamente el compuesto ayapina aumentó el tiempo de reacción respecto al grupo control, pero en menor magnitud que la respuesta de la morfina. Si bien 60 minutos es el tiempo de máxima actividad de ayapina, dicha actividad es de muy corta duración, hecho posiblemente asociado a la farmacocinética del compuesto.

El modelo de la placa caliente se emplea para determinar específicamente un posible efecto antinociceptivo en el sistema nervioso central (13, 14). Por esta razón, se espera que las sustancias que presenten actividad en este modelo tengan un mecanismo similar al de analgésicos opiodes. Teniendo en cuenta que esta evaluación se realizó únicamente con una dosis de 100 mg/kg, es conveniente realizar posteriormente un ensayo dosis-respuesta que permita mostrar la magnitud real de la actividad antinociceptiva de ayapina y ampliar la elucidación de su posible mecanismo de acción.
Ensayo de la formalina
En él se observó (Tabla 2) un número mayor de lamidos en la primera fase (5 minutos de duración) y por consiguiente mayor frecuencia de lamidos respecto de la segunda fase (15 minutos de duración). Como era de esperarse, dado su mecanismo de acción, la morfina (5 mg/kg s. c.) ejerció una acción protectora ante el estímulo químico (formalina) en ambas fases del ensayo, mientras que el ASA (200 mg/kg p. o.) mostró una protección frente al dolor inflamatorio (segunda fase), pero no frente al dolor neurogénico. Durante la primera fase se observó que la fFPP disminuyó, respecto al grupo control, el número de lamidos de la pata inyectada con formalina, mientras que los demás tratamientos no presentaron una actividad significativa en esta fase del ensayo.
Ahora bien, en la segunda fase se observó una disminución, comparado con el control, en el número de lamidos de la pata inyectada en los grupos tratados con la FPP y FSR. Las sustancias patrón utilizadas presentaron una disminución de los lamidos, mientras que los demás tratamientos empleados no mostraron efecto durante esta fase del ensayo.
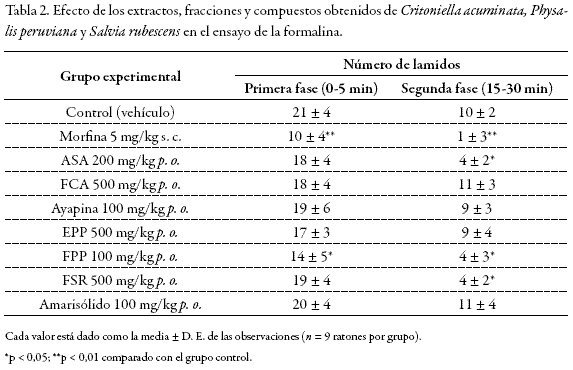
El modelo de nocicepción de la formalina puede discriminar entre el dolor central y el dolor periférico. La primera fase se genera en la periferia por medio de la activación de neuronas nociceptivas por acción directa de la formalina, mientras que la segunda fase ocurre por medio de la activación de neuronas centrales en la médula espinal (13). Por esta razón se recomienda usar dos controles positivos, uno de tipo opioide, como la morfina, que logre inhibir ambas fases, y otro de tipo AINE, como el ASA, que inhiba solamente la segunda fase de este ensayo (13, 14).
Los resultados encontrados en el estudio permiten proponer que para el caso del FSR y la FPP la actividad antinociceptiva de estos involucra mecanismos de tipo aine, lo cual complementa el conocimiento previo de su actividad antiinflamatoria (4, 10).
Los demás tratamientos empleados no mostraron efecto antinociceptivo durante esta fase del ensayo. Teniendo en cuenta que previamente estos extractos y fracciones habían mostrado efecto antiinflamatorio, es probable que la dosis empleada en este estudio no sea suficiente para mostrar actividad antinociceptiva, por lo cual sería interesante evaluar dosis más altas.
Contorsiones abdominales inducidas por ácido acético
En este ensayo (Tabla 3) resalta el efecto mostrado por la FPP, con una inhibición de las contorsiones abdominales del 40%; actividad comparable a la mostrada por la sustancia patrón analgésica: ASA (34% de inhibición).
Los demás extractos y fracciones produjeron inhibiciones entre el 17 y 29%, efectos que no fueron significativos frente al control.

Aunque las contorsiones abdominales inducidas por ácido acético no constituye un modelo de nocicepción específico, permite mostrar un efecto antinociceptivo general de las sustancias que se están evaluando. En este modelo de dolor se generan indirectamente mediadores endógenos como bradiquinina y serotonina, los cuales estimulan las neuronas nociceptivas periféricas. Estas fibras son sensitivas tanto para opiodes como para antiinflamatorios no esteroideos (13, 14).
La FPP inhibió el dolor inducido por ácido acético con una potencia similar a la de la sustancia patrón. A pesar de no ser significativa la disminución de las contorsiones abdominales en los grupos con los demás extractos y fracciones evaluadas, sí se observó inhibición de las contorsiones. Esta situación puede llevar a pensar que existe una relación entre la respuesta encontrada y la actividad antiinflamatoria ya demostrada, pero que a las dosis empleadas en este estudio no se evidencia claramente.
No sorprende que en este tipo de experimentos farmacológicos se encuentre actividad en las fracciones y no en los extractos más complejos de los cuales éstas proceden. Lo cual sucede siempre y cuando el proceso de fraccionamiento lleve a la depuración y enriquecimiento de los principios activos responsables de la actividad. Así mismo, en extractos generales y fracciones complejas se pueden ver enmascaradas las acciones farmacológicas por la posibilidad de presentar efectos de sinergismo y antagonismo a causa de los numerosos compuestos presentes.
CONCLUSIONES
La FPP tiene actividad antinociceptiva frente al dolor producido por estímulos químicos (contorsiones abdominales AINE, que constituye el primer reporte sobre este tipo de actividad para los cálices de Physalis peruviana.
La FCA mostró un efecto antinociceptivo frente al dolor producido por estímulos térmicos (placa caliente), reflejando posiblemente un mecanismo de acción analgésica tipo opioide, lo cual plantea la necesidad de experimentos posteriores para comprobar el posible mecanismo de acción.
AGRADECIMIENTOS
A la División de Investigación de la Sede Bogotá de la Universidad Nacional de Colombia, por la financiación de este proyecto. Al Grupo de investigación "Principios Bioactivos de Plantas" y al Departamento de Farmacia de la Universidad Nacional de Colombia por facilitar los equipos e instalaciones para el desarrollo de este trabajo.
BIBLIOGRAFÍA
1. T. Zinky J. Chaffin, Herbal health products: What family physicians need to know, Am. Fam. Physician, 1, 58 (1998). [ Links ]
2. C. Johns, Herbal remedies: Adverse effects and drug interactions, Am. Fam. Physician, 1, 59 (1999). [ Links ]
3. A. Velásquez, "Efecto antiinflamatorio y antioxidante de algunas plantas utilizadas en la medicina tradicional colombiana", Tesis de Maestría, Universidad Nacional de Colombia, 2002, p. 65. [ Links ]
4. L. A. Franco, G. Matiz, J. Calle, R. Pinzón y L. F. Ospina, Actividad antiinflamatoria de extractos y fracciones obtenidas de cálices de Physalis peruviana L., Biomédica, 27, 110 (2007). [ Links ]
5. F. González y M. Vesga, "Caracterización química de algunos metabolitos secundarios de Critoniella acuminata (H. B. K.) R. M. King & H. Robinson y evaluación de su posible actividad antiinflamatoria", Tesis de Grado, Universidad Nacional de Colombia, 2003, p. 58. [ Links ]
6. H. Y.Bernal y J. E. Correa, "Especies vegetales 6. promisorias de los países del convenio Andrés Bello", Talleres Editoriales Guadalupe Eds., Bogotá, 1998, T. 7, pp. 441-46. [ Links ]
7. F. Cabello, F. Durst, J. Jorrin y D. Werck-Reichhart, Coumarins in Helianthus tuberosus characterization induced accumulation and biosynthesis, Phytochemistry, 38, 918 (1998). [ Links ]
8. T. W. Baumann y C. M. Meier, Chemical defence by withanolides during fruit development in Physalis peruviana, Phytochem., 33, 317 (1993). [ Links ]
9. E. Maldonado, J. Cárdenas, H. Bohórquez, E. Escamilla y A. Ortega, Amarisolide, a neo clerodane diterpene glycoside from Salvia amarissima, Phytochem., 42, 1105 (1996). [ Links ]
10. A. L. Valenzuela Correa, "Estudio sobre la ruta de metabolismo del ácido araquidónico como posible mecanismo de actividad antiinflamatoria para principios bioactivos de plantas medicinales colombianas", Tesis Doctoral, Universidad Nacional de Colombia, 2008, pp. 71-80. [ Links ]
11. M. Rodríguez, N. Vergel, L. F. Ospina, J. Calle y R. Pinzón, Evaluación de actividades enzimáticas elastasa y mieloperoxidasa como marcadores de desgranulación leucocitaria en modelos de inflamación aguda, Rev. Col. Cienc. Quim. Farm., 34, 35 (2005). [ Links ]
12. A. Mrad de Osorio y C. A. Cardozo de Martínez, "Utilización de animales de laboratorio en la experimentación biológica", Universidad Nacional de Colombia, Instituto de Biotecnología, Eds., Bogotá, 2000, p. 27. [ Links ]
13. A. Ortega, A. Roca y J. A. Micó, Modelos animales de dolor: una visión crítica, Rev. Soc. Esp. Dolor, 9, 447 (2002). [ Links ]
14. J. M. González-Dader, Modelos animales de dolor y aspectos éticos de la experimentación animal, Rev. Soc. Esp. Dolor, 7, 3131 (2000). [ Links ]
15. N. B. Eddy y D. Leimbach, Synthetic analgesics. II. Dithienylbutenyl and dithienylbutilamines, J. Pharmacol. Exp. Ther., 107, 385 (1953). [ Links ]
16. S. Hunskaar y K. Hole, The formalin test in mice: Dissociation between inflammatory and non-inflammatory pain, Pain, 30, 103 (1987). [ Links ]
17. H. D. J. Collier, L. C. Dinnin, C. A. Johnson y C. Schneider, The abdominal response and its suppression by analgesic drugs in the mouse, B. J. Pharmacol. Chemother., 32, 295 (1968). [ Links ]














