Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.38 no.1 Bogotá Jan./June 2009
Artículo de Investigación
Modificaciones del perfil hormonal sexual como resultado de la administración conjunta de dos sustancias que inhiben el metabolismo de la testosterona
Sexual hormonal profile modifications as a result of the join administration of two substances inhibitors of the testosterone metabolism
Gloria Gallo I, 1 Lucrecia Rodríguez R, 2 Diana Malaver 3
1 Laboratorio de Control al Dopaje, Bogotá. Correo electrónico: gigal2003@yahoo.es
2 Laboratorio de Control al Dopaje, Bogotá. Correo electrónico: lucreoa_rod@yahoo.es
3 Laboratorio de Control al Dopaje, Bogotá. Correo electrónico: diamadu665@yhaoo.es
Recibido para evaluación: febrero 18 de 2009. Aceptado para publicación: abril 27 de 2009.
RESUMEN
Con este trabajo se pretendió ver el efecto sobre el perfil hormonal sexual y en especial sobre la concentración de testosterona después de administrar dos sustancias que bloquean por diferentes mecanismos la degradación de ésta. Además comprobar, utilizando la técnica gases-combustión-espectrometría de isótopos estables (GC-CIRMS), si la testosterona que se acumula en el organismo por estas inhibiciones se debe simplemente al bloqueo de los mecanismos de degradación o a que alguno de los compuestos administrados entra en la ruta metabólica como precursor para aumentar su producción.
Con tal propósito, se estudiaron los efectos que tenía el inhibidor de la aromatasa 3, 6, 17 androstenetriona (6-Oxo) sobre el perfil hormonal sexual de dos voluntarios sanos y confirmamos mediante el análisis isotópico la participación de esta sustancia en la ruta de producción de testosterona mediante el estudio de sus metabolitos mayoritarios de excreción: androsterona y etiocolanolona. Luego se estudió el efecto que tenía la administración de este inhibidor en combinación con un inhibidor del citocromo P-450 (6', 7', dihidroxibergamotin-DHB) en otros dos voluntarios. En los dos experimentos se observó un aumento del perfil hormonal, especialmente de la concentración de dehidroepiandrosterona (DHEA) y testosterona, explicando por qué se promocionan en el comercio este tipo de mezclas para aumentar la masa muscular y, en consecuencia, la apariencia física.
Palabras clave: Metabolismo de testosterona, inhibidores de la aromatasa, inhibidores del citocromo P-450.
ABSTRACT
This work aimed to see the effect on the sexual hormonal profile and in particular on the concentration of testosterone after administration of two different substances that block the mechanisms of its degradation. In addition check, using the technique of stable isotopes (GC-C-IRMS), if the testosterone that accumulates in the body by these inhibitions is due simply to the blocking of the mechanisms of degradation or any of the compounds administered go into the route as a metabolic precursor to increase its production.
To accomplish this we studied the effects that initially had the aromatase inhibitor 3, 6, 17 androstenetriona (6-Oxo) on the sexual hormonal profile of two healthy volunteers and confirmed, by the isotopic analysis, that this substance participate in the road testosterone production by studying its major metabolites of excretion: Androsterone and Ethiocholanolone. Subsequently we studied the effect of the administration of this inhibitor in combination with an inhibitor of cytochrome P-450 (6 ', 7', dihidroxibergamotin-DHB) in two other volunteers. In both experiments showed an increase in the hormonal profile especially in the concentration of dehydroepiandrosterone (DHEA) and testosterone, explaining the reason of why such mixtures are promoted to increase muscle mass and thus the physical appearance.
Key words: Testosterona metabolism, aromatase's inhibitors, Cytochrome P-450 inhibitor.
INTRODUCCION
La testosterona es uno de los esteroides anabólicos que han sido utilizados por más tiempo para aumentar en forma fraudulenta la masa muscular, la fuerza, la potencia y, por ende, el rendimiento deportivo. Las autoridades que controlan el uso de sustancias prohibidas en el deporte hacen grandes inversiones por medio de sus laboratorios de control al dopaje para detectar las diferentes formas de dopaje con esta sustancia, las cuales van desde la administración directa por diferentes vías (depósitos, parches, ungüentos, etc.), pasan por la utilización de sus precursores en la ruta metabólica como androstendiona, androstendiol, dehidroepiandrosterona, etcétera (1) y llegan hasta el uso de compuestos que inhiben su metabolismo induciendo su acumulación, como los inhibidores de la aromatasa, o impidiendo su excreción, como los inhibidores del citocromo P-450. El configurar un hallazgo analítico adverso o caso positivo para dopaje con testosterona ha sido difícil, pues su producción varía entre los individuos, dependiendo de factores como la alimentación, el ciclo circadiano, la raza y el sexo. Basados en estudios poblacionales, se pudo establecer que el abuso de esta sustancia se podría detectar a través de la medida de la relación entre la concentración de la testosterona (T) y la concentración de su epímero epitestosterona (E), el cual se produce sólo a partir de la testosterona de origen endógeno (2). El valor normal de esta relación (T/E) es 1, y el máximo aceptado es 4. Cuando un individuo presenta valores de relación T/E mayores que 4, se deben hacer investigaciones posteriores para determinar si el aumento de la testosterona en esta relación es debido a factores biológicos o a la ingesta de sustancias sintéticas. Estas investigaciones incluyen estudios de los perfiles hormonales durante un período de tres meses para determinar el comportamiento de las concentraciones de testosterona y sus metabolitos (androsterona, etiocolanolona, 5 alfa diol y 5 beta diol, Figura 1) o la utilización de espectrometría de isótopos estables (c13/c12), la cual al medir la relación isotópica del delta c13/c12, permite identificar el origen de las sustancias, puesto que este delta presenta valores diferentes si los compuestos son de origen endógeno o exógeno. El análisis para confirmar el consumo de testosterona o de alguno de sus precursores se hace evaluando el delta de c13/c12 de los metabolitos mayoritarios androsterona y etiocolanolona, porque son los más fáciles de detectar, debido a las concentraciones en las que excretan. Los resultados que arrojan estos análisis la convierten en una técnica única para dilucidar un posible consumo de testosterona o sus precursores.
Los inhibidores de la aromatasa y del citocromo P-450 son sustancias que tienen un efecto marcado sobre el metabolismo de la testosterona, inhibiendo su degradación a otros compuestos. Los primeros actúan evitando su conversión irreversible a estrógenos, bloqueando la acción mediada por la enzima aromatasa (3) como se muestra en la Figura 1, en la cual la testosterona, por un proceso de aromatización del anillo a del esqueleto ciclopentanoperhidrofenentreno, se transforma en estradiol.
Los excesos de testosterona circulante, debido a su ingesta o a la de prohormonas, aumentan la concentración de estradiol, lo que trae como consecuencia la feminización en varones con aparición de galactorrea, ginecomastia, cambios en la voz y alteraciones en la piel, entre otros efectos (3). Para evitar éstos, los deportistas la utilizan concomitantemente con antiestrogénicos del tipo inhibidores de la aromatasa, logrando además que haya acumulación de testosterona y en consecuencia todos los efectos anabólicos que ésta produce. Por estas razones los antiestrogénicos (ejemplo la 3, 6, 17 androstenetriona, objeto de este estudio) se encuentran prohibidos por la Agencia Mundial Antidopaje (WADA, por su sigla en inglés) desde el año 2003, y desde su inclusión en la lista han sido prohibidos unas veces en hombres y otras veces tanto en hombres como en mujeres, siendo ésta la situación actual (4).
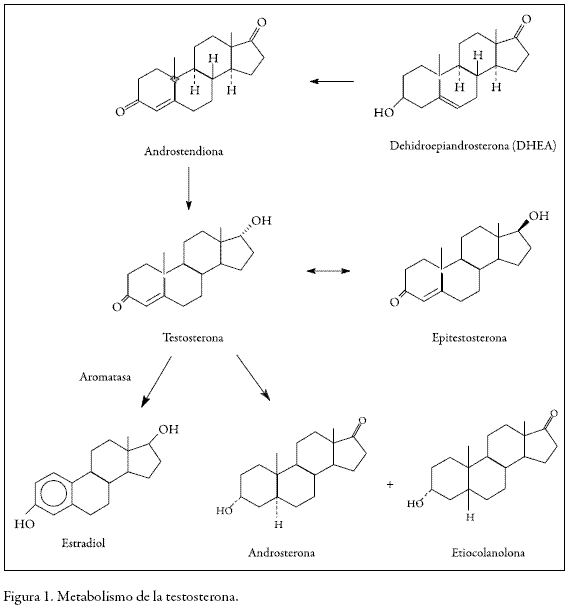
Por otra parte, la testosterona tiende a eliminarse del organismo por medio de otro mecanismo diferente a la aromatización, como es la formación de metabolitos más polares mediante la conjugación con el ácido glucurónico y la formación de sulfatos solubles en agua, reacción que es llevada a cabo por el citocromo p-450 3A4. éste cataliza hidroxilaciones de numerosos sustratos arreactivos, haciéndolos más fácilmente metabolizables mediante un conjunto de reacciones en los que las sustancias potencialmente tóxicas y normalmente hidrófobas se convierten en derivados hidrosolubles menos tóxicos que pueden excretarse con mayor facilidad (5). Los citocromos son hemoproteínas a las que se denomina globalmente citocromo p-450, suelen encontrarse en las membranas del retículo endoplasmático de los hepatocitos, en glándulas suprarrenales, en tejidos involucrados en el procesamiento de alimentos y en los testículos, localizados en las mitocondrias y en el retículo endoplasmático liso (6).
La inhibición del citocromo P-450 ocasiona mayores niveles de la sustancia original, prolongación de los efectos intrínsecos y una mayor incidencia de intoxicación. En el caso de la testosterona, ésta tiende a acumularse y permanecer más tiempo en el organismo, incrementando sus efectos anabólicos.
Algunos inhibidores del citocromo incluyen: antimicóticos, como el ketoconazol (7), itraconazol y fluconazol; antibióticos, como claritromicina, eritromicina y troleandomicina; antidepresivos, como la nefazodona; inhibidores de la proteasa de VIH, como indinavir y ritonavir (3). Se han encontrado reportes de que el jugo de toronja, el cual contiene dos furanocumarinas: la 6', 7'-dihidroxibergamottin (DHB) y el bergamottin poseen el mismo efecto (8). Los análogos alquiloxi-furanocumarinas (del tipo bergamottin) inhiben la actividad del citocromo P-450 3A4 (CYP3A4), de una manera tiempo- dependiente en forma irreversible (9, 10).
El bloqueo intencional de las dos principales rutas metabólicas (aromatización y degradación vía citocromo P-450) está siendo aprovechado en forma fraudulenta por algunos deportistas, los cuales utilizan preparados farmacéuticos que contienen sustancias antiestrogénicas, como la 3, 6, 17 androstenetriona y bloqueadoras del citrocromo P-450, como la DHB, para aumentar las concentraciones de testosterona y de otros endógenos, mantenerlas más tiempo circulando dentro del organismo o estimular la biosíntesis de testosterona (11).
La técnica de gases-combustión-espectrometría de isótopos estables (GC-C-IRMS), que se utiliza en este estudio para establecer el origen de la testosterona, consiste en que los componentes de una mezcla que han sido previamente separados por cromatografía de gases pasan a un horno de combustión donde son convertidos en CO2 y H2O. Estas moléculas pasan a través de una membrana de Nafion que retiene el agua. El CO2 libre de humedad entra a un detector de tiempo de vuelo, el cual tiene tres copas de Faraday que analizan m/z 44 que corresponde a CO2 (C12O16), 45 que corresponde a CO2 (C13O16) y 46 que corresponde a CO2 (C13O16O17). La composición isotópica varía, dependiendo de las condiciones ambientales en que se formen los compuestos. Por ejemplo: en una planta depende de las características del suelo, del agua, de la cantidad de luz, etcétera. En el caso de los metabolitos de la testosterona, el delta de carbono13/ carbono12 depende del lugar donde fue sintetizada: el cuerpo humano o un laboratorio. Hay dos criterios para evaluar los valores de delta y así saber si las sustancias analizadas presentan valores compatibles con sustancias de origen exógeno:
— Establecer unos valores de referencia con la población colombiana, que en nuestro caso son: androsterona: δ%o C13/C12 = entre -17,5 y -23,2
Etiocolanolona: δ%o C13/C12 = entre -18,0 y -23,8
—Establecer el valor del delta de un endógeno de referencia (sustancia que no se ve afectada por el consumo de testosterona o sus precursores exógenos) y compararlo con el delta de los metabolitos androsterona y etiocolanolona de la muestra.
Si la diferencia es de más de 3 unidades de delta, se considera que el resultado es compatible con consumo de sustancias exógenas (12).
METODOLOGíA
Estudios de excreción
Los estudios de excreción se realizaron en cuatro individuos sanos así:

Los dos primeros individuos consumieron sólo el inhibidor de la aromatasa, y los otros dos, la combinación de éste con el inhibidor del citocromo P-450. Los medicamentos se administraron en dos tomas de dos tabletas cada 6 h, tratando de simular la dosificación diaria recomendada, y se recogieron todas las orinas de 4 días a partir de la toma de los medicamentos y una orina anterior a la toma (0 horas) como referencia para el perfil hormonal basal.
Los perfiles de excreción se obtuvieron al graficar la concentración de cada uno de los endógenos vs tiempo. La concentración se obtuvo de curvas de calibración utilizando eion m/z = 432 para la testosterona, epitestosterona y dehidroepiandrosterona (DHEA), el ion m/z = 434 para la androsterona y etiocolanolona y el ion m/z = 241 para 5 alfa diol y 5 beta diol.
Metodología de extracción para GC-MS
Las muestras se procesaron siguiendo el método del screening iv (anabolizantes) del Laboratorio de Control al Dopaje de coldeportes, descrito en el pos prep 001 y que se describe a continuación:
Se tomaron 3 mL de orina y se verificó que el pH estuviera entre 5 y 7. Se adicionó 1 mL de buffer de fosfatos pH 7, 50 µl de β-glucuronidasa de E. coli y 50 µl de metiltestosterona de 10 µg/mL (estándar interno). La mezcla se calentó a 55 °C por una hora. Posteriormente se adicionaron 200 µl de carbonato de potasio (pH = 10) y se hizo una extracción L-Lcon 5 mL de metilterbutiléter. La capa orgánica se llevó a sequedad. Luego se adicionaron 50 µl de MSTFA adicionado con yoduro de amonio y ditioeritritol y se calentó a 65 °C por 30 minutos. Los extractos se inyectaron en un cromatógrafo de gases con detector selectivo de masas 6890-5975 marca Agilent. La columna utilizada fue una Ultra 1 de 25 metros con 0,2 mm de diámetro interno y 0,11 µm de espesor de la fase estacionaria.
Metodología de extracción para GC-C-IRMS
Se tomaron 5 mL de las orinas que presentaron los máximos de excreción para androsterona y etiocolanolona y se pasaron a través de un cartucho c18 Polar Plus (previamente acondicionado), se lavaron dos veces con 5 mL de agua y se eluyeron con metanol. El extracto orgánico se llevó a sequedad y se adicionó 1 mL de buffer de fosfatos pH 7, 50 µl de β-glucuronidasa de E. coli y 50 µl de metiltestosterona de 10 µg/mL (estándar interno). La mezcla se calentó a 55 °C por una hora. El extracto se pasó nuevamente por cartuchos c18 Polar Plus (previamente acondicionados) utilizando como efluente 5 mL de las siguientes mezclas:
—Acetonitrilo: agua 50:50 (lavado).
—Acetonitrilo: agua 75:25. Fracción de interés: contiene androsterona, eticolanolona y epitestosterona.
Esta última fracción se llevó a sequedad y se prepararon derivados acetilados adicionando 50 µl de piridina, 50 µl de anhídrido acético y calentando a 60 ºC durante una hora. Los extractos se inyectaron en un cromatógrafo de gases unido a una interfase de combustión y acoplado a un sistema de espectrometría de masas de isótopos estables Delta v Plus Thermoscientific. La columna utilizada fue una HP-50 de 30 metros con 0,24 mm de diámetro interno y 0,15 µm de espesor de la fase estacionaria.
RESULTADOS
Resultados gc-ms
Para obtener los valores de concentración de la testosterona, epitestosterona, DHEA y metabolitos por GC-MS, se utilizaron los cromatogramas, los cuales permiten relacionar el área bajo la curva con la concentración. Con el fin de calcular las concentraciones de los endogenos bajo estudio, se preparó un calibrador que contenía dichas sustancias en las concentraciones de referencia establecidas para los deportistas colombianos (Tabla 2).

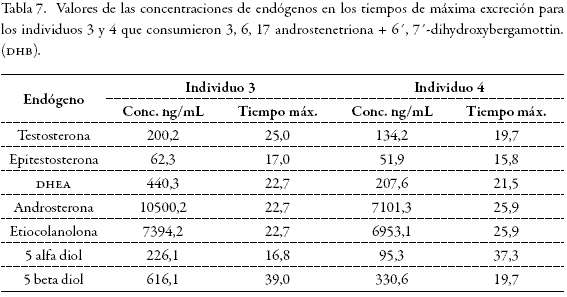
Se hallaron los valores basales para cada uno de los individuos que participaron en el ensayo y la relación entre los endógenos cuantificados (Tablas 3 y 4). Después de administrar los medicamentos se hallaron los tiempos de máxima excreción para los individuos 1 y 2, que consumieron solamente 3, 6, 17 androstenetriona, y para los individuos 3 y 4, que consumieron la combinación de 3, 6, 17 androstenetriona + 6', 7'-dihydroxybergamottin (DHB) (Tablas 5 y 6).
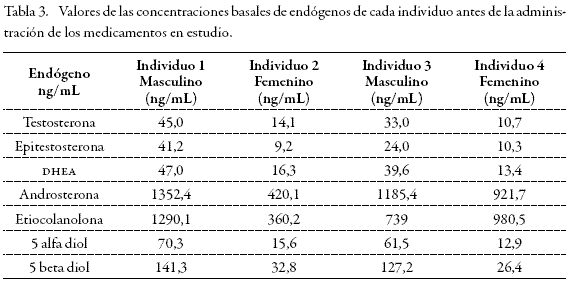

Después de administrar los medicamentos se hallaron los tiempos de máxima excreción para los individuos 1 y 2, que consumieron solamente 3, 6, 17 androstenetriona, y para los individuos 3 y 4, que consumieron la combinación de 3, 6, 17 androstenetriona + 6´, 7´-dihydroxybergamottin (dhb) (Tablas 5 y 6).



ANALISIS DE RESULTADOS
Inicialmente se hizo una evaluación de los perfiles hormonales de los individuos antes de la ingesta del medicamento, como punto de referencia para establecer las tendencias en las variaciones de las concentraciones de los endógenos una vez se ingiriera el medicamento. Esta evaluación mostró que se encontraban dentro de los valores normales de referencia establecidos para los deportistas colombianos, tanto en las concentraciones como en las relaciones (Tablas 2, 3 y 4). En todos los casos las concentraciones de las hormonas en las mujeres fueron más bajas, como era lo esperado.
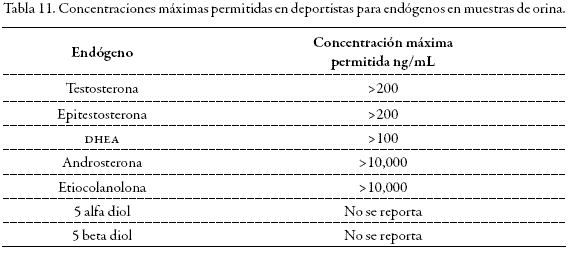
Después de la administración de dos dosis de 300 mg de 3, 6, 17 androstenetriona (6-Oxo), en los voluntarios 1 y 2, se observó aumento paulatino de la concentración de todos los endógenos evaluados hasta alcanzar valores máximos de excreción cerca de las 23 horas, excepto en el 5 alfa diol, que se logró hasta las 37 horas. El comportamiento en general de todos los endógenos es como el que presentaron la androsterona y la eticolanolona, con una distribución en forma de campana gausiana con máximos y mínimos de excreción (Figura 2). Ninguno de los valores calculados, excepto el de la DHEA, permite por sí solo configurar un hallazgo analítico adverso o caso positivo para dopaje, debido a que las concentraciones estuvieron por debajo de las máximas permitidas por WADA (12) para sospechar del uso de una sustancia prohibida (Tabla 11). En todos los casos, después de las 60 horas ya se habían restablecido los valores basales.
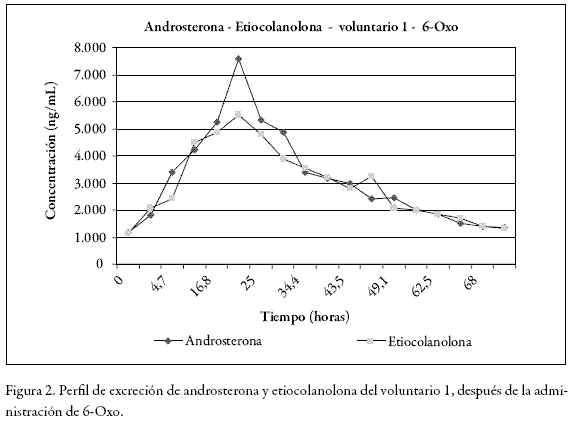
También encontramos que en los dos voluntarios hubo un aumento marcado en las concentraciones de testosterona y dehidroepiandrosterona (DHEA), que se elevaron entre 4 y 6 veces respectivamente, en comparación con los valores basales. Esta situación es concordante con lo reportado en la literatura (13), que establece como mecanismo hipotético de acción para la 6-Oxo la inhibición suicida de la aromatasa, que se une irreversiblemente a la enzima y la desactiva permanentemente. Por ésto, el consumo continuo de este tipo de sustancias puede causar una reducción global en la concentración de las aromatasas y explica la acumulación de testosterona, como se puede observar en la Tabla 5, metabolitos de testosterona (androsterona y etiocolanolona) o endógenos que sean metabolizados por ellas. El aumento observado en la concentración de DHEA puede deberse probablemente a que la 6-Oxo también entra en una ruta metabólica en la que se transforma en la hormona precursora de la testosterona (Figura 1). Esto también explicaría el por qué algunos autores le atribuyen una actividad hormonal directa o de prohormona y el por qué es promocionada en Internet como generadora de testosterona, gracias al efecto combinado de inhibir la aromatasa, impidiendo la degradación de la testosterona y formar parte de la ruta metabólica para la síntesis de ésta. El análisis de GC-C-IRMS también permitió confirmar sus cualidades como prohormona, pues los valores de δ%o C13/C12 para androsterona y etiocolanolona son consistentes con administración de una sustancia exógena, que fue responsable del aumento de la testosterona y, en consecuencia, de sus metabolitos.
Los valores de androsterona y de etiocolanolona (principales metabolitos de la testosterona) también aumentaron notablemente; sin embargo, nunca alcanzaron valores superiores a 10000 ng/mL que condujeran a estudios posteriores por IRMS.
Administración de 3, 6, 17 androstenetriona (6-Oxo) + 6',7'-dihydroxybergamottin (DHB)
Posteriormente se les administró a dos nuevos voluntarios un mezcla de 3, 6, 17 androstenetriona (6-Oxo) + 6', 7'-dihydroxybergamottin (DHB), sustancias que bloquean dos de las rutas metabólicas de la testosterona, la primera, como se mencionó, por inhibición de la aromatasa, y la segunda, por bloqueo del hierro que tiene la enzima citocromo P-450, impidiendo que otros sustratos como la testosterona puedan ligarse a él para ser metabolizados.
Todas las muestras de este estudio, al igual que las del anterior, fueron recolectadas durante cuatro días y extraídas utilizando hidrólisis enzimática, posteriormente una extracción líquido-líquido, utilizando solventes poco polares que garantizaban la extracción de todas las hormonas que tienen una estructura esteroidea, lo que les confiere características liposolubles.
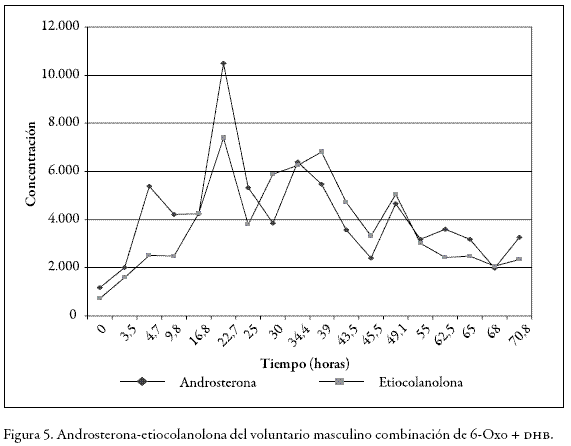
En esta parte del estudio encontramos que los perfiles hormonales basales de los voluntarios 3 y 4 (Tablas 3 y 4) fueron alterados mucho más que cuando se administró la 3, 6, 17 androstenetriona (6-Oxo) solamente. Los valores para dhea, testosterona y epitestosterona, en el caso del voluntario de sexo masculino, alcanzaron valores de 440 ng/mL, 200 ng/mL y 62 ng/mL respectivamente aumentándose 10 veces más en comparación con los valores basales en los tiempos de máxima excreción, como lo muestra la Figura 3.
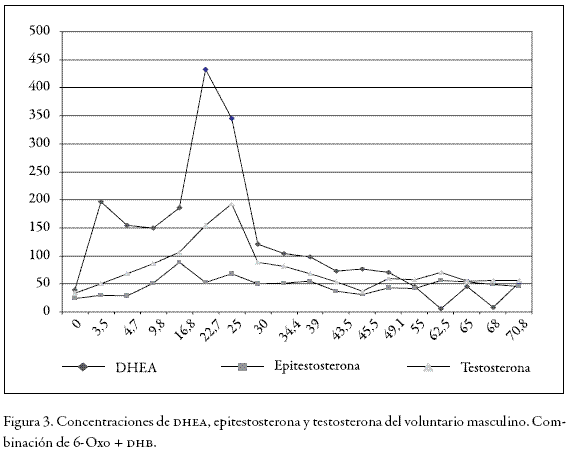
En la Figura 3 se observa que con esta dosificación las concentraciones de dhea sobrepasan los límites establecidos para configurar un hallazgo analítico adverso (100 ng/ mL) o caso positivo en dopaje, entre la primera y las 39 horas siguientes a la administración. Sin embargo, en ningún momento la relación T/E es mayor a 4 y el máximo valor obtenido fue de 3,3 para el voluntario masculino (Figura 4), hallazgo que resulta sorpresivo, pues se esperaría un aumento de esta relación porque al aumentar la concentración de testosterona exógena disminuye la concentración de epitestosterona. Una explicación probable a este resultado es que al inhibirse el citocromo P-450 se acumula también la poca epitestosterona que se produce; lo que además está de acuerdo con la literatura, en la cual se establece que al inhibir los mecanismos de degradación los compuestos endógenos tienden a acumularse (14, 15,16).
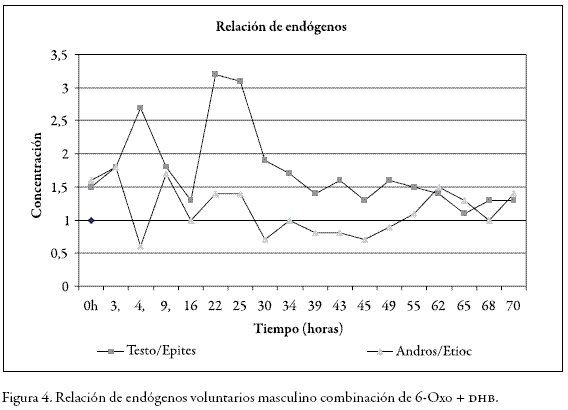
En Figura 4 se puede ver que la relación androsterona/etiocolanolona se mantiene entre 0,5 y 1,7, a pesar de que las concentraciones se encuentran muy elevadas, como se observa en la Figura 5. Esta relación no se ve afectada, porque los dos son metabolitos de la testosterona y por consiguiente su excreción aumenta de forma proporcional a la misma.
Este estudio resolvió la inquietud de establecer si el aumento en las concentraciones de los metabolitos se debía a la acumulación de testosterona por el bloqueo de sus principales vías metabólicas (aromatasa y citocromo P-450) o si se debía a que la 6-Oxo entra en una ruta metabólica en la que se transforma en la hormona precursora de la testosterona dhea y posteriormente en testosterona. Este interrogante sólo pudo solucionarse analizando los metabolitos androsterona y etiocolanolona mediante la técnica cromatografía de gases-combustión-espectrometría de isótopos estables (IRMS). Estas medidas dieron como resultado en el experimento ‐en el que sólo se administró 6-Oxo- que esta sustancia sí intervenía en la ruta metabólica porque los metabolitos analizados de la testosterona presentaron deltas de carbono 13/carbono 12 característicos de sustancias exógenas.
Si se comparan los valores de delta obtenidos en los dos experimentos, se puede evidenciar que para los individuos 1 y 2, que sólo consumieron 6-Oxo, el delta presenta un valor mucho menos negativo (y menos alejado de los valores basales) que para los que consumieron la combinación de 6-Oxo y DHB. Esta diferencia seguramente se deba a que en los que consumieron los dos medicamentos se combinaron en forma sinérgica los dos mecanismos de inhibición de la degradación de la testosterona, como ocurre con muchos otros medicamentos, que administrados conjuntamente, suman y en algunas ocasiones potencian sus efectos (17, 18). Por una parte, la 6-Oxo, al producir testosterona, inhibe la producción endógena de ésta por un mecanismo de feedback, y por el otro lado, la testosterona sintetizada en forma exógena no es degradada rápidamente por el bloqueo de dos de sus principales rutas metabólicas, como son la aromatasa y el citocromo P-450, haciendo que la composición isotópica de las moléculas que se analizan tengan una proporción mayor de carbono 13 exógeno.
Los resultados de este estudio nos permiten entender por qué los medicamentos que contienen un inhibidor de la aromatasa y uno del citocromo P-450 se encuentran de moda en los gimnasios y en las personas que practican algún deporte y que de una u otra forma quieren en forma rápida aumentar de masa muscular, pues esta combinación no solamente induce a la biosíntesis de testosterona, sino que evita que ésta sea degradada garantizando una permanencia más larga en el organismo generando los efectos anabólicos deseados.
CONCLUSIONES
-
El consumo de las sustancias estudiadas afectó el perfil hormonal de todos los voluntarios aumentando especialmente las concentraciones de los endógenos testosterona y DHEA, así como sus metabolitos, aunque las alteraciones fueron más drásticas cuando se administró la combinación de 6-Oxo y DHB.
-
En ninguno de los dos casos estudiados (administración de 6-Oxo y administración de la combinación 6-Oxo-DHB) se observó que la relación T/E aumentara a valores superiores a 4 (valor límite establecido por WADA), de manera que no se podría establecer un hallazgo analítico adverso o caso positivo partiendo de este único criterio.
-
El único valor que permitiría establecer la presencia de un hallazgo analítico adverso es la concentración de DHEA, pues en los dos casos superó el valor límite de 100 ng/mL.
-
Se confirmó que la 6-Oxo, además de tener un efecto anitestrogénico, también es una prohormona que entra en la ruta sintética de la testosterona.
AGRADECIMIENTOS
A COLDEPORTES, que proporcionó todos los elementos para llevar a cabo este estudio.
BIBLIOGRAFIA
1. P. V. Eenoo y F. T. Delbeke, Metabolism and excretion of anabolic steroids in doping control, Journal of Steroid Biochemistry & Molecular Biology, 101, 161- 178 (2006). [ Links ]
2. D Catlin y C. Hatton, Use and abuse of anabolic and other drugs for atletic, Advances in Internal Medicine, 36, 1415-1420 (1991). [ Links ]
3. J. Hardman, L. Limbird y A. Gilman, Goodman & Gilman, "Las bases farmacológicas de la terapéutica", McGraw Hill Eds., Décima edición, pp. 1655, 1039, 1382, 1454-1456. [ Links ]
4. World Antidoping Agency. List of prohibited substances. 2009 http://www.wada-ama.org. [ Links ]
5. T. McKee y J. McKee, "Bioquímica, la base molecular de la vida", McGraw Hill Eds. Tercera edición, pp. 309-310. [ Links ]
6. Omura, T. Forty years of cytochrome P-450. Biochem Biophys Res. Commun 266, pp. 690-698 (1999). [ Links ]
7. R. Grucza, J. Smorawinski y D. Kwiatkowska, Application of Ketoconazole test in doubtful Doping Cases Of Polish Athletes. Recent Advances in Doping Analysis (7) Proceedings of the Manfred Donike Workshop 17th Cologne Workshop on Dope Analysis 14th to 19th march 1999, pp. 347-352. [ Links ]
8. M. Paine, A. Criss y P. Watkins, Two major grapefruit juice components differ in time to onset of intestinal CYP 3A4 inhibition, The Journal of Pharmacology and Experimental Therapeutics, 312(3), 1151-1160 (2005). [ Links ]
9. Y. Naritomi, et al., Utility of microtiter plate assays for human cytochrome P-450 inhibitions studies in drug discovery, Drug Metab. Pharmacokinet, 19, 55-61 (2004). [ Links ]
10. E. C. Row, S. A. Brown, A. V. Stachulski y M. S. Lennard, Design, synthesis and evaluation of furanocoumarin monomers as Inhibitors of CYP3A4, Org Biomol Chem., 4(8), 1604-1610 (2006). [ Links ]
11. U. Marek y G. Sigmund et al. identification of non-steroidal aromatase inhibitors in doping analysis. Recent Advances in Doping Analysis (11) Proceedings of the Manfred Donike Workshop 21 Cologne Workshop on Dope Analysis, pp. 91-96 (2003). [ Links ]
12. World Anti-Doping Agency, TD2004EAAS: Reporting and evaluation guidance for Testosterone, Epitestosterone, T/E ratio and other endogenous steroids. 1.0 (2004) http://www.wada-ama.org.co [ Links ]
13. Incledon, T. The chronic effects of androst-4- ene-3, 6, 17-trione on endocrine responses in resistance-trained,Journal of the American Dietetic Association, 103, 38-39 (2003). [ Links ]
14. P. Glue and R. P. Clement, Cytochrome P-450 enzymes and drug metabolismbasic concepts and methods of assessment, Cellular and Molecular Neurobiology, 19(3), 309-323 (1999). [ Links ]
15. Pierre Lafite, Sylvie Dijols, Didier Buisson, Anne-Christine Macherey, Darryl C. Zeldin, Patrick M. Dansette, and Daniel Mansuy Design and synthesis of selective, high-affinity inhibitors of human cytochrome P450 2J2. Bioorg Med Chem Lett, 16(10), 2777-2780 (2006). [ Links ]
16. M. A Gibbs, et al., Persistent inhibition of CYP3A4 by ketoconazole in modified Caco-2 cells. Journal of Pharmaceutical Sciences 91(9), 1923-1935 (2002). [ Links ]
17. Flórez, J. et al., "Farmacología humana", Masson Eds., Tercera edición, pp. 178- 184 (2004). [ Links ]
18. Gómez M.. Farmacología General II: farmacodinámica. Portales medicos.com (2007). [ Links ]














