Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.38 no.1 Bogotá Jan./June 2009
Artículo de Investigación
Extracto y fracción alcaloidal de Annona muricata con actividad de tipo ansiolítica en ratones
Anxiolytic-like effect of the extract and alkaloid fraction from Annona muricata in mice
Vivian Oviedo1, Mildred García2, Cecilia Díaz 3, Mariel Marder 4, Mirtes Costa5, Javier Rincón 1, Ceferino Sánchez 6, Mario Guerrero1
1 Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, A. A: 11430. Correo electrónico: mfguerrerop@unal.edu.co
2 Departamento de Fisiología, Escuela de Medicina, pronaplamed, Universidad de Costa Rica, San José, Costa Rica, 2060, Costa Rica. Correo electrónico: mildredg@cariari.ucr.ac.cr
3 Instituto Clodomiro Picado, Facultad de Microbiología y Departamento de Bioquímica, Escuela de Medicina, URC. Correo electrónico: cdiaz@cariari.ucr.ac.cr
4 iquifib, Facultad de Farmacia y Bioquímica. Junin 956, (C1113AAD), Buenos Aires (Argentina). Correo electrónico: mmarder@qb.ffyb.uba.ar
5 Universidade Estadual Paulista Júlio de Mesquita Filho, Instituto de Biociências, Departamento de Farmacología. Correo electrónico: mcosta@ibb.unesp.br
6 Facultad de Medicina, Universidad de Panamá. Correo electrónico: ceferino@promed.com.pa
Recibido para evaluación: abril 20 de 2009. Aceptado para publicación: mayo 18 de 2009.
RESUMEN
Se evaluó el efecto neurológico ejercido por el extracto hidroalcohólico (40%) obtenido de las hojas de Annona muricata (0,5 g/kg, vo) en ratones albinos ICR mediante pruebas tendientes a detectar posible actividad de tipo anticonvulsivante (electrochoque- pentilentetrazol), antidepresiva (nado forzado), hipnótica (potenciación de sueño barbitúrico) y ansiolítica (laberinto en cruz). Además se examinó la unión con radioligando del extracto a receptores de benzodiazepina, se efectuó el análisis fitoquímico y a la fracción alcaloidal obtenida se le aplicó la prueba del laberinto en cruz (0,5 g/kg, vo), según los resultados previos obtenidos con el extracto. Finalmente se evaluó la toxicidad del extracto (0,1-10 mg/mL) sobre las líneas celulares ECV-304 y k562. Los hallazgos sugieren que compuestos de tipo alcaloidal presentes en Annona muricata tendrían efectos de tipo ansiolítico (53% y 58% de tiempo y frecuencia de acceso a las zonas abiertas en la prueba de laberinto en cruz elevado), no vinculados la activación de receptores de benzodiacepinas y carentes de efectos citotóxicos in vitro. Estos datos ayudan a dar soporte al uso etnobotánico de esta especie.
Palabras clave: Annona muricata, ansiolítico, alcaloide, sistema nervioso central, cribado farmacológico, ratón de laboratorio.
ABSTRACT
The present study evaluated the neuropharmacological effect exerted by the hydroalcoholic extract (40%) obtained from leaves of Annona muricata (0.5 g/kg, po) in ICR albino mice using tests to detect anticonvulsant (electroshock-pentylenetetrazol), antidepressant (forced swimming test), hypnotic (barbiturate sleeping time) and anxiolytic activities (elevated plus maze). The putative binding of the extract to the benzodiazepine receptor by radioligand techniques was also studied. The phytochemical analysis of the extract led to the isolation of an alkaloid fraction that was evaluated in the elevated maze test (0.5 g/kg, po), in agreement with previous results obtained with the extract. Finally, it was assessed the toxicity of the extract (0.1-10 mg/ml) in cell lines k562 and ECV-304. The results suggest that alkaloid metabolites present in Annona muricata exert anxiolytic effects (53% and 58% of the time and frequency of access to open areas in the elevated plus maze), unrelated to the activation of benzodiazepine receptors and without cytotoxic effects in vitro. These data help support the ethnobotanical use of this plant specie.
Key words:: Annona muricata, anxiolytic, alkaloid, central nervous system, drug screening, laboratory mouse
INTRODUCCION
Los trastornos de ansiedad, en sus diversas formas, ocupan la mayor prevalencia entre los trastornos mentales y causan gran efecto en la morbilidad de la población mundial (1).
Factores de orden psicológico, biológico, genético y ambiental inciden en su etiopatogenia (2, 3) configurando sus diferentes tipos: pánico, ansiedad generalizada, fobias, estrés postraumático y desorden obsesivo compulsivo (4). En todos ellos se requiere siempre un abordaje psicoterapéutico, pero con frecuencia también farmacológico (2, 5).
Cuando están indicados, mediante el uso adecuado de psicofármacos como benzodiacepinas, antidepresivos tricíclicos e inhibidores selectivos en la recaptación de serotonina, se consigue mejoría en la mayoría de los casos de trastornos de ansiedad; no obstante, persiste un grupo de pacientes que abandona la medicación: por sus efectos adversos, en unos casos, o por su escasa respuesta, en otros (6). Fuentes de origen natural podrían ser la base para la consecución de nuevas alternativas terapéuticas (7, 8).
Se utiliza popularmente con fines tranquilizantes la infusión de las hojas de A. muricata (N. V. "guanábana") y otras especies de la familia Annonaceae (9-11). Entre los principales metabolitos de esta especie figuran acetogeninas y alcaloides isoquinolínicos (12), cuyo interés farmacológico y toxicológico es materia de investigación. Aunque a los compuestos de tipo alcaloidal se les han atribuido posibles efectos de tipo sedante y antidepresivo (13, 14), no existe información suficiente obtenida de pruebas de cribado sobre el sistema nervioso central que dé soporte a estos usos. En este estudio se muestran efectos neurológicos en ratones de laboratorio inducidos por el extracto hidroalcohólico (40%) de A. muricata y la fracción alcaloidal obtenida de su análisis fitoquímico.
METODOLOGIA
Obtención y caracterización del extracto
El material vegetal fresco de A. muricata se recolectó en la región de Guápiles (Limón, Costa Rica) y se clasificó en el Herbario Nacional de Costa Rica con el código 1363. El extracto de las hojas se preparó por maceración de 750 g de material vegetal seco y molido con etanol al 40% después de calentar a 50 °C, dejando en reposo durante 24 horas. Posteriormente el extracto se filtró y se concentró en rotavapor a presión reducida hasta sequedad total y por último se liofilizó.
Al extracto seco obtenido se le determinó la presencia de metabolitos secundarios utilizando las reacciones de precipitación: Dragendorff, Mayer, Valser y Reineckato de amonio y preparaciones en cromatografía en capa delgada, utilizando cromatofolios de silicagel HF254, con la mezcla de solventes CHCl3:CH3OH en proporción: 6:4 y los reveladores UV, Dragendorff modificado, NP/PEG y Godin.
Fracción alcaloidal
El extracto hidroalcohólico seco (3,1 g) se trató con 20 mL de HCl al 5%, a 60 °C, seguido por un proceso de filtración en el que se pasó a un embudo de decantación y se alcalinizó con amoniaco hasta pH 8. Posteriormente se realizó una extracción con 3 x 50 mL de CH2Cl2, se separó la fase orgánica y se secó con Na2SO4. Finalmente, se concentró en rotavapor, se pesó y se evaluó por reacciones de precipitación y por cromatografía en capa fina (15).
Animales
Se utilizaron ratones ICR machos de siete a nueve semanas de edad, suministrados por el bioterio del Departamento de Farmacia de la Universidad Nacional de Colombia. Se mantuvieron en condiciones controladas de temperatura (22 + 1 °C) y humedad (60%), expuestos a ciclos de luz y oscuridad de 12 horas, con agua y alimento a libre demanda. Se utilizaron en número de ocho a diez por tratamiento.
Fármacos y soluciones
Se utilizaron los siguientes fármacos y soluciones: difenilhidantoína (Epamín® suspensión –Parke Davis–), clonazepam (Rivotril® gotas –Roche–), clorhidrato de imipramina (Sigma), diazepam, (Valium® ampolla –Roche–) y pentilentetrazol (PTZ, Sigma). El vehículo utilizado fue agua destilada.
Convulsión máxima inducida por electrochoque
Se siguió el procedimiento descrito por Swinyard et al. (16). Los animales se dosificaron por vía oral con el extracto (0,5 g/kg), difenilhidantoína (20 mg/kg, control positivo) o agua destilada (0,1 mL/10 g de peso, control negativo). Una hora después, luego de instilar una gota de solución salina isotónica en cada ojo, se les aplicó, vía corneal, una descarga de corriente alterna de 60 Hz, 50 mA y 20 ms (estimulador eléctrico E13-51 –Coulbourn Instruments®–), para provocar una convulsión de tipo tónico clónico generalizado. El criterio de protección fue la ausencia de extensión tónica de las extremidades posteriores.
Convulsión inducida por pentilentetrazol
Se siguió el procedimiento descrito por Swinyard et al. (16). Los animales se dosificaron por vía oral con el extracto (0,5 g/kg), clonazepam (0,5 mg/kg, control positivo) o agua destilada. Una hora después se les inyectó pentilentetrazol (80 mg/kg, s. c.) y se observaron durante una hora para determinar la presencia o ausencia de convulsiones clónicas en cabeza, tronco o extremidades con una duración mínima de cinco segundos (16).
Prueba de nado forzado
Se siguió el procedimiento descrito por Porsolt et al. (17-18). Los animales se dosificaron con el extracto (0,5 g/kg, vo), imipramina (15 mg/kg, i. p.) o agua destilada (0,01 mL/g, vo). Una hora después se pusieron en cilindros plásticos que contenían agua hasta 13,5 cm de altura a temperatura aproximada de 22 °C. Durante un período de observación de cinco minutos, se registró el tiempo total de inmovilidad definido como aquel en el que el animal efectuó los movimientos apenas necesarios para mantener la cabeza a flote (17, 18).
Prueba de laberinto en cruz elevado
Se siguió el procedimiento validado por Lister para ratones (19), tras determinar el nivel basal de exploración del animal mediante la prueba de placa perforada (20). En ésta se determinó el número de veces que cada animal exploró, introduciendo la cabeza hasta el nivel de las orejas, orificios de 2 cm de diámetro dispuestos equidistantemente en una caja de acrílico (50 x 50 x 10 cm). Esto permitió distribuir uniformemente los tratamientos: extracto (0,5 g/kg, vo), diazepam (0,5 mg/kg, i. p.), fracción alcaloidal (0,5 g/kg, vo) o agua destilada (0,01 mL/g).
Transcurrida una hora de la dosificación, los animales se sometieron a la prueba del laberinto en cruz elevado. En un ambiente de baja iluminación (15 W) se registró durante un período de cinco minutos el número de ocasiones y el tiempo total en los que cada animal ingresó completamente tanto a la zona de brazos abiertos como a la de brazos cerrados del aparato. Cada uno de los brazos del laberinto tenía una dimensión de 30 x 5 cm, dispuestos en cruz, a una altura de 25 cm sobre la zona neutral: una plataforma central de 5 x 5 cm. Al comienzo de cada sesión se situó al animal sobre esta zona con el eje del cuerpo hacia una zona cerrada.
Prueba de sueño inducido por éter etílico
Se siguió el procedimiento descrito por Vieira (21), en el que se aplican para el éter etílico los criterios de la prueba de potenciación de sueño barbitúrico descrita por Carlini et al. (22). La prueba tiene la ventaja de que este anestésico no arroja los falsos positivos propios de aquellas sustancias que compiten con pentobarbital por el metabolismo microsomal hepático. Una hora después de la dosificación con el extracto (0,5 g/kg, vo), diazepam (0,5 mg/kg, i. p.), o agua destilada (0,1 mL/10g, vo) cada animal se situó en una cámara saturada con éter etílico (5 mL en frasco hermético con capacidad de 3 L). El ratón se retiró de la cámara 60 segundos después de la pérdida del reflejo postural. Se registró tanto el tiempo de latencia (tiempo que tarda en perder el reflejo de postura) como el de duración total de sueño (intervalo comprendido entre el momento en que pierde la postura y el momento en que la recupera).
Ensayo de unión al sitio de benzodiazepinas (su-BDZ)
El método empleado consiste en la inhibición de la unión del flunitrazepam tritiado ([3H]-FNZ, 81,8 Ci/mmol; NEN) a las fracciones semipurificadas de membranas sinap tosomales de corteza cerebral de rata lavadas exhaustivamente para eliminar el GABA endógeno presente.
Para la preparación de las membranas, los cerebros de ratas Wistar se disecaron rápidamente sobre hielo y las diferentes estructuras se homogenizaron en 10 volúmenes de sacarosa 0,32 M y se centrifugaron durante 10 min a 900 x g. El sobrenadante resultante se centrifugó 30 min a 100.000 x g y el pellet se lavó dos veces con buffer Tris HCl 25 mM, pH 7,4, a 100.000 x g durante 30 min. Las membranas así obtenidas se guardaron a -20 °C hasta su utilización. Las muestras de membranas, que contenían 0,2-0,4 mg de proteína, se suspendieron en buffer 0,25 mM Tris-HCl, pH 7,3 hasta un volumen final de 1 mL. La incubación se realizó a 4 °C durante 60 min con una solución de [3H]-FNZ 0,6 nM. La unión inespecífica se determinó en incubaciones paralelas con la presencia de FNZ en una concentración de 3 µM, y representó un 5-15% del total. Los ensayos se terminaron por filtración al vacío a través de papel Whatman GF/A, después de tres lavados con 3 mL del medio de incubación. Seguidamente se tomaron los filtros y se contó la radiactividad en un contador líquido de centelleo (Tracor) después de adicionar 1,5 mL de fluido de centelleo (OptiPhase 'HiSafe 3'). Todos los ensayos se realizaron por triplicado. En todos ellos las fracciones se disolvieron en buffer: etanol (1:1) con una cantidad de DMSO que no excedió el 1% del volumen final del ensayo. El FNZ se disolvió en etanol (23).
Pruebas de citotoxicidad
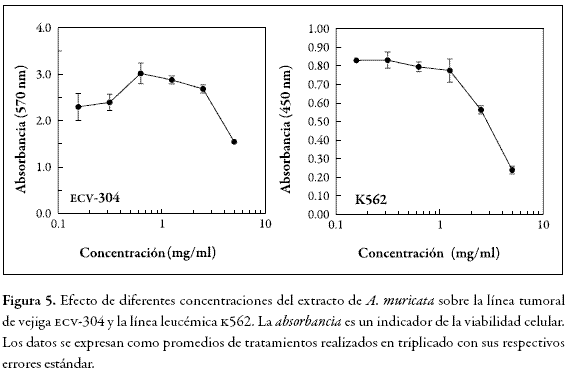
Dos líneas celulares k562 (vejiga) y ECV-304 (leucemia), obtenidas de la compañía American Type Culture Collection (ATCC) se incubaron por 48 horas con un rango de concentración de 0,1 a 10 mg/mL del extracto de A. muricata disuelto en PBS. El efecto citotóxico se evaluó mediante las técnicas de MTT (3-[4,5-dimetiltiazol-2-ilo]- 2,5-difeniltetrazol) y XTT (2,3-bis[2-metoxi-4-nitro-5-sulfofenil]-2Htetrazolio-5-carboxianilida), cuyos valores de absorbancia a 570 y 450 nm, respectivamente, indican el grado de viabilidad celular. El desarrollo de la coloración es proporcional al estado oxidativo de las células, por lo que una disminución en la absorbancia implica una disminución en la supervivencia celular. Los experimentos se realizaron por triplicado (24, 25).
Análisis estadístico
Los datos se expresaron en términos de promedio ± el error estándar (ems), excepto los referentes a las pruebas de convulsiones, que por ser de carácter cuantal (presencia o ausencia de convulsión), se examinaron mediante la prueba de x2 (26). A los datos obtenidos en las pruebas de nado forzado y laberinto en cruz elevado se les aplicó un análisis de varianza de una vía seguido de la prueba de diferencias múltiples de Tukey/ Kramer. En la prueba de sueño inducido por éter se aplicó la prueba no paramétrica de Mann Whitney. Los resultados obtenidos en las pruebas de convulsión y de laberinto en cruz se expresaron en términos de porcentaje de protección anticonvulsivante y de tiempo y de frecuencia de acceso a las zonas abiertas, respectivamente. El valor de p adoptado como significativo fue < 0,05. Se utilizaron la hoja de cálculo excel® y el paquete estadístico SPSS® para el procesamiento de los datos.
Aspectos éticos
Las pruebas in vivo efectuadas, incluso las de convulsiones experimentales, que son las que representan mayor riesgo neurológico, son definitivamente indispensables para identificar posibles efectos farmacológicos y no se dispone de técnicas alternativas que las reemplacen con el suficiente grado de sensibilidad. Se utilizó el menor número posible de animales que permitiera efectuar los análisis estadísticos. Todos los procedimientos se efectuaron con sujeción a los principios del cuidado de animales de laboratorio estipulados en la resolución 8430 de 1993, del Ministerio de la Protección Social de Colombia, y a las directrices éticas de la Organización Mundial de la Salud.
RESULTADOS
Extracto hidroalcohólico y fracción alcaloidal
Las reacciones preliminares de precipitación con los reactivos de Dragendorff, Mayer, Valser y Reineckato de amonio dieron positivas para alcaloides. También se identificó la presencia de flavonoides y se confirmó la presencia de alcaloides en la muestra acidulada con HCl al 5% por medio de ccd utilizando CHCl3:CH3OH, 6:4 como solvente y los reactivos de NP/PEG y Dragendorff modificado.
Convulsión máxima inducida por electrochoque y por PTZ
En las Figuras 1 y 2 se observa que los patrones utilizados en las pruebas de convulsiones inducidas por electrochoque y PTZ –difenilhidantoina y clonazepam– confirieron altos índices de protección (80% y 90%, respectivamente). El efecto del extracto, en cambio, no difirió del control.

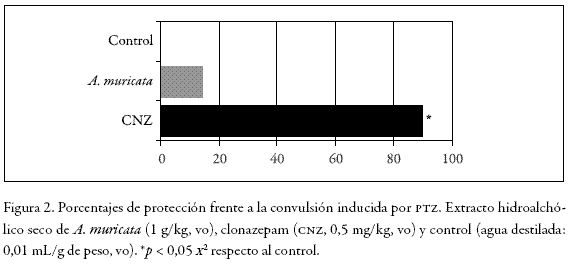
Nado forzado
En la Figura 3 se observa el tiempo total de inmovilidad de los animales al ser expuestos a la prueba de nado forzado durante 5 minutos, que fue significativamente menor en el caso de imipramina con respecto tanto al extracto de A. muricata como al control (93, 180 y 210 s, respectivamente).
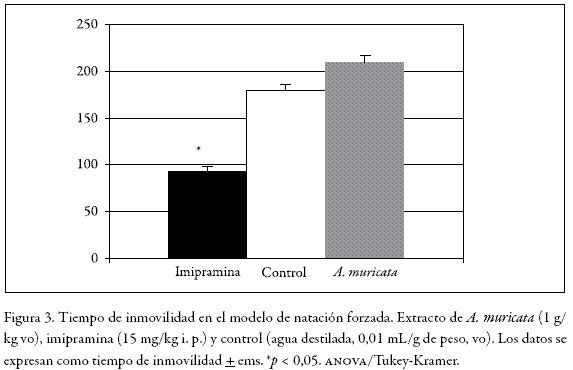
Laberinto en cruz elevado (lce)
En la Figura 4 se observa que tanto diazepam como el extracto y la fracción alcaloidal de A. muricata ejercieron efectos significativamente superiores tanto en frecuencia (59, 45 y 58% frente a 20%) como en tiempo (69, 45, 52% frente a 16%) de acceso a las zonas abiertas.
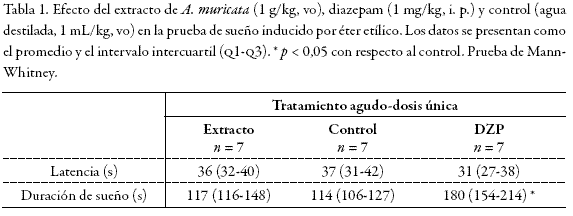
Sueño inducido por éter
En la Tabla 1 se observa que el agente patrón utilizado, diazepam (0,5 g/kg, vo) mas no el extracto de A. muricata, aumentó el tiempo de sueño inducido por éter etílico con respecto al control (180, 117 y 114 s, respectivamente).
Ensayos de unión al sitio de benzodiazepinas
El extracto de A. muricata en el rango de 100 a 300 µg/mL no inhibió la unión del ligando marcado [3H]-FNZ en las condiciones del ensayo.
Ensayo de citotoxicidad
Como se observa en la Figura 5, el extracto de A. muricata solamente presentó toxicidad a concentraciones mayores de 1 mg/mL para el caso de la línea k562 y 2 mg/mL para la línea ECV-304
DISCUSION
En este estudio se observa que el extracto hidroalcohólico (40%) obtenido de las hojas de A. muricata no confiere protección anticonvulsivante frente a la descarga eléctrica ni frente a pentilentetrazol; tampoco logra disminuir el tiempo de inmovilidad en la prueba de nado forzado, ni ejerce efectos hipnóticos, a juzgar por la prueba de sueño inducida por éter. No obstante, ejerce efectos significativos en los parámetros de frecuencia y tiempo de acceso a las zonas abiertas en la prueba de laberinto en cruz, efecto que tiende a aumentarse cuando se evalúa la fracción alcaloidal obtenida del análisis fitoquímico. Estos resultados habrán de considerarse dentro de las limitaciones de un estudio de dosis única; no obstante, cotejados con los obtenidos en las pruebas in vitro de unión al sitio de benzodiacepinas y viabilidad celular, sugieren que A. muricata tiene metabolitos de tipo alcaloidal con efectos de tipo ansiolítico, no relacionados con mecanismos benzodiazepínicos y sin efectos citotóxicos.
Alcaloides isoquinolínicos como annonaina, nornuciferina y asimilobina se han descrito en los frutos de A. muricata, y es posible que estén presentes también en alguna cantidad en las hojas. Se les han atribuido posibles efectos de tipo antidepresivo relacionados con interacción sobre el receptor 5-HT1A (13,14). Aunque en este estudio, a juzgar por la prueba de Porsolt, no hay elementos para apoyar efectos de este tipo, en pruebas posteriores conviene utilizar un protocolo de administración sostenida que mejore la sensibilidad de la respuesta (27).
A juzgar por los resultados de este trabajo, parece improbable que mecanismos gabaérgicos estén implicados en la farmacodinamia de la fracción alcaloidal de A. muricata: no se fijan al sitio de unión de benzodiazepinas y carecen de efectos protectores frente a las convulsiones inducidas tanto por pentilentetrazol como por electrochoque. Se describe que pentilentetrazol ejerce mecanismos inhibitorios sobre GABA y que agentes gabaérgicos del tipo benzodiazepinas y barbitúricos protegen de las convulsiones inducidos por estos dos métodos. Aunque otros autores han señalado algún efecto protector de los alcaloides de A. muricata frente a pentilentetrazol, éstos serían discretos porque si bien logran aumentar el tiempo de latencia antes de la convulsión y disminuir la mortalidad asociada, carecen de la eficacia suficiente para prevenir la crisis (28). Paralelamente parece también improbable que mecanismos bloqueantes de canales de sodio estén implicados, en virtud de la ausencia de protección frente a la descarga eléctrica máxima.
Aunque existen numerosas pruebas orientadas a detectar agentes con potencial ansiolítico, la de laberinto en cruz elevado (elevated plus maze) sigue siendo la más utilizada. Su sensibilidad alcanza a agentes con mecanismos de acción diversa, tales como antagonistas 5-HT3, agonistas 5-HT1A y benzodiacepinas (29-30), si bien la prueba no suele ser útil para detectar grupos farmacológicos del tipo de los antidepresivos tricíclicos e inhibidores selectivos de recaptación de serotonina, que también se usan como agentes ansiolíticos (2, 31). En consecuencia, teniendo en cuenta el perfil neurofarmacológico evidenciado por A. muricata en este trabajo, conviene establecer si mecanismos serotoninérgicos, eventualmente vinculados con los receptores 5-HT3 o 5-HT1A son los responsables de la actividad farmacológica de los alcaloides de esta especie.
Aunque el hecho de evidenciar escasos efectos sobre la viabilidad de las líneas k562 y ECV-304 sugiere que el extracto de A. muricata carecería de importantes efectos citotóxicos agudos, debe señalarse que desde luego se trata de una prueba in vitro que, como tal, no es extrapolable al organismo in vivo y no cabe hacer afirmaciones ligeras sobre la seguridad farmacológica de su uso por la población. Por cierto, el consumo de los frutos y la infusión de las hojas de esta especie parece ser un importante factor en la fisiopatogenia de una forma atípica de parkinsonismo de la Costa Caribe centroamericana, particularmente en la isla de Guadalupe, asociada a demencia y signos oculomotores (32).
No obstante, los estudios realizados hasta la fecha señalan a acetogeninas, lactonas producto de la combinación de ácidos grasos de cadena larga (c32 ó c34) con una unidad de 2-propanol en el carbono 2, como los probables responsables de la neurotoxicidad de A. muricata. Su compuesto mayoritario es anonacina, y su mecanismo de toxicidad se relaciona con la inhibición de la cadena respiratoria en la mitocondria (33), factor a su vez vinculado con sus efectos citotóxicos (34).
Si bien los alcaloides han mostrado también efectos neurotóxicos in vitro en neuronas dopaminérgicas, su potencia es de orden micromolar, en tanto que la de anonacina es de orden nanomolar y son las acetogeninas las particularmente tóxicas sobre la mitocondria (35). En todo caso, es necesario que en estudios posteriores se discrimine cuál es el papel específico que los alcaloides de A. muricata desempeñan en la toxicidad neurológica crónica que induciría esta especie.
En conclusión: compuestos de tipo alcaloidal presentes en las hojas de A. muricata ejercerían efectos ansiolíticos, lo que ayuda a dar soporte al uso etnobotánico de esta especie. Se requieren mayores estudios con el fin de identificar los alcaloides responsables de la actividad farmacológica, precisar su mecanismo de acción y determinar su perfil de seguridad.
AGRADECIMIENTOS
Al Proyecto X.8: "Obtençao de Medicamentos Innovadores com Atividade Ansiolítica/ Antidepresiva a partir de Plantas Medicinais Iberoamericanas Validadas" del Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo CYTED; a la División de Investigación de Bogotá, Vicerrectoría de Investigación, Universidad Nacional de Colombia (Proyecto Hermes 9334).
BIBLIOGRAFIA
1. J. P. Lepine, The epidemiology of anxiety disorders: Prevalence and societal costs, J. Clin. Psychiatry, 63, 4 (2002). [ Links ]
2. Stein, E Hollander, editors. "Textbook of anxiety disorders", American Psychiatric Publishing Eds., Arlington (VA), 2003. [ Links ]
3. J. M. Gorman, J. M. Kent, G. M. Sullivan y J. D. Coplan, Neuroanatomical hypothesis of panic disorder, Am. J. Psychiatry, 157, 493 (2000). [ Links ]
4. American Psychiatric Association, "Diagnostic and statistical manual of mental disorders", Washington, 2009. [ Links ]
5. A. Stoudemire, Epidemiology and psychopharmacology of anxiety in medical patients, J. Clin. Psychiatry, 54 suppl 5, 64 (1993). [ Links ]
6. J. C. Ballenger. Panic disorder in primary care and general medicine. En: "Panic disorder and its treatment", Ed. por J. F. Rosenbaum y M. H. Pollack, Dekker Inc, New York, 1998, pp. 1-36. [ Links ]
7. M. S. Butler, The role of natural product chemistry in drug discovery, J. Nat. Prod., 67, 2141 (2004). [ Links ]
8. P. Vuorelaa, M. Leinonenb, P. Saikkuc, P. Tammelaa, J. P. Rauhad, T. Wennberge y H. Vuorela, Natural products in the process of finding new drug candidates, Curr. Med. Chem., 11, 1375 (2004). [ Links ]
9. J. Tortoriello y, O. Romero, Plants used by Mexican traditional medicine with presumable sedative properties: An ethnobotanical approach, Arch. Med. Res., 23, 111 (1992). [ Links ]
10. J. F. Morton, A survey of medicinal plants of Curacao, Econ. Bot., 22, 87 (1968). [ Links ]
11. M. M. Iwu, "Handbook of african medicinal plants", crc Eds., Boca Ratón, 1993, p. 113. [ Links ]
12. G. S. Kim, L. Zeng, F. Alali, L. L. Rogers, F. Wu, S. Sastrodihardjo y J. L. Mc Laughlin, Muricoreacin and murihexocin c, mono-tetrahydrofuran acetogenins, from the leaves of Annona muricata, Phytochemistry, 49, 565 (1998). [ Links ]
13. J. A Hasrat, L. Pieters, J. P. De Backer, G. Vauquelin y A. J. Vlietinck, Screening of medicinal plants from Suriname for 5-HT1A ligands: Bioactive isoquinoline alkaloids from the fruit of Annona muricata, Phytomedicine, 4, 133 (1997). [ Links ]
14. J. A Hasrat, T. De Bruyne, J. P. De Backer, G. Vauquelin y A. J. Vlietinck. Isoquinoline derivatives isolated from the fruit of Annona muricata as 5-HTergic 5-HT1A receptor agonists in rats: unexploited antidepressive (lead) products, J. Pharm. Pharmacol, 49, 1145 (1997). [ Links ]
15. A. Sanabria, "Análisis fitoquímico preliminar", Universidad Nacional de Colombia Eds., Facultad de Ciencias, Departamento de Farmacia, Bogotá, 1983, pp. 65-69. [ Links ]
16. E. A. Swinyard, W. C. Brown y L. S. Goodman, Comparative assays of antiepileptic drugs in mice and rats, J. Pharmacol. Exp. Ther., 106, 319 (1952). [ Links ]
17. R. D. Porsolt, G. Anton, N. Blavet y M. Jalfre, Behavioural despair in rats: A new model sensitive to antidepressant treatments, Eur. J. Pharmacol, 47, 379 (1978). [ Links ]
18. R. D. Porsolt, P. Martin, A. Lenegre, S. Fromage y K. Drieu, Effects of an extract of Ginkgo biloba (EGB 761) on "learned helplessness" and other models of stress in rodents, Pharmacol. Biochem. Behav., 36, 963 (1990). [ Links ]
19. R. G. Lister, Ethologically-based animal models of anxiety disorders, Pharmacol. Ther., 46, 321 (1990). [ Links ]
20. S. E. File y S. Pellow, The effects of triazolobenzodiazepines in two animal test of anxiety and in the holeboard, Br. J. Pharmacol., 86, 729 (1985). [ Links ]
21. R. A. Vieira, Avaliacao da possivel atividade central da Stachytarpheta cayennensis (gervao-roxo). M. Sc. Dissertacion, Farmacologia, Universidade Federal de Santa Catarina, 2001. [ Links ]
22. E. A. Carlini, J. D. Contar, A. R. Silva-Filho, N. G. Silveira-Filho, M. L. Frochtengarten y O. F. Bueno, Pharmacology of lemongrass. Effects of teas prepared from the leaves on the laboratory animals, J. Ethnopharmacol., 17, 37 (1986). [ Links ]
23. F. S. Duarte, M. Marder, A. A. Hoeller, M. Duzzioni, B. G. Mendes, M. G. Pizzolatti y T. C. De Lima. Anticonvulsant and anxiolytic-like effects of compounds isolated from Polygala sabulosa (Polygalaceae) in rodents: In vitro and in vivo interactions with benzodiazepine binding sites, J. Ethnopharmacol. (Berl), 197, 351 (2008). [ Links ]
24. F. Denizot y R. Lang, Rapid colorimetric assay for cell growth and survival, modifications to the tetrazolium dye procedure giving improved sensitivityand reliability, J. Immunol. Methods, 89, 271 (1986). [ Links ]
25. C. P. Cordero y, F. A. Aristizábal, Evaluación preliminar in vitro de citotoxicidad de extractos vegetales, empleando métodos colorimétricos, Rev. Colomb. Biotecnol., 4, 100 (2003). [ Links ]
26. S. Siegel, "Estadística no paramétrica", Trillas Eds., México, D. F., 1991, p. 120. [ Links ]
27. M. J. Detke, M. Rickels e I. Lucki, Active behaviors in the rat forced swimming test differentially produced by serotoninergic and noradrenergic antidepressants, Psychopharmacology, 121, 66 (1995). [ Links ]
28. P. N'Gouemo, B. Koudogbo, H. P. Tchivounda, C. Akono-Nguema y M. M. Etoua, Effects of ethanol extract of Annona muricata on pentylenetetrazol-induced convulsive seizures in mice, Phytother. Res., 11, 243 (1997). [ Links ]
29. G. R. Dawson y M. D. Tricklebank, Use of the elevated plus-maze in the search for novel anxiolytic agents, Trends. Pharmacol. Sci., 16, 33 (1995). [ Links ]
30. S. Hogg, A review of the validity and variability of the elevated plus-maze as an animal model of anxiety, Pharmacol. Biochem. Behav., 54, 21 (1996). [ Links ]
31. F. Borsini, J. Podhorna y D. Marazziti, Do animal models of anxiety predict anxiolytic-like effects of antidepressants, Psychopharmacology (Berl)., 163, 121 (2002). [ Links ]
32. A. Lannuzel, G. U. Höglinger, S. Verhaeghe, L. Gire, S. Belson, M. Escobar- Khondiker, P. Poullain, W. H. Oertel, E. C. Hirsch, B. Dubois y M. Ruberg, Atypical parkinsonism in Guadeloupe: A common risk factor for two closely related phenotypes? Brain, 130, 816, (2007). [ Links ]
33. A. Cavé, B. Figade're, A. Laurens y D. Cortes, Acetogenins from Annonaceae. En: "Progress in the chemistry of organic natural products", Ed. por W. Herz, G. W. Kirby, R. E. Moore, W. Steglich y C. Tamm, Springer, Vienne, New York, 1997, pp. 81â288. [ Links ]
34. F. R. Chang, C. C. Liaw, C. Y. Lin, C. J. Chou, H. F. Chiu y Y. C. Wu, New adjacent Bis-tetrahydrofuran Annonaceous acetogenins from Annona muricata, Planta Med., 69, 241 ( 2003). [ Links ]
35. A. Lannuzel, G. U. Höglinger, P. Champy, P. P. Michel, E. C. Hirsch y M. Ruberg, Is atypical parkinsonism in the Caribbean caused by the consumption of Annonacae?, J. Neural Transm. Suppl., 70, 153 (2006). [ Links ]














