Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.38 no.2 Bogotá July/Dec. 2009
Artículo de Investigación
Modulación de la diferenciación de células dendríticas por antígenos tumorales pulmonares
Modulation of dendritic cell differentiation by lung tumor antigens
Edward Fabián Carrillo1,2,3, Gabriela Delgado1, Paulina Ojeda3, Carlos Alberto Rodríguez MD4, Miguel Ricardo Buitrago MD3, Fabio Ancízar Aristizábal1.
1 Grupo de Investigación en Inmunotoxicología.
2 Farmacogenética del Cáncer. Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia. Carrera 30 No. 45-03 Ciudad Universitaria, Ed. 450, Bogotá, D. C., Colombia.
3 Grupo de Investigación en Patología Molecular Pulmonar. Departamento de Patología, Hospital Santa Clara. ese. Carrera 15 No. 1-59 Sur, Bogotá, D. C., Colombia.
4 Departamento de Cirugía de Tórax, Hospital Militar Central. Transversal 3A No. 49-00, Bogotá, D. C., Colombia.
Recibido: 27 de julio de 2009. Aceptado: 7 de septiembre de 2009.
RESUMEN
El cáncer es, en la actualidad, un serio problema de salud pública en el ámbito mundial. Una de las aproximaciones más exploradas desde hace cerca de veinte años, es la inmunoterapia con células dendríticas (CD), células presentadoras de antígenos (CPA) profesionales. No obstante, los resultados de los estudios clínicos que emplean CD autólogas pulsadas con antígenos tumorales no han sido tan exitosos como se proyectaba. Una de las hipótesis propuestas que justifique la eficacia tan variable en los protocolos terapéuticos, es la inducción de tolerancia en las CD por los antígenos tumorales y la subsecuente baja actividad de las células efectoras (linfocitos T CD8+, CD4+ y Natural Killer). En este trabajo se evidencia que los antígenos tumorales provenientes de un adenocarcinoma pulmonar favorecen la reaparición de co-receptores como el CD14, conocido marcador de inmadurez en CD. Esto sugiere que en algunos aspectos las CD expuestas a tales antígenos, muestran defectos en la diferenciación. Como se sabe, las CD inmaduras tienen una potencia estimuladora mucho menor sobre las células efectoras, comparativamente con las CD de fenotipo maduro. Sin embargo, antígenos provenientes de la línea comercial A549 (adenocarcinoma) no produjeron cambios similares en la maduración de CD. Ello resalta la necesidad de caracterizar la respuesta individual in vitro al planear una terapia basada en CD, a fin de tener mayor probabilidad de éxito en el tratamiento.
Palabras clave: células dendríticas, cáncer pulmonar, inmunoterapia, antígenos tumorales.
ABSTRACT
Cancer is currently a very serious public health problem worldwide. Dendritic cell (DC) based immunotherapy has been one of the most active research fields during the last 20 years. However, results of several studies, mainly involving tumor antigen pulsed autologous DCs, have not been as successful as expected. Induction of a tolerant behavior of DCs upon the contact with tumor derived antigens is one of the hypotheses proposed since other effector cells like CD8+, CD4+ T lymphocytes and Natural Killers, would be rendered to a non-responsive state seriously impairing tumor growth control. In this work we found additional evidence about a likely DC differentiation defect caused by lung adenocarcinoma specific antigens freshly obtained from a patient, as suggested by the presence of the co-receptor CD14 on the surface of mature DCs (CD14 is a known marker for initial stages of DC differentiation). Our results confirm that some aspects in tumor antigen treated DCs resemble their immature phenotype, largely less efficient presenting cells, and very weak immune response inducers. Interestingly, tumor antigens obtained from the lung adenocarcinoma derived A549 cell line were unable to cause the same effect. This highlights the requirement for a complete characterization of the functional and phenotypic individual conditions when planning a DC based immunotherapy in order to have good success likelihood at cancer patient´s treatment.
Key words:: dendritic cell, lung cancer, immunotherapy, tumor antigens.
INTRODUCCION
Uno de los eventos más importantes de la respuesta inmune frente a los tumores es el procesamiento y presentación de los antígenos. Este proceso implica el reconocimiento, captura e internalización de los antígenos por parte de determinados tipos de células para presentarlos luego a los linfocitos T, encargados de promover etapas posteriores en la respuesta inmune. Las células encargadas de cumplir con estas funciones se denominan células presentadoras de antígenos (CPA), entre las cuales las más eficaces son las células dendríticas (CD). Su función, como activadoras del sistema inmune, se describió por primera vez en los años setenta (2-6). La mayoría de las CD se diferencian a partir de progenitores mieloides comunes en la médula ósea, incluyendo las células de Langerhans y las CD intersticiales; sin embargo, un tipo adicional se deriva a partir de los precursores celulares del linaje linfoide. Los dos linajes se diferencian por marcadores de superficie característicos como, por ejemplo, el CD11c en CD del linaje mieloide o la expresión del receptor de IL-3 (IL-3R) y el interferón i (IF - α) en las del linaje linfoide (también conocidas como CD plasmacitoides).
En la práctica, dada la abundancia relativa y facilidad de obtención, la gran mayoría de las investigaciones se centra en las propiedades y función de las CD del linaje mieloide que pueden derivarse con relativa facilidad en el laboratorio, a partir de monocitos de sangre periférica cultivados en presencia del factor estimulante de colonia de granulocitos y macrófagos (GM-CSF) e interleuquina 4 (IL-4) durante 3 a 5 días, al cabo de los cuales se obtienen células dendríticas inmaduras (CDi). Aunque la fuente más común para obtener CD tipo mieloide son los monocitos, también se pueden obtener a partir de células de médula ósea, cordón umbilical, timo, amígdalas, piel y fluido sinovial (7, 8).
En el organismo, las células mieloides, que se diferencian de las CD, provienen de la médula ósea, y presentan altos niveles de ácido ribonucleico mensajero (ARNm) de las proteínas del complejo mayor de histocompatibilidad (CMH); sin embargo, el nivel del producto es bajo al igual que el nivel de moléculas coestimuladoras como CD40, CD80 y CD86. Las CDi tienen gran capacidad de capturar e internalizar diversas moléculas y microorganismos. Sin embargo, por el bajo nivel de expresión de las moléculas coestimuladoras, no tienen una buena capacidad de estimular linfocitos T. El contacto con diversas moléculas de origen bacteriano, viral, el daño tisular, la presencia de mediadores inflamatorios o ciertas citoquinas, constituyen estímulos inductores de diferenciación; lo cual se asocia con la localización de un gran número de proteínas CMH en la superficie junto con proteínas coestimuladoras, una mayor producción de IL-12 y la pérdida de la actividad fagocítica y de procesamiento de antígenos, características propias de las CD maduras (CDm) (9). El contacto con el antígeno ocurre en diversos niveles, no obstante, su activación no siempre involucra antígenos internalizados, y puede también generarse mediante el contacto con residuos celulares, producto de la apoptosis o necrosis. Además, es de resaltar que la maduración apropiada de las CD es dependiente de la presencia de linfocitos T CD4+ funcionales (10).
Hay diferentes grados de activación de las CD relacionados con la transición de un estado basal de reposo hacia un estado de activación. El conjunto de cambios fenotípicos que muestran las células durante su maduración, constituye una herramienta que permite establecer su grado de diferenciación. Entre los cambios que se observan se encuentran: una mayor capacidad para responder y enviar señales a los linfocitos T mediante la secreción de quemoquinas; la sobreexpresión de marcadores de superficie (moléculas coestimuladoras); la producción de citoquinas que favorecen la activación de linfocitos T; la activación de propiedades migratorias, cambios en su eficacia para procesar y presentar antígenos (sobreexpresión de moléculas CMH clase II y procesamiento extracelular); la modulación de su capacidad fagocítica; la actividad endocítica y cambios en su morfología, entre los más importantes (11, 12).
Basado en este conocimiento, las CD entraron a formar parte, en los últimos años, de esquemas de inmunoterapia para controlar diferentes tipos de neoplasias. Aprovechando su gran actividad como CPA capaces de activar linfocitos T CD4+ y CD8+, las CD se han incorporado en múltiples protocolos clínicos para su utilización con fines terapéuticos (27-30). Dichos protocolos clínicos tienen en común la diferenciación de CD autólogas a partir de precursores mieloides o linfoides, y la posterior transferencia al paciente una vez son estimuladas con antígenos tumorales y moduladas con mediadores solubles. Una aproximación terapéutica interesante, es la obtención de células de fusión que se generan a partir de células tumorales y de CD. Estas células expresan numerosos antígenos tumorales, además de altos niveles de moléculas clases I, II y moléculas coestimuladoras, contrarrestando la pérdida de la capacidad de presentación antigénica que normalmente se observa en células tumorales (31-34). El uso de este tipo de células es compatible con la coadministración de oligonucleótidos sintéticos como adyuvantes, estrategia con la cual se ha logrado incrementar y mantener la respuesta inmune inducida por células fusión in vivo.
Se ha encontrado que la respuesta inmune inducida por las CD se ve afectada por la ruta de administración. El protocolo óptimo, número de células, ruta y método de administración aún no están determinados, y corresponde más bien a los resultados clínicos y experimentales de casos particulares (35). Las CD se han inoculado en pacientes por vía subcutánea, intradérmica, intravenosa y por inoculación directa en el tumor. Algunos hallazgos permiten deducir que el método de administración más adecuado depende de la fisiopatología y grado de diseminación del tumor. Por ejemplo, una administración subcutánea ha sido mejor para tratar algunos tipos de melanoma (36), mientras que la vía intravenosa es la primera opción en inmunoterapia del cáncer pulmonar. Las CD administradas por vía intravenosa para tratar el cáncer pulmonar, se localizan primero en el pulmón, luego se redistribuyen al hígado, bazo y médula ósea, llegando a estar ausentes de nódulos linfáticos o incluso del tumor. Cuando las CD se administran por vía intradérmica, una pequeña cantidad migra a la región nodular linfoide. Lo cual no ocurre cuando la inoculación se realiza por vía subcutánea.
Se ha descrito que la actividad de las CD es un caso crítico en la inducción y mantenimiento de la respuesta inmune contra tumores, mediante la presentación de antígenos a células T específicas. Sin embargo, la situación real en la mayoría de los cánceres no corresponde con lo que se esperaría dadas las propiedades de las CD; pues en lugar de eliminarlos, o como mínimo controlar las células tumorales, en la mayoría de los casos crece el tumor, e incluso genera metástasis. En la actualidad se conocen diversos mecanismos mediante los cuales los tumores evaden la respuesta inmune, entre otros, la baja expresión de proteínas CMH de clases I y II, de proteínas coestimuladoras y de proteínas secretadas necesarias para la adecuada presentación antigénica (13).
Es de anotar que el éxito de este tipo de inmunoterapia autóloga depende de múltiples factores que, en conjunto, determinan que las personas con el mismo tipo de tumor, la misma evolución clínica y el mismo esquema terapéutico, no resuelvan del mismo modo la enfermedad.
En este sentido, se ha demostrado que uno de los principales factores responsables de la ineficiencia del sistema inmune para limitar el desarrollo tumoral, es la inducción de defectos en la función de las CD por parte de los antígenos tumorales a través de alteraciones en la maduración, lo cual sería mediado por varios factores derivados del tumor, como el factor de crecimiento vascular endotelial (VEGF), la interleuquina (IL) IL-6, IL-10, el factor estimulador de colonias de macrófagos (M-CSF) y las señales transductoras y activadoras de transcripción (STAT)-3 (14). La consecuencia es el incremento de la cantidad de CDi circulantes, con una notoria reducción del número de CDm competentes, lo cual en conjunto propicia una ineficiente activación de células T tumor-específicas. Esta hipótesis se ha soportado por observaciones en pacientes cuyo tumor es resecado quirúrgicamente y cuyo patrón de diferenciación normal de las CD se restablece, a la vez que se reduce la cantidad circulante de CDi (15).
Un mecanismo propuesto para evadir la respuesta inmune de las células tumorales, es la capacidad de promover la acumulación de células mieloides inmaduras (CMi) (16-18), población que incluye tanto a las CDi como a los macrófagos y granulocitos, y que puede detectarse mediante citometría de flujo por la expresión del marcador CD33 y la disminución de la expresión de moléculas de clase II. Las CMi ejercen una actividad supresora de la respuesta inmune mediante el incremento de actividad de la indolamina 2,3-dioxigenasa (IDO) (19) y de la arginasa I para producir especies reactivas de oxígeno que inhiben la proliferación de células T. Varios estudios han indicado la presencia de CMi en sangre periférica y nódulos linfoides secundarios de pacientes con varios tipos de cáncer, incluyendo el de mama, el hepático, el de próstata y el glioma maligno (20, 21).
Algunos estudios señalan que el VEGF, molécula importante en la angiogénesis, es supresor del desarrollo y maduración de las CD (22, 23). En el análisis histológico de tumores tipo carcinoma pulmonar de célula no pequeña (CPCNP), la expresión de VEGF y el grado de infiltración por CD están inversamente relacionados, relación que resulta de interés pronóstico. Una molécula cuya expresión en CPCNP se correlaciona de forma positiva con la expresión de VEGF es la cicloxigenasa-2 (COX-2). Su sobreexpresión en CPCNP se asoció en un estudio con un pronóstico desfavorable para el paciente (24). Además, en modelos animales se encontró que los sobrenadantes de cultivo de tejidos tumorales son capaces de suprimir un gran número de funciones en las CD, como el procesamiento de antígenos, la expresión de moléculas coestimulatorias y la secreción de IL-12 en una forma COX-2 dependiente (25). Por otro lado, la prostaglandina E2 (PGE2), un producto importante de la actividad COX-2, inhibe el desarrollo de las CD a partir de los precursores en médula ósea (26).
Con este conocimiento, y en aras de aportar al uso de las CD en inmunoterapia del cáncer, se considera fundamental la caracterización in vitro del tipo de respuesta que se genere cuando las CD pulsadas con antígenos tumorales se pretendan usar in vivo para el control de cierto tipo de neoplasias. En particular, para el tratamiento del cáncer pulmonar, la cantidad de antígeno que se obtiene de una masa tumoral es relativamente escasa, constituyéndose en una limitante al momento de pulsar las CD autólogas. Para otros tipos de tumor, se han empleado líneas celulares comerciales o previamente caracterizadas, algunos con resultados promisorios. En este trabajo, y similar a lo reportado por otros grupos, las líneas celulares de un mismo tipo histológico no se comportan de la misma forma que las células procedentes directamente del tumor, y que los antígenos tumorales "en fresco" presentan posiblemente una mayor capacidad de modular de forma negativa la maduración de CD. A este nivel, se caracterizan los rasgos fenotípicos de CD pulsadas con lisados tumorales, siendo éste un punto de partida para una subsecuente caracterización funcional que permita elucidar el potencial inmunoterapéutico de esta herramienta.
METODOLOGíA
Preparación de antígenos tumorales
Se obtuvieron masa tumoral y tejido normal procedentes del pulmón a partir del material quirúrgico resecado a un paciente diagnosticado con adenocarcinoma primario atendido en el hospital Santa Clara ese. Este material se transportó al laboratorio en 20 mL de medio de cultivo RPMI 1640 suplementado con penicilina/estreptomicina 2X. La muestra se lavó con RPMI, fragmentada en pequeños trozos (2 mm aprox.), suspendida en 5 mL de RPMI 1640 sin suplemento para después someterla a 30 ciclos de congelamiento y descongelamiento por inmersión repetida en nitrógeno líquido. El sobrenadante se separó por centrifugación y su contenido de proteínas se determinó espectrofotométricamente.
Obtención de células dendríticas (CD)
Para la diferenciación n vitro de CD se siguió el protocolo utilizado por Delgado et al. (2003). Brevemente, se tomó una muestra de aproximadamente 35 mL de sangre periférica utilizando tubos Vacutainer® heparinizados (Beckton Dickinson). De la muestra se aislaron cerca de 10-30 x 106 células mononucleares de sangre periférica (PBMC ) por gradiente de densidad (Lymphoprep, Nycomed Pharma as. Oslo, Norway), las cuales se suspendieron en 4 mL de medio RPMI 1640 con 10% de plasma autólogo. La suspensión se depositó en una caja de Petri de poliestireno previamente tratada durante 30 min con gamma globulina humana 10 µg/mL (icn Pharmaceuticals, Inc., EUA ). Dos horas después, las células no adheridas se removieron del cultivo, mientras que las células adheridas se lavaron dos veces con RPMI 1640 precalentado. Finalmente, se agregaron a las células 4 mL de medio RPMI 1640 suplementado con 10% de plasma autólogo, 250 ng/mL de GM -CSF (Leucomax, Essex Chimie SA, Lucerne) y 100 ng/ mL de il-4 (Pharmingen, San Diego, EUA ). Cada tercer día se agregaron cantidades iguales de ambas citoquinas inductoras de transformación. En el día siete, las células, aún en su fenotipo inmaduro (CDi), se colocaron en cultivos separados según el número de extractos proteicos por evaluar, y se trataron con 2 µg/mL de Poly I:C SIGMA(Sigma Chemical Co, eua ) para desencadenar la maduración de las cd y se pulsaron con 10 µg/ mL de extracto proteico tumoral y de tejido normal, preparado como se describió anteriormente. Se hizo también un cultivo control al que no se le agregó ningún extracto.
Caracterización fenotípica de CD por citometría de flujo
El fenotipo de las CD pulsadas con los diferentes extractos proteínicos se caracterizó por citometría de flujo [citómetro de flujo (Beckton Dickinson, San José, CA)], usando anticuerpos específicos para CD14, CD209 (DC-SIGN), CD83 y HLA DR-FITC (Pharmingen, San Diego, eua) en dilución 1:200. Los histogramas que miden la intensidad relativa de fluorescencia en los canales FL1 (FITC) y FL2 (PE) se construyeron y analizaron luego de la adquisición de 10.000 eventos por ensayo.
RESULTADOS Y DISCUSIÓN
Desde los primeros estudios enfocados en la función de las CD en pacientes con cáncer, se obtuvieron claras evidencias de que éstas no cumplían adecuadamente su función y que los defectos observados, afectan notablemente la diferenciación de las CD del linaje mieloide. Por otro lado, los efectos se observan a nivel sistémico en lugar de limitarse sólo a los tejidos tumorales, lo cual sugiere que son causados por factores solubles liberados por las células tumorales (37). En la práctica se observan tres alteraciones básicas como resultado de la afectación del desarrollo de este linaje: I) una producción notablemente disminuida de CDm funcionales competentes (38); II) la acumulación de células inmaduras; es decir, células comprometidas en la línea de desarrollo hacia las CD (CDi), pero que no pueden incrementar la expresión del CMH clase II (HLA-DR), ni producir adecuadamente las citoquinas funcionales esperadas (37), y III) una presencia aumentada de células mieloides inmaduras (CMi) (18). Los tres efectos se presentan con mayor intensidad a medida que el estadio neoplásico es más avanzado.
La gran capacidad para iniciar la activación de una respuesta inmune, hace de la terapia con CD autólogas una herramienta promisoria para el tratamiento del cáncer. La mayoría de las estrategias de vacunación aplicables clínicamente utilizan CD generadas a partir de monocitos (MNC) del mismo paciente, empleando diversas mezclas de citoquinas que incluyen el factor de necrosis tumoral (TNF)-α, IL-1β, IL-6 y PGE2 como las más usadas (39). Un procedimiento de terapia exitoso requiere que se optimicen las condiciones de tratamiento de las preparaciones celulares para obtener el mayor número de células maduras (CDm), dado que la administración de preparaciones heterogéneas que incluyan CDi puede resultar en la inducción de tolerancia en el paciente. Con el fin de seguir el fenotipo de las CD, se usa una serie de marcadores de maduración, es decir, moléculas que sean expresadas por las CDm pero no por los estadios inmaduros. Algunos de los marcadores de maduración utilizados son: CD83, CD80, CD83, HLA-DR, DC-SIGN, CD25 y CCR7 (40, 41). En el presente estudio, se monitoreó el grado de maduración de las CD mediante la detección de CD83, DC-SIGN y HLA-DR; y, además, se analizó la expresión de un marcador indicador de inmadurez en este linaje, el marcador CD14. Los tres marcadores de maduración mostraron el comportamiento esperado; es decir, el nivel de expresión encontrado en los mnc (células precursoras de las cd mieloides) es bajo y se incrementa notablemente a medida que adoptan las características de CDi y DCm. Los diagramas de las figuras 1 a 4 muestran el efecto del tratamiento de las cd en proceso de diferenciación con extractos proteicos obtenidos tanto del tejido tumoral como del tejido normal de un paciente con adenocarcinoma (AD) de pulmón, sobre la expresión de los cuatro marcadores en la superficie de las CD en distintos estadios de maduración (MNC, CDi y CDm). En ensayos paralelos se trataron cultivos similares con extracto proteico de la línea celular A-549, cuyo subtipo histológico primario es también el AD.
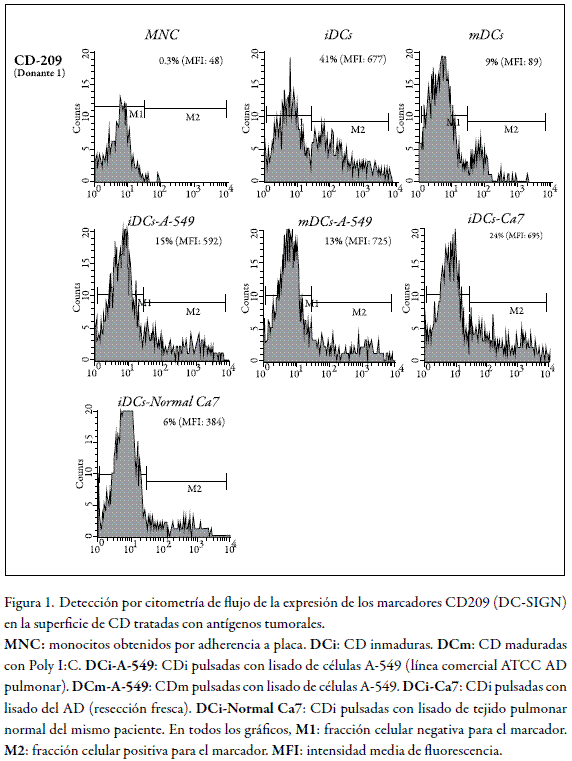
El marcador DC-SIGN (CD209) se monitoreó como indicador de la presencia de CD en las suspensiones celulares analizadas. Este marcador es una lectina tipo C (no integrina) reconocida como ligando de algunos patógenos como Leishmania (42) y algunos virus como el de la inmunodeficiencia humano (HIV-1) y el ébola. En el presente estudio, su expresión no se detectó en los MNC, mientras que en las CDi y CDm se detectó fácilmente (figura 1, nivel superior). El tratamiento de las CDi tanto con antígenos de A-549 como del AD no modificó significativamente la expresión de CD209, con respecto a lo observado en cultivos no tratados (figura 1, nivel medio).
Como se observa en el nivel inferior de la figura 1, las CDi tratadas con antígenos provenientes del tejido normal muestran un nivel de expresión bajo, si se compara con el tratamiento con extractos de origen neoplásico, e incluso menor que los cultivos no tratados con extracto alguno. En el gráfico ubicado en el nivel superior derecho de la figura 1, se observa que la fracción celular positiva para DC-SIGN es sólo del 9% (41% en CDi), al igual que la intensidad media de fluorescencia (MFI, por sus siglas en inglés) se reduce de 677 en CDi a 89. La MFI es un parámetro que permite relacionar la cantidad de moléculas expresadas en cada célula analizada en el citómetro; debido a que el brillo de los fluorocromos acoplados a los anticuerpos se capta como mayoritario, en la medida que dicho anticuerpo se acopla a más moléculas en la superficie de la célula interrogada por el láser durante la adquisición por citometría. Como lectina de tipo C implicada en la internalización de antígenos, DC-SIGN puede moverse desde la superficie celular a compartimentos endosómicos y lisosomales; por lo cual, la estrategia de detección por citometría usada aquí, que detecta únicamente las moléculas localizadas en la membrana, podría subestimar el nivel de expresión real. Otra posibilidad que explicaría la baja expresión de esta molécula, sería la citotoxicidad causada por el tratamiento con el Poly I:C empleado para inducir la maduración (2 µg/ml). En un estudio anterior, este compuesto (denominado ácido polirriboinosínico-polirribocitidílico) demostró un grado significativo de toxicidad en concentraciones tan bajas como 1 µg/ml en macrófagos; si bien en nuestros ensayos se observó también una elevada mortalidad celular que puede influir en las mediciones, los datos arrojados por los controles permiten valorar como específicos los efectos detectados.
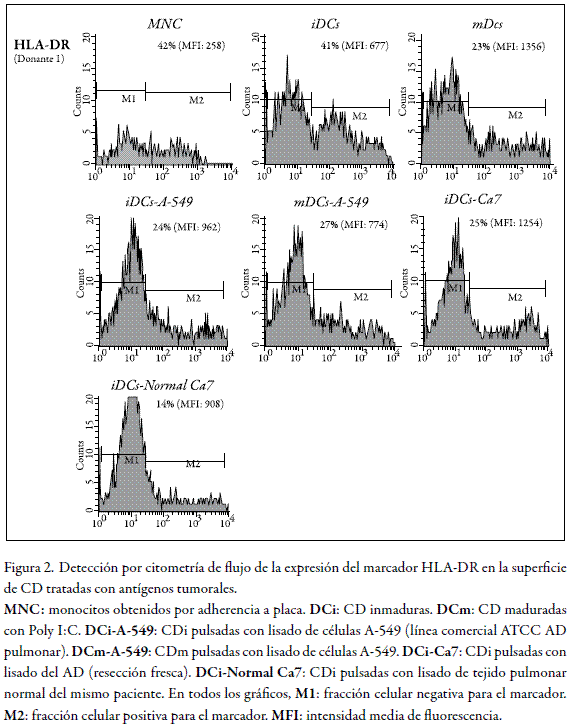
Las CD expresan en su superficie moléculas CMH de clase II. Las moléculas HLA-DR son las de mayor capacidad de presentación antigénica dentro de este grupo, y aun cuando el ARNm correspondiente está presente en estadios tempranos de la diferenciación de CD (MNC y CDi), la síntesis y localización en la membrana de la proteína ocurre con la maduración de modo que se detectan niveles incrementados en CDm. HLA-DR es el principal componente del complejo estimulador que interactúa con el receptor de las células T (TCR) en la superficie de los linfocitos T, activándolos mediante la inducción de diversos mecanismos moleculares.
En la figura 2, la fila superior del panel A muestra que los MNC expresan bajos niveles de HLA-DR, lo cual se evidencia por el valor de la intensidad media de fluorescencia indicada en la parte superior derecha del gráfico (MFI = 258); en CDi se encuentran niveles mayores (MFI = 667), y valores muy altos en CDm (MFI = 1.356). Los niveles de expresión de HLA-DR en CDi tras el contacto con antígenos tumorales provenientes tanto de la línea A-549 como del AD, coinciden en un incremento en la MFI que alcanzó valores de 962 y 1.254, respectivamente. Es interesante el hecho de que el nivel de expresión observado en CDi tratadas con extracto tumoral (Ca7), es comparable con el de CDm. El que dicho incremento sea más acentuado al utilizar el extracto de tumor comparado con el de una línea celular derivada del mismo tipo de tumor, sugiere que el extracto tumoral podría tener una composición distinta, en cuanto a los antígenos capaces de modular la expresión de HLA-DR. Es de resaltar que en CD tratadas con extracto de la línea A-549, y continuando hasta obtener células maduras (CDm), muestran un nivel de expresión menor de HLA-DR comparativamente con las CDm no tratadas (comparar tercera gráfica nivel superior con la segunda del nivel medio). Como se observa en el nivel inferior de la figura 2, este tratamiento generó un incremento leve en la expresión del HLA-DR (MFI = 908), similar a la expresión observada tras el tratamiento con el extracto de la línea A-549. Es necesario realizar estudios en donde los extractos proteicos sean fraccionados para lograr una caracterización completa del extracto tumoral e identificar las moléculas con mayor capacidad moduladora.
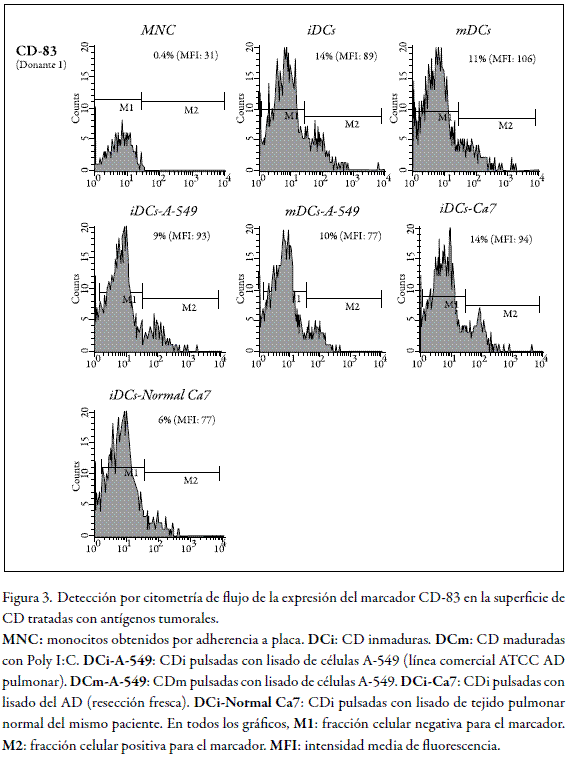
La activación de las células T, además de la señal de activación generada por las moléculas CMH clase II, requiere la participación de un conjunto de moléculas coestimuladoras, también presentes en la superficie de la célula presentadora. Una de ellas es CD83, un conocido marcador de maduración en CD (43, 44).
El gráfico superior izquierdo de la figura 3 muestra que en su expresión no se detectó MNC, mientras que en las CDi y CDm presentó niveles detectables aun cuando la MFI fue en general muy baja (segundo y tercer gráfico en el nivel superior de la figura 3). Por otro lado, la incubación de CDi con extractos tanto de la línea A-549 como del AD (Ca7) no produjo efecto alguno sobre la expresión de este marcador (gráficos primero y tercero del nivel medio). En cultivos continuados hasta la obtención de las CDm, tampoco se observó cambio alguno (segundo gráfico en el nivel medio), así como en cultivos que se trataron con extracto derivado del tejido normal (nivel inferior).
Finalmente, la figura 4 muestra el comportamiento de la expresión del marcador CD14. Esta proteína ha sido tradicionalmente considerada como marcador de MNC y de macrófagos (45); y en el contexto de la diferenciación de las CD, es un marcador de inmadurez, ya que su expresión es notablemente disminuida a medida que las CD progresan hacia CDm (nivel superior de la figura 4).
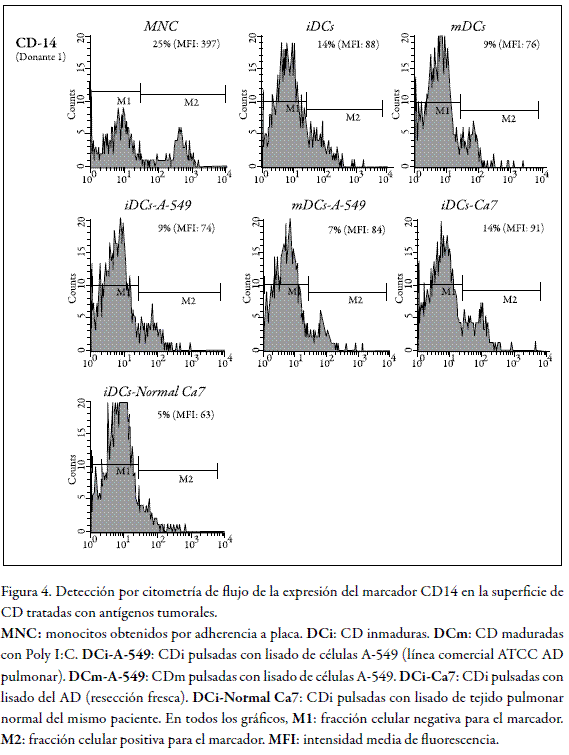
CD14 participa en procesos de señalización celular importantes (46), y tiene la capacidad de reconocer lipopolisacáridos, peptidoglicanos y ácido lipoteicoico, por lo cual se le reconoce como mediadora en la detección de moléculas antigénicas en la superficie de bacterias gram-negativas y gram-positivas (46, 47). Los gráficos en el nivel medio de la figura 4 revelan que en los cultivos de CDi tratados tanto con extracto proteico de la línea A-549 como con el extracto tumoral, existe una subpoblación significativa en la que se detecta CD14 y que aparece en el área M2 de cada gráfico (primero y tercero en el nivel medio), aun cuando los valores de MFI sólo reflejan levemente este hecho. Esta subpoblación claramente se encuentra ausente en CDi no tratadas (gráfico central, nivel superior) como en CDi tratadas con extracto de tejido normal (nivel inferior). CD14 es el más importante receptor de endotoxinas de monocitos y neutrófilos y se ha visto también involucrado en la apoptosis. Su presencia en la membrana disminuye progresivamente a medida que las células se comprometen y evolucionan en el linaje de las CD; no obstante, la selección de poblaciones celulares con base en la detección de este marcador es, en la mayoría de los casos, el primer paso en los estudios orientados a obtener CD. En concordancia con reportes de la literatura, los gráficos en el nivel superior de la figura 4 muestran que en los cultivos no tratados con extractos tumorales, la expresión de CD14 tiene un máximo en MNC y que disminuye progresivamente en CDi y en CDm. Este comportamiento se observa tanto al comparar los datos de fracción celular positiva (que disminuye del 25% en MNC al 9% en CDm) como en la MFI de cada histograma. Los gráficos correspondientes al tratamiento de los cultivos con extracto de la línea A-549 no reflejan grandes cambios en la fracción celular positiva o en la MFI. El tratamiento con el extracto tumoral (Ca7), por su parte, muestra un incremento muy leve tanto en la fracción celular positiva (14%) como en la MFI. Sin embargo, el análisis del comportamiento de todos los cultivos en el estadio de CDi, tratados con antígenos tumorales (A-549 y Ca7), muestra la presencia de una subpoblación bien diferenciada en la región M2 de los gráficos correspondientes, es decir, la fracción celular positiva. Nótese que es en el estado de los MNC en el que se observan subpoblaciones bien definidas en M1 y M2, y que en las CDi no tratadas y en las CDi tratadas con antígenos provenientes de tejido normal, no se detecta una fracción CD14+ claramente definida en la región M2, la cual sí se observa cuando los cultivos se tratan con antígenos tumorales.
Los efectos causados por los factores tumorales sobre el desarrollo de las CD aún se están evaluando: no sólo se toman extractos tumorales como fuente de antígeno, sino que también se emplea suero obtenido de pacientes con CPCNP (Krawczyk et al.) (48), en los cuales se presentan factores capaces de modular su diferenciación. Este estudio, en el cual se tomaron MNC como precursores de CD, incubados con suero obtenido de pacientes con CPCNP, mostró que los cultivos en donde se incluyó dicho suero, luego de 48 horas de incubación, tenían un mayor porcentaje de células CD1a+/ CD14+ que los cultivos suplementados únicamente con albúmina, lo cual es compatible con lo observado en el presente trabajo. Sin embargo, estos autores proveen también un punto de vista distinto. Según ellos, la disminución en la expresión de CD14 medida en los cultivos, se debe a la muerte celular (muerte de gran parte de los MNC cultivados) en lugar de su diferenciación en CDm. El sostenimiento del nivel de expresión cuando el medio de cultivo incluye antígenos tumorales por la presencia de suero autólogo es, entonces, un indicador de que este procedimiento provee un mejor microambiente de cultivo, en el cual las células están menos propensas a entrar en apoptosis. Aun cuando existe consenso general en que la funcionalidad de las CD se encuentra seriamente alterada en pacientes con cáncer, y que dicho efecto es mediado por factores solubles liberados por las células tumorales, es evidente que la caracterización molecular del mecanismo requiere el análisis paralelo de numerosos marcadores para ponderar correctamente el significado de la evidencia experimental.
ávila-Moreno et al. (49) encontraron que los factores solubles producidos por tumores pulmonares de tipo AD y carcinoma escamocelular (CEC), causan un incremento en la expresión en CD de varios marcadores mielomonocíticos in vitro, como CD14, CD16, CD32 y CD163. Sin embargo, los mediadores de los cambios observados podrían no ser los mismos en ambos casos; es decir, los distintos subtipos histológicos en cáncer pulmonar parecen usar mecanismos particulares para afectar la diferenciación de las CD y, por tanto, la respuesta inmune. éstos son aspectos importantes para tener en cuenta en el planteamiento de futuras investigaciones en este campo.
En resumen, extractos proteicos obtenidos tanto de tumores AD como de la línea A-549, tienen la capacidad de alterar el patrón de expresión del marcador CD14. Los resultados son compatibles con la literatura existente, y dan soporte a la idea consenso de que el bloqueo en la maduración de las células presentadoras, es uno de los mecanismos para evadir la repuesta inmune de las neoplasias pulmonares, como se describió en otros modelos. Sin embargo, no permiten excluir la explicación alternativa, según la cual la presencia de antígenos propios de tumores tiende a evitar la entrada de los MNC en apoptosis, razón por la cual el marcador de inmadurez CD14 es detectable en cultivos maduros. En este estudio se encontró que aun cuando algunas de las características propias de la maduración no son afectadas, otras sí lo son. Con respecto a la expresión del CD14, se observó una tendencia compatible con la involución de la maduración, descrita previamente (15, 18); es decir, la expresión de CD14 tiende a regresar al patrón de expresión detectado en los MNC. Estos resultados provienen de ensayos enfocados en la caracterización del efecto de factores producidos por las células tumorales en la diferenciación de CD, y que, posiblemente, afectan de manera negativa la activación de una respuesta inmune afectiva en pacientes con tumores pulmonares. En investigaciones posteriores, se deberá avanzar en la búsqueda de nuevas moléculas que permitan revertir dichos efectos y mejorar la eficiencia de la respuesta inmune contra tumores, asegurando una diferenciación correcta de las CPA y la consecuente respuesta efectora esperada en los protocolos de inmunoterapia con CD.
AGRADECIMIENTOS
Agradecemos a la Fundación Instituto de Inmunología de Colombia (FIDIC) por habernos facilitado las instalaciones e infraestructura del Grupo Funcional de Inmunología Molecular, para el desarrollo experimental de la propuesta. De manera especial, reconocemos la amable colaboración del Hospital Santa Clara ESE, por la asesoría prestada. El presente estudio se realizó con recursos financieros del Grupo de Investigación en Inmunotoxicología.
BIBLIOGRAFíA
1. W.C. Kopp, J.W. Smith, C.H. Ewel et al., Immunomodulatory effects of interferon- gamma in patients with metastatic malignant melanoma, J. Immunother Emphasis Tumor Immunol., 13, 181-190 (1993). [ Links ]
2. R.M. Steinman, G. Kaplan, M.D. Witmer et al., Identification of a novel cell type in peripheral lymphoid organs of mice. V. Purification of spleen dendritic cells, new surface markers, and maintenance in vitro, J. Exp. Med., 149, 1-16 (1979). [ Links ]
3. R.M. Steinman, J.C. Adams, Z.A. Cohn, Identification of a novel cell type in peripheral lymphoid organs of mice. IV. Identification and distribution in mouse spleen, J. Exp. Med., 141, 804-820 (1975). [ Links ]
4. R.M. Steinman, D.S. Lustig, Z.A. Cohn, Identification of a novel cell type in peripheral lymphoid organs of mice. III. Functional properties in vivo, J. Exp. Med., 139, 1431-1445 (1974). [ Links ]
5. R.M. Steinman, Z.A. Cohn, Identification of a novel cell type in peripheral lymphoid organs of mice. II. Functional properties in vitro, J. Exp. Med., 139, 380- 397 (1974). [ Links ]
6. R.M. Steinman, Z.A. Cohn, Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution, J. Exp. Med., 137, 1142-1162 (1973). [ Links ]
7. S. Fossum, The life history of dendritic leukocytes (DL), Curr. Top. Pathol., 79, 101-124 (1989). [ Links ]
8. J.M. Austyn, New insights into the mobilization and phagocytic activity of dendritic cells, J. Exp. Med., 183, 1287-1292 (1996). [ Links ]
9. J. Banchereau, F. Briere, C. Caux et al., Immunobiology of dendritic cells, Annu. Rev. Immunol., 18, 767-811 (2000). [ Links ]
10. V. Shreedhar, A.M. Moodycliffe, S.E. Ullrich et al., Dendritic cells require T cells for functional maturation in vivo, Immunity, 11, 625-636 (1999). [ Links ]
11. L. Santambrogio, A.K. Sato, G.J. Carven et al., Extracellular antigen processing and presentation by immature dendritic cells, Proc. Natl. Acad. Sci. USA, 96, 15056-15061 (1999). [ Links ]
12. L. Santambrogio, A.K. Sato, F.R. Fischer et al., Abundant empty class II MHC molecules on the surface of immature dendritic cells, Proc. Natl. Acad. Sci. USA, 96, 15050-15055 (1999). [ Links ]
13. C.G. Drake, E. Jaffee, D.M. Pardoll, Mechanisms of immune evasion by tumors, Adv. Immunol., 90, 51-81 (2006). [ Links ]
14. E. Gottfried, M. Kreutz, A. Mackensen, Tumor-induced modulation of dendritic cell function, Cytokine Growth Factor Rev., 19, 65-77 (2008). [ Links ]
15. D. Gabrilovich, Mechanisms and functional significance of tumour-induced dendritic-cell defects, Nat. Rev. Immunol., 4, 941-952 (2004). [ Links ]
16. B. Almand, J.I. Clark, E. Nikitina et al., Increased production of immature myeloid cells in cancer patients: A mechanism of immunosuppression in cancer, J. Immunol., 166, 678-689 (2001). [ Links ]
17. S. Kusmartsev, D.I. Gabrilovich, Role of immature myeloid cells in mechanisms of immune evasion in cancer, Cancer Immunol. Immunother, 55, 237-245 (2006). [ Links ]
18. I. Perrot, D. Blanchard, N. Freymond et al., Dendritic cells infiltrating human non-small cell lung cancer are blocked at immature stage, J. Immunol., 178, 2763-2769 (2007). [ Links ]
19. Y. Nashida, T. Kumamoto, E. Azuma et al., Development of a dendritic cell vaccine against measles for patients following hematopoietic cell transplantation, Transplantation, 82, 1104-1107 (2006). [ Links ]
20. T. Ninomiya, S.M.F. Akbar, T. Masumoto et al., Dendritic cells with immature phenotype and defective function in the peripheral blood from patients with hepatocellular carcinoma, Journal of Hepatology, 31, 323-331 (1999). [ Links ]
21. A. Pinzón-Charry, C.S. Ho, R. Laherty et al., A population of HLA-DR+ immature cells accumulates in the blood dendritic cell compartment of patients with different types of cancer, Neoplasia, 7, 1112-1122 (2005). [ Links ]
22. D.I. Gabrilovich, H.L. Chen, K.R. Girgis et al., Production of vascular endothelial growth factor by human tumors inhibits the functional maturation of dendritic cells, Nat. Med., 2, 1096-1103 (1996). [ Links ]
23. D. Gabrilovich, T. Ishida, T. Oyama et al., Vascular endothelial growth factor inhibits the development of dendritic cells and dramatically affects the differentiation of multiple hematopoietic lineages in vivo, Blood, 92, 4150-4166 (1998). [ Links ]
24. S. Patel, S. Chiplunkar, Role of cyclooxygenase-2 in tumor progression and immune regulation in lung cancer, Indian J. Biochem Biophys, 44, 419-428 (2007). [ Links ]
25. S. Sharma, M. Stolina, S.C. Yang et al., Tumor cyclooxygenase 2-dependent suppression of dendritic cell function, Clin. Cancer. Res., 9, 961-968 (2003). [ Links ]
26. H. Harizi, M. Juzan, C. Grosset et al., Dendritic cells issued in vitro from bone marrow produce PGE(2) that contributes to the immunomodulation induced by antigen-presenting cells, Cell. Immunol., 209, 19-28 (2001). [ Links ]
27. S. Sbiera, S. Wortmann, M. Fassnacht, Dendritic cell based immunotherapy - a promising therapeutic approach for endocrine malignancies, Horm. Metab. Res., 40, 89-98 (2008). [ Links ]
28. E. Ullrich, N. Chaput, L. Zitvogel, Killer dendritic cells and their potential role in immunotherapy, Horm. Metab. Res., 40, 75-81 (2008). [ Links ]
29. J.J. Lee, H. Kook, M.S. Park et al., Immunotherapy using autologous monocytederived dendritic cells pulsed with leukemic cell lysates for acute myeloid leukemia relapse after autologous peripheral blood stem cell transplantation, J. Clin. Apher., 19, 66-70 (2004). [ Links ]
30. A. Pinzón-Charry, C. Schmidt, J.A. López, Dendritic cell immunotherapy for breast cancer, Expert. Opin. Biol. Ther., 6, 591-604 (2006). [ Links ]
31. W. Zhang, H. Yang, H. Zeng, Enhancing antitumor by immunization with fusion of dendritic cells and engineered tumor cells, J. Huazhong Univ. Sci. Technolog Med. Sci., 22, 1-4 (2002). [ Links ]
32. M. Shi, L. Su, S. Hao et al., Fusion hybrid of dendritic cells and engineered tumor cells expressing interleukin-12 induces type 1 immune responses against tumor, Tumori, 91, 531-538 (2005). [ Links ]
33. W. Zhang, H. Yang, H. Zeng et al., [Induction of Th1 immune response against tumor by genetically engineered fusion of tumor cells and dendritic cells], Zhonghua Xue Ye Xue Za Zhi, 23, 61-64 (2002). [ Links ]
34. D. Xia, T. Chan, J. Xiang, Dendritic cell/myeloma hybrid vaccine, Methods Mol. Med., 113, 225-233 (2005). [ Links ]
35. H. Zhong, M.R. Shurin, B. Han, Optimizing dendritic cell-based immunotherapy for cancer, Expert Rev. Vaccines, 6, 333-345 (2007). [ Links ]
36. A. Ishikawa, S. Motohashi, E. Ishikawa et al., A phase I study of alpha-galactosylceramide (KRN7000)-pulsed dendritic cells in patients with advanced and recurrent non-small cell lung cancer, Clin. Cancer. Res., 11, 1910-1917 (2005). [ Links ]
37. D.I. Gabrilovich, J. Corak, I.F. Ciernik et al., Decreased antigen presentation by dendritic cells in patients with breast cancer, Clin. Cancer. Res., 3, 483-490 (1997). [ Links ]
38. T. Ishida, T. Oyama, D.P. Carbone et al., Defective function of Langerhans cells in tumor-bearing animals is the result of defective maturation from hemopoietic progenitors, J. Immunol., 161, 4842-4851 (1998). [ Links ]
39. M. Jeras, M. Bergant, U. Repnik, In vitro preparation and functional assessment of human monocyte-derived dendritic cells-potential antigen-specific modulators of in vivo immune responses, Transpl. Immunol., 14, 231-244 (2005). [ Links ]
40. C.G. Figdor, I.J. de Vries, W.J. Lesterhuis et al., Dendritic cell immunotherapy: Mapping the way, Nat. Med., 10, 475-480 (2004). [ Links ]
41. F.W. Velten, F. Rambow, P. Metharom et al., Enhanced T-cell activation and T-cell-dependent IL-2 production by CD83+, CD25high, CD43high human monocyte-derived dendritic cells, Mol. Immunol., 44, 1544-1550 (2007). [ Links ]
42. M. Colmenares, A. Puig-Kroger, O.M. Pello et al., Dendritic cell (DC)-specific intercellular adhesion molecule 3 (ICAM-3)-grabbing nonintegrin (DC-SIGN, CD209), a C-type surface lectin in human DCs, is a receptor for Leishmania amastigotes, J. Biol. Chem., 277, 36766-36769 (2002). [ Links ]
43. M. Lechmann, S. Berchtold, J. Hauber et al., CD83 on dendritic cells: more than just a marker for maturation, Trends Immunol., 23, 273-275 (2002). [ Links ]
44. U.R. Sorg, T.M. Morse, W.N. Patton et al., Hodgkin´s cells express CD83, a dendritic cell lineage associated antigen, Pathology, 29, 294-299 (1997). [ Links ]
45. H.W. Ziegler-Heitbrock, R.J. Ulevitch, CD14: Cell surface receptor and differentiation marker, Immunol. Today, 14, 121-125 (1993). [ Links ]
46. T.F. Leung, N.L. Tang, G.W. Wong et al., CD14 and toll-like receptors: Potential contribution of genetic factors and mechanisms to inflammation and allergy, Curr. Drug Targets Inflamm Allergy, 4, 169-175 (2005). [ Links ]
47. T.L. Kielian, F. Blecha, CD14 and other recognition molecules for lipopolysaccharide: A review, Immunopharmacology, 29, 187-205 (1995). [ Links ]
48. P. Krawczyk, K. Wojas, J. Milanowski et al., The influence of different culture microenvironments on the generation of dendritic cells from non-small-cell lung cancer patients, Arch. Immunol. Ther. Exp. (Warsz) (2007). [ Links ]
49. F. Ávila-Moreno, J.S. López-González, G. Galindo-Rodríguez et al., Lung squamous cell carcinoma and adenocarcinoma cell lines use different mediators to induce comparable phenotypic and functional changes in human monocytederived dendritic cells, Cancer. Immunol. Immunother, 55, 598-611 (2006). [ Links ]














