Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.39 no.1 Bogotá Jan./June 2010
Artículo de investigación tecnológica
Desarrollo y validación de una metodología analítica por HPLC para la cuantificación de fenobarbital en una suspensión extemporánea
Development and validation of an analytical method by HPLC for quantification of phenobarbital in extemporaneous suspensions
Marcela Morantes 1, Mónica Vargas, Fanny S. Figueroa 1, Noralba Sierra 2, Helber Barbosa2*
1 Servicio Farmacéutico, Clínica Country, Bogotá, D. C., Colombia.
2 Universidad Nacional de Colombia, Departamento de Farmacia, A.A. 14490, Bogotá, D. C., Colombia, * Correo electrónico: hdbarbosab@unal.edu.co.
Recibido para evaluación: 12 de abril de 2010. Aceptado para publicación: 17 de mayo de 2010.
RESUMEN
En este artículo se presentan los resultados del desarrollo, estandarización y validación de una metodología analítica por cromatografía líquida de alta eficiencia para la cuantificación de fenobarbital en una suspensión extemporánea, usando butobarbital como estándar interno. El método cromatográfico utiliza un detector UV con arreglo de diodos (DAD) como sistema de detección, una fase móvil compuesta por una mezcla de metanol y agua (48:52) adicionada de H3PO4 al 0,1% y una columna cromatográfica C18 estabilizada a una temperatura de 35°C. La metodología validada fue selectiva, lineal, precisa y exacta. La linealidad se evaluó para concentraciones entre 4,8 y 24 µg/mL. La metodología desarrollada se utilizó para llevar a cabo el estudio de estabilidad de una suspensión extemporánea de fenobarbital, utilizada en la Clínica Country para el tratamiento de las convulsiones en pacientes pediátricos.
Palabras clave: fenobarbital, suspensión extemporánea, validación, HPLC, arreglo de diodos.
SUMMARY
In this article we present the data obtained during the development, standardization and validation of a high performance liquid chromatography method for the quantification of phenobarbital in an extemporaneous suspension using butobarbital as internal standard. The chromatographic method uses a UV detector with diode array (DAD) as detection system, as mobile phase a mixture of H3PO4 0.1% in methanol and H3PO4 to 0.1% in water (48:52) and column chromatography C18 stabilized at 35 °C. The validated methodology was selective, linear, precise and accurate. The linearity was evaluated for concentrations between 4.8 and 24 mcg/mL. The developed methodology was used to carry out the study of stability of an extemporaneous suspension of phenobarbital used in the Clinic Country for the treatment of convulsions in pediatric patients.
Key words: phenobarbital, extemporaneous suspension, validation, HPLC, diode array.
INTRODUCCION
El fenobarbital (figura 1) es un barbitúrico de acción prolongada utilizado en el tratamiento de las convulsiones neonatales, convulsiones tónico-clónicas generalizadas, epilepsias parciales, prevención de algunas convulsiones febriles y en el estado de mal epiléptico resistente a otros tratamientos (1).
Debido a que la forma farmacéutica líquida oral de fenobarbital disponible en el mercado colombiano (2), es una solución homogénea en forma de elíxir, cuyo contenido de alcohol excede el recomendado para formulaciones dirigidas a pacientes pediátricos que puede provocar daños y efectos adversos al sistema nervioso central (3), es necesario generar una preparación extemporánea libre de alcohol, que, por lo general, es una suspensión en agua o dextrosa del fenobarbital proveniente de la trituración de las tabletas y que sin ningún soporte bibliográfico ni experimental respecto a la estabilidad se usa en el campo hospitalario.
En el presente trabajo se desarrolló y validó de una metodología para la cuantificación de fenobarbital en una preparación extemporánea tipo suspensión. Luego del estudio de la selectividad de la metodología y de sus resultados, la metodología se considera indicadora de la estabilidad, principal propósito de la investigación. De esta manera, la metodología se puede emplear para la cuantificación del principio activo en el estudio de estabilidad de esta preparación extemporánea y garantizar así la integridad de la preparación después de varios días para su uso en pacientes pediátricos.
PARTE EXPERIMENTAL
Equipos
Cromatógrafo Agillent Technologies 1200, detector UV con arreglo de diodos, columna cromatográfica Eclipse ® XDB - C18, de 150 × 4 mm y tamaño de partícula 0,5 µm.
Reactivos
Estándar de fenobarbital usp, estándar de butobarbital usp (Merck), metanol y agua de calidad HPLC. Otros reactivos de calidad R.A. empleados fueron: ácido fosfórico (Carlo Erba), hidróxido de sodio (Merck) y ácido clorhídrico (Merck).
Estandarización del sistema cromatográfico
La usp 30 (4) ofrece un método de cuantificación para las tabletas de fenobarbital que cuenta, en términos generales, con las siguientes condiciones: fase móvil compuesta por una solución buffer pH 4,5 (acetato de sodio trihidrato, ácido acético glacial y agua) y metanol, en una proporción 3:2, respectivamente; cafeína como patrón interno, longitud de onda 254nm, flujo 2 mL/min, volumen de inyección 10 µL y una solución estándar de 0,75 mg/mL de fenobarbital USP RS. A fin de generar un método de cuantificación más sensible, en el cual se pudiera cuantificar el analito en concentraciones mucho más bajas y una fase móvil menos agresiva para la columna y el equipo, se procedió a determinar las condiciones favorables que nos permitieran obtener los resultados esperados. Para la estandarización y optimización de las condiciones cromatográficas, se desarrolló un método que ofreciera la mejor interacción entre las fases y la mejor separación entre los compuestos, estableciéndose las siguientes condiciones: columna C18 de 150 × 4 mm, 0,5 µm, fase móvil compuesta por H3PO4 al 0,1% en metanol y H3PO4 al 0,1% en agua en proporción 48:52 v/v, temperatura de la columna 35 °C, flujo 1,25 mL/min, volumen de inyección 20 µL y una longitud de onda 212 nm.
RESULTADOS Y DISCUSION
Idoneidad del sistema
El análisis cromatográfico para comprobar la idoneidad del sistema se realizó tanto para el analito como para el estándar interno. Se encontró un valor de resolución entre picos de 8,3 para las dos sustancias, una asimetría para el pico del fenobarbital de 0,906 y de 0,916 para el butobarbital. El factor de capacidad para el fenobarbital fue de 2,11 y para el butobarbital de 3,32, mientras que el número de platos teóricos fue de 6328 para el fenobarbital y de 8101 para el butobarbital. Estos parámetros cumplen con lo establecido por la farmacopea americana usp 30 (4). Un cromatograma representativo del analito y del estándar interno se presenta en la figura 2.

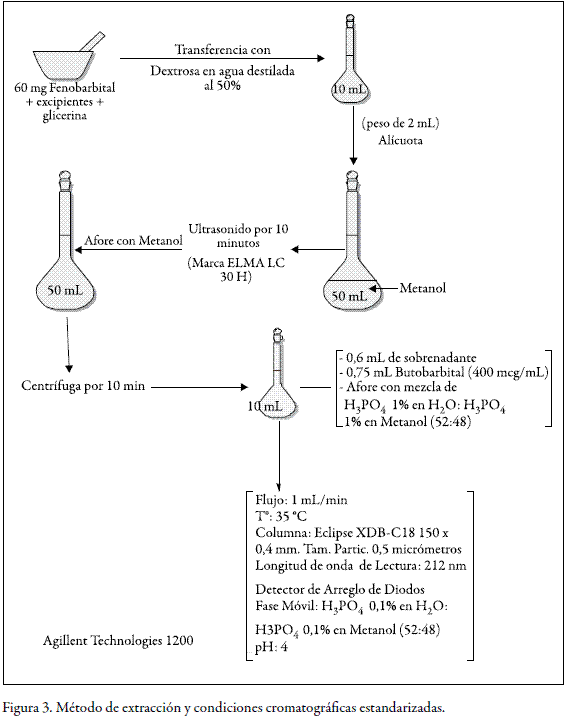
Estandarización del método de extracción
El método de extracción se desarrolló teniendo en cuenta los insumos que se utilizan en la elaboración de las preparaciones extemporáneas pediátricas. Las condiciones estandarizadas son las que se muestran en la figura 3.
Selectividad
La selectividad se evaluó respecto a los excipientes y frente a los productos generados por la degradación forzada del activo. Se estudiaron los excipientes por separado, la matriz sola y la matriz enriquecida con estándar de fenobarbital. En cuanto a la selectividad relacionada con los productos de degradación, ésta se determinó realizando la degradación forzada del fenobarbital en medio ácido y en medio alcalino, sometiendo muestras a reflujo en cada caso a una temperatura de 80 °C por 1 y 3 h y posterior análisis, luego de la neutralización de las soluciones. Como medios de degradación se utilizaron HCl 0,1N y NaOH 0,1N. Los ensayos de oxidación y fotólisis no se efectuaron, pues esta molécula es estable a estas condiciones, razón por la cual no se justifica su realización (5).
Mediante el análisis cromatográfico de las diferentes muestras evaluadas, se pudo concluir que ni los excipientes de la matriz ni los productos de degradación generan señales que pudieran interferir con las señales debidas al principio activo ni con el estándar interno. Mediante el detector de arreglo de diodos se estudió la pureza de pico de las señales obtenidas, indicando que la metodología desarrollada permite distinguir y diferenciar entre el fenobarbital y sus productos de degradación, permitiendo, por tanto, ser utilizada en un estudio de estabilidad.
Linealidad
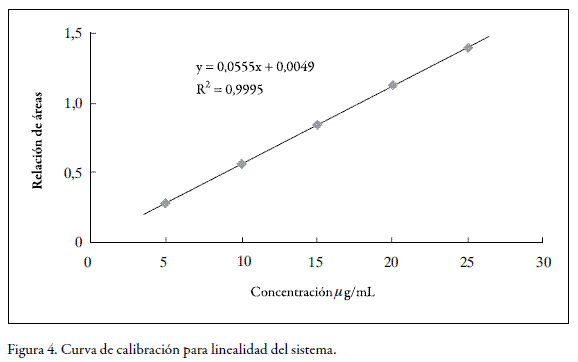
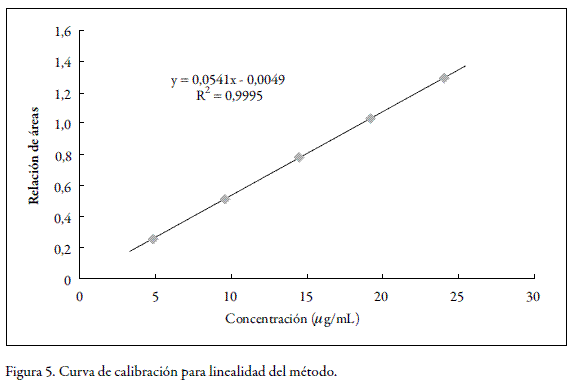
La linealidad del sistema y del método, se estudió para cinco niveles de concentración, realizando tres réplicas de cada concentración, tal como lo establecen los lineamientos de la ICH (6). Se emplearon concentraciones entre 5 y 25 µg/mL para el sistema y entre 4,8 y 24 µg/mL para el método. Para la linealidad del método se utilizaron muestras de placebo enriquecidas con fenobarbital, las cuales se sometieron al correspondiente proceso de extracción y posterior análisis, según el método establecido. La concentración de estándar interno fue de 30 µg/mL en todos los casos.
Dentro de los rangos de concentración estudiados, tanto para el sistema como para el método, se obtuvo un comportamiento lineal. La prueba de t indicó que los interceptos no son estadísticamente diferentes de cero y que las pendientes son estadísticamente diferentes de cero. De la misma manera, el análisis de varianza mediante un test F, demostró una regresión significativa y desvíos no significativos de los puntos alrededor de la recta, e igualmente una variabilidad no significativa entre los resultados para cadauna de las diferentes concentraciones. En las figuras 4 y 5 se presentan las curvas de calibración (relación de áreas vs. concentración) para el sistema y para el método, mientras que los respectivos análisis estadísticos se presentan en las tablas 1 y 2 para el sistema y en las tablas 3 y 4 para el método.
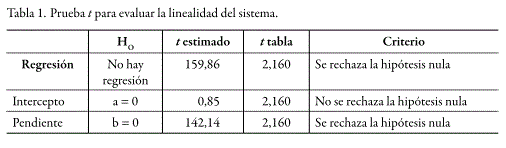
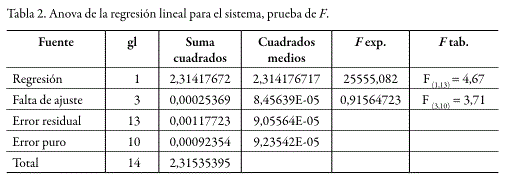
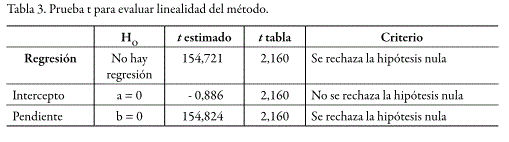
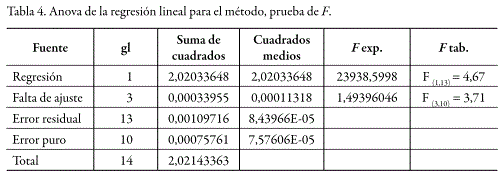
Precisión del sistema y método
Para determinar la repetibilidad del sistema y del método, se realizaron seis determinaciones utilizando concentraciones de 15,0 y 14,4 µg/mL, respectivamente. Los valores de los coeficientes de variación obtenidos fueron de 0,15 para el sistema y 0,69 para el método, los cuales son inferiores al valor máximo aceptado para métodos cromatográficos (2%) (7), indicando una adecuada repetibilidad tanto para el sistema como para el método.
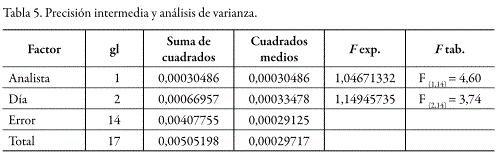
La precisión intermedia del método se evaluó a una concentración de 14,4 µg/mL para dos analistas en tres días diferentes, realizando tres determinaciones y una concentración de 14,4 µg/mL para el método. El coeficiente de variación global de las respuestas fue de 2,2. El análisis de varianza, mediante un test F, indica que no existen diferencias significativas en los resultados por cambio de analista o al realizar el análisis en diferentes días (tabla 5).
Exactitud
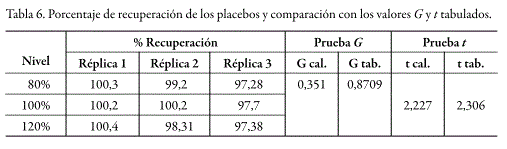
La evaluación de este parámetro se determinó mediante el porcentaje de recuperación proveniente de placebos enriquecidos con fenobarbital a niveles de concentración correspondientes al 80%, 100% y 120%, y realizando tres replicas por cada nivel. Los porcentajes de recuperación obtenidos se encontraron en un intervalo entre 98,70 y 99,37%. El coeficiente de variación global en los tres niveles de concentración fue de 1,35%. La prueba de Cochran indica que el nivel de concentración no afecta la variabilidad de los resultados. El valor de t experimental, menor que el valor t tabulado, confirma la exactitud del método, como se puede constatar en la tabla 6.
CONCLUSIONES
Se desarrolló y validó una metodología analítica por HPLC para la cuantificación de fenobarbital en una suspensión extemporánea. La metodología validada es selectiva, lineal, precisa y exacta. El método propuesto utiliza una columna C18 a una temperatura de 35 °C, una fase móvil conformada por metanol y agua (48:52), acidulada con H3PO4 al 0,1% y un flujo de 1,25 mL/min. El volumen de inyección fue de 20 µL y la detección se realizó a 212 nm.
El estudio de la selectividad llevada a cabo, permite la utilización de la metodología desarrollada para los estudios de estabilidad de la preparación extemporánea, como se indica con las señales generadas, y comprobar la pureza de pico de cada una de las señales obtenidas durante la evaluación de la selectividad.
AGRADECIMIENTOS
A los químicos farmacéuticos del Servicio Farmacéutico de la Clínica del Country, por sus aportes académicos y la información necesaria para el desarrollo del proyecto. A los equipos de trabajo de los laboratorios de Análisis Instrumental y Asesorías y Servicios, por su colaboración y disposición durante el desarrollo de este proyecto. Al profesor Jorge Ariel Martínez, por sus aportes académicos al inicio del proyecto.
REFERENCIAS
1. J. Flórez, J.A. Armijo, A. Mediavilla, "Farmacología humana", España, Ed. Masson, 2005, pp. 530-531. [ Links ]
2. invima, Consultas de información acerca de registros sanitarios: R.S. M-14108, R.S. M-14111, R.S. M-13617, R.S. M-13616, R.S. M-14110, enero 2009. url: http://www.invima.gov.co [ Links ]
3. M. Petrea, C. Johnson, Stability of an extemporaneously prepared alcohol-free phenobarbital suspension, Am. J. Health-Syst. Pharm., 64, 644 (2008). [ Links ]
4. usp 30-nf 25, Farmacopea de los Estados Unidos de América, vol. 3, 2007. [ Links ]
5. K.A. Connors, G.L. Almidon, V.J. Stella, "Chemical stability of pharmaceuticals: A handbook for pharmacists", 2nd edition, John Wiley & Sons, New York, 1986, p. 655. [ Links ]
6. ich, "Validation of analytical procedures: Text and methodology Q2 (R1)", 2006. [ Links ]
7. Asociación Española de Farmacéuticos de la Industria, aefi, "Validación de métodos analíticos", 2001. [ Links ]














