Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.40 no.1 Bogotá Jan./June 2011
Artículo de Investigación científica
Actividad funcional de anticuerpos inducidos por péptido-miméticos derivados del antígeno MSP-2 del Plasmodium, como potenciales agentes inmunoterapéuticos en malaria causada por Plasmodium yoelii y Plasmodium berghei en ratones BALB/c
Functional activity of antibodies induced by peptido-mimetics derived from the Plasmodium MSP-2 antigen, as potential immuno-therapeutic agents in rodent malaria induced by P. berghei and P. yoelii strains
Liliana Patricia Lesmes 1 , Gina Marcela Gallego 2,3 , Luisa Fernanda Carreño 1,2 , Johan Hoebecke 4 , José Manuel Lozano 1,2,3
1 Universidad Nacional de Colombia, Bogotá, D. C., Colombia.
2 Fundación Instituto de Inmunología de Colombia (FIDIC), carrera 50 No. 26-20, Bogotá, D. C., Colombia. Correos electrónicos: jmlozanom@unal.edu.co, jm_lozano@fidic.org.co
3 Universidad del Rosario, Bogotá, D. C., Colombia.
4 UPR 9021, IBMC, CNRS, Université Louis Pasteur, Strasbourg, France.
Recibido para evaluación: 25 de abril de 2011. Aceptado para publicación: 20 de mayo de 2011.
SUMMARY
Bearing in mind the high degree of genetical conservation of critical binding residues from the primary structure of the peptide 4044 ( 21 KNESKYSNT- FINNAYNMSIR 40 ), which was previously identified as being crucial for the MSP-2 antigen to lead Plasmodium falciparum to bind red blood cells with high specific capacity, and so causing malaria, two peptido-mimetics so-named reduced amide pseudopeptides, in which a nature-made amide bond was replaced with a ψ[CH2 -NH] methylene amide isoster bond, one between the Phe-Ile aminoacid pair and the second between Ile-Asn, were designed and synthesized in a site-directed manner as monomer and polymer forms, and were coded as ψ-128 for the monomer (ψ-129 polymer) and ψ-130 for the monomer (ψ-131 for polymer) respectively. These peptido-mimetics were used to produce monoclonal antibodies which displayed in both cases IgM isotype. By controlled in vitro immunization experiments their parent reactive hybridomas were induced to a Ig isotype-switching to IgG1, IgG2a, IgG2b and IgG3 sub-classes. These immunoglobulins were tested for their in vivo functional activity against malaria, showing a high efficacy property for controlling the malaria infection when passively transferred into BALB/c mice. The neutralizing effect of these site-directed designed antibodies on the Plasmodium biological development, make them a potential tool for the control of malaria
Key words: peptido-mimetic, antibody, passive immunization, vaccine candidate
RESUMEN
Teniendo en cuenta el alto grado de conservación genética de los residuos críticos de la estructura primaria del péptido 4044 ( 21 KNESKYSNTFINNAYNMSIR 40 ) identificado como crucial en el antígeno MSP-2 para que el Plasmodium falciparum pueda unirse con alta capacidad específica a glóbulos rojos y causar malaria, se diseñaron y sintetizaron dos secuencias en formas monomérica y polimérica de péptido-miméticos denominados pseudopéptidos amida reducida en las cuales se sustituyó un enlace peptídico normal por su isóstero ψ[CH 2-NH] entre los residuos fenilalanina-isoleucina y entre los residuos isoleucina-asparagina, para dar lugar a los pseudopéptidos codificados ψ-128 forma monomérica (ψ-129 forma polimérica) y ψ-130 forma monomérica (ψ-131 forma polimérica). Con estos péptido-miméticos se generaron anticuerpos monoclonales de isotipo IgM. Mediante experimentos controlados de inmunización in vitro se indujo el cambio isotipo de los clones reactivos a las subclases IgG1, IgG2a, IgG2b e IgG3. Estas inmunoglobulinas se ensayaron por su actividad funcional antimalárica in vivo mostrando una alta eficacia en el control de la infección por malaria al ser administradas por transferencia pasiva. El efecto neutralizador del desarrollo biológico del patógeno por parte de estos anticuerpos inducidos de manera sitio-dirigida los hacen potencialmente útiles, como una potencial herramienta para el control de la infección por malaria.
Palabras clave: péptido-mimético, anticuerpo, inmunización pasiva, candidato a vacuna.
INTRODUCCIÓN
La malaria es una enfermedad infecciosa transmitida por la hembra del mosquito Anopheles, vector de transmisión de la enfermedad y causada por parásitos del genero Plasmodium entre ellos, P. falciparum, P. vivax, P. ovale, P. malariae y P. knowlesi descrito recientemente (1). El impacto económico y sociodemográfico de esta enfermedad hace que haya sido catalogada como una prioridad para su erradicación según los objetivos del milenio planteados por la Organización Mundial de la Salud (OMS). La morbilidad anual por malaria está entre 300 y 500 millones de casos clínicos y su índice de mortalidad es de aproximadamente 3 millones de decesos (2). Esta enfermedad afecta principalmente a niños menores de cinco años y a mujeres embarazadas, principalmente de países deprimidos económicamente ubicados en las regiones tropicales y subtropicales del mundo, donde habita una población alrededor de 2 billones de personas en regiones endémicas para esta enfermedad, lo que representa que aproximadamente entre el 21% y el 40% de la población del mundo está en riesgo de adquirir malaria (3). La malaria continúa siendo uno de los flagelos de la humanidad pese a las medidas de salud pública establecidas para las zonas de riesgo, tales como el uso de mosquiteros y toldillos impregnados con insecticidas, la desecación de pozos y charcos, así como a otros factores como el incremento en la resistencia del vector transmisor (hembra del mosquito Anopheles) a los insecticidas, junto a los fenómenos globales que han permitido la expansión gradual de cepas del parásito resistentes a los antibióticos y fármacos antimálaricos. Los fenómenos climáticos de reciente data, como el calentamiento global, afectan drásticamente la distribución global de la enfermedad haciendo que ésta llegue a lugares del mundo donde ya había sido controlada o nunca antes había llegado (4, 5).
El impacto socioeconómico de esta enfermedad ha provocado un sensible detrimento en el crecimiento económico como consecuencia de numerosos factores sobre la salud y la sociedad, como los efectos sobre la fertilidad, el decrecimiento de la población, la disminución del ahorro y la inversión, la baja en la productividad del trabajador, el ausentismo laboral y escolar, la mortalidad prematura y el incremento en los costos médicos (6).
Colombia es uno de los países de América que presenta alta incidencia en malaria. En la última semana epidemiológica del 2010, se notificaron al sistema de vigilancia en salud pública (sivigila) del Instituto Nacional de Salud, un total de 104.598 casos; de los cuales, 1.346 fueron causados por malaria mixta (1,29%), 29.844 por P. falciparum (28,60%), 50 por P. malarie (0,004%), 73.122 por P. vivax (70,07%), 596 casos de malaria complicada y 23 muertes; las áreas de mayor riesgo incluyen la rivera baja del río Cauca, la costa pacífica, la rivera alta del río Sinú y el Urabá (7).
Por todo lo anterior, es urgente la búsqueda de nuevas soluciones de tipo terapéutico e inmunoprofiláctico para esta enfermedad, por lo que el desarrollo de una vacuna altamente eficaz así como el desarrollo de nuevas estrategias inmunoterapéuticas contra la malaria deberán ser prioritarios. La investigación en estos campos de la biomedicina ha tomado como blancos moleculares estratégicos diversas proteínas de superficie de los estadios asexuales sanguíneos del Plasmodium falciparum, entre éstas se encuentra el antígeno de superficie del merozoito MSA-2, también conocida como MPA-2 (8). Este antígeno de superficie de aproximadamente 30 kDa (9) a 45kDa (10) está constituido por dos regiones genéticamente conservadas, una en el extremo carboxilo y la otra en el extremo amino, una región variable y dos regiones semiconservadas en la región central (11).
El análisis bioinformático, al emplear la secuencia de este antígeno presente en diferentes especies de Plasmodium y la reproducción sintética de la secuencia completa de la MSA-2, permitió identificar péptidos con alta capacidad de unión específica a glóbulos rojos. Por esto, estos péptidos se han denominado como HABP (del inglés high activity binding peptides); entre ellos se identificó la secuencia de aminoácidos del residuo 21 al 40 del antígeno, cuyo producto sintético se codificó como 4044 (8). Este péptido posee un motivo constituido por residuos críticos para su unión a glóbulos rojos. Basados en esta información, se decidió mantener la secuencia de este antígeno intacta, pero si realizar la sustitución puntual de dos enlaces peptídicos clave para la unión del péptido, para así generar dos péptido-miméticos del tipo amida reducida en forma de monómero y polímero, respectivamente. Así, se sintetizaron estas dos nuevas secuencias en las cuales se sustituyeron los enlaces peptídicos con el propósito de evaluar posibles cambios en la estructura global del péptido modificado y así sus propiedades inmunológicas frente a las ofrecidas por el péptido nativo 4044. En este estudio presentamos el uso de cuatro pseudopéptidos derivados del péptido 4044, a los cuales se les incluyó en cada caso, un enlace amida reducida en reemplazo de un enlace peptídico normal de tipo amida y se evaluó su papel frente a una infección por malaria in vitro e in vivo en un modelo de roedores. Estos análogos se codificaron como ψ-128 (modificado entre los residuos 30 Phe-Ile 31 ) y ψ-130 (modificado entre los residuos 31 Ile-Asn 32 ), cada uno contiene un enlace peptídico isostérico ψ[CH 2-NH] amida reducida. Estos análogos en sus formas poliméricas se emplearon como inmunógenos que eficientemente indujeron clones de linfocitos B secretores de anticuerpos. Estos clones se inmortalizaron para obtener así dos clones de anticuerpos monoclonales secretores de inmunoglobulinas de isotipo definido. Estos anticuerpos mostraron propiedades neutralizadoras de la infección por malaria in vivo protegiendo a los animales desafiados experimentalmente con dosis letales de Plasmodium berghei y Plasmodium yoelii.
MATERIALES Y MÉTODOS
Análisis bioinformático
Se realizó un análisis bioinformático con las secuencias disponibles en plasmo DB (http://plasmodb.org/plasmo) para la proteína MSP-2 de P. falciparum PFB0300c y su secuencia ortóloga en P. berghei PBANKA_124700. Debido a que la proteína MSP-2 aún no presenta ortóloga reportada en P. yoelii, se realizó un análisis blast de proteínas (http://blast.ncbi.nlm.nih.gov/Blast.cgi) con la secuencia del péptido 4044 contra todas las proteínas reportadas de P. yoelli, encontrándose cierta homología con la proteína hipotética PY05325. Además, por este mismo método se encontró un importante porcentaje de identidad con una proteína hipotética de P. berghei PB000459.00.0 Posteriormente, con estas cuatro secuencias se realizó un alineamiento múltiple a través del servidor Clustal W ( http://npsa-pbil.ibcp.fr/cgi-bin/align_clustalw.pl). Finalmente, se ejecutó análisis de conservación de secuencias mediante el software jalview versión 2.5.1 y se calculó el porcentaje de identidad con el programa Bioedit sequence alignment editor versión 7.0.5.3. En la figura 1 se ilustra la comparación de estas secuencias y su grado de semejanza, similitud e identidad, tal y como se discutirá más adelante.

Diseño experimental para la obtención de modificaciones sitio-dirigidas en la secuencia del antígeno nativo 4044
Para este diseño se partió del análisis de los motivos de unión presentes en el antígeno nativo codificado como 4044 ( 21 KNESKYSNTFINNAYNMSIR 40 ) derivado de la proteína MSP-2. Como puede observarse, existen en este antígeno tres motivos de unión a glóbulos rojos, todos ellos subrayados en la secuencia, dos de ellos ubicados hacia el extremo amino de la secuencia y uno ubicado en el centro de ésta. Este último se seleccionó para el diseño de las dos modificaciones debido a su potencial papel como antígeno B, potencial inductor de una respuesta inmune de tipo humoral mediada por estimulación de anticuerpos específicos. Por tal motivo, se tomó la secuencia 30 FIN 32 como blanco del diseño para modificar los enlaces entre los residuos 30 Phe-Ile 31 para dar lugar al pseudopéptido ψ-128 y su forma polimérica ψ-129 y entre los residuos 31 Ile- Asn 32 para generar el pseudopéptido ψ-130 y su forma polimérica ψ-131, tal como se describe en la figura 2.
Síntesis de péptido-miméticos del tipo amida reducida ψ[CH2-NH]
La síntesis de pseudopéptidos involucra síntesis orgánicas alternas, como lo es la reducción a aminoaldehído del aminoácido comprometido en el enlace modificado de la secuencia peptídica; la reducción de cada uno de los aminoácidos modificados usados en este trabajo, se realizó siguiendo el procedimiento propuesto por Fehrentz y Castro (12).
El procedimiento estándar para la reducción del grupo carbonilo del aminoácido involucra la síntesis de un intermediario (carboxamida), seguido de la reducción con LiAlH4 sobre éter seco. Este proceso tiene un rendimiento global cercano al 80% para la mayoría de los aminoácidos; a pesar de ser una síntesis bastante limpia y la cual presenta un bajo porcentaje de reacciones colaterales, es necesaria una caracterización tanto del aminoácido como de la carboxamida y del producto final. Nosotros empleamos para la caracterización de nuestros compuestos, técnicas analíticas: infrarrojo, RMN- 1 H, y cromatografía de capa fina.
Posteriormente se incorporaron los aminoácidos modificados fenilalanina e iso leucina para la síntesis de los pseudopéptidos ψ-128 (F-ψ[CH 2 NH]-I), ψ-129 (F-ψ[CH2 NH]-I, en forma polimérica), ψ-130 (I-ψ-[CH 2NH]-N) y ψ-131 (I-ψ- [CH 2 NH]-N, en forma polimérica) de manera simultánea.
La síntesis química de los cuatro pseudopéptidos se llevó a cabo empleando aminoácidos protegidos con el grupo t-Boc en el amino alfa, siguiendo el procedimiento de síntesis de péptidos en fase sólida, descrito por Merrifield (13). El acople del aminoaldehído a la secuencia requiere unas condiciones de síntesis diferentes a las de un acople normal entre aminoácidos; es necesario mencionar que el tiempo de reacción de este acople es mayor al de un acople normal entre aminoácidos, tal como se muestra en la figura 3.
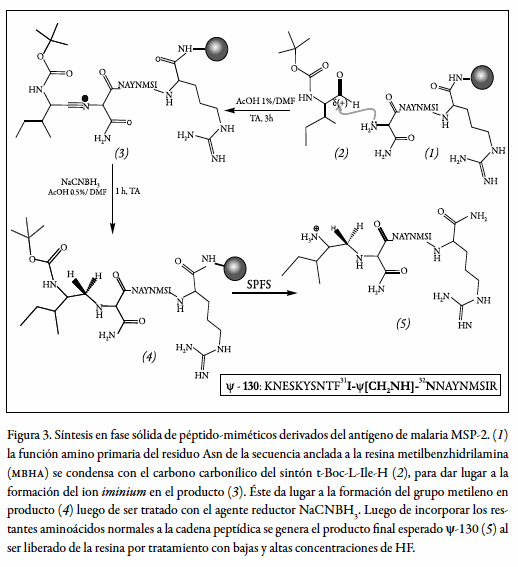
La reacción de condensación de cada t-Boc-L-aminoaldehído, consiste en disolver tres equivalentes del aminoaldehído en 2 mL de DMF/ácido acético al 1% y luego poner en contacto con la resina-péptido manteniendo agitación por un período de tres horas. Terminado este tiempo, descartar la solución aminoaldehído/DMF y realizar lavados con DMF, IPA y DCM 3 mL de cada uno por un minuto; preparar una solución de un equivalente de NaBH3 CN en DMF/ácido acético al 1% y poner a reaccionar con ella la resina-péptido por una hora. Finalizado este tiempo, se realizan los mismos lavados del paso anterior y se hace el test de ninhidrina; si el resultado es positivo se repite el procedimiento las veces que sea necesario, hasta observar que aparentemente no hay aminos libres. Como ya se mencionó, esta reacción es un poco lenta; no es de extrañarse que se haga necesario repetir el acople aproximadamente cinco veces hasta obtener una reacción completa; sin embargo, no es recomendado dejar el acople por períodos más largos a los sugeridos en este documento, puesto que se podrían inducir reacciones laterales no deseadas como, por ejemplo, la unión de dos moléculas del mismo sintón alterando así la identidad del análogo diseñado. Terminada la reacción de este acople, se desprotege el grupo amino y se continúa la síntesis en la forma estándar. Las formas poliméricas ψ-129 y ψ-131 son idénticas a sus formas monoméricas ψ-128 y ψ-130, respectivamente; pero se diferencian en que las primeras contienen el par de residuos Cys-Gly en el amino terminal y Gly-Cys en el carboxi-terminal. Al ser desancladas de la resina estos propolímeros, se disuelven en solución salina y se llevan a una concentración de 4 mg/mL y se someten a burbujeo de N2 a pH 7,4 a temperatura ambiente, hasta que no se detecte la presencia de grupos sulfhidrilo libres mediante la prueba de Ellman, prueba de lo cual todos ellos estarán comprometidos en puentes disulfuro intermoleculares.
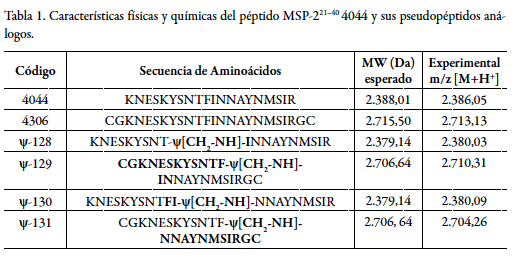
Los pseudopéptidos utilizados para el estudio que se describe en este documento, son análogos a la secuencia del péptido denominado 4044, el cual corresponde, como ya se mencionó, a la región de aminoácidos 21 a 40 de la proteína MSP-2. En la tabla 1 se muestran dichas secuencias y su respectivo código. Los pseudopéptidos sintetizados se obtuvieron con un rendimiento promedio del 70% y se garantizó un nivel de pureza superior al 99% según los análisis de HPLC-FR y su identidad evaluada por espectrometría de masas maldi-tof, como luego se discutirá. Estas moléculas se sometieron posteriormente a análisis de posibles patrones de estructura secundaria por dicroísmo circular (DC) y por técnicas bidimensionales de resonancia magnética nuclear de hidrógeno (RMN-1H).
Análisis de patrones de estructura secundaria por dicroísmo circular (DC)
Los análisis por dicroísmo circular se realizaron a temperatura ambiente en una celda sometida a flujo de nitrógeno en un espectropolarímetro Jasco J-810 (Madrid, España). Se registraron espectros en un intervalo de longitudes de onda entre 190-250 nm en una celda rectangular de una trayectoria óptica de 1 nm. Cada espectro se obtuvo como la media de tres barridos tomados a una velocidad de 20 nm/min, con un ancho de banda espectral de 1 nm y se realizó la corrección de línea base mediante el programa del equipo Jasco. El perfil DC para cada molécula se obtuvo por disolución del liofilizado de cada molécula purificada en i) buffer fosfato de sodio (PBS), 50 mM pH 7,0, o en ii) solución acuosa 0-30% de 2,2,2-trifluoroetanol (TFE) para un volumen final de 500 µL. Se empleó una concentración media en cada caso de 0,2 mM para cada molécula en la mezcla 0-30% agua-TFE. Los resultados se expresan como la media de la elipticidad molar (θ); sus unidades son grados x cm 2 x dmol -1 , de acuerdo con la relación (θ) = θ λ /(100lcn), donde θ λ es la elipticidad medida, l la trayectoria óptica, c la concentración de la molécula y n es el número de residuos de aminoácidos en la secuencia.
Resonancia magnética nuclear de hidrógeno (RMN- 1 h) para análisis de estructura secundaria
El péptido no modificado MSP-2 21-40 (4044) y sus análogos pseudopeptídicos se emplearon para análisis con RMN- 1 h en experimentos conducidos en un espectrómetro Bruker DRX-600 MHz a 295 K. Los datos se procesaron y analizaron en una estación de trabajo Silicon Graphics empleando el programa xwin-nmr 1.3 (Bruker, Darmstadt, Alemania). Se realizaron experimentos por las técnicas bidimensionales denominadas: double quantum filter-correlation spec-troscopy (DQF-COSY), total correlation spectroscopy (TOCSY), y nuclear Overhauser effect spectroscopy (NOESY), con el objetivo de caracterizar y asignar todos los átomos de hidrógeno vecinos en la secuencia de cada molécula. El desplazamiento en 4,75 ppm, señal de los hidrógenos del agua se empleó como referencia. Los coeficientes de temperatura se determinaron a partir de los espectros tocsy, empleando un rango de temperatura entre 285-315 K. Se obtuvo la pendiente de la curva calibrada para la relación entre el desplazamiento químico frente a la temperatura para cada uno de los hidrógenos de los grupos amida (-ΔδHN/ΔT, ppm/K). Las constantes de acoplamiento 3 J HNHα se midieron a partir de la separación de los multipletes de los picos-cruzados (cross-peaks) obtenidos en los experimentos unidimensionales dqf-cosy. La figura 4 muestra las conectividades interprotónicas para las tres moléculas en estudio.

Producción de anticuerpos monoclonales anti ψ-128 (129) y ψ-130 (131)
Las células del bazo de ratones BALB/c, enriquecidas en linfocitos B, previamente inmunizados activamente con los pseudopéptidos ψ129 y ψ131, se fusionaron con células de mieloma murino X63Ag8, usando polietilenglicol 3000-3700 (Sigma Chemical Co., St. Louis, mo) de acuerdo con la metodología descrita anteriormente (11, 14) para obtener hibridomas reactivos. Estos hibridomas se clonaron dos veces por dilución limitante. Después de una evaluación específica por Elisa y Western Blot, los clones reactivos se expandieron a un volumen de cultivo mayor.
Inducción del cambio de isotipo por inmunización in vitro de hibridomas reactivos
Las células de los clones de hibridomas derivados de los péptido-miméticos ψ-129 y ψ-131 se distribuyeron de 100.000 células/pozo en una caja de 96 pozos de fondo plano, en medio de cultivo rpmi-1640 suplementado con suero fetal bovino (SFB) al 15%. Estas células se pulsaron posteriormente durante cinco veces con 200 ng de su respetivo pseudopéptido monómero (ψ128 y ψ130) diluido en rpmi 15% sfb, a intervalos de ocho días por pulso. El cambio de isotipo se verificó por medio del monoclonal antibody isotyping kit (hrp/abts) de Thermo Scientific (Rockford, IL, EE. UU.). Los sobrenadantes se recogieron periódicamente para su análisis. Los sobrenadantes provenientes del hibridoma inducido por el ψ128 (ψ129) se codificaron como SN 6 y SN 7 y los sobrenadantes provenientes del hibridoma inducido por el ψ130 (ψ131) se codificaron como SN: G, M, O y Q. Se evaluó reactividad de los anticuerpos presentes en cada uno de los sobrenadantes de los hibridomas frente a lisado de P. falciparum cepa FCB2 por Western Blot.
Producción in vivo de anticuerpos monoclonales anti ψ-129 y ψ-131
Con el objetivo de producir fluido ascítico enriquecido en anticuerpos monoclonales, la cavidad peritoneal de ratones BALB/c se irritó previamente por inyección vía intra- peritoneal (i.p.) con 500 µL de Pristano (Sigma Chemical Co., Saint Louis, mo, EE. UU.). A los ocho días, a cada uno de los animales se le inyectó por la misma vía 500 µL de los hibridomas celulares derivados de ψ-129 y ψ-131 (1.000.000 de células) suspendidas en medio rpmi incompleto. Luego de ocho días, se comenzó a recoger el fluido ascítico producido en cada animal por punción abdominal; el líquido ascítico obtenido se centrifugó a 1.200 x g durante 5 min, se inactivó la actividad de las moléculas de complemento por calentamiento a 56 °C y se realizó el procedimiento para deslipidificación de cada solución (11) y de esta manera dar continuidad a la purificación de los anticuerpos presentes en esta disolución.
Purificación de inmunoglobulinas
Los sobrenadantes provenientes de cultivo celular se precipitaron por saturación con sulfato de amonio al 80%. Posteriormente se centrifugaron, los sobrenadantes se separaron cuidadosamente y el precipitado fue reconstituido usando 10 mM Tris-HCl pH 8,0; luego dializado contra este mismo buffer en una membrana Spectra-pore® dialysis de 3.500 mwco (Houston, Texas, EE. UU.) a 4 °C. Posteriormente, los precipitados enriquecidos con anticuerpos y dializados versus la solución tamponadora de pH de equilibrio, se sometieron a cromatografía de intercambio aniónico débil usando Deae Sephadex A-25 resina (Pharmacia, Uppsala, Suecia) previamente equilibrada con 10mM Tris-HCl buffer, pH 8,0 y a la cual anticipadamente se había permitido unir a los anticuerpos toda una noche a 4 °C con agitación constante. Las inmunoglobulinas fueron eluidas de la columna por incremento progresivo de fuerza iónica del tampón de pH desde 50 mM, 100 mM y 500 mM de NaCl. Un total de cuatro volúmenes de columnas (250 mL) se adicionó por paso, colectando fracciones de 10 mL a un flujo constante de 0,5 mL/min. La resina fue reequilibrada con 10 mM Tris-HCl buffer, pH 8,5. Todas las fracciones fueron caracterizadas por Dot directo (técnica inmunoquímica para la detección de inmunoglobulinas) para detección de Ig. Las fracciones reactivas se mezclaron en grupos o pooles de acuerdo con la fuerza iónica con que fueron eluidas. Los grupos de fracciones se dializaron en contra de pbs a 4 °C. La pureza de cada pool de fracción se determinó por electroforesis en geles de poliacrilamida dodecil sulfato de sodio (sds-page) y Western Blot (15).
Estandarización de modelos de infección con malaria por P. yoelii y P. berghei en ratones BALB/c
Con el objetivo de establecer infección de malaria in vivo en ratones BALB/c (obtenidos del bioterio de la Facultad de Medicina Veterinaria de la Universidad Nacional de Colombia), se descongeló un vial de P. yoelii 17XL y un vial de P. berghei ANKA criopreservados en solución de Krebs (NaCl 0,85%, glucosa 5%, sorbitol 4,2% p/v). Para ello se realizaron tres lavados con rpmi incompleto a 2.500 rpm durante 10 min y finalmente se inyectó intraperitonealmente el contenido del vial resuspendido en 500 µL de rpmi incompleto. A partir del sexto día posinfección se evaluó la parasitemia diariamente con tinción de Wright en extendidos de sangre periférica.
Para realizar los retos experimentales, se permitió que estos ratones alcanzaran una parasitemia del 10%. Posteriormente, se realizó recuento de glóbulos rojos en cámara de Neubauer con laminilla de naranja de acridina, para determinar la cantidad de glóbulos rojos parasitados a inyectar.
Actividad antimalárica in vivo de inmunoglobulinas inducidas por péptido-miméticos
Se efectuó una adaptación de condiciones estándar para el crecimiento in vitro de P. yoelii y P. berghei de acuerdo con los procedimientos previamente reportados (16, 17, 18, 19).
Para el ensayo de actividad funcional in vivo, se utilizaron grupos de cinco ratones BALB/c para cada una de las muestras a evaluar: grupo 1: control (solución salina); grupo 2: Ig anti ψ-129-6-100 mM; grupo 3: Ig anti ψ-129-7-50 mM; grupo 4: Ig anti ψ-129-7-100 mM; grupo 5: Ig anti ψ-131-50 mM; grupo 6: Ig anti ψ-131-100 mM; grupo 7: Ig anti ψ-131-500 mM, y grupo 8: control negativo suero policlonal antipartículas semejantes a virus del Papilloma (VLP).
Los ensayos de inmunización pasiva se realizaron mediante el siguiente esquema: en el día -1 se hizo la primera inmunización intravenosa con 250 µL de anticuerpos a cada ratón. En el día 0 se realizó la infección intravenosa con 50.000 GRP/µL de P. berghei diluidos en pbs filtrado. En los días 2 y 4 se hizo la segunda y tercera inmunización en la misma dosis, respectivamente. Se evaluaron porcentajes de parasitemia desde el día 6 al día 20. En el día 21 se realizó la segunda infección con P. berghei con 100.000 GRP/µL por vía intraperitoneal. En los días 25, 28 y 30 se realizaron la cuarta, quinta y sexta inmunización por vía intravenosa (i.v.) con la misma dosis inicial. Se evaluaron porcentajes de parasitemia desde el día 25 hasta el día 40. Los grupos que se trabajaron fueron los siguientes:
Para el ensayo con P. yoelii se utilizaron grupos de cinco o cuatro ratones BALB/c para cada una de las muestras a evaluar: grupos 1 y 10: control (solución salina); grupo 2: cloroquina; grupo 3: Ig anti ψ129-6-50 mM; grupo 4: Ig anti ψ129-6-100 mM; grupo 5: Ig anti ψ129-7-50 mM; grupo 6: Ig anti ψ129-7-100 mM; grupo 7: Ig anti ψ131-50 mM; grupo 8: Ig anti ψ131-100 mM; grupo 9: Ig anti ψ131- 500 mM. Dada la virulencia de la cepa P. yoelii, el esquema de inmunización se modificó de la siguiente manera: en el día -1 se hizo la primera inmunización intravenosa con 250 µL de anticuerpos a cada ratón. En el día 0 se realizó la infección con 2.000 GRP/µL intravenosamente. En los días 2 y 5 se realizó la segunda y tercera inmunización en la misma dosis, respectivamente. Se evaluaron porcentajes de parasitemia desde el día 6 al día 28. En el día 13 se realizó la segunda infección con P. yoelii con 5.000 GRP/µL vía intraperitoneal. En el día 15 se realizó la cuarta inmunización intravenosamente con la misma dosis inicial.
Para el reto experimental con P. yoelii en los grupos 7, 8, 9 y 10 se realizó el siguiente esquema: en el día 0 se realizó la primera inmunización intravenosa con 100 µL de anticuerpos a cada ratón. En el día 0 se realizó la infección con 2.000 GRP/µL intravenosamente de P. yoelii. En los días 1, 2 y 4 se efectuaron las 2, 3 y 4 inmunizaciones respectivamente con 200 µL a cada ratón. Se evaluó la aparición de parasitemia desde el día 3 hasta el día 9.
RESULTADOS Y DISCUSIÓN
Análisis bioinformático y diseño experimental
De acuerdo con el análisis bioinformático realizado, mostrado en la figura 1, la secuencia del péptido 4044 se encuentra presente en la proteína ortóloga de MSP-2 de P. falciparum en P.berghei PBANKA_124700 con 21% de identidad y en una proteína hipotética de esta misma especie PB000459.00.0 con 42% de identidad; de igual manera ocurre en la proteína hipotética de P. yoelii PY05325 con 20% de identidad. Este análisis bioinformático unido a los resultados obtenidos anteriormente in vitro (datos no mostrados pero disponibles), permitieron proponer los ensayos de evaluación de las propiedades funcionales de los pseudopéptidos y de sus anticuerpos inducidos mediante ensayos in vivo con las cepas de P. berghei y P. yoelii causantes de malaria en ratones BALB/c.
Diseño, síntesis y caracterización estructural del péptido de alta unión 4044 del antígeno MSP-2 y de sus péptido-miméticos amidas reducidas
Como se observa en la figura 1, el péptido nativo codificado como 4044 proveniente del bloque 1 conservado de la región amino terminal de la secuencia del antígeno MSP-2. El motivo de unión a glóbulos rojos definido por el par de residuos 30 FIN 31 , sirvió como base para el diseño para la sustitución sitio-dirigida de un solo enlace peptídico a la vez por el isóstero ψ[CH 2-NH], para dar lugar a los pseudopéptidos ψ-128 (F-I) y ψ-130 (I-N) y a sus correspondientes formas poliméricas ψ-129 y ψ-131, respectivamente.
El diseño experimental sintético para la obtención de las dos moléculas objetivo del estudio, los pseudopéptidos amida reducida ψ-128 ( 30Phe-Ile 31 ) y ψ-130 ( 31 Ile-Asn 32 ) y sus correspondientes formas poliméricas ψ-129 y ψ-131, se pueden observar en la figura 2.
En un proceso sintético realizado en fase sólida, el sintón (2) se incorpora a la cadena peptídica creciente (1) in situ para dar lugar al aducto (3) caracterizado por la estabilización del ion iminium. Este ion selectivamente se reduce en condiciones moderadamente suaves con cianoborohidruro de sodio (NaCNBH3 ) para dar así lugar a la función metilenamino (-CH2-NH-) entre el residuo protegido en su función amino con el grupo t-Boc y el residuo amino terminal de la secuencia anclada a la resina (4). Los péptido-miméticos objetivo (5) se obtienen luego de finalizar la síntesis en fase sólida y ser desanclados de la resina tal como se ilustra en la figura 3. En la tabla 1 se pueden observar las características fisicoquímicas de las moléculas producidas para este estudio, es decir, el péptido nativo 4044 y sus análogos pseudopeptídicos en sus formas de monómero y polímero. Todas ellas reunieron las cualidades moleculares adecuadas, como son un perfil cromatográfico que evidencia alta pureza (superior al 98%), su identidad plena basada en análisis maldi-tof para detección de especies de masa molecular relativa aproximadamente iguales o comparables con las esperadas, y propiedades antigénicas detectables por ensayos de Elisa, para la realización de los experimentos inmunológicos.
Seguidamente, este nuevo grupo de moléculas se caracterizó en cuanto a la presencia de elementos de estructura secundaria, mediante la técnica de dicroísmo circular (DC). Dada la relevancia de los datos obtenidos, se procedió a realizar estudios de RMN- 1 h mediante la aplicación de técnicas bidimensionales como noesy (nuclear Overhauser effect spectroscopy) para generar datos más precisos acerca de la estructura 3D de las tres moléculas. Como resultado de estos experimentos, se obtuvieron diagramas de conectividad entre las diferentes familias de hidrógeno de cada molécula tal como se aprecia en la figura 4. Según se observa, la estabilidad de rasgos tipo hélice-α en el péptido nativo 4044 es más fuerte que en cualquiera de los péptido-miméticos ψ-128 y ψ-130. Esto se evidencia por la presencia de varios puentes de hidrógeno, propios de estructuras helicoidales, como se observa en el aparte A de la figura. La tendencia estructural más relajada en los dos péptido-miméticos es también evidente, como se observa en B y en C. El impacto estructural de los dos nuevos grados de libertad introducidos en los dos análogos moleculares es dramático, tanto así que se pierden rasgos característicos de las hélices-α del péptido nativo en sus nuevos análogos.
En la figura 5 se pueden observar los modelos moleculares obtenidos mediante el cálculo de estructura en condiciones de simulación al vacío de minimización de energía. Para ello se tomaron como base los archivos generados para cada molécula en formato pdb (protein data bank). éstos se sometieron a análisis con el programa vmd 1.8 para generar así las imágenes moleculares en cada caso. Como puede observarse, la estructura del péptido nativo 4044 presenta diferencias estructurales globales respecto a sus dos análogos pseudopeptídicos ψ-128 y ψ-130, los cuales evidencian la presencia del grupo metileno -CH2- como sustituyente del grupo carbonilo -CO- de un enlace peptídico, en particular haciendo que estas estructuras tengan un carácter de conformación más extendida respecto a la original en apariencia más compacta. Estos datos coinciden en alto grado con los datos obtenidos por RMN.

Establecimiento de modelos de infección por malaria in vitro e in vivo
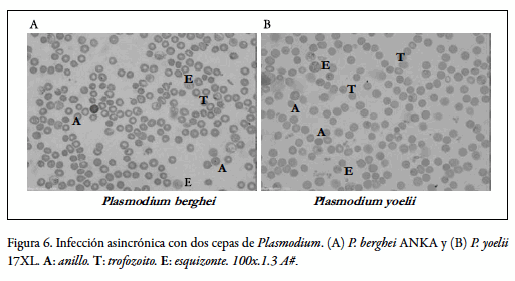
La morfología propia de eritrocitos de ratones BALB/c infectados con las cepas de malaria de roedores Plasmodium yoelii 17XL y Plasmodium berghei ANKA, permitió controlar y caracterizar el ciclo eritrocítico de estas dos entidades, como se observa en la figura 6, en la cual se muestran los estadios sanguíneos de anillos, trofozoitos y esquizontes maduros del parásito de la malaria. En condiciones controladas se logró mantener cada cultivo celular en etapas temporales hasta de un mes en ambos casos.
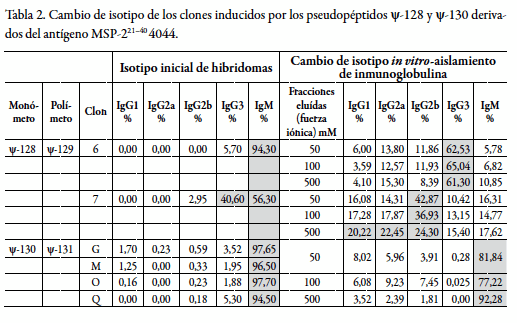
Seguidamente se procedió a la producción de anticuerpos monoclonales inducidos por los péptido-miméticos ψ-128 y ψ-130. Se generó un grupo de hibridomas que en principio presentaron isotipo IgM. Esta molécula pentavalente sirvió de base para realizar experimentos de inmunización in vitro para inducir el cambio de isotipos a formas de anticuerpos más simples pero igualmente funcionales.
En la tabla 2 se muestran los principales resultados obtenidos mediante este procedimiento y su versatilidad al inducir el cambio drástico de isotipo por inmunización in vitro de hibridomas secretoras de inmunoglobulinas de isotipo IgM a IgG1, IgG2a, IgG2b e IgG3, cuya actividad neutralizante de la infección por malaria fue evidente. El efecto inductor del cambio de isotipo evidenció ser más eficiente para los clones estimulados con el pseudopéptido ψ-128, permitiendo obtener subclones de los isotipos IgG1, IgG2a e IgG3 en proporciones entre el 20% y el 65%, mientras que la estimulación de los clones inducidos por el pseudopéptido ψ-130 fue inferior al 10%.
Estos anticuerpos se probaron por su reactividad frente a un lisado de Plasmodium falciparum, tal como se observa en la figura 7.
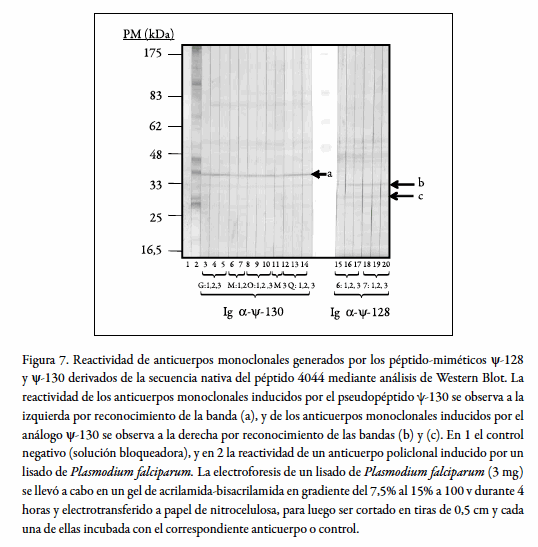
Los anticuerpos inducidos por el péptido-mimético ψ-130 (I-N) evidencian una reactividad fuerte y específica por una banda denominada (a) que migra con una movilidad relativa respecto a los patrones de peso molecular de 37,90 kDa. Por otra parte, los anticuerpos inducidos por el péptido-mimético ψ-128 (F-I) reconocen dos bandas de alta intensidad y especificidad con movilidad relativa más rápida denominadas (b) y (c), respectivamente. La banda (b) tiene una masa molecular relativa de 34,21 kDa y la banda (c) una masa molecular relativa de 30,54 kDa. Datos obtenidos al interpolar el valor de la movilidad de cada una de estas bandas en cm en una curva de calibración establecida para la relación entre el log10 de la masa molecular (pm) frente a la distancia recorrida por cada uno de los patrones (cm) (datos no mostrados pero disponibles).
Estas bandas reconocidas por los dos grupos de anticuerpos están de acuerdo con la masa molecular relativa reportada para el antígeno MSP-2.
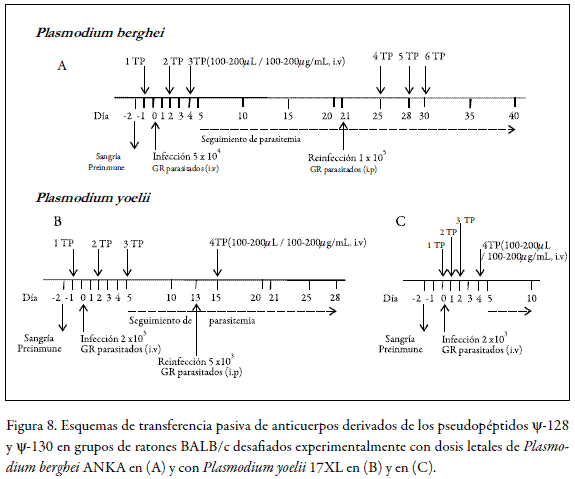
Posteriormente, estos anticuerpos se administraron vía i.v. en ensayos de transferencia pasiva a ratones de la cepa BALB/c desafiados experimentalmente con las cepas de malaria murina de Plasmodium berghei ANKA y Plasmodium yoelii 17XL. El esquema de transferencia pasiva de los anticuerpos específicos inducidos por los pseudopéptidos ψ-128 (F-I) y ψ-130 (I-N) se describe en la figura 8. Mediante la aplicación de estos esquemas se pudo evaluar en un período posterior a veinte días el porcentaje de parasitemia en cada individuo del estudio.
Una vez se logró establecer los modelos de infección en cultivo controlado in vitro, puesto que en nuestras manos no existía esta metodología anteriormente a este estudio, así como la infección de ratones hembra de la cepa BALB/c in vivo, se procedió a realizar la evaluación de la actividad funcional de anticuerpos monoclonales inducidos por los péptido-miméticos derivados de la secuencia del péptido nativo 4044. En la figura 9 se observa el efecto neutralizador de la infección in vivo de los anticuerpos purificados transferidos pasivamente en ratones hembra BALB/c, frente al desafío experimental con inóculos infecciosos letales la cepa de P. berghei ANKA en (A) y P. yoelii 17XL en (B) y (C). En todos los casos, los grupos de control, tratados por vía i.v. con solución salina, presentaron cinéticas de infección superiores a las de los grupos de estudio tratados por la misma vía con inmunoglobulinas puras de isotipo definido. éstos, además de evidenciar un retraso en la aparición de porcentajes significativos de parasitemia, lograron manejar niveles mucho más altos de parasitemia evidenciando un efecto modulador de los anticuerpos en el parásito. Notoriamente, los grupos de animales administrados con solución salina se infectaron más rápidamente, luego del desafío experimental que los grupos de estudio manejó niveles inferiores de parasitemia suficientes para causar la muerte de estos animales, lo cual no ocurrió en los otros grupos.
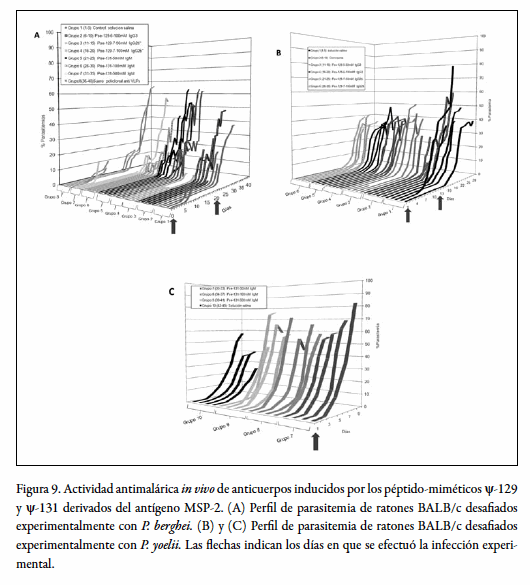
Los animales pertenecientes al grupo 2 transferidos pasivamente con anticuerpos inducidos por el ψ-128 (ψ-129), controlaron la infección significativamente, logrando revertir el efecto infeccioso de la cepa P. berghei al compararlos con los grupos de control; los cuales no sólo manejaron porcentajes más elevados de parasitemia, sino que en la mayoría de los casos fallecieron por causa de la infección. Los animales de los grupos 6 y 7 transferidos pasivamente con anticuerpos inducidos por el ψ-130 (ψ-131), controlaron la i nfección mucho mejor que los demás grupos, evidenciando el potencial funcional de este péptido-mimético frente a la cepa de P. berghei. La cepa de P. yoelii mostró rasgos de virulencia más fuertes que la cepa de P. berghei, así los animales desafiados con esta cepa manejaron porcentajes de parasitemia mucho más altos. El efecto de los anticuerpos transferidos pasivamente en los ratones del estudio lograron, de manera semejante al primer caso, controlar la infección causada por P. yoelii (figura 9B y C). Igual que en el primer caso, los animales tratados con solución salina manejaron porcentajes de parasitemia menores, pero fallecieron en un período mucho menor que los demás grupos de estudio. Todos los grupos en estudio fueron desafiados dos veces, la primera por administración vía intravenosa y la segunda vía intraperitoneal.
La cepa de P. yoelii fue menos virulenta que en los ensayos in vivo, como se observa en la figura 9B. Todos los grupos administrados con anticuerpos controlaron mejor los niveles de parasitemia a excepción del grupo tratado con egta (ethylene glycol-bis(2- aminoethylether)-N,N,N´,N´-tetraacetic acid).
Es importante resaltar que durante los primeros veinte días del ensayo in vivo para los grupos desafiados experimentalmente con la cepa de P. berghei y los primeros doce días luego del desafío experimental con P. yoelii, la totalidad de los animales pertenecientes a los grupos de estudio tuvieron porcentajes de protección entre 90% y 100%, razón por la cual se decidió hacer una nueva infección (reinfección) con el doble de carga de parásito por vía i.p.
CONCLUSIONESEl diseño sitio-dirigido de péptido-miméticos del tipo pseudopéptidos amida reducida a partir de una secuencia nativa codificada 4044, la cual en estudios previos y en éste demostró ser pobremente inmunogénica y no inductora de protección contra la malaria, permitió obtener, en cambio, dos pseudopéptidos potentes inductores de una respuesta inmune de carácter humoral mediada por anticuerpos que específicamente reconocieron dos grupos de proteínas derivadas del antígeno MSA-2. La versatilidad de la modificación entre dos residuos adyacentes pero que involucran dos residuos diferentes 30 Phe-Ile 31 e 1 Ile-Asn 32, indujo dos grupos de anticuerpo poseedores de reactividades fuertes y específicas; el primer grupo inducido por el inmunógeno ψ-130 ( 30 Phe-Ile 31 ), reconoció una banda de movilidad relativa de 37,90 kDa, y el segundo grupo de anticuerpos inducidos por el inmunógeno ψ-128 ( 31 Ile-Asn 32 ), reconoce específicamente dos bandas con pesos moleculares relativos de 34,21 kDa y 30,54 kDa, respectivamente. Estos anticuerpos monoclonales poseen propiedades neutralizantes de la infección in vivo, cuando son transferidos pasivamente en ratones BALB/c desafiados experimentalmente con dosis letales de Plasmodium berghei y Plasmodium yoelii en un doble reto por dos vías de administración.
Las evidencias obtenidas en este estudio permiten proponer a estos péptido-miméticos del tipo amida reducida, como potenciales candidatos a una formulación de una vacuna de subunidades contra la malaria y a sus anticuerpos inducidos como potenciales agentes inmunoterapéuticos para el manejo de esta enfermedad. El diseño sitio-dirigido de péptido-miméticos, tomando como base éste y otros antígenos de superficie del Plasmodium, permitirá evaluar más extensamente los datos reportados en este trabajo.
AGRADECIMIENTOS
Los autores de este trabajo agradecemos al Posgrado Interfacultades de Microbiología y a la Maestría en Ciencias Farmacéuticas, área Curricular de Farmacia de la Universidad Nacional de Colombia. A los diferentes grupos funcionales de investigación de la Fundación Instituto de Inmunología de Colombia (FIDIC). A la Doctora Lilian Spencer-Valero del Departamento de Biología Celular de la Universidad Simón Bolívar (Caracas, Venezuela), por la donación de la cepa de Plasmodium yoelii 17XL y a la Doctora Silvia Blair del Laboratorio de Malaria, Facultad de Medicina de la Universidad de Antioquia (Medellín, Colombia), por la donación de la cepa de Plasmodium berghei ANKA. Especial agradecimiento al Profesor Manuel Elkin Patarroyo, inspirador de las ideas desarrolladas en este trabajo.
REFERENCIAS
1. B. Singh, L. K. Sung, A. Matusop, A. Radhakrishnan, S.G. Shamsul, J. Cox- Singh, A. Thomas, D.J. Conway, A large focus of naturally acquired Plasmodium knowlesi infections in human beings, Lancet, 363, 1017-1024 (2004). [ Links ]
2. R. Tuteja, Malaria the global disease, FEBS Journal, 274, 4669 (2007). [ Links ]
3. S.I. Hay, C.A. Guerra, A.J. Tatem, A.M. Noor, R.W. Snow, The global distribution and population at risk of malaria: Past, present, and future, Lancet Infect. Dis., 4, 328 (2004). [ Links ]
4. P.E. Parham, E. Michael, Modeling the effects of weather and climate change on malaria transmission, Environ. Health Persp., 118 (5), 620-626 (2010). [ Links ]
5. K.P. Paaijmans, S.S. Imbahale, M.B. Thomas, W. Takken, Relevant microclimate for determining thedevelopment rate of malaria mosquitoes and possible implications of climate change, Malaria J., 9 (196), 1-8 (2010). [ Links ]
6. D. D´alessandro, U. Olaleve, W. Mcguire, P. Langerock, S. Bennett, M.K. Aikins, Mortality and morbidity from malaria in Gambian children after introduction of an impregnated bednet programme, Lancet, 345, 479 (1995). [ Links ]
7. Instituto Nacional de Salud (sivigila), reporte semana 52 de 2010 [en línea]. Bogotá, sivigila, 2011, url: http://www.ins.gov.co. [ Links ]
8. M. Ocampo, M. Urquiza, F. Guzmán, L.E. Rodríguez, J. Suárez, H. Curtidor, et al., Two MSA-2 peptides that bind to human red blood cells are relevant to Plasmodium falciparum merozoite invasion, J. Peptide Res., 55 (3), 216-223 (2000). [ Links ]
9. C.G. Adda, V.J. Murphy, M. Sunde, L.J. Waddington, J. Schloegel, G.H. Talbo, K. Vingas, V. Kienzle, R. Masciantonio, G.J. Howlett, A.N. Hodder, M. Foley, R.F. Anders, Plasmodium falciparum merozoite surface protein 2 is unstructured and forms amyloid-like fibrils, Mol. Biochem. Parasit., 166, 159-171 (2009). [ Links ]
10. J.A. Smythe, M.G. Peterson, R.L. Coppel, A.J. Saul, D.J. Kemp, R.F. Anders, Structural diversity in the 45-kilodalton merozoite surface antigen of Plasmodium falciparum, Mol. Biochem. Parasitol., 39, 227-234 (1990). [ Links ]
11. J.M. Lozano, F.J. Montoya, J. Hoebeke, G.H. Cifuentes, M. Forero, M.E. Patarroyo, Antibodies induced by Plasmodium falciparum merozoite surface antigen2-designed pseudopeptides possess neutralizing properties of the in vitro malarial infection, Peptides, 28, 1954-1965 (2007). [ Links ]
12. J.A. Fherentz, B. Castro, An Efficien t synthesi s o f opticall y activ e α-(t-butoxycarbonylamino)-aldehydes from α-amino acids, Synthesis, 676-678 (1983). [ Links ]
13. R.B. Merrifield, Solid phase peptide synthesis. I. the synthesis of a tetrapeptide, J. Am. Chem. Soc., 85, 2149 (1963). [ Links ]
14. G. Kohler, C. Milstein, Derivation of specific antibody producing tissue culture and tumor lines by cell fusion. Eur. J. Immunol., 6 (7), 511-519 (1976). [ Links ]
15. J.M. Lozano, L.P. Lesmes, G.M. Gallego, M.E. Patarroyo, Protection against malaria is conferred by passive transferring rabbit F(ab)2´ antibody fragments, induced by Plasmodium falciparum MSP-1 site-directed designed pseudopeptide-BSA conjugates assessed in a rodent model, Mol. Immunol., 48, 657-669 (2011). [ Links ]
16. M.E. Smalley, G.A. Butcher, The in vitro culture of the blood stages of Plasmodium berghei, Int. J. Parasitol., 5, 131-132 (1975). [ Links ]
17. B. Mons, C.J. Janse, J.J.A.B. Croon, H.J. van der Kayy, In vitro culture of Plasmodium Berghei using a new suspension system, Int. J. Parasitol., 13 (2), 213-217 (1983). [ Links ]
18. P.H. Lewis-Hughes, M.J. Howell, In vitro culture of Plasmodium yoelii blood stages, Int. J. Parasitol., 14 (5), 447-451 (1984). [ Links ]
19. M. Ramaiya, Kamath, R. Vijayalaxmi, D.M. Renapurkar, Long-term in vitro cultivation of Plasmodium berghei, Int. J. Parasitol., 17 (7), 1329-1331 (1987). [ Links ]














