Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.40 no.1 Bogotá Jan./June 2011
Artículo de Revisión
Efeitos biológicos das antocianinas no processo aterosclerótico
Biological effects of anthocyanins on the atherosclerotic proces
Luciana Marques Cardoso ,1 , Joâo Paulo Viana Leite1 , Maria do Carmo Gouveia Peluzio2
1 Departamento de Bioquímica e Biologia Molecular, Programa de Pós-Graduaçâo em Bioquímica Agrícola, Universidade Federal de Viçosa, Av. Peter Henry s/n, 36570-000 Viçosa, MG, Brasil, e-mail: luciana.cardoso@ufv.br, fax: (31) 3899-2373.
2 Departamento de Nutrição e Saúde, Universidade Federal de Viçosa, Viçosa, MG, Brasil.
Recibido para evaluación: 5 de abril de 2011 Aceptado para publicación: 30 de mayo de 2011
RESUMO
As antocianinas são metabólitos secundários biossintetizados por plantas e pertencentes ao grupo dos flavonóides. Pesquisas indicam que as antocianinas podem aumentar a resistência da LDL à oxidação, comparado a outros compostos com alto poder antioxidante, como o ácido L-ascórbico, e reduzir fatores pró-inflamatórios, como citocinas, quimiocinas, moléculas de adesão e metaloproteinases. Como a inflamação e a oxidação são processos característicos da aterosclerose, tem se investigado o efeito das antocianinas no processo aterosclerótico e há evidências que estes compostos podem diminuir o desenvolvimento e a progressão das lesões ateroscleróticas.
Palavras chaves: Antocianinas, Aterosclerose, Antioxidante, Antiinflamatório .
SUMMARY
Anthocyanins are secondary metabolites biosynthesized by plants and belonging to the group of flavonoids. Research indicates that anthocyanins can increase resistance of LDL to oxidation, compared to other compounds with high antioxidant properties, such as L-ascorbic acid, and reduce pro-inflammatory factors such as cytokines, chemokines, adhesion molecules and metalloproteinases. As inflammation and oxidation processes are characteristic of atherosclerosis, has investigated the effect of anthocyanins in the atherosclerotic process and there is evidence that these compounds can reduce the development and progression of atherosclerotic lesions.
Key words: nthocyanins, atherosclerosis, antioxidants, antiinflamator.
INTRODUÇÃO
As antocianinas são pigmentos naturais que pertencem ao grupo de metabólitos secundários vegetais conhecidos como flavonóides. Algumas das principais funções das antocianinas nos vegetais são a atração de agentes polinizadores e dispersores de sementes e a proteção a diversos tecidos da planta durante as etapas de seu ciclo de vida (1).
As antocianinas ocorrem mais comumente na natureza como glicosídeos de geninas antocianidinas, podendo estar aciladas com ácidos orgânicos como, cumárico, caféico, ferúlico, p-hidroxibenzóico, acético, malônico, succínico, oxálico e ácidos málicos (2). Sua estrutura geral é derivada do cátion flavílico (Figura 1)
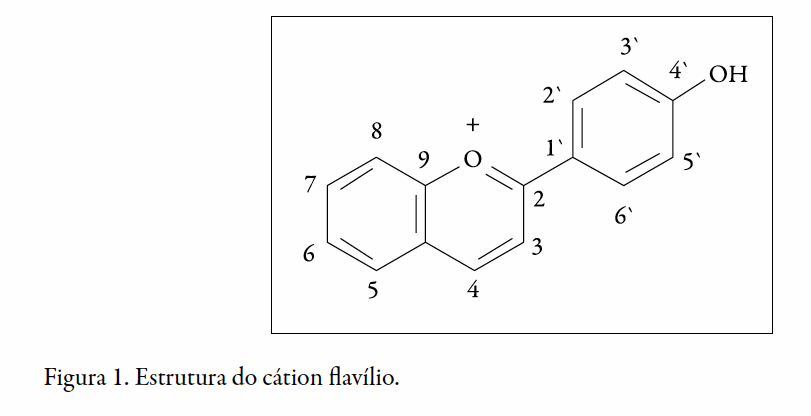
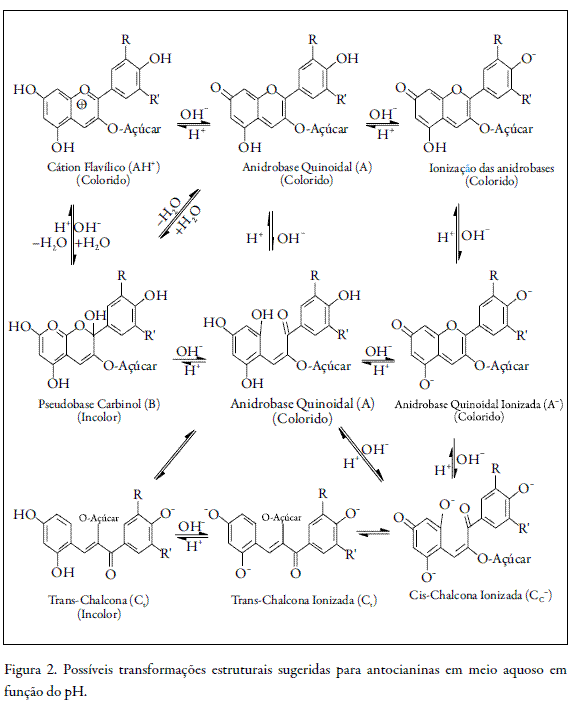
As antocianinas podem apresentar diferentes formas estruturais, tais como o cátion flavílio, a base quinoidal, o carbinol e a chalcona. Essas estruturas podem sofrer interferência de diversos fatores, entre estes, temperatura, pH e possíveis ligações com outras substâncias químicas, proporcionando diferentes colorações às antocianinas. O pH é o fator que mais influencia na coloração das antocianinas, visto que, em função de sua acidez ou alcalinidade, estas podem apresentar diferentes estruturas (3).
Com o aumento do pH ocorre nas antocianinas a protonação do cátion flavílio e, conseqüentemente, diminuição do número de ligações duplas conjugadas, que são responsáveis pelo aumento nos máximos de absorção destas substâncias. Em meio ácido (pH = 1), as antocianidinas apresentam coloração na região visível do vermelho (cátion flavílio) e em pH ainda ácido, porém maior (pH = 4,5), as antocianidinas apresentam uma coloração vermelha bem menos intensa, próxima ao incolor, como mostra a figura 2 (3).
As antocianinas são solúveis em água e podem ser facilmente extraídas com solventes polares, sendo os solventes alcoólicos, como metanol e etanol, os mais utilizados. Muitos trabalhos têm empregado solventes extratores alcoólicos acidificados para favorecer a extração, pois além de aumentar a estabilidade das antocianinas, dificulta o aparecimento de fungos (5). Porém, o uso de solventes ácidos para a extração de antocianinas deve ser cauteloso, pois o excesso de ácido pode promover sua hidrólise, levando a formação de antocianidinas. O aquecimento durante a extração também deve ser observado, pois estudos indicam que as antocianinas são termicamente estáveis até 60 °C (4, 6).
A quantidade e o tipo das antocianinas nos vegetais também sofrem influência de alguns determinantes, como as condições de cultivo, tempo de plantio, exposição à luz UV e método de colheita. Por esse motivo, a comparação de teores de antocianinas entre diferentes culturas de um mesmo vegetal, como frutas, pode gerar resultados bastante distintos (7).
Há diversos métodos descritos na literatura para quantificar as antocianinas (totais ou individuais), dentre os quais se destacam aqueles que envolvem espectrofotometria UV-VIS, cromatografia líquida de alta eficiência (CLAE) e espectrometria de massas (8, 9, 10).
Têm-se observado um crescente interesse no uso de antocianinas em diversos segmentos, dentre os quais se destacam as indústrias alimentícia, farmacêutica e cosmética, onde podem ser aplicadas, por exemplo, como corantes, principalmente de coloração vermelha, sendo estes uns dos corantes naturais mais difíceis de serem encontrados na natureza em forma estável. Entretanto, o uso industrial de antocianinas como corantes ainda é restrito devido a algumas limitações, dentre as quais podemos citar a baixa estabilidade e a capacidade corante reduzida, quando comparadas a corantes sintéticos; além de dificuldades na etapa de obtenção e pelo elevado custo desse processo (5). Como importantes fontes de antocianina na dieta podem ser citadas as frutas como o açaí, ameixa, amora, cereja, figo, framboesa, uva, maçã, morango e acerola e os vegetais, como o repolho roxo, batata roxa, berinjela, entre outros (1).
Estima-se que a ingestão de antocianinas nos Estados Unidos, principalmente na forma de cianidina e malvidina, esteja entre 12 a 215 mg/dia por indivíduo (11), a qual é maior que outros flavonóides incluindo quercetina, kaempferol, miricetina, apigenina e luteolina (12).
Além de suas funções como corantes naturais, as antocianinas têm apresentado grandes benefícios á saúde devido suas atividades biológicas, que incluem propriedades antioxidantes (13), antiinflamatórias (14), inibição da oxidação do LDL (15), diminuição dos riscos de doenças cardiovasculares (16) e de câncer (17).
Propriedades antioxidantes das antocianinas
O estresse oxidativo é caracterizado por um desequilíbrio entre agentes oxidantes, como os radicais livres, e moléculas antioxidantes, favorecendo o aumento de espécies oxidantes no sistema biológico. Nessa situação, os oxidantes podem provocar danos em estruturas celulares, como os ácidos nucléicos, proteínas e lipídios (30).
Radical livre é uma espécie química que tem elétrons desemparelhados, sendo por isso instável e com grande capacidade de reatividade. Outras espécies químicas também instáveis podem-se formar a partir dos radicais livres, que embora, não tenham elétrons desemparelhados, possuem similar instabilidade estrutural a dos radicais livres. Assim, para designar as espécies reativas na forma de radical livre e na forma não radical são utilizados os termos espécies reativas de oxigênio (EROs) e espécies reativas de nitrogênio (ENOs) (31).
As espécies reativas são formadas a partir de inúmeras reações no organismo, como parte de seu metabolismo normal. Como exemplos está a formação de íons superóxidos por células de defesa imunológica a partir do oxigênio molecular (O2) por meio da respiração mitocondrial, assim como a formação de óxido nítrico como mecanismo de vasodilatação vascular (32). Porém condições patológicas como a inflamação e fontes exógenas como o cigarro, poluentes do ar, radiação, medicamentos e dieta podem aumentar a produção das espécies reativas (30).
A ocorrência de um estresse oxidativo moderado, freqüentemente é acompanhada pelo aumento das defesas antioxidantes enzimáticas, mas a produção de uma grande quantidade de radicais livres pode causar danos e morte celular (33). Os danos oxidativos induzidos nas células e tecidos têm sido relacionados com a etiologia de várias doenças, incluindo a aterosclerose.
Os radicais livres, principalmente as sustâncias reativas de oxigênio (EROs), parecem ser uma das principais causas da disfunção endotelial que precede e promove a aterogênese. As EROs podem lesar membranas celulares e o núcleo, interagir com mediadores vasomotores, inativando seus efeitos vasodilatadores, e principalmente, oxidar os lipídios da LDL, elemento chave na aterosclerose (34).
O organismo humano possui mecanismos de defesa antioxidante, os quais atuam intracelular e extracelularmente e mantém o equilíbrio redox da célula, assegurando que o aumento das EROs seja transitório. Existem dois mecanismos antioxidantes: o enzimático e o não enzimático, os quais agem cooperativamente para manter o equilíbrio dos radicais livres no organismo (31).
O mecanismo de defesa enzimático é a primeira linha de defesa do organismo contra os danos oxidativos. O sistema é constituído por um conjunto de enzimas, tais como a superóxido dismutase, glutationa peroxidase, glutationa redutase, catalase, tiorredoxinas, peroxirredoxinas e inúmeras outras redutases (31). Já o mecanismo não-enzimático é constituído por um grande número de compostos de baixo peso molecular, ingeridos pela dieta (nutrientes e não-nutrientes) ou sintetizados no organismo, como as vitaminas A, C e E, o peptídeo glutationa e os flavonóides (31, 22).
Estudos in vitro e in vivo mostram que as antocianinas podem atenuar o estresse oxidativo envolvido no processo aterosclerótico. Sendo que vários mecanismos podem estar envolvidos nesse processo, como a capacidade das antocianinas de inibir a oxidação do LDL (15) e reduzir a injúria oxidativa das células endoteliais vasculares (35).
Os efeitos biológicos antioxidantes das antocianinas dependem da sua estrutura química, tais como grau de glicosilação e o números de grupos hidroxilas (36). O número de hidroxilas (-OH) total, a presença de hidroxilas nas posições C3´ e C4´ no anel B e no C3 do anel C do núcleo fundamental flavônico parecem ser os principais requisitos estruturais para as antocianinas inibirem a injúria oxidativa das células endoteliais e a atividade intracelular de radicais livres. Por outro lado, a presença de metilações nas posições (C3´, C4´e C3) reduzem esses efeitos. Comparando as ubstituições por diferentes açúcares, as antocianinas que possuem os monossacarídeos glicose e galactose apresentam benefícios antioxidantes superiores com relação as que contêm dissacarídeos (35).
Nos quadros 1 e 2 encontram-se resumos de trabalhos realizados in vivo e in vitro, respectivamente, que correlacionam a atividade antioxidante das antocianinas ou de fru- tos que são fontes características desta classe de flavonóides.
A capacidade antioxidante das antocianinas também tem sido extensivamente avaliada nos derivados dos vegetais ricos nesta classe de flavonóides como nas polpas e sucos, como representado no quadro 3.
Propriedades antiinflamatórias das antocianinas
Existem evidências que comprovam que as antocianinas também apresentam propriedades antiinflamatórias. Alguns autores sugerem que os efeitos antiinflamatórios das antocianinas podem ser explicados por diferentes mecanismos, tais como:
a) Inibição da ativação do fator nuclear Kappa B (NF-kB) em humanos. Dentre os mecanismos regulatórios da resposta inflamatória, a via do fator nuclear kappa B (NF-kB) representa uma via crucial no controle da transcrição de vários genes pró-inflamatórios, como citocinas, quimiocinas, moléculas de adesão, proteínas de fase aguda, reguladores da apoptose e da proliferação celular (25). Portanto, a inibição desta via pode contribuir para a redução do processo aterosclerótico.
b) Redução da concentração plasmática da proteína quimiotática de monócitos 1 (MCP-1) em humanos, in vitro e in vivo. A MCP-1 é um biomarcador envolvido na evolução de doenças inflamatórias e é expressa, principalmente nas fases iniciais da aterosclerose (40). Esta proteína está envolvida na aterogênese através de diferentes mecanismos. Ela promove o recrutamento de monócitos e linfócitos T circulantes do sangue para o espaço subendotelial e contribui para a diferenciação dos macrófagos em células espumosas (49). A MCP-1 é uma quimiocina membro da subfamília de quimiocinas secretadas por vários tipos de células presentes na parede arterial, como as células endoteliais, as células musculares lisas, fibroblastos e macrófagos e sua expressão pode ser mediada por fatores de transcrição NF-kB (50).
In vitro, o extrato aquoso de Hibiscus sabdariffa (10, 50 e 100 µg/mL), rico nas antocianidinas delfinidina e cianidina, promoveu uma efetiva proteção da morte de células sanguíneas humanas induzidas por adição de peróxido de hidrogênio (H2O2). Houve redução na concentração de MCP-1 de uma maneira dose dependente. O mesmo extrato de Hibiscus sabdariffa, porém liofilizado, foi administrado oralmente na dose de 10 g, a 5 homens e 5 mulheres, ambos saudáveis, com idade entre 23 e 50 anos. As concentrações plasmáticas de MCP-1 reduziram-se significativamente com a administração aguda de 10 g do extrato liofilizado de Hibiscus sabdariffa (40).
Garcia-Alonso et al., 2008 (13) avaliaram o consumo do extrato de vinho tinto, com alto teor de antocianinas, nos níveis plasmáticos de MCP-1 de indivíduos saudáveis. A caracterização do extrato por HPLC evidenciou a presença de 71,2% de antocianidinas monoglicosiladas do total de antocianidinas, representadas em ordem decrescente, pela malvidina-3-glicosídeo, delfinidina-3-glicosídeo, petunidina-3-glicosídeo, peonidina-3-glicosídeo e cianidina-3-glicosídeo. Sete indivíduos (dois homens e cinco mulheres), com idade média de 31 anos e índice de massa corporal médio de 23,2 receberam oralmente, após jejum de 12 horas, uma dose única de 12 g do extrato rico em antocianinas. A dosagem de MCP-1 foi realizada as 0, 3, 6, 10 e 24 h após a ingestão do extrato. Porém, apenas 3 horas após a ingestão do extrato foi encontrado uma redução significativa de MCP-1 no plasma e após 24 horas os níveis de MCP-1 voltaram ao normal. Esse fato pode ser decorrente do extrato ter sido administrado aos participantes do estudo em uma única dose e seria interessante a avaliação da ingestão do extrato rico em antocianinas por um período maior. Os resultados deste trabalho sugeriram fortes evidências de que as antocianinas podem interferir na produção da quimiocina MCP-1, e conseqüentemente, reduzir processos inflamatórios.
c) Inibição da resposta inflamatória e a apoptose de células endoteliais humanas induzidas pelo fator CD40. O fator imune CD40 e seu ligante (CD40L) são um dos mediadores do processo inflamatório, e estão sendo considerados como potentes ativadores da patogênese da aterosclerose. O CD40 e CD40L são membros do fator de necrose tumoral (TNF) e da família de receptores de TNF (TNFR) e são expressos pela interação de células imunes como os linfócitos T e B e também por células não imunes, como as células endoteliais vasculares. A ligação do CD40 com seu ligante CD40L induz a produção de várias citocinas e quimiocinas inflamatórias, tais como as interleucinas e MCP-1, respectivamente, além das moléculas de adesão, como a VCAM-1 (molécula-1 de adesão vascular) e ICAM-1 (molécula-1 de adesão intercelular). Esta interação também parece desempenhar um papel importante no desenvolvimento da ruptura da placa aterosclerótica e na regulação da expressão de metaloproteinases da matriz. VCAM-1 e ICAM-1 são moléculas pró-inflamatórias que atraem linfócitos T e macrófagos para o ateroma, promovendo a iniciação e a progressão da lesão aterosclerótica. As metaloproteinases da matriz são capazes de degradar componentes da matriz extracelular nos vasos sanguíneos e aumentar a vulnerabilidade das placas ateroscleróticas à ruptura com conseqüente formação de trombos (51).
O tratamento com as antocianinas cianidina-3-glicosídeo e peonidina-3-glicosídeo (1, 10 e 100 µM) por 24 horas em cultura de células endoteliais humanas da veia umbilical atenuou a resposta inflamatória e a apoptose destas células induzidas por CD40, por reduzir a secreção de moléculas de adesão (VCAM-1 e ICAM-1), reduzir a produção e atividade de metaloproteinases de matriz e suprimir a ativação de JNK e p38 induzida por CD40. Os autores mostraram que a ativação de p38 é um dos mecanismos chaves pelo qual o CD40 induz a resposta inflamatória e que a estimulação de JNK é necessária para promover a apoptose das células endoteliais estimuladas por CD40 (14).
d) Inibição da produção de óxido nítrico e a expressão de iNOS (óxido nítrico sintase induzida) em células de animais.
A iNOS (óxido nítrico sintase induzida) é a enzima responsável pela produção de óxido nítrico em diferentes células, como macrófagos, células endoteliais e hepatócitos, após ativação com lipopolissacarídeos e citocinas. A utilização de agentes que inibem a atividade e/ou a indução da iNOS pode ser útil como ferramenta terapêutica na redução de processos inflamatórios em diferentes tecidos (43).
Matheus et al., 2006 (43), evidenciaram efeito inibitório de Euterpe oleracea (açaí) na produção do óxido nítrico e na expressão da iNOS. Neste trabalho foram investigados os efeitos de extratos etanólico, de acetato de etila e butanólico obtido a partir de flores, frutos e casca do caule de Euterpe oleracea em cultura de células de monócitos e macrófagos de camundongos (RAW 264,7) estimuladas com lipopolissacarídeos e citocinas. As antocianinas predominantes nos extratos foram cianidina-3-glicosídeo e cianidina-3-raminosídeo, sendo encontradas em maiores concentrações no extrato etanólico dos frutos de E. oleracea. Os resultados mostraram que o extrato etanólico obtido a partir dos frutos foi o mais potente em inibir a produção de óxido nítrico e a expressão da iNOS, provavelmente devido seu maior conteúdo de antocianinas que as outras frações. A redução da viabilidade celular foi encontrada apenas em altas doses dos extratos (acima de 500 µg/mL).
Processo de formação da aterosclerose
As doenças cardiovasculares são as principais causas de morbidade e mortalidade no mundo ocidental, sendo suas principais manifestações decorrentes dos eventos clínicos da aterosclerose, como o infarto, as embolias e os acidentes vasculares cerebrais (18).
A aterosclerose é caracterizada como uma doença inflamatória crônica de origem multifatorial que ocorre em resposta à agressão endotelial, acometendo principalmente a camada íntima de artérias de médio e grande calibre (19).
A disfunção endotelial é considerada o fator inicial para a formação das placas ateroscleróticas e caracteriza-se por uma resposta inflamatória à injúria da parede vascular. Um conjunto de reações celulares e moleculares a diversos agressores, dentre eles o excesso de radicais livres, a elevação das partículas de lipoproteína de baixa densidade (LDL) no plasma e a presença de LDL oxidada (LDLox) no interior da célula endotelial são responsáveis pelo comprometimento do endotélio (20, 21).
A oxidação da LDL ocorre principalmente na íntima da artéria (21). As espécies reativas de oxigênio (EROs) e as espécies reativas de nitrogênio (ERNs) são as principais responsáveis por esta. As EROs incluem o ânion superóxido (O 2- ), o radical hidroxil (OH) e o peróxido de hidrogênio (H2O2), sendo os representantes principais das ERNs o óxido nítrico (NO -) e o peroxinitrito (ONO2-) (22).
As partículas de LDL difundem-se passivamente pelas células endoteliais por transporte vesicular, podendo aderir à parede do vaso por interações entre a apoproteína B e os proteoglicanos da matriz subebdotelial (19).
A LDLox estimula a camada de células endoteliais a produzir moléculas de adesão celular como VCAM-1 (molécula-1 de adesão vascular), ICAM-1 (molécula-1 de adesão intercelular), fatores de crescimento, como o M-CSF (fator estimulador de colônia de macrófagos) e proteínas quimiotáticas, como MCP-1 (proteína-1 quimiotática para monócitos), resultando na adesão e no recrutamento de monócitos e linfócitos circulantes para dentro do vaso. Os monócitos migram para o espaço subendotelial onde se diferenciam em macrófagos, que por sua vez captam as LDL-ox, pela ação dos seus receptores seqüestradores (19).
Dentro dos macrófagos, a LDLox é degradada e o colesterol livre é esterificado, resultando em um grande acúmulo de colesterol e a formação de células espumosas, originando a primeira lesão da aterosclerose: a estria gordurosa (23).
Posteriormente, as células musculares lisas começam a migrar da camada média da parede arterial para a íntima ou espaço subendotelial, proliferam e secretam colágeno, dando origem à lesão intermediária. Nesta fase, o espessamento da íntima provoca o remodelamento, ou seja, uma dilatação da artéria, compensatória ao estreitamento do lúmen. Mais uma vez, sob o estímulo da LDLox, as células do sistema imune local liberam enzimas, citocinas e fatores de crescimento capazes de induzir necrose local. Ciclos repetidos de acúmulo e ativação de células mononucleares, migração e proliferação das células musculares lisas com produção de colágeno, levam ao aumento progressivo da lesão, até que se estruture uma capa fibrosa ao redor de um núcleo lipídico e de tecido necrótico, a chamada lesão avançada (24).
Como exposto, a LDLox participa de todas as etapas do processo de desenvolvimento da aterosclerose, desde a disfunção endotelial até a evolução final do processo aterosclerótico, com oclusão total do lúmen do vaso (21). Além dos seus efeitos biológicos citados, produtos derivados da LDLox são citotóxicos, podendo promover a apoptose celular. Outras contribuições da LDLox para o processo inflamatório na aterosclerose são a inibição da produção de óxido nítrico, que é um vasodilatador, o estímulo da produção de citocinas, como a interleucina-1, e o aumento da agregação plaquetária (22).
Dentre os mecanismos regulatórios da resposta inflamatória, a via do fator nuclear kappa B (NF-κB) representa uma via crucial no controle da transcrição de vários genes pró-inflamatórios, cujo envolvimento na patogênese da aterosclerose tem sido documentado, a liberação de proteínas de fase aguda, como citocinas, quimiocinas, moléculas de adesão e reguladores da apoptose e da proliferação celular (25). A indução à inflamação promovida pela LDLox parece ser decorrente da ativação dessa via pelos seus fosfolipídios oxidados, como a lisolecitina e o ácido lisofosfatídico (26).
Antocianina no tratamento da lesão aterosclerótica
Na busca da elucidação de possíveis mecanismos de ação das antocianinas sobre o processo aterosclerótico algumas pesquisas foram realizadas, dando enfoque mais específico. Podemos citar os trabalhos de Xia et al., 2006 (14), Mauray et al., 2009 (28) e Miyazaki et al., 2008 (29) que analisaram os efeitos de extratos com alto teor de antocianinas em camundongos com aterosclerose: o extrato de arroz preto, de uvas e de batata doce roxa, respectivamente.
Xia et al., 2006 (14) investigaram a influência de dietas suplementadas com extrato de arroz preto com alto teor antocianina (300 mg/Kg/dia) e com sinvastatina (50 mg/Kg/dia) na vulnerabilidade de placas ateroscleróticas avançadas em camundongos deficientes na apoproteína E. Após 20 semanas de intervenção, o tamanho da placa aterosclerótica foi reduzido em 18% e 13% nos grupos de animais que receberam o extrato e a sinvastatina, respectivamente. Em ambos os grupos houve redução da freqüência de núcleos necróticos grandes, da espessura da cápsula fibrosa e um aumento no conteúdo de colágeno 1, comparado ao grupo controle. Sabe-se que o aumento no conteúdo de colágeno é importante, pois contribui para a estabilização das placas ateroscleróticas. Nos grupos que receberam o extrato e a sinvastatina também houve decréscimo da expressão da iNOS (óxido nítrico sintase reduzida) e do fator tecidual, que são importantes fatores pró-inflamatórios durante o desenvolvimento e progressão das lesões ateroscleróticas. Em adição, a suplementação na dieta com o extrato de arroz preto melhorou o perfil lipídico plasmáticos dos camundongos, diminuindo os triglicerídeos, colesterol total e a fração não HDL, porém, também reduziu a fração HDL, comparado com o grupo controle. Comparado com o grupo do extrato, o grupo que recebeu sinvastatina apresentou níveis maiores de triglicerídeos e menores de HDL. Os autores atribuíram esses resultados benéficos do extrato ao seu alto conteúdo de antocianinas. Através de cromatografia líquida de alta eficiência (CLAE), foram identifdas duas antocianinas majoritárias, a cianidina-3-glicosídeo e peonidina-3-glicosídeo, que representaram 43,2% do total de compostos presentes no extrato.
Mauray et al., 2009 (28) observaram efeito antiaterogênico da suplementação na dieta (0,02%) por 16 semanas com dois extratos ricos em antocianinas extraídos de uvas fermentadas e não fermentadas, em camundongos deficientes na apoproteína E. A suplementação na dieta com os extratos de uva não fermentada e fermentada reduziu as lesões ateroscleróticas em 15% e 36%, respectivamente. O melhor resultado foi observado com o extrato de uvas fermentadas, sugerindo que a fermentação gerou novos compostos bioativos mais eficientes na atenuação da progressão da aterosclerose. Entretanto, não foram observadas alterações na capacidade antioxidante no plasma, determinada pelas técnicas de capacidade de absorção do radical oxigênio (ORAC), peroxidação lipídica hepática e perfil lipídico (colesterol total e triglicerídeos) plasmático e no fígado dos animais. Miyazaki et al., 2008 (29) avaliaram o potencial antiaterogênico de antocianinas da batata doce roxa adicionadas por 4 semanas na dieta (1%) de camundongos deficientes na apoproteína E com 6 semanas de idade, alimentados com dieta enriquecida de colesterol e gorduras. In vitro, estas antocianinas foram capazes de aumentar a resistência da LDL à oxidação, comparado ao ácido L-ascórbico. Comparado ao grupo controle, os animais que receberam a dieta suplementada com antocianinas da batata doce roxa apresentaram uma redução nas lesões ateroscleróticas (45%), nos níveis de TBARS (substâncias que reagem com o ácido tiobarbitúrico) no fígado e nos níveis plasmáticos de VCAM-1 (molécula-1 de adesão da célula vascular). Entretanto, não foi observado efeito significativo no perfil lipídico no plasma e no fígado destes animais.
A constatação destes diferentes estudos nos estimula à continuação das interpretações, principalmente com o objetivo de buscar novos mecanismos de ação que possa fortalecer o envolvimento das antocianinas na redução do processo aterosclerótico.
CONCLUSÃO
As antocianinas possuem grande potencial em reduzir o risco de desenvolvimento da aterosclerose. Os mecanismos envolvidos neste processo são, principalmente, referentes às atividades antioxidantes das antocianinas e a capacidade destes compostos em reduzir fatores pró-inflamatórios. Ainda há lacunas sobre a dose de antocianinas necessária para exercer estes efeitos. Ademais, é necessário ter cautela com a suplementação desses compostos, visto que essa não foi analisada por longos períodos de tempo em humanos. A ingestão de altas doses de substâncias antioxidantes pode exercer efeitos pró-oxidantes deletérios, principalmente se utilizados por longos períodos.
BIBLIOGRAFIA
1. L.S. Eibond, K.A. Reynertson, X.D. Luo, M.J. Basile, E.J. Kennelly, Anthocyanin antioxidants from edible fruits, Food Chemistry, 84(1), 23 (2004). [ Links ]
2. E.F. Gris, E.A. Ferreira, L.D. Falcão, M.T. Bordignon-Luiz, Caffeic acid copigmentation of anthocyanins from Cabernet Sauvignon grape extracts 11in model systems, Food Chemistry, 100(3), 1289 (2007). [ Links ]
3. C. Bordignon Jr., V. Francescatto, A.A. Nienow, E. Calvete, F.H. Reginatto, Influência do pH da solução extrativa no teor de antocianinas em frutos de morango, Ciência e Tecnologia de Alimentos, 29(1), 183 (2009). [ Links ]
4. H.P. Março. "Estudo da influência da radiação e pH no comportamento cinético de antocianinas de plantas do gênero hibiscus por métodos quimiométricos". Tese de Doutorado, Universidade Estadual de Campinas, Intituto de Química, Campinas, São Paulo, 2009. [ Links ]
5. G.A. Macz-Pop, J.C. Rivas-Gonzalo, J.J. Pérez-Alonso, A.M. Gonzaléz-Paramás, Natural occurrence of free anthocyanin aglycones in beans (Phaseolus vulgaris L.), Food Chemistry, 94(3), 448 (2006). [ Links ]
6. D.B.L. Terci, "Aplicações Analíticas e Didáticas de Antocianinas Extraídas de Frutas". Tese de Doutorado, Instituto de Química - UNICAMP, Campinas, São Paulo, 2004. [ Links ]
7. T. Siriwoharn, R.E. Wrolstad, C.E. Finn, C.B. Pereira, Influence of cultivar, maturity and sampling on blackberry (Rubus L. Hybrids) Anthocyanins, poly-phenolics, and antioxidant properties, Journal of Agricultural and Food Chemistry, 52(26), 8021 (2004). [ Links ]
8. A. Castañeda-Ovando, M.L. Pacheco-Hernández, M.E. Páez-Hernandez, A.J. Rodriguez, C.A. Galán-Vidal, Chemical studies of anthocyanins: A review, Food Chemistry, 113(4), 859 (2009). [ Links ]
9. Q. Tian, R.M. Aziz, G.D. Stoner, S.J. Schwartz, Anthocyanin determination in black raspberry (Rubus occidentalis) and biological specimens using liquid chromatography-electrospray ionization tandem mass spectrometry, Journal of Food Science, 70(1), 43 (2005). [ Links ]
10. J. B. Harborne. "The Flavonoids: advanced in research since 1986", 5th edition, Chapman and Hall, New York, 1994. [ Links ]
11. X. Wu, G.R. Beecher, J.M. Holden, D.B. Haytowitz, S.E. Gebhardt, R.L. Prior, Concentrations of anthocyanins in common foods in the United States and estimation of normal consumption, Journal of Agricultural and Food Chemistry, 54(11), 4069 (2006). [ Links ]
12. M.G.L. Hertog, P.C.H. Hollman, M.B. Katan, D. Kromhout, Intake of potentially anticarcinogenic flavonoids and their determinants in adults in the Neth- erlands, Nutritional Cancer, 20(1), 21 (1993). [ Links ]
13. M. Garcia-Alonso, A.M. Minihane, G. Rimbach, J.C. Rivas-Gonzalo, S.P. Tereza, Red wine anthocyanins are rapidly absorbed in humans and affect monocyte chemoattractant protein 1 levels and antioxidant capacity of plasma, Journal of Nutritional Biochemistry, 20(7), 521 (2009). [ Links ]
14. M. Xia, W. Ling, H. Zhu, J. Ma, Q. Wang, M. Hou, Z. Tang, H. Guo, C. Liu, Q. Ye, Anthocyanin attenuates CD40-mediated endothelial cell activation and apoptosis by inhibiting CD40-induced MAPK activation, Atherosclerosis, 202(1), 41 (2009). [ Links ]
15. Y.C. Chang, K.X. Huang, A.C. Huang, Y.C. Ho, C.J. Wang, Hibiscus anthocyanins-rich extract inhibited LDL oxidation and oxLDL-mediated macrophages apoptosis, Food and Chemical Toxicology, 44(7), 1015 (2006). [ Links ]
16. M.C. Toufektsian, M. De Lorgeril, N. Nagy, P. Salen, M.B. Donati, L. Giordano, H.P. Mock, S. Peterek, A. Matros, K. Petroni, R. Pilu, D. Rotillo, C. Tonelli, J. De Leiris, F. Boucher, C. Martin, Chronic dietary intake of plant-derived anthocyanins protects the rat heart against ischemia reperfusion injury, Journal of Nutrition, 138(4), 747 (2008). [ Links ]
17. P.N. Chen, W.H. Kuo, C.L. Chiang, H.L. Chiou, Y.S. Shou, S.C. Chuc, Black rice anthocyanins inhibit cancer cells invasion via repressions of MMPs and u-PA expression, Chemico-Biological Interactions, 163(3), 218 (2006). [ Links ]
18. Y. Ishigaki, H. Katagiri, J. Gao, T. Yamada, J. Imai, K. Uno, Y. Hasegawa, K. Kaneko, T. Ogihara, H. Ishihara, Y. Sato, K. Takikawa, N. Nishimichi, H. Matsuda, T. Sawamura, Y. Oka, Impact of plasma oxidized low-density lipoprotein removal on atherosclerosis, Circulation, 118(1), 75 (2008). [ Links ]
19. A.J. Lusis, Atherosclerosis, Nature Reviews, 407(6801), 233 (2000). [ Links ]
20. P.A. Jorge, Endotélio, lípides e aterosclerose, Arquivo Brasileiro de Cardiologia, 68(2), 129 (1997). [ Links ]
21. A.F.A. Siqueira, D.S.P. Abdalla, S.R.G. Ferreira, LDL: da síndrome metabólica à instabilidade da placa aterosclerótica, Arquivo Brasileiro de Cardiologia, 50(2), 334 (2006). [ Links ]
22. U. Singh, I. Jialal, Oxidative stress and atherosclerosis, Pathophysiology, 13(3), 129 (2006). [ Links ]
23. D. Steinberg, A critical look at the evidence for the oxidation of LDL in atherogenesis, Atherosclerosis, 131, Suppl. S5 (1997). [ Links ]
24. R. Ross, Atherosclerosis - an inflammatory disease, New England Journal of Medicine, 340(2), 115 (1999). [ Links ]
25. M.P.J. Winther, E. Kanters, G. Kraal, M.H. Hofker, Nuclear factor κB signaling in atherogenesis, Arteriosclerosis, Thrombosis and Vascular Biology, 25(5), 904 (2005). [ Links ]
26. P.T. Kovanen, M.O. Pentikainen, Circulating lipoproteins as proinflammatory and anti-inflammatory particles in atherogenesis, Current Opinion Lipidology, 14(5), 411 (2003). [ Links ]
27. X. Xia, W. Ling, J. Ma, M. Xia, M. Hou, Q. Wang, H. Zhu, Z. Tang, An anthocyanin-rich extract from black rice enhances atherosclerotic plaque stabilization in Apolipoprotein E-deficient mice, Journal of Nutrition, 136(8), 2220 (2006). [ Links ]
28. A. Mauray, D. Milenkovic, C. Besson, N. Caccia, C. Morand, F. Michel, A. Mazur, A. Scalbert, C. Felgines, Atheroprotective effects of bilberry extracts in Apo E-deficient mice, Journal of Agricultural and Food Chemistry, 57(23), 11106 (2009). [ Links ]
29. K. Miyazari, K. Makino, E. Iwadate, Y. Deguchi, F. Ishikawa, Anthocyanins from purple sweet potato Ipomoea batatas cultivar Ayamurasaki suppress the development of atherosclerotic lesions and both enhancements of oxidative stress and soluble vascular cell adhesion molecule-1 in Apolipoprotein E-deficient mice, Journal of Agricultural and Food Chemistry, 56(23), 11485 (2008). [ Links ]
30. J.G. Scandalios, Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses, Brazilian Journal of Medical and Biological Research, 38(7), 995 (2005). S.M.R. Ribeiro, M.E.L.R. Queiroz, M.C.G. Peluzio, N.M.B. Costa, S.L.P. 31. [ Links ]
31. Matta, J.H. Queiroz, Antioxidantes na dieta, Em: N.M.B. Costa, M.C.G. Peluzio, "Nutrição Básica e Metabolismo", Universidade Federal de Viçosa, Viçosa, 2008, p.235-260. [ Links ]
32. C. Manach, A. Sacalbert, C. Morand, C. Rémésy, L. Jiménez, Polyphenols: food sources and bioavailability, American Journal of Clinical Nutrition, 79(5), 727 (2004). [ Links ]
33. D. Anderson, Antioxidant defenses against reactive oxygen species causing genetic and other damage, Mutation Research, 350(1), 103 (1996). [ Links ]
34. L. Aviram, L. Dornfeld, M. Rosenblat, N. Volkova, M. Kaplan, R. Coleman, Pormegranate juice consumption reduces oxidative stress, atherogenic modifications to LDL, and plaquet aggregation: studies in human and in atherosclerotic apolipoprotein E- deficient mice, American Journal of Clinical Nutrition, 71(5), 1062 (2000). [ Links ]
35. L. Yi, C. Chen, X. Jin, M. Mi, W. Ling, T. Zhang, Structural requirements ofanthocyanins in relation to inhibition of endothelial injury induced by oxidized low-density lipoprotein and correlation with radical scavenging activity, FEBS Letters, 584(3), 583 (2010). [ Links ]
36. J. Kong, L. Chia, N. Goh, T. Chia, R. Brouillard, Analysis and biological activities of anthocyanins, Phytochemistry, 64(5), 923 (2003). [ Links ]
37. Y. Quin, M. Xia, J. Ma, Y.T. Hao, J. Liu, H.Y. Mou, L. Cao, W.H. Ling, Anthocyanin supplementation improves serum LDL- and HDL-cholesterol concentrations associated with the inhibition of cholesteryl-ester transfer protein in dyslipidemic subjects, American Journal of Clinical Nutrition, 90(3), 485 (2009). [ Links ]
38. S. Mertens-Talcott, J. Rios, R. Jilma-Stohlawetz, L.A. Pacheco-Palencia, B. Meibohm, S.T. Talcott, H. Derendorf, Pharmacokinetics of Anthocyanins and antioxidant effects afte r th e consumptio n o f Anthocyanin-ric h aca i juic e an d pulp (Euterpe oleracea Mart.) in Human Healthy Volunteers, Journal of Agricultural and Food Chemistry, 56(17), 7796 (2008). [ Links ]
39. M.O.S. Souza, M.S. Silva, M.E. Silva, R.P. Oliveira, M.L. Pedrosa, Diet supplementation with acai (Euterpe oleracea Mart.) pulp improves biomarkers of oxidative stress and the serum lipid profile in rats, Nutrition, 26(7-8), 804 (2009). [ Links ]
40. R. Beltrán-Debón, C. Alonso-Villaverde, G. Aragonés, I. Rodríguez-Medina, A. Rull, V. Micol, A. Segura-Carretero, A. Fernández-Gutiérrez, J. Camps, J. Jovem, The aqueous extract of Hibiscus sabdariffa calices modulates the production of monocyte chemoattractant protein-1 in humans, Phytomedicine, 17(3-4), 186 (2010). [ Links ]
41. S. Hogan, H. Chung, L. Zhang, J. Li, Y. Lee, Y. Dai, K. Zho, Antiproliferative and antioxidant properties of anthocyanin-rich extract from açai, Food Chemistry, 118(2), 208 (2010). [ Links ]
42. E.S. Kao, T.H. Tseng, H.J. Lee, K.C. Chan, C.J. Wang, Anthocyanin extracted from Hibiscus attenuate oxidized LDL-mediated foam cell formation involving regulation of CD36 gene, Chemico-Biological Interactions, 179(2-3), 212 (2009). [ Links ]
43. M.E. Matheus, S.B.O. Fernandes, C.S. Silveira, V.R. Rodrigues, F.S. Menezes, P.D. Fernandes, Inhibitory effects of Euterpe oleracea Mart. on nitric oxide production and iNOS expression, Journal of Ethnopharmacology, 107(2), 291 (2006). [ Links ]
44. A. Solomon, S. Golubowicz, Z. Yablowicz, M. Bergman, S. Grossman, A. Altman, Z. Kerem, M. A. Flaishman, EPR Studies of O2 , OH, and 1O2 scavenging and prevention of Glutathione depletion in fibroblast cells by Cyanidin-3-rhamnoglucoside isolated from fig (Ficus carica L.) fruits, Journal of Agricultural and Food Chemistry, 58(12), 7158 (2010). [ Links ]
45. R.V. Tonon, C. Bradet, M.D. Hubinger, Anthocyanin stability and antioxidant activity of spray-dried açai (Euterpe oleracea Mart.) juice produced with different carrier agents, Food Research International, 43(3), 907 (2010). [ Links ]
46. M.S.M. Rufino, R.E. Alves, E.S. Brito, J. Pérez-Jiménez, F. Saura-Calixto, J. Mancini-Filho, Bioactive compounds and antioxidant capacities of 18 non-traditional tropical fruits from Brazil, Food Chemistry, 121(4), 996 (2010). [ Links ]
47. G.M. Santos, G.A. Maia, P.H.M. Souza, J.M.C. Costa, R.W. Figueredo, G.M. Prado, Correlação entre atividade antioxidante e compostos bioativos de polpas comerciais de açaí (Euterpe oleracea Mart), Archivos Latinoamericanos de Nutrición, 58(2), 187 (2008). [ Links ]
48. R. B. Rodrigues, R. L. Ler, B. F. Zimmermann, M. Papagiannopoulos, H. Fabricius, F. Marx, Total oxidant scavenging capacity of Euterpe oleracea Mart. (açaí) seeds and identification of their polyphenolic compounds, Journal of Agricultural and Food Chemistry, 54(12), 4162 (2006). [ Links ]
49. A. Karlsen, L. Retterstøol, P. Laake, I. Paur, S. Kjølsrud-Bøhn, L. Sandvik, R. Blomhoff, Anthocyanins inhibit nuclear factor-kappaB activation in monocytes and reduce plasma concentrations of pro-inflammatory mediators in healthy adults, Journal of Nutrition, 137(8), 1951 (2007). [ Links ]
50. L. Gu, Y. Okada, S. K. Clinton, Absence of monocyte chemoattractant protein 1 reduces atherosclerosis in low density lipoprotein receptor-deficient mice, Molecular Cell, 2(2), 275 (1998). [ Links ]
51. F. Mach, U. Schonbeck, P. Libby, CD40 signaling in vascular cells: a key role in atherosclerosis? Atherosclerosis, 137, Suppl. S 89 (1998). [ Links ]














