Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.41 no.1 Bogotá Jan./June 2012
Artículo de investigación tecnológica
Obtención de hidroxiapatita sintética por tres métodos diferentes y su caracterización para ser utilizada como sustituto óseo
Synthetic hydroxyapatite obtaining using three different methods and characterization to use it as bone substitute
Luis Gonzalo Sequeda1, José Milciades Díaz2, Sandra Janeth Gutiérrez3, Sandra Janeth Perdomo3, Olga Lucía Gómez3
1 Grupo de Investigación Fitoquímica, Departamento de Química, Facultad de Ciencias, Pontificia Universidad Javeriana, carrera 7ª No. 43-82, Bogotá, D. C., Colombia. Correo electrónico: . Correo electrónico: lsequeda@javeriana.edu.co
2 Departamento de Física, Facultad de Ciencias, Pontificia Universidad Javeriana, carrera 7ª No. 43-82, Bogotá, D. C., Colombia. Correo electrónico: jmdiaz@javeriana.edu.co.
3 Centro de Investigaciones Odontológicas, Facultad de Odontología, Pontificia Universidad Javeriana, carrera 7ª No. 40-82, Bogotá, D. C., Colombia. Correos electrónicos: s.gutierrez@javeriana.edu.co; olga.gomez@javeriana.edu.co
Recibido para evaluación: 10 de febrero de 2012.
Aceptado para publicación: 31 de mayo de 2012.
RESUMEN
El método de obtención de la hidroxiapatita (HAp) para ser utilizada como sustituto óseo, debe ofrecer un producto de alta pureza, rendimiento, rapidez y bajo costo, y contar con propiedades como bioactividad, biocompatibilidad, osteoconductividad y unión directa al hueso. En este trabajo se elaboró HAp sintética mediante tres métodos reportados en la literatura de vía sinterización y vía precipitación. El material obtenido se caracterizó por espectrometría de absorción atómica (AAS), espectrometría de absorción molecular (UV-Vis), espectroscopía infrarroja con transformada de Fourier (FTIR), difracción de rayos X (XRD), microscopía electrónica de barrido (SEM) y espectroscopía por dispersión de energía de rayos X (EDX). La ruta de síntesis de HAp por precipitación ofreció mejores resultados, comparados con la muestra estándar comercial y el hueso bovino, obteniéndose un tamaño de grano aproximado de 1 µm, relación molar Ca/P de 1,7, alta pureza y cristalinidad; mientras que los resultados obtenidos por vía sinterización mostraron la presencia de fases amorfas. El método de síntesis por precipitación vía húmeda usando nitratos de calcio y fosfatos, mostró ser práctico y adecuado para realizar la inmovilización de HAp sobre un soporte metálico como silicio, importante para su uso en cirugía reconstructiva en el área odontológica y médica.
Palabras clave: hidroxiapatita (HAp), hueso bovino, UV-Vis, FTIR, XRD, SEM, EDX.
SUMMARY
The method by which to obtain Hydroxyapatite to be used as bone substitute should offer specific qualities such as, high purity, performance, low cost and has to be the following, bioactive, biocompatible, it has to have osteoconductivity and it has to bond directly to the bone. In this paper, synthetic HAp was prepared using 3 different methods reported in the literature as a route via sintering and precipitation, and subsequently characterized by atomic absorption spectrometry (AAS), molecular absorption spectrometry (UV-Vis), infrared spectroscopy (FTIR), X-ray diffraction (XRD), scanning electron microscopy (SEM) and energy dispersive spectroscopy X-ray (EDX). The route of synthesis of HAp precipitation gives better results, compared to the commercial standard sample and bovine bone, such as grain size which is of about 1 µm, molar ratio Ca/P of 1.7, high purity and crystallinity, while the results obtained via sintering show the presence of amorphous phases. The synthesis method using a wet precipitation of calcium nitrates and phosphates is practical and suitable for the immobilization of HAp on a metal substrate such as silicon, important for the use in dental and medical reconstructive surgery.
Key words: hydroxyapatite (HAp), bovine bone, UV-Vis, FTIR, XRD, SEM, EDX.
INTRODUCCIÓN
La ingeniería de tejidos ha desarrollado biomateriales para ser utilizados en el reemplazo de tejidos que se hayan perdido en el cuerpo humano. En el caso de defectos óseos, ya sea por alguna injuria o por enfermedad, el hueso xenogénico, usualmente de origen bovino, se ha convertido en una alternativa para este reemplazo por su bajo costo y facilidad de obtención. El problema yace en el riesgo de infección, reacción inmunológica e irritación que puede llegar a causar (1). Ante esto, la hidroxiapatita sintética (HAp), Ca10(PO4)6(OH)2, se presenta como una buena opción, pues ella es el mayor componente inorgánico del hueso mineral y se considera el material más atractivo para implante óseo, debido a su similitud tanto en composición como en características biológicas con el hueso natural (2). Hasta ahora este material se ha usado para varias aplicaciones biomédicas, entre ellas el recubrimiento de implantes por su excelente bioactividad, promoción de la función celular y osteoconductividad. Además, varios autores (3) señalan que la HAp puede unirse directamente a los tejidos y promover su crecimiento. Su principal problema radica en su baja resistencia mecánica, por lo que cada vez es menos utilizada en implantes que requieren permanecer largo tiempo y soportar alta carga, siendo más utilizada como relleno de bolsas periodontales, regiones adyacentes a implantes y defectos de huesos largos.
La resistencia mecánica de la HAp, depende del tamaño del grano, su distribución, porosidad y otros defectos microestructurales (4, 5), por lo que la HAp ha sido sintetizada por varios métodos, entre los que se encuentran: el químico-húmedo en solución acuosa (6); el sol-gel (7, 8); el hidrotermal (9); la deposición térmica (6); la precipitación continua y el método de reacción en estado sólido (10). Teniendo en cuenta lo anterior, una nueva generación de materiales porosos sintéticos de hidroxiapatita (HAp), fabricados con el proceso de bloques sólidos, ha surgido, con el fin de reproducir mejor las características del hueso (11-13). Éstos se han clasificado de acuerdo con el tamaño y la estructura del poro. En cuanto al tamaño del poro, el más adecuado es el que va en un rango de 100-300 mm y respecto a la estructura del poro, es vital que éstos se encuentren interconectados (14, 15).
Puesto que actualmente uno de los principales enfoques de la ingeniería de tejidos es la regeneración ósea, es necesario considerar la producción de materiales biocompatibles con características muy similares al hueso, que permitan la migración celular, vascularización y difusión de nutrientes. Basados en estas consideraciones, este trabajo reporta la elaboración de HAp sintética mediante tres métodos y su posterior caracterización, con el fin de determinar con cuál de los métodos utilizados se obtiene un material sintético con mejores propiedades y similares características al hueso natural bovino, para ser utilizado en un futuro como material de andamiaje en regeneración ósea periodontal y ortopédica.
MATERIALES MÉTODOS
Síntesis
Método 1. En un erlenmeyer se vertió 900 mL de nitrato de calcio tetrahidratado Ca(NO3)2.4H2O de concentración 0,333 M; se adicionaron 1.500 mL de fosfato monoácido de diamonio (NH4)2HPO4 a una concentración de 0,12 M a una velocidad de 1 mL/min, y 75 mL de amoníaco NH4OH, manteniendo el sistema a 90 oC en agitación durante 1 h. Se obtuvo la siguiente reacción química:
10Ca(NO3)24H2O + 6(NH4)2HPO4 + 8NH4OH→Ca10(PO4)6(OH)2 + 20 NH4NO3 +46 H2O
La solución se dejó en reposo durante diez días a temperatura ambiente. El precipitado obtenido se lavó varias veces con agua destilada y se secó a 250 oC durante 1 h; luego este precipitado se calcinó a 1.000 oC durante 3 h (16).
Método 2. Se mezclaron 400 mL de una solución de 0,6 M de H3PO4 y 400 mL de una suspensión de 1,0 M de hidróxido de calcio Ca(OH)2, a una velocidad de 5 mL/min. Se obtuvo la siguiente reacción:
10Ca(OH)2 + 6H3PO4 → Ca10(PO4)6(OH)2 + 18H2O
El pH de la mezcla se ajustó entre 11 y 12; ésta se sometió a calentamiento durante 1 h a 90 oC, para activar la reacción química; luego se agitó durante otra hora. Posteriormente, se procedió a dejar en reposo la solución a temperatura ambiente durante 72 h. Al finalizar el tiempo de envejecimiento, la HAp precipitada se lavó con agua destilada hasta pH neutro. El polvo de HAp se llevó a la mufla a 1.000 oC durante 3 h (17).
Método 3. Se mezclaron 7,76 g de hidróxido de calcio, Ca(OH)2, con 4,30 g de pentaóxido de fósforo (P2O5) en un mortero cerámico; luego se compacta a una presión de 7 ton/cm2 durante 30 min. El bloque de la mezcla se llevó a sinterización en mufla a 1.000 oC durante 3 h (18). Las reacciones químicas durante el proceso fueron:
Ca(OH)2 → CaO +H2O
P2O5+3Ca(OH)2 → Ca3(PO4)2 +3H2O
P2O5+2Ca(OH)2 → 2CaHPO4 + H2O
6CaHPO4+4Ca(OH)2→Ca10(PO4)6(OH)2 + 6H2O
6Ca3(PO4)2 +2CaHPO4+Ca(OH)2 →Ca10(PO4)6(OH)2 + 2H2O
6Ca3(PO4)2 + 2Ca(OH)2 → Ca10(PO4)6(OH)2
Caracterización
Espectrometría de absorción atómica (AAS). Las muestras se disolvieron en medio ácido. El calcio se determinó por espectrometría de absorción atómica de llama (AAS), mediante un espectrómetro Varian 140 usando llama acetileno-óxido nitroso, a una longitud de onda de 442,7 nm. Como estándar de calcio se usó una solución de 1.000 ppm de J. T. Baker y óxido de lantano (Sigma) a 500 ppm (19).
Espectrometría de absorción molecular (UV-Vis). A las muestras disueltas se les determinó el contenido de fósforo por espectrometría de absorción molecular UV-Vis, mediante la formación de un complejo de fosfovanadomolibdato, analizado a 420 nm usando un espectrómetro UV-Vis Varian Cary 100. Las soluciones estándar de fosfato se prepararon a partir de fosfato diácido de potasio y del reactivo de vanadomolibdato (molibdato de amonio y metavanadato de amonio), sales provenientes de J. T. Baker, respectivamente (19).
Espectroscopía infrarroja con transformada de Fourier (FTIR). La determinación de frecuencias de vibración características de la hidroxiapatita, en el rango de 4.000 a 400 cm-1, se determinó en un equipo IR Shimadzu Prestige 21 donde las muestras en polvo son suspendidas en KBr grado espectroscópico de Sigma (20).
Difracción de rayos X (XRD). Los difractogramas de rayos X se obtuvieron en un equipo Panalytical X'Pert PRO MPD con los siguientes parámetros: rango de medición entre 2o y 90o (2θ), tamaño de paso 0,02o (2θ), tiempo por paso 0,4 s, radiación CuKα1 (λ = 1.5406 Å, detector LynxEye; la identificación cualitativa de las fases cristalinas presentes en las muestras se realizó mediante comparación de las reflexiones del perfil, medido con las reflexiones de los perfiles de difracción reportados en la base de datos Powder Diffraction File (PDF-2) del International Centre for Diffraction Data (ICDD) utilizando el software Search Match (19, 21).
Microscopía electrónica de barrido (SEM-EDX). La morfología de las partículas se evaluó usando microscopía electrónica de barrido (SEM) en un equipo JEOL modelo JSM 6490-LV operado en el modo de alto vacío, equipado con detectores que permiten la obtención de imágenes de electrones retrodispersados; el detector de espectroscopía por dispersión de energía (EDX) permitió la realización del microanálisis cualitativo (21).
Muestras de hueso bovino y patrón Las muestras de hueso bovino (fémur) se tomaron del mercado local y se les realizó un proceso de limpieza y desinfección para retirar tejidos, material orgánico y microorganismos. Se utilizó agua caliente para la extracción de la médula ósea, soda (NaOH al 2%) para retirar grasas y proteínas, solución antiséptica al 1% para evitar el crecimiento de microorganismos y abundante agua para eliminar trazas de las soluciones de limpieza y desinfección; posteriormente se sometieron a tratamiento térmico a 1.000 oC durante 3 h para eliminar todo el material orgánico. Al fémur se le realizó cortes para separar el hueso laminar y el hueso poroso. Como muestra patrón se usó Calcitite®; (Zimmer Dental) (22).
RESULTADOS Y DISCUSIÓN
Síntesis
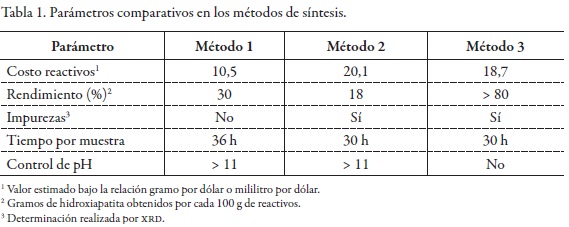
Métodos 1 y 2 – Precipitación (vía húmeda). La obtención de HAp por precipitación presentó ventajas por su costo, rendimiento y simplicidad, factores importantes para su posterior uso práctico en la inmovilización de HAp sobre un soporte metálico como silicio poroso. La influencia de variables como pH, temperatura y orden de mezcla de los reactivos son factores fundamentales en la síntesis; autores como García et al., han documentado su control (23). En nuestro caso, el valor del pH durante la reacción se mantuvo por encima de 11, valores inferiores promueven la formación de fosfatos de calcio. La velocidad de adición de los reactivos se realizó entre 1 y 5 mL por min, agregando la solución de fosfatos correspondiente sobre la solución de calcio, que favoreció la nucleación de HAp. Se ha reportado que a mayores flujos se incrementa la formación de especies de fosfato de calcio amorfo (24-26). En la síntesis, utilizando el método 2 es posible obtener Ca(OH)2 gracias al descenso rápido en el pH causado por la adición de H3PO4, lo que a su vez permite que la especie predominante PO43- no esté en una concentración suficiente para formar HAp estequiométrica (Ca/P = 1,67). También, debido al ácido fosfórico, que es un ácido triprótico de naturaleza débil, no se disocia completamente, lo cual favorece la obtención de HAp deficiente en calcio (27, 28).
Método 3 – Sinterización en estado sólido. La sinterización se realizó mediante la compactación de los reactivos sólidos y el posterior sometimiento de esta mezcla a altas temperaturas de calentamiento. En este proceso de reacción química irreversible realizado a partir de los reactivos y densificación de los polvos, se produce una disminución de la energía libre, debida a la superficie de las partículas, a la presión y temperatura aplicada. Es así que el beneficio de este tipo de reacción es la eliminación de la calcinación en la formación de sólidos (29, 30).
En los métodos 1 a 3, se mencionaron algunas ventajas como costo, rendimiento y simplicidad. En la Tabla 1 se indican los parámetros relacionados con las ventajas y desventajas y la forma como se evaluaron en el trabajo.
Caracterización
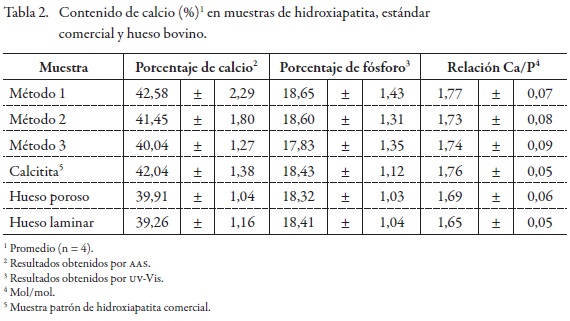
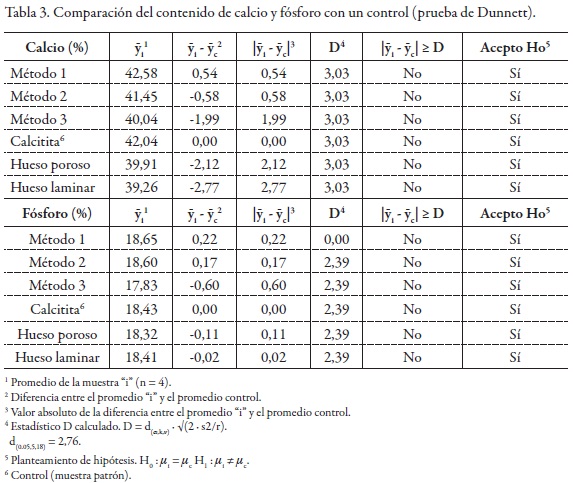
Determinación del contenido de calcio y fósforo por AAS y UV-Vis. Los resultados se muestran en la Tabla 2, y oscilaron entre 40,04% y 42,58% en contenido de calcio para las muestras obtenidas por síntesis, método 3 vía sinterización y método 1 vía precipitación, respectivamente; mientras que las muestras de hueso bovino estuvieron entre 39,26% y 39,91% en calcio para hueso laminar y hueso poroso, en su orden. El contenido de calcio en la muestra comercial, calcitita, fue de 42,04%, considerada como una muestra patrón. El contenido de fósforo en todas las muestras fue similar, entre 17,83% y 18,65% para las muestras de síntesis por el método 3 (sinterización) y síntesis por el método 1 (precipitación), respectivamente; y en 18,32% a 18,43% para el hueso poroso y la calcitita, en su orden. La relación calcio a fósforo se encontró en 1,65 a 1,69 en las muestras de hueso bovino y en 1,73 a 1,77 para las muestras de síntesis. En la muestra de calcitita, la relación fue de 1,76. El análisis de varianza (ANAVA) de una vía (p = 0,05) para las muestras de síntesis, y las muestras de hueso bovino, para los contenidos de calcio y fósforo no evidencian diferencias significativas. El “p valor” en el ANAVA para el contenido de calcio en síntesis y hueso bovino fue de 0,20 y 0,69, respectivamente, y en el contenido de fósforo fue de 0,45 y 0,90, respectivamente. El análisis estadístico usando la prueba Dunnett, comparación del contenido promedio de calcio y fósforo para las síntesis 1 a 3, hueso bovino laminar y poroso, con un control como es la calcitita, indica que no hay diferencias entre los valores obtenidos con el patrón (véase Tabla 3).
Espectroscopía infrarroja con transformada de Fourier (FTIR). figura 1 corresponde a los espectros FTIR de las tres síntesis de HAp, del patrón calcitita y del hueso bovino (laminar y poroso). En la caracterización por FTIR se identificaron las bandas de los grupos hidroxilo (OH1-) aproximadamente en 3.572 y 631 cm-1 que corresponden a vibraciones de tipo estiramiento y flexión, respectivamente; las bandas de los grupos fosfato (PO43-) entre 2.200-1.950 (sobretonos), 1.090, 1.040, 962, 601, 574 y 472 cm-1 son debido a vibraciones de tipo estiramiento y cambio en el ángulo de enlace; impurezas como carbonatos (CO32-) muestran bandas de tipo flexión en 1.540 y 1.455 cm-1 producto del intercambio de OH1- por CO32- y bandas en 1.450 y 1.410 cm-1 debido al intercambio de PO43- por CO32-; impurezas como hidrogenofosfato (HPO42-) vibran en forma de flexión aproximadamente en 875 cm-1; las vibraciones de tipo flexión de los silicatos (SiO32-) se encuentran en 890, 830 y 750 cm-1; y vibraciones correspondientes a moléculas de agua (H2O) entre 3.700-2.500 cm-1 y 1.630 cm-1 (19, 31). La comparación de los espectros muestra que en el espectro FTIR correspondiente al método 3 no hay presencia de vibraciones de los grupos OH1-; sólo hay algunas vibraciones de los grupos PO43- en 1.088, 1.041 y 602 cm-1, la banda en 879 cm-1 se produce por la vibración de impurezas de tipo HPO42-; el espectro FTIR para el método 2 muestra vibraciones del grupo CO32- indicando que existe sustitución de grupos hidroxilo y grupos fosfato por carbonatos correspondiente al compuesto carbohidroxiapatita de tipo A y de tipo B, respectivamente; mientras que el espectro FTIR del método 1 se observan vibraciones de los grupos hidroxilo y fosfato, sin impurezas, y la nitidez de las bandas en 636, 601 y 574 cm-1, indican que se obtuvo HAp de muy buena cristalización (19, 32). Los resultados de las muestras de hueso tanto laminar como poroso reflejan vibraciones de los grupos hidroxilo y fosfato, evidenciando bandas nítidas de HAp con excelente cristalización aproximadamente en 631, 601 y 574 cm-1; igualmente contienen carbohidroxiapatita de tipo A (sustitución de OH1- por CO32-) y de tipo B (sustitución de PO43- por CO32-) (19, 22). La muestra patrón de calcitita presenta bandas vibracionales correspondiente a los grupos hidroxilo (3.572 y 631 cm-1), fosfato (1.087, 1.041, 964, 605, 578 y 478 cm-1), carbohidroxiapatita de tipo A (1.546 y 1.458 cm-1), tipo B (1.408 cm-1) e impurezas de fosfato monoácido (879 cm-1) (33). Todas las muestras exhiben vibraciones de tipo estiramiento aproximadamente en 1.630 cm-1 correspondiente a la absorción de agua.
Difracción de rayos X (XRD). Los difractogramas de rayos X de las muestras se observan en la figura 2, en donde se encuentran picos estrechos y de mayor intensidad a medida que se aumenta el tiempo de permanencia, e indican buena cristalinidad. En el análisis cualitativo de cada uno de los difractogramas, están presentes las reflexiones correspondientes a los compuestos identificados a partir del perfil de difracción que se encuentran en la base de datos PDF-2 del International Centre for Diffraction Data (ICDD). Para la muestra correspondiente a la síntesis 1, sólo se identificó la hidroxiapatita Ca10(PO4)6(OH)2 (84-1.998); para la síntesis 2 se identificaron la hidroxiapatita Ca10(PO4)6(OH)2 (84-1.998) y el limo CaO (78-649); para la síntesis 3 se identificaron la hidroxiapatita Ca10(PO4)6(OH)2 (84-1.998), whitlockita Ca3(PO4)2 (9-69), la portlandita Ca(OH)2 (87-673) y coesita SiO2 (73-1.748), la presencia de esta fase podría ser atribuida a contaminación cruzada procedente del material de vidrio utilizado en la preparación de las soluciones de los reactivos o trazas de silicio en los reactivos de partida. En las muestras correspondientes a hueso laminar se identificaron las fases hidroxiapatita Ca10(PO4)6(OH)2 (00-024-0033) e hidróxido de hidrógeno fosfato cálcico Ca9HPO4(PO4)5OH (00-046-0905); para el hueso poroso las fases identificadas corresponden a hidroxiapatita Ca10(PO4)6(OH)2 (00-024-0033), fosfato de calcio hidratado Ca3(PO4)2xH2O (00-018-0303) y carbonato de calcio CaCO3 (01-086-2341) (33, 34). Por último, en la muestra patrón calcitita se identificaron las fases hidroxiapatita Ca10(PO4)6(OH)2 (00-024-0033), óxido de fosfato cálcico Ca10(PO4)6O (01-089-6495) y apatita A Ca10(PO4)6(CO3)(OH) (01-072-7532).
Microscopía electrónica de barrido (SEM-EDX). Los resultados de las imágenes obtenidas por SEM se muestran en la figura 3. Las síntesis 1 y 2 generaron morfologías y tamaños de grano de tipo globular, cristales bien definidos entre 1 y 3 µm; mientras que en la síntesis 3 se encuentran agregados de mayor tamaño entre 5 y 10 µm, sin morfología definida. La muestra patrón de calcitita presenta morfología irregular pero compacta, tamaño de grano superior a 10 µm, y hojuelas entre 1 y 2 mm sobre la superficie del grano. Las muestras correspondientes al hueso bovino de tipo poroso presentan morfología globular con tamaño de grano entre 1 y 2 µm, poros entre 1 y 7 µm; en el hueso laminar se encuentran varias formas de morfología con tamaños de grano menores a 0,5 µm y granos de bordes irregulares superiores a 2 µm. El microanálisis por espectroscopía por dispersión de rayos X (EDX) de tipo cualitativo reveló presencia de calcio, fósforo y oxígeno en todas las muestras. La técnica de mapeo químico con EDX (la cual no se presenta), se empleó para determinar la distribución en la composición química, y todas las muestras revelaron formación homogénea, (33, 35).
CONCLUSIONES
El análisis de los tres métodos realizado en este trabajo muestra que la síntesis de HAp por precipitación ofrece mejores resultados comparados éstos con la muestra estándar comercial y el hueso bovino, ya que se obtuvo un tamaño de grano aproximado de 1 mm, relación molar Ca/P de 1,7, alta pureza y cristalinidad; mientras que los resultados obtenidos por vía sinterización muestran presencia de fases amorfas. No se encontraron diferencias entre la composición del hueso laminar y la composición del hueso poroso. Igualmente, la muestra patrón calcitita presentó similitud en su composición con las muestras del hueso bovino. Por último, el método de síntesis por precipitación por vía húmeda usando nitratos de calcio y fosfatos, es práctico y adecuado para realizar la inmovilización de HAp sobre un soporte metálico como silicio, con miras a su uso en cirugía reconstructiva en áreas médicas. Más estudios deben ser propuestos, en la búsqueda de materiales con propiedades y características necesarias, que permitan su utilización como andamiaje para el crecimiento de células productoras de tejido óseo con fines regenerativos. Los resultados de la síntesis de este material obtenidos en el presente estudio por diferentes métodos, nos permite seguir avanzando en esta búsqueda; pues a pesar de que se dispone de varios materiales que actúan como andamios, aún no se ha descrito el que pueda sustituir al hueso autólogo corticoesponjoso o particulado. Es por esto por lo que es necesario seguir realizando investigaciones de nuevos materiales de alta resistencia, en el que el tamaño del poro mimetice la arquitectura del hueso trabecular y en el que la interconectividad de estos materiales permita que estos andamios sean impregnados con fases activas biológicas como factores de crecimiento. De esta manera, la combinación de materiales que logren crear el microambiente específico ideal para recibir células que produzcan tejido óseo, se presenta como una de las grandes perspectivas para obtener una rápida y aumentada regeneración tisular. Avances en este campo redundarán en beneficio de los pacientes que sufran de defectos óseos como osteoporosis y osteopenia, un desafío que se presenta para el futuro y que requiere, asimismo, el uso de diseños mediante la ingeniería de tejidos en 3D. Finalmente, el énfasis para la regeneración tisular también debe ser dado sobre mecanismos que produzcan autorreparación, como materiales bioactivos que estimulen genes que activen la diferenciación y proliferación de células osteoprogenitoras in situ.
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectoría Académica de la Pontificia Universidad Javeriana, por el apoyo financiero (Proyecto 003263). Igualmente, agradecen a las Facultades de Ciencias Básicas y de Odontología de la Universidad Javeriana, por el apoyo logístico. Por último, nuestro sincero reconocimiento a la colaboración prestada por el Prof. Dr. César Augusto Sierra Ávila, director del Grupo de Macromoléculas, Departamento de Química, de la Universidad Nacional de Colombia; y por el Dr. Miguel Ángel Ramos García, coordinador del Laboratorio de Difracción y Fluorescencia de Rayos X, Unidad de Caracterización y Estructura de Materiales, Instituto Zuliano de Investigaciones Tecnológicas, Venezuela. Y a nuestros colaboradores Andrés Eduardo Ortiz Ardila y Carlos Enrique Parada Parra, miembros del Laboratorio de Absorción y Emisión Atómica, Departamento de Química de la Pontificia Universidad Javeriana.
REFERENCIAS
1. J.G. Albarova, L. Garrido-Lahiguera, A. Salinasc, J. Román, A. Bueno-Lozano, R. Gil-Albarova, M. Vallet-Regi, The in vivo performance, Biomaterials, 25, 4639 (2004). [ Links ]
2. M. Vallet-Regi, Revisiting ceramics or medical applications, Dalton Trans., 44, 5211 (2006). [ Links ]
3. J. He, M.C. Wang, Constitutive modelling of the densification and the grain growth of hydroxyapatite ceramics, Biomaterials, 26, 1613 (2005). [ Links ]
4. R.W. Rice, The porosity dependence of physical properties of materials: A summary review, Key. Eng. Mater., 115, 1 (1996). [ Links ]
5. D. Shi, G. Jaing, X. Wen, "In vitro behavior of hydroxyapatite prepared by a depositon method", Processing and fabrication of advanced materials, VIII, eds. K. Khor et al., World Scientific, Singapore, 2001, p. 117. [ Links ]
6. N. Kivrak, A.C. Tas, Synthesis of calcium hydroxyapatite-tricalcium phosphate composite bioceramic powders and their sintering behavior, J. Am. Ceram. Soc., 81, 2245 (1998). [ Links ]
7. P. Layrolle, A. Ito, T. Tateishi, Sol-gel synthesis of amorphous calcium phosphate and sintering into microporous hydroxyapatite bioceramics, J. Am. Ceram. Soc., 81, 1421 (1998). [ Links ]
8. A. Balamurugan, S. Kannan, S. Rajeswari, Bioactive sol-gel hydroxyapatite surface for biomedical application - in vitro study, Trends Biomater. Artif. Organs, 16, 18 (2002). [ Links ]
9. M. Sivakumar, T.S.S. Kumar, K.L. Shantha, K.P. Rao, Development of hydroxyapatite derived from Indian coral, Biomaterials, 17, 1709 (1996). [ Links ]
10. D. Tadic, M. Epple, Mechanically stable implants of synthetic bone mineral by cold isostatic pressing, Biomaterials, 24, 4565 (2003). [ Links ]
11. W.M. Sigmund, N.S. Bell, L. Bergstrom, Novel powder-processing methods for advanced ceramics, J. Am. Ceram. Soc., 7, 1557 (2000). [ Links ]
12. M.H. Prado da Silva, A.F. Lemos, I.R. Gibson, J.M.F. Ferreira, J.D. Santos, Porous glass reinforced hydroxyapatite materials produced with different organic additives, J. Non-Crystall Solids, 304, 286 (2002). [ Links ]
13. S. Madhavi, C. Ferraris, T.J. White, Synthesis and crystallization of macroporous hydroxyapatite, J. Solid State Chem., 178, 2838 (2005). [ Links ]
14. O. Lyckfeldt, J.M. Ferreira, Processing of porous ceramics by starch consolidation, J. Eur. Ceram. Soc., 18, 131 (1998). [ Links ]
15. K.S. Toohey, N.R. Sottos, J.A. Lewis, J.S. Moore, S.R. White, Self-healing materials with microvascular networks, Nat. Mater., 7, 56 (2007). [ Links ]
16. I. Mobasherpour, M.S. Heshajin, A. Kazemzadeha, M. Zakeri, Synthesis of nanocrystalline hydroxyapatite by using precipitation method, J. Alloys Comp., 430, 330 (2007). [ Links ]
17. A. Wang, D. Liu, H. Yin, H. Wu, Y. Wada, M. Ren, T. Jiang, X. Cheng, Y. Xu, Size-controlled synthesis of hydroxyapatite nanorods by chemical precipitation in the presence of organic modifiers, Mater. Sci. Engineer. C, 27, 865 (2007). [ Links ]
18. S. Pramanik, A.K. Agarwal, K.N. Rai, A. Garg, Development of high strength hydroxyapatite by solid-state-sintering process, Ceram. Int., 33, 419 (2007). [ Links ]
19. M. Markovic, B.O. Fowler, M.S. Tung, Preparation and comprehensive characterization of a calcium hydroxyapatite reference material, J. Res. Natl. Inst. Stand. Technol., 109, 553 (2004). [ Links ]
20. J.A. Rivera, G. Fetter, L. Baños, J. Guzmán, P. Bosch, New hydroxyapatite-hydrotalcite composites I. synthesis, J. Porous Mater., 16, 401 (2009). [ Links ]
21. S. Manafi, M.R. Rahimipour, Synthesis of nanocrystalline hydroxyapatite nanorods via hydrothermal conditions, Chem. Eng. Technol., 34, 972 (2011). [ Links ]
22. N.A.M. Barakat, M.S. Khila, A.M. Omrand, F.A. Sheikhd, H.Y. Kima, Extraction of pure natural hydroxyapatite from the bovine bones bio waste by three different methods, J. Mater. Process. Technol., 209, 3408 (2009). [ Links ]
23. C. García, C. Páucar, J. Gaviria. Study of some parameters that determine the synthesis of hydroxyapatite by the precipitation route. Dyna Rev. Fac. Nac. Minas., 73, 148 (2006). [ Links ]
24. C. Liu, Y. Huang, W. Shen, J. Cui, Kinetics of hydroxyapatite precipitation at pH 10 to 11, Biomaterials, 22, 301 (2001). [ Links ]
25. S.H. Park, I.Y. Ryu, D.J. Kim, J.S. Han, M.H. Lee, Influence of hydrothermal reaction temperature and pH on phase stability of hydroxyapatite, Key Engineer. Mater., 330, 147 (2007). [ Links ]
26. L.T. Banga, K. Ishikawab, R. Othmana, Effect of silicon and heat-treatment temperature on the morphology and mechanical properties of silicon-substituted hydroxyapatite, Ceram. Int., 37, 3637 (2011). [ Links ]
27. M. Pretto, A.L. Costa, E. Landi, A. Tampieri, C. Galassi, Dispersing behavior of hydroxyapatite powders produced by wet-chemical synthesis, J. Am. Ceram. Soc., 86, 1534 (2003). [ Links ]
28. S. Ramesh, C.Y. Tan, R. Tolouei, M. Amiriyan, J. Purbolaksono, I. Sopyan, W.D. Teng, Sintering behavior of hydroxyapatite prepared from different routes, Materials & Design, 34, 148 (2012). [ Links ]
29. V.P. Orlovskii, V.S. Komlev, S.M. Barinov, Hydroxyapatite and hydroxyapatite-based ceramics, Neorganicheskie Materialy, 38, 1159 (2002). [ Links ]
30. S. Nath, K. Biswas, K. Wang, R.K. Bordia, B. Basuw, Sintering, phase stability, and properties of calcium phosphate-mullite composites, J. Am. Ceram. Soc., 93, 1639 (2010). [ Links ]
31. R.M. Silverstein, F.X. Webster, D.J. Kiemle, "Spectrometric identification of organic compounds", 7th edition, John Wiley & Sons, New York, 2005, 502 p. [ Links ]
32. B. Wopenka, J.D. Pasteris, A mineralogical perspective on the apatite in bone, Mater. Sci. Engineer. C, 25, 131 (2005). [ Links ]
33. M.E. Bahrololoom, M. Javidi, S. Javadpour, J. Ma, Characterisation of natural hydroxyapatite extracted form bovine cortical bone ash, J. Ceram. Process. Res., 10, 129 (2009). [ Links ]
34. A. Ruksudjarit, K. Pengpat, G. Rujijanagul, T. Tunkasiri, Synthesis and characterization of nanocrystalline hydroxyapatite from natural bovine bone, Curr. Appl. Phys., 8, 270 (2008). [ Links ]
35. K. Donadel, M.C.M. Laranjeira, V.L. Goncalves, V.T. Fávere, J.C. de Lima, L.H.M. Prates, Hydroxyapatites produced by wet-chemical methods, J. Am. Ceram. Soc., 88, 2230 (2005). [ Links ]