Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.41 no.2 Bogotá July/Dec. 2012
Artículo de investigación científica
Avaliação citotóxica em três linhagens de células tumorais das frações obtidas da casca do caule de Salacia crassifolia (MART. ex. Schult.) G. Dom. (Celastraceae)
Assessment of cytotoxicity in three tumor cell lines of the fractions attained from the stem bark of Salacia crassifolia (Mart. ex. Schult.) G. Dom (Celastraceae)
Clayton Rodrigues de Oliveira1 *, Antânio Calos Severo Menezes1,Manoel O. de Moraes2, Letícia de Melo Vieira1, Adriana Gomes Pereira1 Rosa Silva Lima 1, Mirley Luciene dos Santos 1
1Laboratório de Análise Instrumental, Unidade Universitária de Ciências Exatas e Tecnológicas Universidade Estadual de Goiás, 75132-903 Anápolis, GO, Brasil
2Laboratório de Oncologia Experimental da Universidade Federal do Ceará/ UFC
*E-mail: oliveira.cr_12@yahoo.com.br (+55 16 3351 8066)
Recibido para evaluación: 27 de junio de 2012
Aceptado para publicación: 13 de agosto de 2012.
RESUMO
A utilização de plantas pela humanidade com fins medicinais é uma das formas mais antigas para tratamento, cura e prevenção de doenças, dentre elas o câncer, cujas espécies vegetais são encontradas em elevada diversidade no ecossistema. Com essa perspectiva, se optou por um arbusto típico do Cerrado, Salacia crassifolia (Celastraceae), para um screening inicial na determinação do potencial citotóxico desta espécie in vitro. Na medicina popular, S. crassifolia é utilizada no tratamento de problemas renais, tosse crônica, dores de cabeça, cicatrizantes, ulcerogênicas e na terapia da malaria. As frações: hidroalcoólica (SCCcM-W), diclorometânica(SCCcM-D), hexânica (SCCcM-H) e acetato de etila (SCCcM-A) da casca do caule foram submetidas a testes de citotoxicidade in vitro frente às linhagens MDA-MB-435(melanoma), HCT-8 (cólon-humano) e SF-295 (sistema nervoso central) utilizando o método colorimétrico MTT. As frações hexânica (SCCcM-H) e de acetato de etila(SCCcM-A) foram aquelas que proporcionaram citotoxicidade significativas frente às células tumorais analisadas.
Palavras-chave: Salacia crassifolia, MDA-MB-435 (melanoma), HCT-8 (cólon-humano) e SF-295 (sistema nervoso central).
SUMMARY
For millennia humans have been using plants for medicinal purposes to treat, cure, or prevent diseases, including cancer. Brazilian ecosystem has a high diversity of plant species. From this perspective, a species found in the Cerrado, Salacia crassifolia (Celastraceae), was selected, for an initial screening to determine the cytotoxic potential of this species "in vitro". S. crassifolia has been widely used in traditional medicine to treat kidney diseases, chronic cough, headaches, healing, ulcerogenic, and for treatment of malaria. The fractions: hydroalcoholic (SCCcM-W), dichloromethane(SCCcM-D), hexane (SCCcM-H) and ethyl acetate (SCCcM-A) from the stem bark were tested for cytotoxicity "in vitro" to within MDA -MB-435(melanoma), HCT-8 (human-colon), and SF-295 (CNS) using the MTT colorimetric method. The hexane (SCCcM-H) and ethyl acetate (SCCcM-A) fractions were those that provided significant cytotoxicity against analyzed tumor cells.
Key words: Salacia crassifolia, MDA-MB-435 (melanoma), HCT-8 (human-colon), and SF-295 (CNS).
INTRODUÇÃO
Durante séculos, as plantas vêem sendo utilizadas como fontes terapêuticas de auxílio ao homem no combate de doenças (1). O potencial antitumoral de derivados de compostos naturais, tem apresentado um crescente interesse nos últimos anos. Durante as duas últimas décadas, um valor superior a 25% das drogas utilizadas provém diretamente de derivados de plantas, enquanto que os outros 25% são produtos naturais quimicamente modificados (2).
A produção de inúmeros medicamentos contemporâneos é proveniente de muitos metabólitos secundários, os quais se destacam pelo seu alto poder de atividades microbiológicas, bactericidas, antifúngicas e várias outras. De tal modo, parcerias entre químicos medicinais e químicos de produtos naturais desempenham papéis fundamentais na descoberta desses novos metabólitos (3).
Dentre os quimioterápicos para o câncer, a vimblastina e a vincristina (extraídas de Catharrantus roseus), o etoposídeo, o teniposídeo e o taxol, nos últimos 20 anos se tornaram fármacos imprescindíveis na terapêutica, além do renascimento de seu interesse nas indústrias farmacêuticas (4).
O etoposídeo é um derivado semi-sintético da podofilotoxina produzido nas raízes da Mandragoa americana ou pelo fruto dessa planta. Trata-se de um composto muito útil contra cânceres de células germinativas testiculares e ovarianos, linfomas e câncer de pulmão (5). Outros exemplos são o teniposídeo e o taxol, extraído de Taxus brevifolia e Taxus baccata cujos estudos clínicos revelaram a sua capacidade na regressão do câncerde mama e ovário (6).
A família Celastraceae é encontrada principalmente em regiões tropicais. As plantas desta família Celastraceae estão representadas em 98 gêneros e aproximadamente 1264 espécies (7). São representadas em seus habitats naturais como árvores, arbustos, trepadeiras e cipós (8). Atualmente, plantas da família da Hippocrateaceae têm sido classificadas como plantas da família Celastraceae devido à ocorrência de substâncias químicas comuns entre as duas espécies. Os estudos de filogenia apresentaram à família Hippocrateaceae como pertencente à família Celastraceae, o que caracteriza ambas como um grupo parafilético (8, 9). Além disso, são conhecidas como "Bacupari", "Bacupari-do-Cerrado", "Saputá", "Seputá" e outros nomes populares (10). No Brasil, os gêneros mais representativos da família Celastraceae são: Maytenus e Salacia, respectivamente(11). Muitas atenções têm sido dadas às espécies desta família, devido ao seu amplo leque de atividades biológicas que vem sendo descritos na literatura como: antireumáticas, antibacterianas, antitumorais (no tratamento de câncer de pele), ações curativas de feridas de pele, ações antiulcerogênicas, antiinflamatórias, cicatrizantes, imunossupressoras, antimicrobianas, antimalariais, tripanomicidas, no tratamento de diabéticos e outras (7, 8, 10).
O gênero Salacia está formado por aproximadamente 200 espécies. Com baixo percentual, apenas 15,5% das espécies do gênero foram estudadas, o que corresponde a 31 espécies, considerando que muitos desses estudos precisariam de uma nova abordagem (8).
Estudos fitoquímicos das diversas espécies de Salacia resultaram no isolamento de triterpenos (fridelanos, maiteninos, oleananos, ursanos e lupanos), flavonóides, esteróides, alcalóides (sesquiterpênicos, macrocíclicos ou maitansinóides), e outras substâncias, além dos triterpenos quinonametídios os mais representativos, os quais são considerados marcadores quimiotaxonômicos em Salacia (7, 8, 10).
Segundo Oe e Ozaki (12), estudos com Kothala-himbutu (Salacia reticulata) têm recebido muita atenção no tratamento de diabetes, por apresentar atividade inibidora em α-glicosidase, uma enzima especifica no tratamento anti-diabete.
No entanto, na literatura não há relatos de estudos fitoquímicos e atividades farmacológicas de S. crassifolia, conhecida popularmente como "Bacupari-do-Cerrado". Na medicina popular, S. crassifolia é utilizada no tratamento de problemas renais, tosse crônica, dores de cabeça, cicatrizantes, ulcerogênicas e na terapia da malaria.
O presente trabalho teve como objetivo fazer um screening inicial para determinar o possível potencial citotóxico das frações: hexânica (SCCcM-H), diclorometânica (SCCcM-D), acetato de etila (SCCcM-A) e hidroalcoólico (SCCcMW) da casca do caule de Salacia crassifolia (Celastraceae), em linhagens MDA-MB-435 (melanoma), HCT-8 (cólon-humano) e SF-295 (sistema nervoso central).
MATERIAL E MÉTODOS
Material vegetal
As cascas do caule da planta S. crassifolia (Celastraceae) foram coletadas no Campus da Universidade Estadual de Goiás (UEG), em Anápolis, Goiás, Brasil. A identificação do material vegetal foi feita pela professora Dra. Mirley Luciene dos Santos, e as exsicatas foram depositadas no herbário do departamento de Ciências Biológicas da UEG com número de registro equivalente a 5910.
Obtenção das frações
Após a coleta do material vegetal, foi colocado à estufa com circulação de ar a 45ºC, em seguida pulverizado em moinho de facas e colocado em erlenmeyer de 2 Litros, posteriormente foi extraído com metanol exaustivamente, fornecendo o extrato bruto metanólico (390,0 g). O solvente orgânico foi evaporado à pressão reduzida em evaporador rotativo resultando em um resíduo, denominado extrato bruto metanólico. O extrato bruto metanólico foi ressuspendido em metanol:água (1:3), e particionado com solventes por ordem de polaridade: hexano, diclorometano e acetato de etila. Então, obtiveram-se as frações: hexânica (SCCcM-H) (4,65 g), diclorometânica (SCCcM-D) (0,41g), acetatode etila (SCCcM-A) (26,84 g) e hidroalcoólica (SCCcM-W) (256,15 g).
Teste de Verificação de Alcalóides
Foi realizado teste para a verificação da possível presença de alcalóides nas frações obtidas da casca do caule de S. crassifolia, através de cromatografia em camada delgada SCCcM-H, SCCcM-D e SCCcM-A, e diclorometano/metanol (90/10)para a fração SCCcM-W, e como revelador o reagente Dragendorff.
Preparação das Frações Vegetais e das Células para Teste de Citotoxicidade in vitro
As frações SCCcM-H, SCCcM-D, SCCcM-A e SCCcM-W, foram diluídas em dimetilsulfóxido (DMSO) até a concentração estoque de 5mg/mL.
As células foram cultivadas em meio de RPMI 1640, suplementado com 10% de soro fetal bovino e 1% de antibióticos, e foram mantidas em estufa a 37ºC e atmosfera contendo 5% de CO2.
Ensaios da Citotoxicidade in vitro em linhagens celulares MDA-MB-435, HCT-8 e SF-295.
Os ensaios de citotoxicidade foram realizados no Laboratório de Oncologia Experimental da Universidade Federal do Ceará com as frações de S. crassifolia. Os ensaios foram baseados em uma analise colorimétrica na conversão do sal 3-(4,5-dimetil-2- tiazol)-2,5-difenil-2-H-brometo de tetrazolium (MTT) em azul de formazam, a partir de enzimas mitocondriais presentes somente nas células metabolicamente ativas. Este método foi descrito por Mosman (13).
As células foram plaqueadas na concentração de 0,1 x 106 céls./100µL, para células aderidas. As frações SCCcM-H, SCCcM-D, SCCcM-A e SCCcM-W utilizadas no teste foram acrescidas em concentrações de 5µg/mL, em dose única. Em seguida, foram incubadas por 72 horas em estufa a 5% de CO2 a 37ºC. Antes do término do período de incubação, as placas foram centrifugadas e o sobrenadante foi removido. Em seguida, foram adicionados 200µL da solução de MTT (sal de tetrazolium), e as placas foram incubadas por 3 horas. A absorbância foi lida após dissolução do precipitado com DMSO em espectrofotômetro de placa de 550nm.
Nos experimentos de MTT, os resultados foram analisados segundo suas médias e respectivos desvios-padrão no programa Graph Pad Prism. Cada amostra foi analisada a partir de dois experimentos realizados em duplicata. As frações são selecionadas de acordo com o percentual de inibição do crescimento tumoral maior que 90% nas linhagens de celulares utilizadas em MTT.
RESULTADOS E DISCUSSÃO
Alguns constituintes químicos são oriundos de metabólitos secundários, metabólitos os quais podem ser provenientes do reino vegetal. A família Celastraceae é apontada como fonte rica de triterpenos e alcalóides. No teste para verificação de alcalóides, com o reagente de Dragendorff, ficou evidenciado a presença destes constituintes químicos nas frações hexânica (SCCcM-H), acetato de etila (SCCcM-A) e hidroalcoólica (SCCcM-W) obtidos da casca do caule de S. crassifolia.
Através dos testes de Citotoxicidade realizados in vitro, o qual faz parte de um screening inicial para determinar o possível potencial antitumoral, observou-se resultados expressivos de atividade citotóxica para as frações hexânica (SCCcM-H) e acetato de etila (SCCcM-A) frente ao modelo utilizado. As frações foram selecionadas de acordo com o percentual de inibição do crescimento tumoral maior que 90% nas linhagens de celulares utilizadas em MTT em concentrações de 5 µg/mL, em dose única.
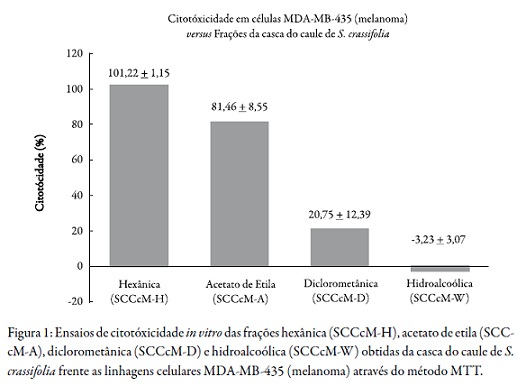
As atividades citotóxicas das frações obtidas da casca do caule de S. crassifolia, as quais estão ilustradas na Figura 1, se destacam por seus expressivos percentuais de inibição do crescimento tumoral maior que 90% frente às células MDAMB-435 (melanoma) utilizada em MTT. Com isso, a fração de SCCcM-H(101,22%) demonstrou potencial citotóxico relevante, que corresponde a inibição no crescimento celular. As frações SCCcM-A (81,46%) e SCCcM-D (20,75%) não demonstraram potenciais citotóxicos relevantes, a fração SCCcM-W (-3,23% de inibição) ao contrário, levou à proliferação celular.
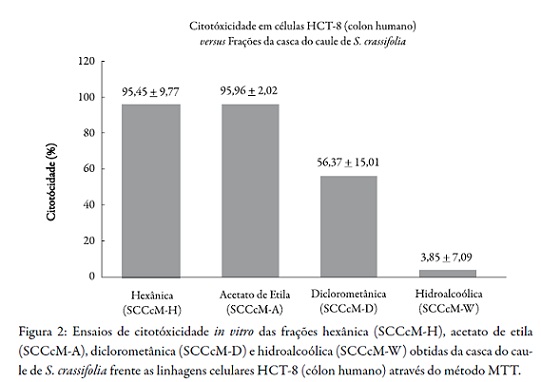
A Figura 2 ilustra o percentual de citotoxicidade e desvio padrão das frações SCCcM-H, SCCcM-A, SCCcM-D e SCCcM-W frente à linhagem HCT-8 (cólon humano). Para à linhagem SF-295 (sistema nervoso central), o percentual de citotoxicidade e desvio padrão estão apresentados na Figura 3. As frações de SCCcM-H (95,45%) e SCCcM-A (95,96%) demonstraram potenciais citotóxicos relevantes, que correspondem a inibição no crescimento celular. As frações de SCCcM-D (56,37%) e SCCcM-W (3,85%) não demonstraram potenciais citotóxicos satisfatórios.
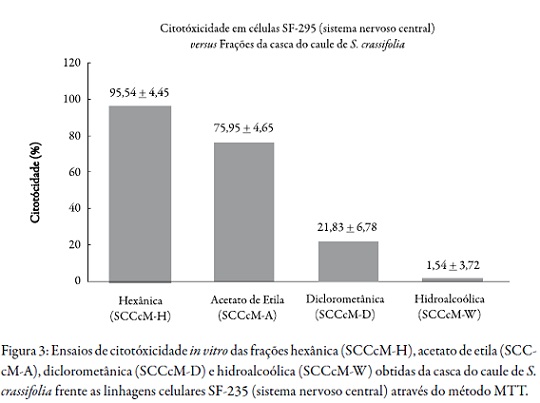
A Figura 3 ilustra o percentual de citotoxicidade e desvio padrão dessas frações frente à linhagem SF-295 (sistema nervoso central).
A fração de SCCcM-H (95,54%) demonstrou potencial citotóxico relevante, que corresponde à inibição no crescimento celular. As frações de SCCcM-A (75,95%), SCCcM-D (21,83%) e SCCcM-W (1,54%) não demonstraram potenciais citotóxicos relevantes pois o valores ficaram abaixo de 90%.
Portanto, nesse trabalho podemos observa-se o grande potencial citotóxico das cascas do caule da espécie S. crassifolia, uma espécie típica do bioma Cerrado brasileiro. As frações SCCcM-H e SCCcM-A foram aquelas que apresentaram resultados mais expressivos (acima de 90%) frente às linhagens de células MDA-MB-435 (melanoma), HCT-8 (human-colon) e SF-295 (CNS). Desse modo, o estudo de screening em frações vegetais deve ser mais explorado pelos pesquisadores de áreas como a Biologia, a Farmácia e Química, caracterizadas como trabalhos multidisciplinares. Esses trabalhos possibilitam a escolha de melhores métodos e estratégias a serem utilizados na busca de novos compostos com atividades biológicas, os quais no futuro podem contribuir para o isolamento, identificação e aplicabilidade em diferentes áreas, bem como: farmacêuticas, alimentícias, agronômicas, etc.
AGRADECIMIENTOS
Os autores agradecem a Coordenação de Aperfeiçoamento de Pessoal de Ensino Superior (CAPES), Fundação de Amparo à Pesquisa do Estado de Goiás (FAPEG) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro.
REFERÊNCIAS
1. K. Hostettmann, E.F. Queiroz, P.C. Vieira, "Princípios 1. Ativos de Plantas Superiores", EdUFSCar, São Carlos, SP, 2003, pp. 9-10. [ Links ]
2. A. Jaafari, H.A. Mouse, E.M. Rakib, L.A. M`Barek, M. Tilaoui, C. Benbakhta, A. Boulli, A. Abbad, A. Zyad, Chemical composition andantitumor activity of different wild varieties of Moroccan thyme, Brazilian Journal of Pharmacognosy, 17(4), 477-491 (2007). [ Links ]
3. V.S. Bolzani, E.J. Barreiro, Biodiversidade: Fonte Potencial para a descoberta de fármacos, Química Nova, 32(3), 679-688 (2009). [ Links ]
4. C. Viegas Jr., V.S. Bolzani, E.J. Barreiro, Os produtos naturais e química medicinal moderna, Química Nova, 29(2), 326-337 (2006). [ Links ]
5. R.B. Oliveira, R.J. Alves, Agentes antineoplásicos biorredutíveis: Uma nova alternativa para o tratamento de tumores sólidos, Química Nova, 25(6), 976-984 (2002). [ Links ]
6. G.S. Oliveira, "Avaliação da Atividade Citotóxica das Frações Obtidas dos Frutos de Erythroxylum sp. (Erythroxylaceae) Frente à Célula Sarcoma 180", Monografia para título de Licenciado em Química, Universidade Estadual de Goiás, GO, Brasil, 2007, pp. 10-27. [ Links ]
7. A.P.N.D. Fonseca, G.D.F. Silva, J.J.C. Carvalho, G.D.C.M. Salazar, L.P. Duarte, R.P. Silva, R.M. Jorge, C.A. Tagliati, C.L. Zani, T.M.A. Alves, V. Peres, S.A. Vieira Filho, Estudo fitoquímico do decocto das folhas de Maytenus truncata REISSEK e avaliação das atividades antinociceptiva, antiedematogênica e antiulcerogênica de extratos do decocto, Química Nova, 30(4), 842-847 (2007). [ Links ]
8. L.M. Lião, "Alcalóides Sesquiterpênicos Piridínicos e Triterpenos Quinonametídeos Degradados de Salacia campestris (Hippocrateaceae)", Tese para a obtenção de título de Doutor em Ciências (Química Orgânica), Universidade Federal de São Carlos, SP, Brasil, 1997, pp. 1-137. [ Links ]
9. V.C. Souza, H. Lorenzi, "Botânica Sistemática: Guia Ilustrado para identificação das plantas das famílias de Angiospermas da flora brasileira, baseada em APG II", Nova Odessa, São Paulo, 2005, p. 279. [ Links ]
10. S.B.V. Rodrigues, R.R.S. Miranda, L.P. Duarte, 10. G.D.F. Silva, D.M. Oliveira, I.S. Lula, Triterpenos pentacíclicos isolados de Salacia elliptica (Mart.) Peyr., Sociedade Brasileira de Química (SBQ), Belo Horizonte, MG. 29ºed., 2006. [ Links ]
11. L.M. Lião, "Triterpenos quinonametídeos de Salacia campestris (Hippocrateaceae)", Dissertação para título de Mestre em Química, Universidade Federal de São Carlos, SP, Brasil, 1994, p. 3-18. [ Links ]
12. H. Oe, S. Ozaki, Hypoglycemic effect of 13-membered ring thiocyclitol, a novel α-glucosidase inhibitor from Kothala-himbutu (Salacia reticulata), Bioscience Biotechnology and Biochemistry, 72(7), 1962-1964 (2008). [ Links ]
13. T. Mosmann, Rapid colorimetric assay for the cellular growth and survival: application to proliferation and cytotoxicity assays, Journal of Immunological Methods, 65(1-2), 55-63 (1983). [ Links ]