Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.41 no.2 Bogotá July/Dec. 2012
Artículo de investigación revisión
Tratamiento farmacológico contra la obesidad
Drug treatment for obesity
Milton Enrique Londoño-Lemos
Departamento de Química Inorgánica, Facultad de Química, Universidad Nacional Autónoma de México, Ciudad Universitaria, Coyoacán, México, D. F. 04510, México.
Correo electrónico milti.lole@gmail.com
Recibido para evaluación: 23 de noviembre de 2012.
Aceptado para publicación: 20 de diciembre de 2012.
RESUMEN
La obesidad, una de las enfermedades más críticas del siglo XXI, se halla asociada con otros problemas de salud como la diabetes tipo 2, las enfermedades cardiovasculares y una expectativa de vida reducida, y ejerce un efecto importante sobre la economía. Pese a que se han desarrollado fármacos antiobesidad que actúan de diferentes maneras (disminuyendo el apetito, alterando el metabolismo o inhibiendo la absorción calórica), dichos fármacos han representado serias preocupaciones en cuanto a la seguridad en su uso, a tal punto que, debido a sus efectos secundarios, Se retiraron del mercado la sibutramina y el rimonabant; a consecuencia de estos reveses existen pocos medicamentos antiobesidad aceptados. Por otra parte, el conocimiento acerca del eje intestino-cerebro ayuda a entender cómo funciona el sistema gastroenteropancreático, con relación a una serie de péptidos y hormonas que participan en la regulación alimentaria y el cerebro, específicamente el hipotálamo como centro homeostático de los estados de hambre y anorexia, o del apetito, y por ende, del peso corporal. Esto nos lleva a estudiar aquellos fármacos que se encuentran en fase de investigación y desarrollo como las monoterapias y las combinaciones, para concluir que existen tres fármacos aprobados por la Agencia de Alimentos y Medicamentos (FDA, por sus siglas en inglés), dos de ellos recientemente (en el 2012), y otros que podrían llegar a ser aceptados para su uso terapéutico.
Palabras clave: obesidad, intestino-cerebro, farmacoterapia, mecanismos de acción. Pharmacotherapy for obesity
SUMMARY
Obesity is one of the most critical diseases of the 21st century, which is associated with other health problems such as type 2 diabetes, cardiovascular disease and reduced life expectancy, and a strong effect on the economy. Over time, have developed anti-obesity drugs which work in different ways: by suppressing appetite, altering metabolism or inhibiting absorption heat. However, these drugs have had serious concerns about the safety of commonly prescribed use derivative side effects, leading the recent withdrawal of sibutramine and rimonabant. As a result of these setbacks, there are few anti-obesity drugs accepted. Knowledge about the gut-brain axis help you understand how the gastro-entero pancreatic, related to a series of peptides and hormones involved in food regulation and the brain, specifically the hypothalamus as a central regulator of the states of hunger and anorexia or appetite and body weight thereby. These lead us to study those drugs that are under research and development as monotherapies and combinations to conclude that there are three drugs already approved by the Food and Drug Administration or by its acronym U.S. FDA (two of them recently approved in 2012) and others which will become accepted for therapeutic use.
Key words: Obesity, gut-brain, pharmacotherapy, mechanisms of action.
TRATAMIENTO FARMACOLÓGICO CONTRA LA OBESIDAD
En la mayoría de las sociedades la prevalencia de la obesidad ha alcanzado proporciones epidémicas (1). Por ejemplo, Estados Unidos es el segundo país con obesidad a nivel mundial, ya que el 80,5% de los adultos presentan sobrepeso u obesidad. De acuerdo con las predicciones del Gobierno, se estima que el 75% de adultos y cerca de un 24% de los niños y adolescentes en Estados Unidos tendrán obesidad o sobrepeso en el 2015 (2). Hoy en día la obesidad es definida como una enfermedad neurobiológica que reduce la esperanza de vida y es un factor de riesgo para desarrollar enfermedades cardiovasculares, ciertos tipos de cánceres y desarrollo de diabetes tipo 2 (3). Por eso la obesidad es considerada un problema de salud pública, que afecta a otros sectores sociales como el industrial, el educativo y el gubernamental, además de generar costos de millones de dólares a la economía.
En estudios recientes, científicos de la Universidad de Liverpool argumentaron que los fármacos antiobesidad no tienen ventajas duraderas para la salud y el bienestar porque solo tratan las consecuencias biológicas de la obesidad y no las causas psicológicas importantes del sobreconsumo y la ganancia de peso. De hecho, el doctor Jason Halford, líder en obesidad y apetito, de la Universidad de Liverpool, precisa que los fabricantes de medicamentos antiobesidad se enfocan sobre todo en la pérdida de peso como su principal objetivo y no toman en cuenta los factores motivacionales y comportamientos mentales que comúnmente causan la obesidad. La obesidad típica resulta de consumir demasiado alimento, combinado con un estilo de vida sedentario; sin embargo, la gente obesa también tiene una relación psicológica complicada con los alimentos, ante los cuales le es difícil controlar el apetito lo suficiente como para manejar su peso corporal.
Los fármacos antiobesidad pueden obrar de varias maneras, por ejemplo: suprimiendo el apetito, alterando el metabolismo o inhibiendo la absorción de calorías, pero los comúnmente prescritos han generado serias preocupaciones para la seguridad de los pacientes, a tal punto que recién se han retirado del mercado europeo medicamentos líderes como la sibutramina (reductil, meridia) y el rimonabant (Acomplia). A consecuencia de estos reveses, hay pocos medicamentos antiobesidad en desarrollo.
El profesor Tim Kirkham, autoridad en el área de la biofísica del apetito en la Universidad de Liverpool, afirma:
- Los nuevos y efectivos tratamientos antiobesidad deben apuntar hacia diferentes factores. Necesitamos identificar fármacos que puedan selectivamente afectar el deseo de comer, el disfrute de comer, plenitud y satisfacción. Intervenciones diseñadas específicamente para modular estos procesos podrían ayudar a reducir la experiencia aversiva de la dieta y maximizar la capacidad de exitosamente ganar peso sobre su apetito. Sabemos poco sobre los efectos comportamentales de los fármacos antiobesidad bajo desarrollo, y así tenemos poca indicación [de] si estos nuevos tratamientos tratan las causas subyacentes de la obesidad (4).
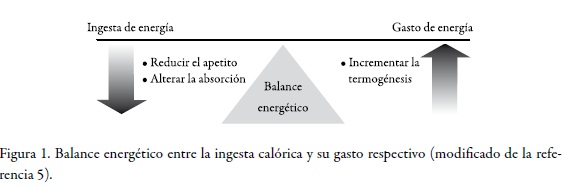
Hay que tener en cuenta que la regulación corporal es un sistema complejo de sistemas de retroalimentación múltiples sobrepuestos. La obesidad resulta por una mayor ingesta de energía que de un gasto energético, aunque este balance es afectado por factores genéticos, ambientales y culturales. Los tres mecanismos primarios que pueden ser alterados para revertir el estado de ingesta energética mayor que el gasto energético son la ingesta de alimento, el manejo de nutrientes y el gasto energético (v. Figura 1). Muchos de los medicamentos disponibles y en desarrollo apuntan a uno de estos tres mecanismos: reducir el apetito, decrecer la absorción de nutrientes, incrementar la termogénesis (5).
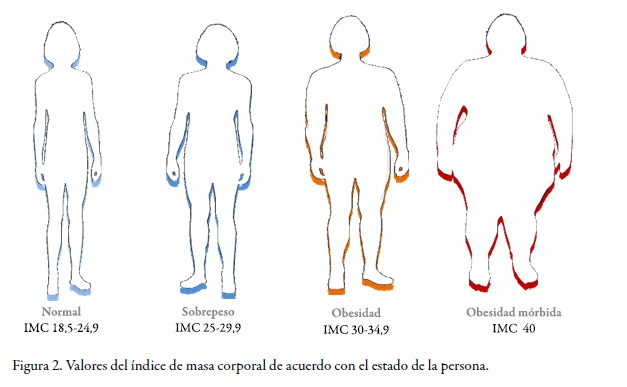
Se debe recordar que la manera más común utilizada para estimar el nivel de obesidad que tiene una persona es por medio del índice de masa corporal, IMC (o BMI, por sus siglas en inglés), que define la razón del peso corporal en kilogramos y su altura en metros cuadrados (kg/m2). De acuerdo con este criterio, la Organización Mundial de la Salud (OMS) (6) ha clasificado los diversos estados en los cuales se encuentra una persona (v. Figura 2).
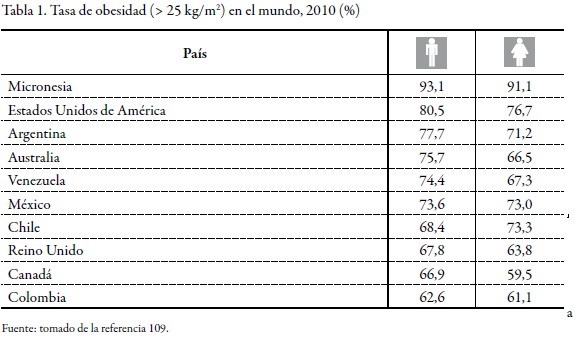
La OMS estima que en el mundo 1.700 millones de personas presentan sobrepeso y 310 millones son obesas. En la Tabla 1 podemos observar las cifras actuales de los países donde más se presenta esta enfermedad, al punto de ser considerada un problema de salud pública.
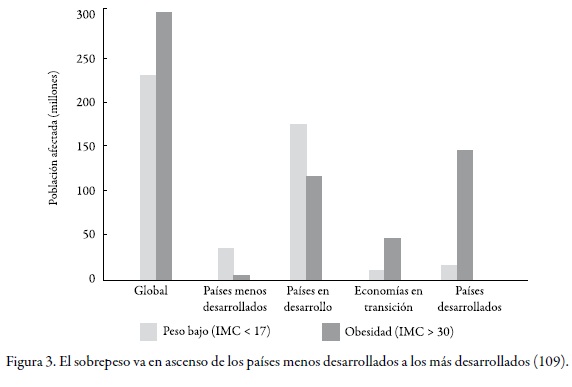
Sabemos que hoy en día se considera a la obesidad como una enfermedad crónica, compleja, multifactorial, que aún no tiene una cura específica, no está siendo bien enfocada y por ende no es tratada adecuadamente. Aún más preocupante resulta el hecho de que la obesidad aumenta tanto en los países en desarrollo como en los desarrollados (v. Figura 3).
Tomando como referencia a nivel latinoamericano a México, según la última Encuesta Nacional de Salud y Nutrición (Ensanut, 2006), el 71,9% de las mujeres mayores de 20 años y el 66,7% de los hombres tienen prevalencia combinada de sobrepeso u obesidad. Y causa alarma lo reportado en el 2010 sobre el primer lugar mundial en obesidad infantil que presenta México, según el Instituto Mexicano del Seguro Social (IMSS), por encima de países desarrollados como Estados Unidos.
Existe una fuerte correlación entre el desarrollo de la obesidad infantil y su prevalencia en la edad adulta. Asimismo, los niños que no presentan esta enfermedad tienen altas probabilidades de que permanezcan dentro del peso normal en la edad adulta (7).
La gran mayoría de las personas con sobrepeso u obesas deben modificar su tipo de alimentación para reducir la ingesta de energía diaria. Sin embargo, las dietas de muy bajo grado de energía o hipocalóricas no son recomendables, son abandonadas con mayor facilidad que las de restricción moderada y a largo plazo producen el mismo resultado que estas e incluso provocan una alteración en el metabolismo del cuerpo humano tal que requieren más cantidades de los nutrientes que se retuvieron en dicha dieta y a corto plazo ocasionan obesidad. Por ello resulta difícil tener una estrategia para bajar de peso y reducir la ingesta calórica, situación que crea la necesidad de buscar alternativas terapéuticas de prevención y tratamiento de esta enfermedad.
La obesidad se debe tratar idealmente con ejercicio y dieta, pero pocas personas pueden soportar regímenes dietéticos durante demasiado tiempo (8, 9). Así entonces, se ha buscado promover el desarrollo de tratamientos farmacológicos para tratar esta enfermedad. No obstante, pese al descubrimiento de las bases genéticas de la obesidad (10) y de más de una decena de hormonas y péptidos que regulan el apetito (ver abajo), aún no se ha podido frenar la epidemia de la obesidad (11, 12).
El eje intestino-cerebro
El esfuerzo de las investigaciones en los últimos veinte años se centraliza en entender cómo el organismo regula la ingesta de alimento y qué sustancias corporales participan en dicha homeostasis. Recién las investigaciones se están enfocando en el estudio del sistema gastroentero-pancreático, ya que se han identificado en el intestino una serie de hormonas que coordinan varias funciones involucradas en la regulación de la ingesta de alimento. Estas hormonas endocrinas envían señales al cerebro para dar por terminada una comida o para consumir más alimento. Por eso esta red de comunicación se conoce como gut-brain axis o eje intestino-cerebro (13); a continuación se describe el mecanismo de acción de las hormonas que intervienen en la regulación de la alimentación y las principales áreas cerebrales que tienen que ver con la homeostasis alimentaria y el peso corporal.
Generalidades sobre los mecanismos de regulación alimentaria
El cerebro humano es capaz de regular el apetito y el peso corporal al integrar la información acerca de las necesidades energéticas que requiere la persona y el estado de sus reservas, por lo cual se generan cambios en la conducta en respuesta a la energía proporcionada por el alimento, especialmente en las áreas cerebrales especializadas que estimulan tanto las sensaciones de apetito como las de saciedad (14), y lo hace a través de la activación de las señales transmitidas por el tejido adiposo y algunas regiones del tracto gastrointestinal (TGI) así como las vías vagales periféricas.
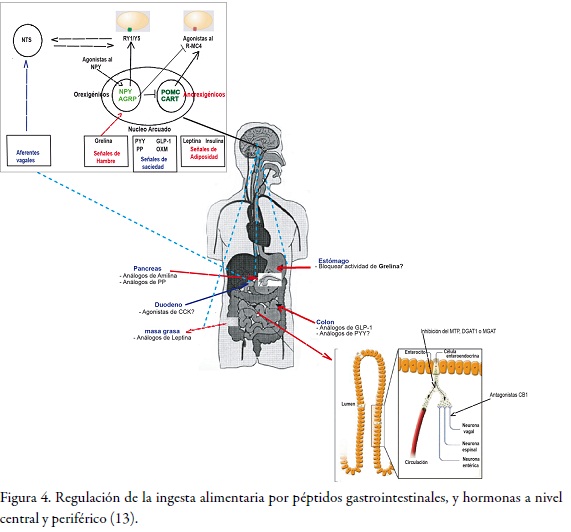
En la Figura 4 se observa cómo las señales que estimulan las respuestas en la regulación de la ingesta en el cerebro provienen de los órganos digestivos y del tejido adiposo, los cuales constituyen indicadores a corto plazo del estado alimenticio (a excepción de la leptina, que funciona como una señal a largo plazo).
En esta revisión se pretende dar a conocer los mecanismos o estrategias farmacológicas para combatir la obesidad con base en la literatura reciente y de acuerdo con la investigación y el desarrollo científico realizado tanto en la industria farmacéutica como en el ámbito académico hasta el presente. Con este fin agrupamos hormonas y fármacos según sus mecanismos de acción, que son: 1) disminución de la absorción de lípidos; 2) reducción de la ingesta de energía; 3) reducción de la masa o grasa corporal; 4) disminución de la diferenciación y la proliferación de los preadipocitos; 5) disminución de la lipogénesis y aumento de la lipólisis (15).
Ha de tenerse en cuenta que el criterio de la FDA para la aprobación de nuevos medicamentos antiobesidad consiste en que al menos un 35% de las personas sometidas a la terapia deben perder un mínimo de su peso corporal, es decir, que la terapia debe conducir a una pérdida de peso mínimo del 5% corregido a la pérdida de peso del grupo placebo.
DISMINUCIÓN DE LA ABSORCIÓ DE LÍDOS
1.1. Inhibidores de la lipasa pancreática
1.1.1. Orlistat
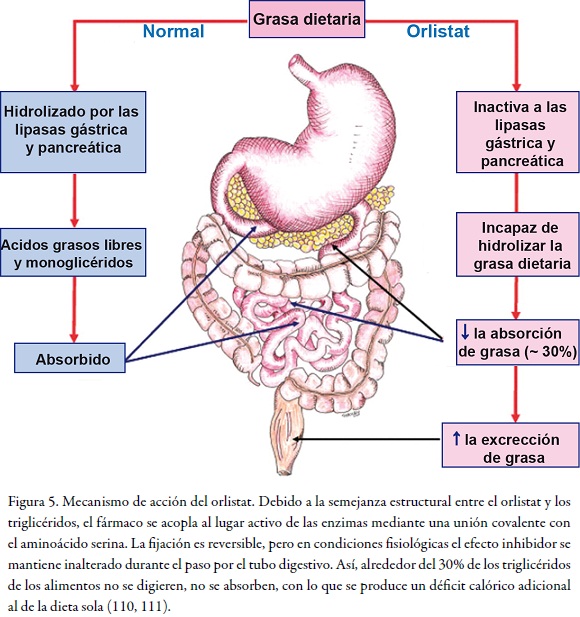
El orlistat o Xenical® es un medicamento diseñado para tratar la obesidad y su función primaria es la de prevenir la absorción de grasas de la dieta humana, por lo cual reduce la ingesta calórica. Fue aprobado en 1998 por la FDA para el tratamiento de la obesidad en compañía de una dieta reducida en calorías supervisada por el médico. Es un derivado de la lipstatina, un potente inhibidor natural de las lipasas pancreáticas aislado de la bacteria Streptomyces toxytricini. Su mecanismo de acción consiste en inhibir la lipasa pancreática, una enzima clave que interviene en la hidrólisis de los triglicéridos de los alimentos, libera ácidos grasos y monoglicéridos que son absorbidos luego por la mucosa intestinal. Este fármaco se encuentra en el lumen intestinal para reducir la absorción de la grasa dietaria (v. Figura 5).
Los estudios sistemáticos realizados tanto en adultos como en jóvenes adolescentes demuestra una significativa reducción del peso corporal con orlistat, comparado con el placebo de 6,2 kg (95% CI, 1,7 a 14,0 kg) (16, 17, 18, 19). Es interesante afirmar que el orlistat reduce la absorción de la dieta ingerida a una dosis máxima de 120 mg tres veces al día, y como lo muestra la figura 2, se excreta hasta un 30% de la dieta ingerida (20). En la figura 5 se indica la eficacia de este fármaco, que se formula como Xenical® y fue desarrollado por Laboratorios Roche, para la pérdida de peso, demostrada en una terapia que duró de dos a cuatro años, comparada con el placebo (21).
El orlistat es uno de los tres medicamentos antiobesidad actualmente aprobados en Estados Unidos y Europa; sin embargo la FDA en octubre del 2009 envió un comunicado sobre la seguridad del orlistat, debido a reportes de los pacientes que toman dicho medicamento, en los que refieren eventos adversos relacionados con un potencial daño al hígado; específicamente nombra treinta y dos casos en Estados Unidos. Los efectos adversos del orlistat sobre el sistema gastrointestinal comprenden manchas oleosas, heces líquidas, flatulencia y dolor abdominal (calambres) e incontinencia fecal, lo cual puede ser desconcertante para los sujetos. Se ha encontrado además que el orlistat reduce la absorción de las vitaminas liposolubles (A, D, E), por lo cual se recomienda suplementar estas vitaminas cuando se administra dicho fármaco (22).
1.1.2. Cetilistat (ATL-962)
Es un inhibidor de la lipasa que se encuentra en etapa avanzada de investigación y desarrollo (fase clínica III) como una alternativa potencial. Recientemente se ha observado que los pacientes obesos a quienes se les prescribió cetilistat presentaron reducciones de peso corporal similares a los observados con orlistat relativo al placebo, pero hubo un mayor número de reportes de eventos adversos en los sujetos que recibieron este último. 2 La compañía Takeda Pharmaceutical presentó el pasado 30 de octubre una solicitud de nuevo fármaco (NDA) al Ministerio de Salud, Trabajo y Bienestar en Japón para el cetilistat (nombre genérico, con el código: ATL-962) para el tratamiento de la obesidad con complicaciones. Basado en tres ensayos clínicos de fase III, de cincuenta y dos semanas, que se compararon con placebo para evaluar la eficacia y seguridad del medicamento en veinticuatro y cincuenta y dos semanas en pacientes obesos con diabetes tipo 2 y dislipidemias, el resultado del estudio de eficacia demuestra que el cetilistat a una dosis de 120 mg tres veces al día fue superior al placebo; la reducción del peso corporal promedio, de -2,776 a -1,103% frente al placebo (1%). Mayores reducciones en HbA1c y colesterol LDL se observaron también en pacientes tratados con cetilistat. Todos los ensayos clínicos demostraron que cetilistat tiene un buen perfil de seguridad y es bien tolerado. Estos resultados se pueden detallar en la página web http://www.takeda.com/press/article_49201.html.
1.1.3. Inhibidores de la ATDG1
La O-Acil Transferasa Diacil Glicerol (ATDG) es una enzima que cataliza el último paso de la síntesis de triacilglicerol. Esta enzima se halla en varios tejidos, incluidos el hígado y el tejido adiposo blanco. Se han descubierto, asimismo, dos isoenzimas del ATDG: ATDG1 y ATDG2, y se ha visto que un alto nivel de ATDG2 desempeña un papel importante en la esteatosis, mientras que la ATDG1 es fundamental para el ensamblaje de las proteínas de muy baja densidad, las cuales, a concentraciones muy altas, pueden promover el desarrollo de la obesidad, por lo cual esta isoenzima es considerada como un blanco potencial para el control de esa enfermedad. La farmacéutica Pfizer finalizó recientemente (2010) las pruebas de fase clínica I con un compuesto (PF 04620110) inhibidor del ATDG1, cuyo mecanismo de acción es antagonizar la absorción del triglicérido intestinal, lo que promueve tanto la pérdida de peso como los efectos antidiabéticos (diabetes tipo II), y Astra Zeneca reportó un nuevo compuesto inhibidor del ATDG1 en julio del 2010 (AZD4017), el cual se encuentra en la etapa de fase clínica I.
COMPUESTOS QUE DISMINIYEN LA INGESTA DE ENERGÍA POR INCREMENTAR EL ESTADO DE SACIEDAD Y ANOREXIA
Por este mecanismo podemos estudiar péptidos y hormonas que se originan en el tracto gastrointestinal y promueven la sensación de saciedad o la fase en que se promueve la de terminación de la comida o meal size, que es estimulada por los niveles circulantes de glucosa, aminoácidos (aa) y lípidos, los cuales son detectados por el cerebro o por medio de receptores periféricos. La saciedad se refiere a los efectos de la comida cuando está en los períodos de precarga y cuando se termina, y los efectos posprandiales que implican estos intervalos de alimentación, eso significa que interviene en la regulación de la frecuencia de comida. Así entonces, la saciedad per se previene el sobreconsumo, se presenta gastrointestinalmente (GI) en varios sitios (estómago, intestino delgado proximal, colon, páncreas) y la comida evoca la sensación de saciedad por dos efectos principales en el tracto gastrointestinal: la distensión gástrica y la liberación de péptidos de las células enteroendocrinas. Asimismo, el tallo cerebral es el principal centro y por lo tanto recibe las "entradas" de las señales de saciedad que actúan a corto plazo, las cuales son transmitidas por vía neural (proyecciones al nervio vago al núcleo del tracto solitario o NTS) y hormonal (mediante péptidos intestinales que actúan en el hipotálamo y el área postrema o AP (v. Figura 4). Estos péptidos transmiten señales de "saciedad" porque promueven la terminación de la comida y afectan la ingesta de alimento si se libera entre las comidas.
2.1. Compuestos que interfieren con las vías de señalización al cerebro
Amilina
La amilina es un péptido de 37 aminoácidos, coliberado, con la insulina, en las células β-pancreáticas después de la ingesta (24, 25). Los principales sitios de acción se localizan en el tallo cerebral y en el área postrema, en la que se presentan funciones anorécticas centrales. Entre sus efectos se encuentra la regulación tanto de la actividad motora del estómago como de la reabsorción renal de iones, el incremento de la secreción de bicarbonato de sodio, la inhibición de la secreción de pepsina y, quizás la más importante, el mantenimiento de la homeostasis de los carbohidratos. Se ha observado además que la inyección intrahipotalámica aumenta los niveles de dopamina y serotonina en el núcleo accumbens. En la regulación de glucosa los pacientes con diabetes tipo 1 presentan deficiencia de insulina y amilina; además, dichas hormonas tienen niveles circulantes bajos durante el ayuno, y aumentan en respuesta al consumo de alimento (23). Es de suponer que la amilina trabaja de forma conjunta con la insulina en regular los niveles de glucosa posprandial. Se ha notado que el uso de la amilina endógena puede incrementar el riesgo de formación de fibras amiloides (24). Hace poco la compañía Amylin Pharmaceuticals desarrolló un análogo sintético llamado pramlintida (Symlin®, Pubchem CID 16132446), el cual no contiene la secuencia considerada responsable de este efecto degenerativo y además tiene perfiles farmacocinético y farmacodinámico similares a los de la amilina endógena (26). La pramlintida fue utilizada originalmente para el tratamiento de la diabetes tipo 1 y tipo 2 y se asocia con la reducción en la ingesta de alimento y del apetito e incremento de la saciedad, en especial por disminución de la motilidad gastrointestinal, por eso se investiga como un potencial fármaco antiobesidad (27, 28). En el ámbito clínico la pramlintida se ha evaluado en sujetos obesos con resultados muy promisorios en cuanto a la reducción de peso corporal en el transcurso de un año de tratamiento con inyecciones dos o tres veces al día (bid) y utilizando un grupo placebo (29). De este análogo se está desarrollando una combinación farmacológica con un análogo sintético de leptina, llamado metraleptina, del cual se hablará luego.
2.2. Señales de saciedad que llegan al hipotálamo
2.2.1. Péptido YY (PYY)
El PYY (1-36) es un polipéptido de treinta y seis aminoácidos sintetizado por las células enteroendocrinas tipo L, sobre todo en el intestino distal. La principal forma circulante de esta hormona es el PYY (3-36), que se forma a partir de la ruptura parcial de PYY (1-36) por medio de la enzima dipeptidilpeptidasa IV (24). El PYY está presente en la circulación, se secreta a los quince minutos de empezar a comer y persiste hasta seis horas. Entre sus funciones se le conoce la de inhibir la secreción pancreática, la contracción de la vesícula, la motilidad GI y el incremento la secreción de ácido gástrico, la absorción de electrolitos y su absorción en el íleon.
Los efectos anorexigénicos son mediados por el receptor Y2, el cual se encuentra en el sistema nervioso central (SNC) y en las vías aferentes vagales e inhibe la liberación de las neuronas que expresan al neuropéptido Y (NPY) en el núcleo arcuato (30).
En seres humanos se ha demostrado que la aplicación de una infusión por vía intravenosa (IV) de PYY (3-36) disminuye la ingesta de alimentos de manera dosis-dependiente, con una inhibición máxima de 35%; P < 0,001 frente a control) (31). Sin embargo, este estudio no se continuó debido a que los pacientes experimentaron como efecto adverso náuseas dosis-dependiente, por lo cual no sería una estrategia terapéutica útil. En el 2008 se desarrolló una formulación intranasal de PYY (3-36) que mostró resultados prometedores en las pruebas de fase clínica II, no obstante fue retirado también debido a los constantes efectos adversos de náuseas y vómito, además de una eficacia posterior muy limitada.
2.2.2. Polipéptido pancreático
El polipéptido pancreático (PP) tiene treinta y seis aminoácidos y pertenece a la familia de péptidos PP (PPY, NPY) pero, a diferencia del PPY, es secretado principalmente por el páncreas y, en menor cantidad, por el colon. Posee una mayor afinidad con el receptor Y4 en el tallo cerebral y en el hipotálamo. Su secreción estimula la vía colinérgica vagal, la ingesta proteica y de grasas, la distensión gástrica y algunas hormonas intestinales (gastrina, secretina). Los niveles plasmáticos posprandiales son proporcionales a la ingesta calórica y pueden aumentar con la edad, algunas enfermedades como la diabetes y el cáncer de páncreas, el estrés y el ejercicio. Su secreción, por otra parte, ayuda a controlar la secreción pancreática, inhibe la secreción de insulina, modula la motilidad GI, inhibe la contracción del íleon y afecta las funciones metabólicas (glucogenólisis) (23).
El PP ejerce su efecto principalmente por inducir saciedad por vía periférica, de modo que suprime la ingesta alimentaria y el vaciado gástrico (32). Asimismo, activa neuronas en el área postrema, en la que abundan los receptores Y4, por lo cual incrementa la expresión hipotalámica de NPY y el consumo de oxígeno y la administración por vía central incrementa la ingesta alimentaria y el vaciado gástrico (acción orexigénica).
La farmacéutica Pharma desarrolló un análogo sintético de PP y un agonista selectivo al receptor Y4 llamado TM30339. Este compuesto demostró en los estudios preclínicos una pérdida de peso en ratones que presentaban obesidad, inducida por la dieta, y ahora se encuentra en estudios de fase clínica II. Sin embargo se han observado varios efectos adversos, como desórdenes gastrointestinales que incluyen colitis ulcerosa, malabsorción y mucositis. Dicha compañía también desarrolló un análogo dual de los péptidos PP y PYY obinepitida, con actividad agonística hacia los receptores Y2 y Y4, que en los estudios de fase preclínica tuvo mayores efectos que el PYY 3-36. El compuesto se encuentra ahora en fases clínicas I/II y su administración por vía subcutánea en pacientes obesos inhibió la ingesta de alimento significativamente hasta nueve horas después de la inyección.
2.2.3. GLP-1 (péptido como glucagón 1)
Entre las hormonas intestinales el GLP-1 es el más prometedor y constituye un blanco farmacológico para la regulación del peso corporal. Es un péptido derivado del gen pre-proglucagón sintetizado en las células L intestinales en respuesta al consumo de alimento y es fragmentado a sus activos GLP-17-37 y GLP 17-36 amida, este último, la mayor forma circulante. El GLP-1 es inactivado en forma rápida por la enzima dipeptidilpeptidasa IV (DPP-IV), lo cual lo lleva a un tiempo de vida media de eliminación de tan solo dos minutos.
El péptido actúa sobre el receptor GLP-1, el cual se expresa ampliamente en todo el SNC y los tejidos periféricos (24). La administración del GLP-1 ocasiona reducción dosis-dependiente de la ingesta de alimento. Se están investigando algunas estrategias para combatir la poca duración de su efecto debido a su tiempo de vida media, extremadamente corto: la primera consiste en producir análogos más estables de GLP-1; la segunda, la inhibición de la enzima DPP-IV. Hasta ahora los análogos de GLP-1 estables han producido los mejores resultados.
Un primer desarrollo importante fue el descubrimiento del análogo natural del GLP-1 4-exendina. Amylin Pharmaceuticals y Eli Lilly desarrollaron exenatida (Byetta®); la exenatida tiene un tiempo de vida más largo y fue aprobada para el tratamiento de la diabetes tipo 2 (33). No se han publicado estudios sobre el uso de exanatida como un agente antiobesidad en pacientes obesos; solo se sabe de una investigación no controlada, realizada en pacientes con diabetes tipo 2, en la que después de veinticuatro semanas la exenatida fue asociada a una pérdida de peso de 4,3 kg (34).
La exenatida debe ser administrada dos veces al día por vía subcutánea, lo cual es una desventaja; un efecto adverso desagradable son las náuseas, en particular durante la fase inicial del tratamiento. A comienzos del 2012 la FDA aprobó una formulación de exenatida (Bydureon, Amylin Pharmaceuticals) que requiere solo una inyección a la semana. Se usa como adyuvante de la dieta y el ejercicio para mejorar el control glicémico en adultos con diabetes tipo 2. Es la primera vez que un medicamento de liberación prolongada para este padecimiento sale al mercado.
Otra alternativa promisoria es la liraglutida (Novo Nordisk), un análogo de GLP-1 que tiene un 97% de homología al GLP-1 humano (35, 36). La liraglutida se une a la albúmina, por lo cual su vida media llega a ser de trece horas; este fármaco ha sido aprobado para su uso en diabetes y cuenta con licencia en Europa, Canadá, Japón, México y Estados Unidos. Una etapa amplia de programa de ensayos clínicos III se completó para evaluar la eficacia y seguridad del tratamiento con liraglutida, tanto en monoterapia como en combinación con algunos medicamentos antidiabéticos orales (ADO) y los datos de estos ensayos apoyan la aprobación de liraglutida en Europa, Japón, México y Estados Unidos (37). La mencionada compañía desarrolló un análogo por vía oral del GLP-1 NN9924 que ha completado los ensayos clínicos de fase I en el año 2012.
2.2.4. Colecistoquinina (CCK)
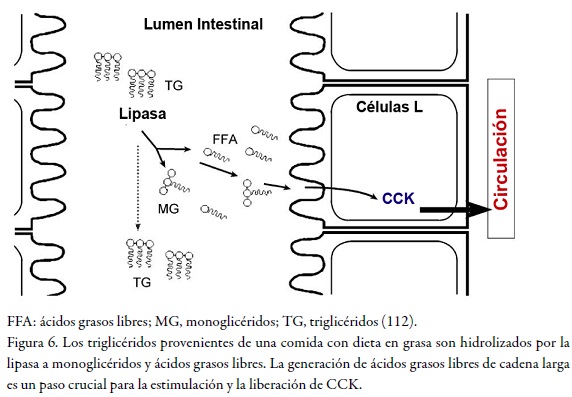
La colecistoquinina o CCK es un péptido hormonal secretado por las células-L en la parte proximal del intestino delgado (duodeno) que induce una señal de saciedad al cerebro (38); es el péptido gastrointestinal más estudiado. Siguiendo el consumo de los nutrientes, los niveles de CCK circulante comienzan a incrementarse de manera bifásica a los quince minutos, alcanzan un pico aproximadamente a los veinticinco minutos y permanecen elevados durante tres horas (v. Figura 6) (24).
Este péptido presenta dos receptores que se encuentran acoplados a proteínas G. Uno de ellos es el CCK-1, que se halla principalmente en el tracto gastrointestinal y las vías aferentes vagales, donde la CCK causa una sensación de saciedad mediada por este receptor, mientras que el CCK-2 se encuentra predominantemente en el cerebro. La administración exógena de CCK induce reducción en la ingesta de alimentos.
EL CCK no funciona como un agente antiobesidad per se
Su uso en la terapia antiobesidad se encuentra limitado hasta el momento, por eso se dice que la CCK es más importante en la sensación de saciedad que en la obesidad por sí misma. La compañía GSK detuvo el desarrollo de su compuesto GI181771 después de realizadas las pruebas de fase clínica II en el 2008, ya que no produjo una pérdida de peso significativa. Una limitación de este estudio pudo deberse a que los participantes en el estudio se les permitió comer ad libitum y pudieron haber compensado su energía con el incremento de su frecuencia de consumo alimentario (39). Al final de dicho año Pfizer también descontinuó el desarrollo de un agonista de CCK (CE-326597) luego de los estudios de fase clínica II, ya que la magnitud de pérdida de peso en un rango de dosis de 5, 25, 50 y 100 mg del fármaco CE-326597, administrado por vía oral, fue similar al placebo, con excepción de la dosis de 50 mg. No hubo relación dosisrespuesta en cuanto al efecto de reducción de peso (40).
2.2.5. Grelina
La grelina fue reportada por Masayasu Kojima y colaboradores en 1999. Es un polipéptido de 28 aminoácidos y peso molecular de 3.3 kiloDalton (kDa) liberado de las células gástricas. En contraste con las demás hormonas gastrointestinales, la grelina estimula la ingesta de alimento tanto en las vías aferentes vagales como en el núcleo arcuato del hipotálamo, tanto en roedores como en humanos. Esta hormona se secreta de manera pulsátil y varía notablemente en el transcurso del día.
Se ha demostrado que la grelina actúa sobre el receptor de la hormona de crecimiento secretagoga 1 A (GHS-R1a), presente en varias áreas cerebrales (41, 42). La grelina necesita estar bioactivada, lo que se logra por medio de una enzima llamada orto acil transferesa gástrica (GOAT, por sus siglas en inglés), enzima que ha despertado interés como blanco potencial para modular la actividad de grelina (43).
Se ha visto que la administración de grelina, sea por vía central o periférica, produce aumento de peso, y los niveles altos de la hormona mejoran el aprendizaje, pero si son muy altos afectan la ingesta de comida.
Estudios recientes indican que la grelina activa el circuito de búsqueda de la recompensa e incrementa el valor palatable de los alimentos (42); investigar la modulación de los efectos orexigénicos de la grelina al bloquear al receptor, y utilizar antagonistas, puede ser una opción muy interesante en el futuro.
2.3. Señales anorexigénicas que llegan al hipotálamo
2.3.1. Leptina
La leptina (44) es una hormona de 146 aminoácidos cuyo nombre proviene del griego leptos, que significa "delgado". Es el producto del gen OB, secretado por el tejido adiposo, y regula tanto la ingesta de alimentos como el balance de energía en sujetos de peso normal. Cuando se inyecta leptina exógena en roedores con obesidad genética (45, 46, 47, 48, 49) o inducida por la dieta disminuyen el peso corporal y la adiposidad; mejora el control metabólico por una regulación central o utilizando vías efectoras periféricas. Se ha observado que las concentraciones séricas de esta hormona se correlacionan de manera positiva con la masa de tejido adiposo. Aunque la leptina es una señal circulante que reduce el apetito sobre todo por acción central (50), en general los sujetos obesos presentan concentraciones inusualmente altas de leptina circulante y por consiguiente se desarrolla la resistencia a esta hormona (51).
La leptina no solo es secretada en la placenta y en el tejido adiposo, también lo es en el intestino. El ARNm de leptina y la leptina han sido detectados en las células principales de la mucosa estomacal (52, 53) y en el fondo gástrico (54). El receptor de leptina está presente en los núcleos arcuato y paraventricular (PVN); en las áreas hipotalámicas ventromedial (VMH), lateral (LH) y dorso medial (DMH). Así, la leptina es una hormona clave en la regulación a largo plazo de la ingesta de alimento y de la homeostasis del peso corporal.
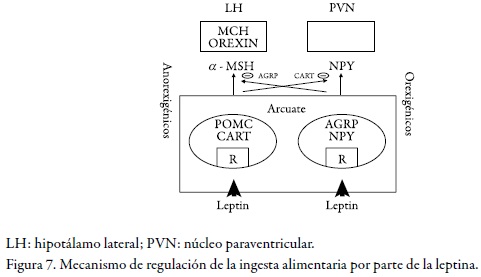
¿La leptina cómo regula la ingesta alimentaria? Esto lo podemos ver en la Figura 7:
La señal adipostática se da cuando hay ingesta de alimento, por lo cual se estimula la producción de leptina y esta a su vez activa las neuronas que liberan hormonas inhibidoras de la ingesta alimentaria (pro-opiomelanocortina, POMC), precursor del neuropéptido α-MSH (hormona estimulante de melanocitos) que ejerce su efecto anorexígeno uniéndose a los receptores de melanocortina MC3 y MC4 y, por lo tanto, inhibiendo la acción tanto de la proteína relacionada con agouti como de la CART (la transcriptasa relacionada con la cocaína-anfetamina); cuando hay poca leptina en dicho núcleo dentro del hipotálamo se activan las neuronas que liberan hormonas inducidoras del hambre, como lo son el neuropéptido y la proteína r-agouti (AgrP), identificada en 1997, un potente antagonista de los receptores de melanocortina MC3 y MC4 (55). Se ha notado que aquellos animales que presentan defectos en la vía de señalización, ya sea porque no producen hormona funcional (ratones ob/ob) (56), porque exhiben formas defectivas (ratas fa/fa) o ya sea el que no expresan su receptor (ratones db/ db), se caracterizan por hiperfagia y obesidad masiva de aparición temprana, además de padecer diabetes, hipotermia e infertilidad. En los seres humanos lo habitual es que los individuos obesos tengan niveles más elevados de leptina circulante, ya que tienen más tejido adiposo y desarrollan resistencia a los efectos de saciedad de la leptina. Su resistencia podría deberse a defectos en el sistema que la transporta al SNC o bien en las vías de transducción posreceptor de la leptina (57).
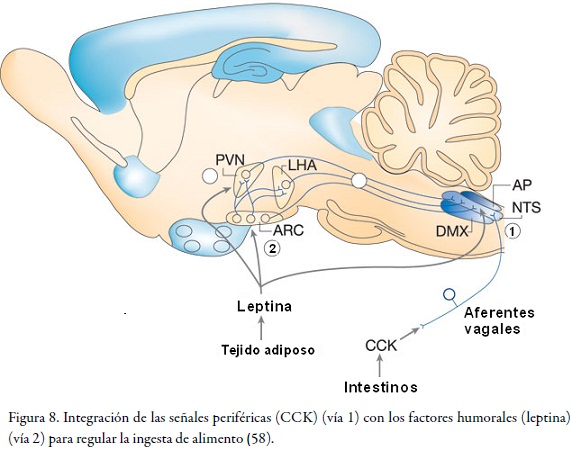
En la Figura 8 se observan las señales que inducen un estado de saciedad (e. g. CCK). El efecto de saciedad de CCK involucra la activación de las fibras aferentes vagales que terminan en el NTS (vía 1).
La leptina puede actuar directamente en el NTS, o en el núcleo dorsal motor del nervio vago incluso influenciar la respuesta del CCK (58), o finalmente mediante la activación de las neuronas POMC para inducir saciedad en el VMH (v. Figura 8, vía 2) (59).
Los ensayos clínicos para el tratamiento de la obesidad utilizando leptina fallaron porque muchos de los pacientes obesos presentaban dicha resistencia. Actualmente, con la leptina ha emergido una alternativa terapéutica utilizada en combinación con un análogo de amilina (v. combinación de fármacos).
2.4. Fármacos que actúan sobre la neurotransmisión y receptores en el SNC
Se han investigado y desarrollado compuestos que inducen la pérdida de peso corporal, que actúan dentro del SNC. Incluso, muchos fármacos que fueron inicialmente desarrollados para otras aplicaciones también son considerados en este grupo por sus efectos secundarios, pues se demostraba pérdida de peso en los pacientes que los utilizaban. Asimismo, un gran número de compuestos en el SNC pueden modular varias vías u órganos blancos al mismo tiempo.
2.4.1. Compuestos que modulan la disponibilidad de serotonina en el cerebro
La serotonina endógena hipotalámica (5-HT) desempeña una función importante en la sensación de saciedad en el transcurso de la comida y en los procesos de saciedad poscomida, aparte de los sensoriales, motores y comportamentales. Así entonces, los niveles altos de 5-HT estimulan el hipotálamo, y en este, al núcleo arcuato, activan las neuronas que expresan los neuropéptidos anoréxigénicos POMC/CART y suprimen a la vez las neuronas que expresan los neuropéptidos orexigénicos AgRP/NPY, por lo cual regulan la ingesta alimentaria (60). Numerosos estudios demuestran el efecto farmacológico de reducción en la ingesta por fenfluramina (61) y dexflenfluramina (62) en sujetos delgados y obesos. Se ha comprobado que estos fármacos inducen una pérdida de peso corporal hasta por doce meses de tratamiento y muestran mayor eficacia en el tercer mes, al comparar con el grupo control o placebo (63).
Numerosos subtipos de receptores de serotonina han sido identificados; de estos, los receptores 5-HT2C y 5-HT1B han sido específicamente reconocidos como mediadores de la saciedad inducida por serotonina. La activación de los receptores 5-HT2C sobre las neuronas que expresan al POMC del núcleo arcuato (ARC) se da por la misma vía de la melanocortina, crítica para la leptina que media en la anorexia. La activación del receptor 5-HT1B sobre el arcuato inhibe la actividad neuronal de las células que expresan los péptidos NPY/AgRP, lo cual ocasiona la estimulación indirecta de las células de POMC.
Dada esta actividad intrínseca de la serotonina y de algunos de sus receptores en la conducta de ingesta, se están desarrollando fármacos agonistas al receptor 5-HT2C, que son, hasta ahora, los candidatos más prometedores al respecto.
2.4.2. Compuestos dopaminérgicos
A pesar del papel que desempeña la dopamina en regular la conducta alimentaria, los receptores dopaminérgicos no parecen estar considerados como blancos atractivos hasta el momento. Los estudios preclínicos sugieren que los antagonistas D3 podrían ser efectivos en dicha regulación (64). La farmacéutica GlaxoSmithKline está investigando un antagonista al receptor D3 GSK598809 para tratar el comportamiento compulsivo hacia el consumo de alimento.
2.4.3. Compuestos antagonistas al receptor H3
Se ha dado mucha atención al desarrollo de compuestos antagonistas al receptor H3 que están expresados exclusivamente en el SNC. Un ejemplo de ello es el compuesto A-331440, que en dosis orales de 5 mg/kg y 15 mg/kg dos veces al día induce una pérdida de peso significativa en ratones. Otro ejemplo es el compuesto HPP404, de Transtech Pharma (http://www.ttpharma.com), que se encuentra en fase clínica I.
Otro compuesto es la betahistina (Histalean®), disponible en el mercado de Canadá y Europa para el vértigo, la cual se le ha formulado también para la reducción de ingesta por bloqueo de los receptores H1 y H3, sin embargo falta evidencia que muestre su eficacia en los seres humanos.
2.4.4. Antagonistas al NPY
El neuropéptido Y es un péptido orexigénico que actúa centralmente y pertenece a la familia de los polipéptidos pancreáticos de PYY y PP. La señalización a los receptores neuronales Y1 y Y5 produce los efectos orexigénicos del NPY, mientras que la señalización a los receptores Y2 y Y4 ocasiona un efecto anorexigénico debido a la inhibición presináptica de la liberación de NPY. Estos dos últimos receptores son también blancos de las hormonas intestinales PYY y PP, ya mencionados en la primera parte.
Teniendo en cuenta los receptores de tipo orexigénico, se han desarrollado moléculas antagonistas que han sido sintetizadas, varias de ellas por los laboratorios Merck. Uno de estos, velneperit (S-2367), de la compañía Shionogi (http://www.shionogi.co.jp), se encuentra en la fase clínica II de desarrollo; indujo una pérdida de peso ajustado al placebo de 3% relativo al peso en la línea base, en cincuenta y cuatro semanas de terapia, en una muestra de 342 personas obesas. Valga decir que la eficacia del fármaco es limitada (65).
2.4.5. Inhibidores a la proteína relacionada con agouti (AgRP)
De manera similar al NPY, la AgRP es una proteína orexigénica endógena que actúa en el hipotálamo basal, por lo cual su inhibición selectiva podría tener potencial en la inhibición de la ingesta alimentaria.
Hasta el momento se conoce un compuesto inhibidor selectivo de la proteína, el TTP435 de Transtech Pharma (http://www.ttpharma.com), de actividad oral y alta penetración en el cerebro; este compuesto se encuentra en pruebas de fase clínica II.
2.4.6. Compuestos mixtos
Fentermina
La fentermina es una anfetamina tipo análogo; actúa indirectamente con agentes simpaticomiméticos que incrementan los niveles de norepinefrina en la hendidura sináptica, lo cual estimula los receptores R 2-adrenérgicos e inhibe la alimentación en el SNC y periférico. Es el único fármaco aprobado para el tratamiento de la obesidad a corto término, debido a la falta de estudios a largo plazo comprobados (66). De la fentermina también se ha reportado que inhibe la monoaminooxidasa e incrementa los efectos de la serotonina, inhibiendo su depuración pulmonar. También se piensa que estimula la liberación de norepinefrina y dopamina (NA; DA) (4).
Existen estudios acerca del efecto de la fentermina en los sujetos (niños y adultos), pero con resultados modestos, incluso inefectivos, ya que se revierte el efecto una vez se suspende el tratamiento (67). Un estudio interesante fue realizado en un ensayo de treinta y seis semanas, en el que se administró fentermina a tres grupos de sujetos en dosis continuas e intermitentes, contra un grupo control o placebo; los resultados mostraron que ambos regímenes de dosificación ocasionaron mayor pérdida de peso (12,2 kg vs. 13 kg vs. 4,8 kg, respectivamente) (68).
La fentermina se encuentra disponible en muchos países, incluyendo a Estados Unidos; sin embargo, como es similar a las anfetaminas los individuos pueden desarrollar adicción a ella.
Este fármaco puede causar efectos adversos, dadas sus propiedades de liberación de catecolaminas (taquicardia, elevada presión sanguínea, insomnio, desasosiego). Adicional a lo dicho, la fentermina tiene el potencial de causar dependencia física y psicológica (69).
Como se discutirá adelante, la fentermina ha sido parte en la terapia de combinación de fármacos para la reducción de la ingesta alimentaria y, por ende, la reducción de peso corporal.
Bupropión
El bupropión es un antidepresivo de la clase aminocetona; químicamente no tiene relación con los inhibidores de recaptación tri y tetracíclicos selectivos de serotonina u otros agentes antidepresivos conocidos. Se conoce como un fármaco antidepresivo y es utilizado para dejar de fumar; fue aprobado en 1984 por la FDA como un antidepresivo y se lanzó al mercado con el nombre de Wellbutrin, pero en 1986, debido a la significativa incidencia de ataques epilépticos a la dosis originalmente recomendada (400-600 mg), se debió retirar el medicamento del mercado, en el cual fue reintroducido, sin embargo, en 1989, a una dosis máxima de 450 mg/día. Su mecanismo de acción consiste en inhibir la recaptación de DA y NA, lo que desencadena pérdida del apetito y por ende la reducción en la ingesta de alimento (70). El bupropión presenta antagonismo por los receptores nicotínicos (71).
Uso como agente antiobesidad
En 1997 Hurt y sus colaboradores emplearon una forma de liberación sostenida del bupropión efectiva para dejar de fumar, acompañado de una ganancia de peso reducida y mínimos efectos adversos (72).
En un estudio más reciente realizado en sujetos delgados el bupropión redujo el peso corporal en 2,8 kg, comparado con el placebo, entre los seis a dieciocho meses (18), pero con resultados modestos de pérdida de peso en los sujetos obesos, en quienes produjo una pérdida de peso hasta del 10,1% del peso inicial, comparado con el 5% del placebo en veinticuatro semanas, con mantenimiento de pérdida en peso de forma incrementada durante cuarenta y ocho semanas (73).
Por eso se pensó en la posibilidad de utilizarse el bupropión como agente antiobesidad; aunque no está aprobado para este propósito, se encuentra en investigación clínica en dos combinaciones farmacológicas que se abordarán en la próxima sección.
Tesofensina
Es un inhibidor de la receptación de serotonina-noradrenalina-dopamina de la familia del feniltropano que se está probando por la empresa danesa NeuroSearch para el tratamiento de la obesidad; fue desarrollado inicialmente para el tratamiento del Parkinson y del Alzheimer.
Usando el modelo de obesidad inducida por dieta en ratas, al tratarse con tesofensina (2,0 mg/kg, s. c.) durante dieciséis días mostraron mayor reducción del peso corporal que las ratas tratadas con vehículo, lo cual se vio reflejado por una marcada respuesta hipofágica; el más probable mecanismo de supresión de ingesta de alimento por tesofensina en la rata obesa depende de la capacidad del fármaco de estimular indirectamente el receptor adrenérgico α1 y la función del receptor dopaminérgico D1. Los efectos adversos asociados con este fármaco se han encontrado a una dosis de 1 mg, al afectarse significativamente la presión sanguínea sistólica y diastólica, además de efectos gastrointestinales que incluyen boca seca, náuseas, dolor abdominal, constipación, heces duras y diarrea (74).
Este compuesto ya pasó las pruebas de fase clínica II (ClinicalTrial.gov NCT00394667), en las que se evidenció pérdida de peso de manera dosis-dependiente (75). Actualmente se encuentra en la fase clínica III (4, 76).
2.4.7. TM30338 (Obinepitida)
Es un agonista dual de los receptores Y2- Y4 desarrollado por 7TM Pharma para el tratamiento de la obesidad y las enfermedades relacionadas con ella. La obinepitida se deriva de la hormona pancreática Gln-63. En los estudios clínicos de fases I/II, TM30338 demostró ser seguro y bien tolerado por el ser humano. Es importante destacar que en personas obesas la dosis es de una vez al día por vía subcutánea.
La obinepitida inhibe la ingesta de alimentos en forma estadísticamente significativa hasta por nueve horas. El TM30338 administrado a sujetos obesos sanos, en dosis múltiples de una y dos veces al día, también resultó ser seguro y bien tolerado. No hubo retiros ni fueron reportados eventos adversos graves (77). Se encuentra en estudios de fase clínica II.
2.5. Compuestos retirados del mercado
2.5.1. Fenfluramina
La fenfluramina (Pondimin) llegó al mercado en 1970, mientras que su enantiómero más activo, dexfenfluramina (Redux), fue el primer fármaco antiobesidad aprobado por un tiempo mayor de tres meses, a partir de los años noventa. Estos fármacos elevan los niveles séricos de serotonina (5HT) en el sistema nervioso central, estimulando su liberación e inhibiendo su recaptación.
No obstante, la fenfluramina y la dexflenfluramina fueron retiradas del mercado en 1997 debido a los múltiples reportes de enfermedades cardiovasculares e hipertensiones pulmonares primarias debidas a estos fármacos (78). Este evento de efectos adversos se debe a que el metabolito producido por la fenfluramina (nordexfenfluramina) tiene una gran afinidad con los receptores de serotonina 2B, los cuales actúan sobre las válvulas del corazón y producen valvulopatías.
2.5.2. Sibutramina
Es un fármaco que fue aprobado por la FDA en 1997 como agente antiobesidad para su uso en adultos en Estados Unidos, y en Europa a partir de 1999. Es un inhibidor de la recaptación que ayuda a aumentar la saciedad por inhibir la de serotonina (53%), noradrenalina (NA) (54%) y dopamina (DA) (16%).
En cuanto a su mecanismo de acción farmacológica, la sibutramina tiene una acción dual que explica la reducción en el peso corporal y por lo tanto su acción anoréctica. Esta acción es mediada por los receptores adrenérgicos centrales Α1 y β1, y los efectos termogénicos por el receptor β3 a nivel periférico (79). Por ello, los efectos terapéuticos de la sibutramina se deben a la inhibición de receptar norepinefrina, serotonina y dopamina. Aunque es inefectivo como antidepresivo, propósito para el cual fue originalmente desarrollado, este fármaco reduce el peso corporal y el apetito, e incrementa la saciedad (80). Un análisis de tres pruebas con un año de duración mostraron que los pacientes con sibutramina perdieron 4,3 kg o 4,6% más de peso que aquellos que quienes tomaron placebo, de los cuales, un 34% lograron un mínimo de pérdida de peso del 5% y el 15% un mínimo de pérdida del 10%, comparado con el placebo (81). Otros estudios recientes demuestran pérdidas de peso similares (4).
Los efectos adversos incluyen constipación, incremento de la presión sanguínea y de la frecuencia cardíaca, boca seca y dolor de cabeza (16, 82).
Retiro del mercado en Europa
Recientemente se suspendió la licencia de la sibutramina debido a fallas en la seguridad del medicamento, detectadas por la Agencia Europea de Medicamentos (EMEA) de acuerdo con los datos obtenidos en estudios de evaluaciones cardiovasculares. La revisión concluyó que con sibutramina hay riesgo incrementado de ataques al corazón no fatales. La EMEA adujo que pese a compensar este riesgo los beneficios de perder peso, sus resultados eran modestos y no podían sostenerse luego de suspender el tratamiento. A este retiro de licencia le siguió el del rimonabant, en octubre del 2008.
La FDA ha sugerido que los pacientes con historia de enfermedades de alto riesgo deben evitar el uso de sibutramina. La advertencia está basada en los resultados de un estudio con 10.000 pacientes en el que, de acuerdo con los análisis preliminares, un número muy alto de ellos sufrieron eventos cardiovasculares; sin embargo este medicamento es ampliamente prescrito para pacientes que han fallado al responder a un régimen dietario estricto. Actualmente la FDA está revisando los beneficios potenciales y los riesgos de su uso terapéutico (83).
2.5.3. Dietilpropión
El dietilpropión es un agente anoréctico con alguna actividad farmacológica similar a la del prototipo de fármacos de esta clase usados en obesidad, las anfetaminas. Sus efectos incluyen la estimulación del sistema nervioso central y elevación de la presión sanguínea. Se considera que este fármaco y sus metabolitos atraviesan la barrera hematoencefálica y la placenta.
El dietilpropión, que se encuentra disponible como fármaco antiobesidad desde 1960, está indicado en el manejo de la obesidad exógena como un coadyuvante a corto plazo (unas pocas semanas) en el régimen de reducción de peso basado en la restricción calórica en pacientes con un índice de masa corporal (BMI) de 30 kg/m2 o mayores que no han respondido al régimen apropiado de reducción de peso (dieta o ejercicio). Este fármaco no debe ser prescrito a pacientes con hipertensión o con enfermedades cardiovasculares sintomáticas, incluyendo arritmias. En las interacciones con otros fármacos, el uso concurrente de fenotiazinas puede antagonizar el efecto anoréctico del dietilpropión.
Recientemente el dietilpropión, en una dosis de 50 mg administrada dos veces al día, mostró ser más efectivo que el placebo durante seis meses, en una muestra de sesenta y nueve pacientes adultos obesos -9,8%- (s. d. 6,9%) del peso corporal inicial contra 3,2% (3,7%) en el grupo placebo (P < 0,0001). Además, después de doce meses de tratamiento la pérdida de peso inducida por el dietilpropión fue de 10,6% (8,3%). Por lo tanto, el tratamiento del dietilpropión más la dieta produjo una pérdida de peso clínicamente significativa y sostenida en un año de tratamiento. Este fármaco parece ser seguro con relación a los eventos cardiovasculares y psiquiátricos en la población seleccionada para el estudio (84). Los efectos adversos más comunes fueron los de boca seca e insomnio.
Retiro del mercado en Europa
Este fármaco fue retirado del mercado europeo en el 2001, pero se sigue prescribiendo en Estados Unidos (22).
2.5.4. Rimonabant
El sistema endocanabinoide modula la ingesta de alimento y el metabolismo energético a diferentes niveles, comenzando en los receptores del sistema gastrointestinal (GI) para regular la recompensa hedónica en el cerebro (85). Asimismo, canabinoides presentes en la Cannabis sativa estimulan el apetito. Por tal motivo, luego de múltiples observaciones se desarrollaron compuestos bloqueadores de este sistema (CB1), y uno de los primeros en utilizarse fue el rimonabant.
El sistema endocanabinoide modula la ingesta de alimento y el metabolismo energético a diferentes niveles, comenzando en los receptores del sistema gastrointestinal (GI) para regular la recompensa hedónica en el cerebro (85). Asimismo, canabinoides presentes en la Cannabis sativa estimulan el apetito. Por tal motivo, luego de múltiples observaciones se desarrollaron compuestos bloqueadores de este sistema (CB1), y uno de los primeros en utilizarse fue el rimonabant.
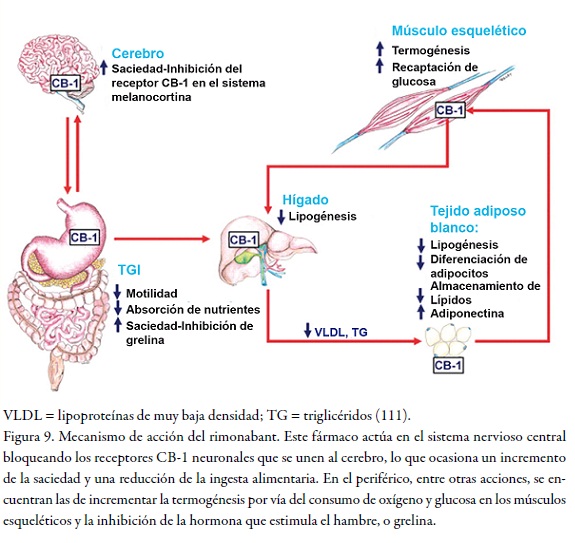
Este es un potente antagonista selectivo del receptor canabinoide del cerebro CB1, generado por la farmacéutica Sanofi-Aventis (Acomplia). El rimonabant está indicado para el tratamiento de la obesidad. La activación de dichos receptores por los canabinoides endógenos como la andamida incrementa el apetito, lo cual podemos apreciar en la Figura 9.
Aunque estuvo disponible en Europa desde el 2006 para pacientes obesos o con sobrepeso con factores de riesgo asociados, como adjunto de la dieta y el ejercicio, el Acomplia no fue aprobado por la FDA en Estados Unidos. Las preocupaciones han estado creciendo en pacientes que toman Acomplia (o Zimulti, en el mercado de Estados Unidos) debido al incremento de eventos adversos psiquiátricos, incluyendo el suicidio. Un análisis de los datos sobre seguridad del rimonabant indicaron aumento de riesgo a suicidio en pacientes con una dosis mayor de 2 mg: dos suicidios fueron registrados en el programa de pruebas clínicas del rimonabant, uno de los cuales ocurrió en la prueba de RIO-Norteamérica.
En Europa la EMEA observó algo similar, lo cual puede verse en la página electrónica: http://www.drugdevelopment-technology.com/projects/rimonabant/.
En el año 2008 los fabricantes del rimonabant (Sanofi-Aventis) anunciaron que todos los estudios de fase clínica serían detenidos en forma permanente. Este anuncio fue seguido por la decisión de retirar el fármaco del mercado debido especialmente a sus efectos adversos de tipo psiquiátrico, considerados más relevantes que sus efectos benéficos (86).
Otros endocanabinoides en desarrollo
Hacia el año 2008 unas nueve compañías farmacéuticas terminaron el desarrollo de proyectos que incluían bloqueadores al CB1. Algunos compuestos han mostrado efecto sostenido en el peso sin inducir una supresión temporal de la ingesta de alimento, lo que fue visto con el rimonabant. En el 2010 la compañía 7TM Pharma completó de manera exitosa las pruebas clínicas de fase I con un compuesto llamado TM38837, el cual mostró propiedades farmacocinéticas favorables en seres humanos (13).
3. COMPUESTOS QUE REDUCEN LA MASA O GRASA CORPORAL
De interés resultan ser las aproximaciones evaluadas para la reducción de peso mediante el incremento del gasto energético o la reducción o redistribución del tejido adiposo. Enfocarse en el gasto energético (o la bioenergética celular), y en particular en la termogénesis adaptativa, es una opción valiosa (87).
La termogénesis adaptativa es generada por la mitocondria del músculo esquelético y el tejido adiposo pardo (BAT), en respuesta a los estímulos externos, por medio de la disipación del exceso de energía en forma de calor (88). Por eso el BAT desempeña un papel importante en la regulación de la obesidad mediante el control del balance de energía.
Los hallazgos recientes demuestran que los adultos mantienen en forma activa el BAT (89). Por lo tanto, el BAT es un nuevo blanco para el tratamiento de la obesidad (87, 90).
Mencionaremos algunos de estos compuestos con mayor potencial futuro en la terapia antiobesidad.
3.1. Inhibidores de la hidroxiesteroide-11-β tipo 1 deshidrogenasa (11β-HSD1)
La enzima (11β-HSD1) está recibiendo mucha atención debido a su posible función en el desarrollo del síndrome metabólico (91, 92). Esta enzima cataliza primariamente la reducción de la cortisona hormonalmente inactiva, cortisona en el ligante altamente afín al cortisol (o corticosterona en roedores).
Los inhibidores selectivos al 11β-HSD1 que son efectivos en el tejido adiposo han tenido resultados positivos en los modelos animales y pueden ser también eficaces al mejorar la sensibilidad a la insulina y reducir el peso corporal en los seres humanos. Se está desarrollando el compuesto INCB 13739 por la farmacéutica Incyte, el cual ha demostrado mejoría en la sensibilidad de insulina y disminuye los niveles de colesterol en diabéticos tipo 2; se encuentra en ensayos clínicos de fase IIa. Los estudios al respecto se encuentran en la página web http://cholesterolnewsonline.blogspot.mx/2011/05/incyte-selective-oral-inhibitor-of.html.
Inhibidores de la angiogénesis
La expansión del lecho capilar adiposo que se aprecia en la obesidad sugiere que la antiangiogénesis puede ser una estrategia terapéutica para el manejo del peso. Los adipocitos activados producen un equilibrio de factores de crecimiento vascular que incluyen los de crecimiento vascular endotelial (VEGF), VEGF-C, VEGF-D, el receptor-2 soluble de VEGF (sVEGFr2), el factor de crecimiento del hepatocito, la angiopoietina- 2 y la angiogenina, entre otros; las concentraciones séricas de varios de estos factores de crecimiento están más altas en los sujetos que presentan obesidad o sobrepeso que en los individuos con peso normal (93).
Rupnick et al. demostraron que los agentes antiangiogénicos sistémicos causan una reducción de peso reversible que es dosis-dependiente y pérdida de tejido adiposo. Una de las compañías que trabajan en esta área es Korean AngioLab (http://angiolab.co.kr/), que está desarrollando una preparación basada en productos naturales para este propósito llamada ALSL1023.
4. DISMINUCIÓN DE LA DIFERENCIACIÓN Y LA PROLIFERACIÓN DE LOS PREADIPOCITOS
Los adipocitos desempeñan un papel central en el mantenimiento de lípidos y el equilibrio y la homeostasis de la energía, mediante el almacenamiento de triglicéridos y liberación de ácidos grasos libres en respuesta a las demandas cambiantes de energía.
Debido a que el crecimiento de tejido adiposo puede ser a consecuencia tanto de la hiperplasia como de la hipertrofia de los adipocitos, la realización de estudios para la detección de posibles compuestos antiobesidad se ha centrado asimismo en los procesos de proliferación y diferenciación de los adipocitos.
Los ácidos grasos, particularmente los ácidos grasos poliinsaturados (PUFA) actúan como moléculas de transducción de señales en la diferenciación de adipocitos y en el tejido de los adipocitos los ácidos grasos saturados y monoinsaturados son más fácilmente acilados a triglicéridos de PUFA (94), de ahí que los PUFA desempeñan un papel central en la síntesis de la supresión de ácido graso y en regular la diferenciación de los adipocitos mediante la supresión de la fase tardía de dicha diferenciación.
Por lo tanto, el ciclo celular está estrechamente asociado al crecimiento y la proliferación de los adipocitos y es por consiguiente un factor importante a considerar en el diseño de los nuevos fármacos antiobesidad.
5. DISMINUCIÓN DE LA LIPOGÉNESIS Y AUMENTO DE LA LIPÓLISIS
Las estrategias farmacológicas de la lipólisis pueden verse de dos maneras. La primera estrategia implica la hidrólisis de los triglicéridos estimulantes con la finalidad de disminuir los depósitos de grasa y combatir de este modo la obesidad. Dicha opción requiere la oxidación asociada a la nueva liberación de los ácidos grasos, lo que condujo al desarrollo de los agonistas ß3-adrenérgicos. Por otra parte, considerando que la lipólisis excesiva contribuye a los altos niveles circulantes de ácido grasos y el desarrollo de la dislipidemia (como se ve en el síndrome metabólico), el bloqueo de esa liberación de ácido graso puede ser de interés terapéutico (95).
COMBINACIONES DE FÁRMACOS PARA TRATAR LA OBESIDAD
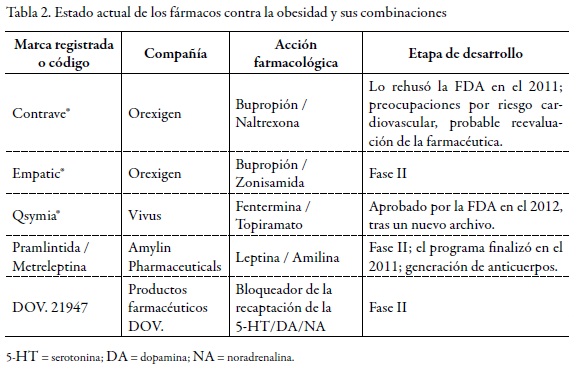
Las investigaciones, en el transcurso de los años, han revelado que la combinación de algunos fármacos parece ser el próximo avance en el tratamiento de la obesidad; a continuación se detallan las actuales combinaciones de fármacos y las que se estudian para una futura aplicación como politerapias antiobesidad (v. Tabla 02).
Veamos algunas combinaciones politerapéuticas:
6.1. Bupropión + Naltrexona (Contrave®)
Esta combinación la está desarrollando Orexigen Therapeutics, junto con Takeda. El bupropión ya fue descrito.
La naltrexona (NTX) fue aprobada en 1984 por la FDA para tratar la adicción a las drogas opiáceas, y al alcohol, en 1995). Es un antagonista de los receptores opioides (µ principalmente y ?-receptores) de acción prolongada, pero por sí solo es inefectivo para producir un efecto significativo en la pérdida de peso. Los compuestos agonistas opiáceos inhiben la señalización neuronal del POMC, un efecto que es disminuido por la NTX. Del bupropión (BUP), además de lo atrás dicho, se conoce que su potencial anoréctico está vinculado a la activación de las neuronas que expresan el POMC, así que la inducción de la señalización neuronal inducida por el BUP es potenciada por el antagonismo del mecanismo normal inhibitorio que limita la activación sostenida del POMC por la NTX (96). El Contrave mostró eficacia en la disminución del peso corporal en aproximadamente el 50% de los pacientes, ocasionó una pérdida de al menos el 5% de peso en los estudios de fase clínica III y presentó beneficios potenciales especialmente en las personas obesas con diabetes y con depresiones mayores (97). Además, este medicamento es útil para las personas que manifiestan deseos de comer permanentemente, o como lo denominan en inglés, craving, lo cual está asociado al desarrollo de la obesidad, pues se demostró además que se disminuyen estas ansias de comer, ya que ambos componentes de la formulación actúan sobre el sistema de recompensa y adicionalmente sobre los centros del hambre en el hipotálamo (98).
El Contrave no obtuvo la aprobación por la FDA a principios del 2011, debido a los problemas de seguridad cardiovascular que ocasiona, ya que aumentaba la presión arterial y la frecuencia cardíaca, lo que es en especial peligroso para las personas obesas. Orexigen está llevando a cabo un ensayo cardiovascular sobre este particular, estudio que se puede encontrar en la página web ClinicalTrials.gov. A tales efectos, la mencionada farmacéutica comenzó a reclutar voluntarios en el primer semestre del 2012 para realizar un ensayo. Ahora la FDA recomienda Contrave, sin perjuicio de los resultados sobre la seguridad cardiovascular (99).
6.2. Bupropión + Zonisamida (Empatic®)
Es la combinación del bupropión con la zonisamida, la cual ha reportado una alta eficacia con muy pocos efectos adversos; el Empatic lo está desarrollando la biofarmacéutica Orexigen Therapeutics, desarrollo que puede verse en la página electrónica (http://ir.orexigen.com/phoenix.zhtml?c=207034&p=irol-news&nyo=0).
La zonisamida, al igual que el topiramato, es un fármaco anticonvulsivante, con actividad agonística serotonérgica y dopaminérgica incluso hacia GABA (4), que ha demostrado su inducción a la pérdida de peso (100).
La evaluación de su eficacia se ha hecho en ensayos clínicos fase II. En un estudio piloto de doce semanas con dieciocho mujeres obesas, la pérdida de peso fue de 2,9 kg reportados (3,1%) en el grupo de zonisamida, significativamente inferior a los 7,2 kg (7,5%) observados en el grupo de tratamiento combinado (zonisamida 100 mg, aumentando a 400 mg durante cuatro semanas, y bupropión 100 mg aumentando a 200 mg después de dos semanas) (52). Curiosamente, la tolerancia de la combinación fue mejor que la de monoterapia con zonisamida. Por último, en otro ensayo de fase IIb durante 24 semanas, doble ciego y controlado con placebo, la zonisamida 120 mg y 360 mg en monoterapia redujo el peso corporal en 3,2% y 5,3%, respectivamente, mientras que el bupropión 360 mg lo redujo 2,3% y un 1,4% con placebo. Por otro lado, el Empatic que contiene 120 mg de bupropión / 360 mg zonisamida ocasionó una pérdida de peso del 6,1%, mientras que la combinación de 360 mg de zonisamida / 360 mg de bupropión produjo 7,5% de reducción del peso corporal. Estos informes sugieren significativas reducciones de peso por efecto de la combinación de bupropión/zonisamida. Sin embargo, varias preocupaciones en seguridad con respecto al bupropión y la zonisamida deben ser abordadas en futuros estudios de fase III para el Empatic® antes de sacar conclusiones firmes acerca de su perfil de seguridad farmacológica.
6.3. Metreleptina + Pramlintida
El tratamiento combinado de amilina y leptina desarrollado por la compañía Amylin Pharmaceuticals ha demostrado inducir mayor pérdida de peso y de grasa corporal. La pramlintida es un fármaco aprobado para el tratamiento de la diabetes, mientras que la metraleptina ha sido probada en monoterapia para la obesidad y pérdida de peso; desafortunadamente este medicamento falló debido al desarrollo de resistencia hacia la leptina. Estudios recientes han comprobado que estas dos hormonas actúan de forma sinérgica para reducir la ingesta de alimento y el peso corporal (101).
Otros estudios clínicos recientes confirman que el efecto combinado de los fármacos es robusto y logra disminuir el peso corporal por medio de la restauración de la sensibilidad a la leptina y la potenciación de los efectos de la pramlintida; de hecho, se ha observado reducción del peso corporal, de manera significativa, cerca de la cuarta semana de tratamiento, registrándose una pérdida del 12,7% de peso corporal, comparado con una pérdida de 8,4% con pramlintida y de 8,2% con metraleptina. Para ello se trató a los pacientes con 180 µg de pramlintida en dos tomas diarias durante dos semanas, y luego con 360 µg durante otras dos semanas, junto con una dieta deficiente de calorías hasta en un 40% (550-1150 kCal/día). Quienes lograron disminución de su peso corporal entre un 2-8% durante la cuarta semana fueron aleatoriamente seleccionados al grupo de pramlintida + metreleptina (360 µg + 5 mg dos veces al día, respectivamente), pramlintida (360 µg dos veces al día) y metraleptina (5 µg dos veces al día) por veinte semanas e instruidos a seguir una dieta deficiente de calorías del 20% (102). Es interesante observar que después de la cuarta semana de tratamiento la pérdida de peso presentada por la combinación sinérgica entre pramlintida y metraleptina continuó a lo largo del estudio sin evidencia de una meseta o, como se conoce en francés, una plateau. Los efectos adversos más comunes son los eventos en el sitio de inyección y náuseas, de medias a moderadas, las cuales decrecen con el transcurrir del tiempo.
Sin embargo, a pesar de que dicha combinación farmacológica se encontraba en una etapa adelantada de fase clínica II, su desarrollo se detuvo a causa de problemas significativos con la generación de anticuerpos y reacciones en la piel. Para una mayor información sobre este particular se puede acceder a la página web http://www.takeda.com/press/article_42791.html.
6.4. Leptina y colecistoquinina
La leptina y la colecistoquinina (CCK) son dos hormonas implicadas en la regulación del peso corporal y la alimentación; la leptina, una señal derivada de la adiposidad, y la CCK un péptido gastrointestinal que induce saciedad periférica. Se ha visto que interactúan de manera sinérgica y su tratamiento concomitante provoca mayor pérdida de peso que cualquier hormona administrada sola. La interacción sinérgica entre CCK y leptina ha sido ampliamente caracterizada en ratas delgadas, pero hay pocos estudios realizados en ratas obesas. Es interesante observar que recientemente se estudió la combinación de fármacos entre la leptina y la CCK-8 en un modelo de obesidad inducida por dieta (OID) con un hallazgo interesante, el de un efecto sinérgico en la reducción de peso corporal y reducción en el consumo nocturno de la dieta sólida Chow (Purina, contenido calórico de 3,38 Kcal/g) utilizando solo esta combinación en ratas jóvenes y delgadas. Mientras tanto, en ratas adultas obesas no se observó efecto reductivo de peso, por lo cual el efecto sinérgico entre la leptina y la CCK depende de la edad del animal, mas no así del consumo (103).
7. MEDICAMENTOS ANTIOBESIDAD APROBADOS POR LA FDA EN EL 2012 (104)
7.1 Belviq (Lorcaserina)
Es un agonista selectivo al receptor 5-HT2C de la serotonina. Este receptor es blanco irresistible para el tratamiento de la obesidad. La localización del receptor es consistente con su función de modelar directamente las vías de control de la ingesta de alimento y de peso corporal. Esta función fue descubierto a finales del siglo pasado, cuando se investigaban los mecanismos de acción de la fenfluramina en los roedores (105).
Debido a ello varias compañías farmacéuticas comenzaron a desarrollar agonistas selectivos al receptor 5-HT2C como posibles candidatos para el tratamiento de la obesidad. De estas investigaciones resultó una molécula potencial, la lorcaserina (APD356), un análogo, estructuralmente hablando, de la dexfenfluramina.
Dicho compuesto, desarrollado por Arena Pharmaceuticals, es un agonista, con una selectividad quince y cien veces mayor que los receptores 5-HT2A y 5-HT2B, respectivamente (106). La selectividad de la lorcaserina y la falta de efectos adversos apreciada en la liberación de serotonina y en otras monoaminas en los ensayos in vitro representó una diferencia importante con los medicamentos anteriores que promueven la señalización de la serotonina, tales como la dexfenfluramina.
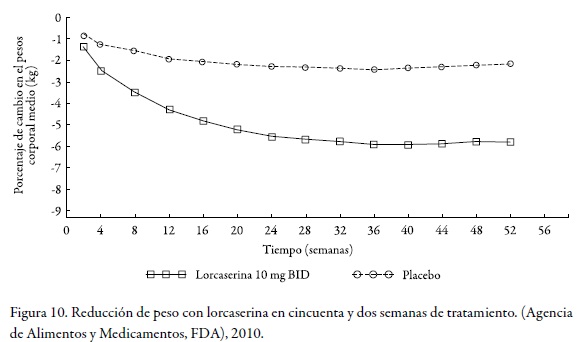
Luego de completar el programa de fase clínica III, la citada compañía lo sometió para aprobación a la FDA, en diciembre de 2009, apoyada en datos de dieciocho ensayos clínicos con un total de 8.576 pacientes tratados durante períodos hasta de dos años con lorcaserina en una formulación de tabletas de 10 mg, que se administraba dos veces al día (v. Figura 10).
7.2 Rechazo parcial de la lorcaserina
Entre septiembre y octubre de 2010 la FDA rechazó la aplicación (por nueve votos contra cinco), a causa de sus posibles riesgos a la seguridad de los pacientes, riesgos hallados en archivos de datos preclínicos, que incluyen cáncer, depresión y pérdida de memoria. Arena Pharmaceuticals había descubierto este fármaco a partir de una serie de estudios de relación estructura-actividad que presentaron mayor potencia de inhibición dosis-dependiente en la ingesta aguda de alimento dos horas posdosis (107).
7.3 Aceptación final del Belviq
Arena Pharmaceuticals volvió a presentar la solicitud de aceptación del fármaco en diciembre de 2011. La Comisión Consultiva de Fármacos Endocrinológicos y Metabólicos de la FDA se reunió el 10 de mayo del 2012 para evaluar la lorcaserina, y por una votación final de dieciocho contra cuatro se admitió que los beneficios del tratamiento con este fármaco a largo plazo eran mayores que los riesgos en los pacientes con sobrepeso y obesos. A su vez, la Agencia Europea de Medicamentos también ha aceptado la comercialización de lorcaserina como Belviq. Un informe de la evaluación clínica a principios de este año mostró que el uso de lorcaserina hasta por un año en pacientes obesos, con sobrepeso y aun con diabetes tipo 2 que además estaban recibiendo metformina o sulfonilurea, ocasionaba una significativa pérdida de peso, con mejoras concomitantes en el control glicémico.
En junio del 2012 la FDA aprobó el uso de lorcaserina para el tratamiento de poblaciones obesas seleccionadas. La compañía fabricante accedió a la realización de estudios poscomercialización con la finalidad de evaluar debidamente los riesgos cardiovasculares y demostrar que es un fármaco seguro, específico y eficaz en el tratamiento de obesidad a largo plazo (99).
7.4 Fentermina + Topiramato (Qsymia)
Este medicamento está aprobado para su uso en adultos con un índice de masa corporal (IMC) de 30 o más (obesidad) o adultos con un IMC de 27 o mayor (con sobrepeso) que tienen al menos una enfermedad relacionada con el peso, como la presión arterial alta (hipertensión), diabetes tipo 2 o colesterol alto (dislipidemia). Es una combinación a una dosis fija de la amina simpaticomimética fentermina, que es un agente anoréctico con el fármaco antiepiléptico topiramato. Ambos medicamentos reducen el apetito e incrementan la termogénesis.
El derivado anfetamínico fentermina, del cual se ha recomendado una dosis de 37,5 mg/día, se utiliza para el tratamiento de la obesidad a corto plazo en Estados Unidos, mientras que el topiramato, un agonista GABA, está indicado como anticonvulsivante en el tratamiento de la epilepsia y para la prevención de la migraña a una dosis de 100 mg/día. Este fármaco ha sido probado en calidad de monoterapia para la pérdida de peso (58). Un metaanálisis reportó pérdida de peso utilizando topiramato de 6,5% del peso inicial, al paso que el placebo mostró un efecto de solo el 2% durante seis meses (18), pero no se conoce el mecanismo exacto de acción, del cómo induce dicha pérdida de peso.
Sin embargo, los efectos adversos presentados por el topiramato en el SNC y periférico, y en lo cognitivo (pérdida de la memoria y dificultades en el trabajo) condujo a su reformulación, a una fórmula de liberación sostenida que, al fallar en las pruebas de tolerabilidad, llevó a descontinuar su uso en diciembre del 2004.
La combinación de fentermina y topiramato o (Qsymia®) ha sido patentada y goza de licencia por la compañía farmacéutica Vivus (Mountain View, California); su formulación es de liberación prolongada, con dosis bajas diarias de los componentes (15 mg o menos de fentermina y 92 mg o menos de topiramato), que ha mostrado buenos resultados; recientemente, en pruebas de fase clínica III a 1.267 pacientes con un IMC de 42 kg/m2 durante cincuenta y seis semanas, indican que la combinación de 15 mg de fentermina con 92 mg de topiramato generó una pérdida de peso promedio de 14,4%, mientras que las personas del grupo placebo perdieron apenas un 2,2% (v. Tabla 2, de la compañía Vivus, obtenida en la página web http://ir.vivus.com/releasedetail.cfm?ReleaseID=407933.
La FDA aprobó la Qsymia el 17 de julio del 2012, con evaluación de riesgos y estrategia de mitigación (REM), que es una guía sobre cómo aconsejar a los pacientes sobre la seguridad y elementos a tener en cuenta para garantizar un uso médico seguro que incluyen la capacitación y certificación de farmacia. El propósito de los REM es educar a los prescriptores y pacientes sobre el riesgo creciente de defectos congénitos asociados con la exposición durante el primer trimestre de Qsymia, la necesidad de prevenir el embarazo y la necesidad de interrumpir el tratamiento si se produce un embarazo. La Qsymia solo se dispensa en farmacias especialmente certificadas (108). Este medicamento se usa como coadyuvante de una dieta baja en calorías y del aumento de la actividad física para el control de peso crónico en adultos obesos (104).
CONCLUSIONES
De esta revisión detallada se concluye que es relevante la amplia diversidad de blancos terapéuticos que están siendo investigados y desarrollados. La industria farmacéutica está preparada para asumir riesgos aun si, por ejemplo, estos condujeron el retiro del mercado del ribonabant y de la sibutramina, por citar algunos.
La combinación de fármacos para uso en el SNC (topiramato, zonizamida, fentermina, bupropión, naltrexona) se encuentran entre los más avanzados en el desarrollo de nuevos medicamentos para tratar la obesidad, tanto así que en el 2012 se aprobaron dos nuevos fármacos con efectos en un tiempo mayor a seis meses y existen combinaciones de fármacos en una fase alta de investigación para su uso en obesidad a largo plazo.
Otros blancos del SNC, como la 5-HT, H3 y receptores-Y, continúan siendo estrategias promisorias de tratamiento. Los compuestos que actúan como blancos terapéuticos a nivel periférico pueden tener ventajas en cuanto a sus efectos adversos (análogos del GLP-1 liraglutida y exenatida. Entre los blancos dentro del intestino, aquellos que estimulan la liberación del GLP-1 parecen ser los más prometedores hasta el momento. Específicamente es de interés el receptor GPR 119; asimismo, el desarrollo de un nuevo inhibidor de lipasa (cetilistat) parece ser uno de los que afronta menores riesgos.
En general, el arsenal terapéutico de los fármacos para el manejo del peso corporal, y otros compuestos usados en la obesidad, cambiará considerablemente en los próximos cinco años, al conocerse sus mecanismos de acción relacionados con el eje intestinocerebro o gut-brain axis.
AGRADECIMIENTOS
Este artículo fue apoyado por el Instituto de Ciencia y Tecnología del Distrito Federal (ICyTDF) a través del programa de becas 2012-2013 y por la doctora Norah Barba Behrens, profesora titular de tiempo completo del Departamento de Química Inorgánica y Nuclear de la Facultad de Química de la Universidad Nacional Autónoma de México (UNAM).
REFERENCIAS
1. P.J. Kissane, Medical and surgical treatment of obesity, Best Pract. Res. Clin. Anaesthesiol., 25, 11-25 (2011). [ Links ]
2. C.P. Cannon, A. Kumar, Treatment of overweight and obesity: lifestyle, pharmacologic, and surgical options, Clin. Cornerstone, 9, 55-68; discussion 69-71 (2009). [ Links ]
3. Obesity, N. T. F. o. t. p. a. t. o., Overweight, obesity and health risk, Arch. Intern. Med., 160, 898-904 (2000). [ Links ]
4. J.C. Halford, E.J. Boyland, J.E. Blundell, T.C. Kirkham, J.A. Harrold, Pharmacological management of appetite expression in obesity, Nature Reviews, 6, 255-269 (2010). [ Links ]
5. M.M. Huizinga, Weight-Loss Pharmacotherapy: A Brief review clinical, Clinical Diabetes, 25, 135-140 (2007). [ Links ]
6. WHO, W. H. O. Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee, WHO, 1-452, 1995. [ Links ]
7. S.D. Stovitz et al., Child height and the risk of young-adult obesity, Am. J. Prev. Med., 38, 74-77 (2010). [ Links ]
8. S. Rossner, M. Hammarstrand, E. Hemmingsson, M. Neovius, K. Johansson, Long-term weight loss and weight-loss maintenance strategies, Obes. Rev., 9, 624-630 (2008). [ Links ]
9. J.M. Jakicic, The effect of physical activity on body weight, Obesity (Silver Spring), 17 Suppl 3, S34-38 (2009). [ Links ]
10. M. Ravishankar-Ram, G. Beena, P. Ragunathan, R. Malathi, Analysis of structure, function, and evolutionary origin of the ob gene product-leptin, J. Biomol. Struct. Dyn., 25, 183-188 (2007). [ Links ]
11. K.G. Murphy, S.R. Bloom, Gut hormones and the regulation of energy homeostasis, Nature, 444, 854-859 (2006). [ Links ]
12. Y. Wang, M.A. Beydoun, The obesity epidemic in the United States-gender, age, socioeconomic, racial/ethnic, and geographic characteristics: A systematic review and meta-regression analysis, Epidemiol. Rev., 29, 6-28 (2007). [ Links ]
13. R.F. Witkamp, Current and future drug targets in weight management, Pharm. Res., 28, 1792-1818 (2011). [ Links ]
14. J.S. Flier, E. Maratos-Flier, What fuels fat, Sci. Am., 297, 72-81 (2007). [ Links ]
15. J.W. Yun, Possible anti-obesity therapeutics from nature-a review, Phytochemistry, 71, 1625-1641 (2010). [ Links ]
16. R. Padwal, S.K. Li, D.C. Lau, Long-term pharmacotherapy for obesity and overweight, Cochrane database of systematic reviews (Online), CD004094 (2004). [ Links ]
17. B. Hutton, D. Fergusson, Changes in body weight and serum lipid profile in obese patients treated with orlistat in addition to a hypocaloric diet: a systematic review of randomized clinical trials, Am. J. Clin. Nutr., 80, 1461-1468 (2004). [ Links ]
18. Z. Li et al., Meta-analysis: pharmacologic treatment of obesity, Annals of Internal Medicine, 142, 532-546 (2005). [ Links ]
19. S. Czernichow et al., Efficacy of weight loss drugs on obesity and cardiovascular risk factors in obese adolescents: a meta-analysis of randomized controlled trials, Obes. Rev., 11, 150-158 (2010). [ Links ]
20. J. Zhi et al., Retrospective population-based analysis of the dose-response (fecal fat excretion) relationship of orlistat in normal and obese volunteers, Clin Pharmacol Ther., 56, 82-85 (1994). [ Links ]
21. J.S Torgerson, J. Hauptman, Boldrin, L. Sjöström, XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients, Diabetes Care, 27, 856 (2004). [ Links ]
22. S.S. Hussain, S.R. Bloom, The pharmacological treatment and management of obesity, Postgrad. Med., 123, 34-44 (2011). [ Links ]
23. M.A. Valentino, J.E. Lin, S.A. Waldman, Central and peripheral molecular targets for antiobesity pharmacotherapy, Clin. Pharmacol. Ther., 87, 652-662 (2010). [ Links ]
24. M.T. Neary, R.L. Batterham, Gut hormones: implications for the treatment of obesity, Pharmacol. Ther., 124, 44-56 (2009). [ Links ]
25. T.H. Morán, M.J. Dailey, Minireview: Gut peptides: targets for antiobesity drug development?, Endocrinology, 150, 2526-2530 (2009). [ Links ]
26. W.V. Andrew A. Young, R.G. Bronislava, R. Pittner, S. Janes, L.S.L. Gaeta, A. Percy, C.X. Moore, J.E. Koda, T.J. Rink, K. Beaumont, Preclinical pharmacology of pramlintide in the rat: Comparisons with human and rat amylin, Drug Development Research, 37, 231-248 (1996). [ Links ]
27. M.F. Li, B.M.Y. Cheung, Pharmacotherapy for obesity, British Journal of Clinical Pharmacology, 68, 804-810 (2009). [ Links ]
28. K.M. Gadde, D.B. Allison, Combination pharmaceutical therapies for obesity, Expert Opin. Pharmacother, 10, 921-925 (2009). [ Links ]
29. A.L. Smith-S.R., C.M. Burns, N.C. Kesty, A.E. Halseth, C. Weyer, Sustained weight loss following 12-month pramlintide treatment as an adjunct to lifestyle intervention in obesity, Diabetes Care, 9, 1816-1823 (2008). [ Links ]
30. D. Larhammar, Structural diversity of receptors for neuropeptide Y, peptide YY and pancreatic polypeptide, Regul. Pept., 65, 165-174 (1996). [ Links ]
31. L. Degen et al., Effect of peptide YY3-36 on food intake in humans, Gastroenterology, 129, 1430-1436 (2005). [ Links ]
32. R.L. Batterham et al., Pancreatic polypeptide reduces appetite and food intake in humans, J. Clin. Endocrinol. Metab., 88, 3989-3992 (2003). [ Links ]
33. N. Giannoukakis, Exenatide. Amylin/Eli Lilly, Curr. Opin. Investig. Drugs, 4, 459-465 (2003). [ Links ]
34. D.J. Drucker et al., Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomised, open-label, non-inferiority study, Lancet, 372, 1240-1250 (2008). [ Links ]
35. L.L. Nielsen, T. Okerson, J. Holcombe, B. Hoogwerf, Effects of exenatide on diabetes, obesity, cardiovascular risk factors, and hepatic biomarkers in patients with type 2 diabetes, J. Diabetes Sci. Technol., 2, 255-260 (2008). [ Links ]
36. A. Astrup et al., Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study, Lancet, 374, 1606-1616 (2009). [ Links ]
37. S.C. Gough, Liraglutide: from clinical trials to clinical practice, Diabetes Obes. Metab., 14 Suppl 2, 33-40 (2012). [ Links ]
38. A. Weller, G.P. Smith, J. Gibbs, Endogenous cholecystokinin reduces feeding in young rats, Science, 247, 1589-1591 (1990). [ Links ]
39. R. Chandra, R.A. Liddle, Cholecystokinin, Curr. Opin. Endocrinol. Diabetes Obes., 14, 63-67 (2007). [ Links ]
40. P. INC., A 12-week, phase 2a, randomized, subject and investigator blinded, placebo-controlled trial to evaluate the safety, tolerability and efficacy of CE-326,597 on glucose control and body weight in overweight adult subjects with type 2 diabetes mellitus (2009). [ Links ]
41. E. Egecioglu et al., Ghrelin increases intake of rewarding food in rodents, Addict. Biol., 15, 304-311 (2010). [ Links ]
42. E. Egecioglu et al., Ghrelin increases intake of rewarding food in rodents, Addict. Biol., 15, 304-311 (2010). [ Links ]
43. J. Yang, T.J. Zhao, J.L. Goldstein, M.S. Brown, Inhibition of ghrelin O-acyltransferase (GOAT) by octanoylated pentapeptides, Proc. Natl Acad. Sci. USA, 105, 10750-10755 (2008). [ Links ]
44. Y. Zhang et al., Positional cloning of the mouse obese gene and its human homologue, Nature, 372, 425-432 (1994). [ Links ]
45. L.A. Campfield, F.J. Smith, Y. Guisez, R. Devos, P. Burn, Recombinant mouse OB protein: evidence for a peripheral signal linking adiposity and central neural networks, Science, 269, 546-549 (1995). [ Links ]
46. J.L. Halaas et al., Weight-reducing effects of the plasma protein encoded by the obese gene, Science (New York, NY), 269, 543-546 (1995). [ Links ]
47. M.A. Pelleymounter et al., Effects of the obese gene product on body weight regulation in ob/ob mice, Science (New York, NY), 269, 540-543 (1995). [ Links ]
48. T.W. Stephens et al., The role of neuropeptide Y in the antiobesity action of the obese gene product, Nature, 377, 530-532 (1995). [ Links ]
49. D.S. Weigle et al., Recombinant ob protein reduces feeding and body weight in the ob/ob mouse, The Journal of Clinical Investigation, 96, 2065-2070 (1995). [ Links ]
50. M.W. Schwartz, R.J. Seeley, L.A. Campfield, P. Burn, D.G. Baskin, Identification of targets of leptin action in rat hypothalamus, The Journal of Clinical Investigation, 98, 1101-1106 (1996). [ Links ]
51. J.M. Friedman, J.L. Halaas, Leptin and the regulation of body weight in mammals, Nature 395, 763-770 (1998). [ Links ]
52. S. Cinti et al., Secretory granules of endocrine and chief cells of human stomach mucosa contain leptin, Int. J. Obes. Relat. Metab. Disord., 24, 789-793 (2000). [ Links ]
53. I. Sobhani et al., Leptin secretion and leptin receptor in the human stomach, Gut, 47, 178-183 (2000). [ Links ]
54. A. Bado et al., The stomach is a source of leptin, Nature, 394, 790-793 (1998). [ Links ]
55. O. Chaudhri, C. Small, S. Bloom, Gastrointestinal hormones regulating appetite, Philos. Trans. R. Soc. Lond B Biol. Sci., 361, 1187-1209 (2006). [ Links ]
56. D.L. Coleman, Obese and diabetes: two mutant genes causing diabetes-obesity syndromes in mice, Diabetologia, 14, 141-148 (1978). [ Links ]
57. A. Palou, M.L. Bonet, C. Pico, A.M. Rodríguez, Nutrigenomics and obesity, Rev. Med. Univ. Navarra, 48, 36-48 (2004). [ Links ]
58. G.J. Morton, D.E. Cummings, D.G. Baskin, G.S. Barsh, M.W. Schwartz, Central nervous system control of food intake and body weight, Nature, 443, 289-295(2006). [ Links ]
59. P.C. Konturek et al., Neuro-hormonal control of food intake: basic mechanisms and clinical implications, J. Physiol. Pharmacol., 56 Suppl 6, 5-25 (2005). [ Links ]
60. A.S. Garfield, L.K. Heisler, Pharmacological targeting of the serotonergic system for the treatment of obesity, The Journal of Physiology, 587, 49-60 (2009). [ Links ]
61. P.J. Rogers, J.E. Blundell, Effect of anorexic drugs on food intake and the microstructure of eating in human subjects, Psychopharmacology, 66, 159-165 (1979). [ Links ]
62. E. Goodall, T. Silverstone, Differential effect of d-fenfluramine and metergoline on food intake in human subjects, Appetite, 11, 215-228 (1988). [ Links ]
63. A. Carvajal, J. García del Pozo, I. Martin de Diego, A.M. Rueda de Castro, A. Velasco, Efficacy of fenfluramine and dexfenfluramine in the treatment of obesity: a meta-analysis, Methods and Findings in Experimental and Clinical Pharmacology, 22, 285-290 (2000). [ Links ]
64. P.K. Thanos et al., The effects of two highly selective dopamine D3 receptor antagonists (SB-277011A and NGB-2904) on food self-administration in a rodent model of obesity, Pharmacol. Biochem. Behav., 89, 499-507 (2008). [ Links ]
65. B.J. Sargent, N.A. Moore, New central targets for the treatment of obesity, Br. J. Clin. Pharmacol., 68, 852-860 (2009). [ Links ]
66. J. Korner, L.J. Aronne, Pharmacological approaches to weight reduction: therapeutic targets, The Journal of Clinical Endocrinology and Metabolism, 89, 2616-2621 (2004). [ Links ]
67. J. Lorber, Obesity in childhood. A controlled trial of anorectic drugs, Archives of Disease in Childhood, 41, 309-312 (1966). [ Links ]
68. J.F. Munro, A.C. MacCuish, E.M. Wilson, L.J. Duncan, Comparison of continuous and intermittent anorectic therapy in obesity, British Medical Journal, 1, 352-354 (1968). [ Links ]
69. M.L. Cordido, Approved and off-label uses of obesity medications, and potential new pharmacologic treatment options, Pharmaceuticals, 3, 125-145 (2010). [ Links ]
70. N.Q. Plodkowski-R.A, U. Sundaram, L. Nguyen, D.L. Chau, S. St. Jeor, Bupropion and naltrexone: a review of their use individually and in combination for the treatment of obesity, Expert Opin. Pharmacother, 10, 1069-1081 (2009). [ Links ]
71. R.A. Dwoskin-L.P., K.A. King-Pospisil, M.T. Bardo, Review of the pharmacology and clinical profile of bupropion, an antidepressant and tobacco use cessation agent, CNS Drug Rev., 12, 178-207 (2006). [ Links ]
72. R.D. Hurt et al., A comparison of sustained-release bupropion and placebo for smoking cessation, The New England Journal of Medicine, 337, 1195-1202 (1997). [ Links ]
73. J.W. Anderson et al., Bupropion SR enhances weight loss: a 48-week doubleblind, placebo- controlled trial, Obesity Research, 10, 633-641 (2002). [ Links ]
74. A.M. Axel, J.D. Mikkelsen, H.H. Hansen, Tesofensine, a novel triple monoamine reuptake inhibitor, induces appetite suppression by indirect stimulation of alpha1 adrenoceptor and dopamine D1 receptor pathways in the diet-induced obese rat, Neuropsychopharmacology, 35, 1464-1476 (2010). [ Links ]
75. A. Astrup et al., Effect of tesofensine on bodyweight loss, body composition, and quality of life in obese patients: a randomised, double-blind, placebo-controlled trial, Lancet 372, 1906-1913 (2008). [ Links ]
76. J.A. Gilbert et al., The effect of tesofensine on appetite sensations, Obesity (Silver Spring), 20, 553-561 (2012). [ Links ]
77. A. Khan et al., Current updates in the medical management of obesity, Recent Pat. Endocr. Metab. Immune Drug Discov., 6, 117-128 (2012). [ Links ]
78. L.L. Ioannides-Demos, J. Proietto, A.M. Tonkin, J.J. McNeil, Safety of drug therapies used for weight loss and treatment of obesity, Drug Saf., 29, 277-302 (2006). [ Links ]
79. I.P. Connoley et al., Thermogenic effects of sibutramine and its metabolites, British Journal of Pharmacology, 126, 1487-1495 (1999). [ Links ]
80. A. Astrup, D.L. Hansen, C. Lundsgaard, S. Toubro, Sibutramine and energy balance, Int. J. Obes. Relat. Metab. Disord., 22 Suppl 1, S30-35; discussion S36-37, S42 (1998). [ Links ]
81. D. Rucker, R. Padwal, S.K. Li, C. Curioni, D.C. Lau, Long term pharmacotherapy for obesity and overweight: updated meta-analysis, BMJ, Clinical Research Ed., 335, 1194-1199 (2007). [ Links ]
82. A. Siebenhofer et al., Long-term effects of weight-reducing drugs in hypertensive patients, Cochrane database of systematic reviews (Online), CD007654 (2009). [ Links ]
83. A. Astrup, Drug management of obesity-efficacy versus safety, The New England Journal of Medicine, 363, 288-290 (2010). [ Links ]
84. C. Cercato et al., A randomized double-blind placebo-controlled study of the long-term efficacy and safety of diethylpropion in the treatment of obese subjects, Int. J. Obes. (Londres), 33, 857-865 (2009). [ Links ]
85. D. Cota, The role of the endocannabinoid system in the regulation of hypothalamic- pituitary-adrenal axis activity, J. Neuroendocrinol., 20 Suppl 1, 35-38 (2008). [ Links ]
86. L.L. Ioannides-Demos, L. Piccenna, J.J. McNeil, Pharmacotherapies for obesity: past, current, and future therapies. J. Obes., 2011, ID 179674 18 p. (2011). [ Links ]
87. C.A. Tseng-Y.H., C.R. Kahn, Cellular bioenergetics as a target for obesity therapy, Nat. Rev. Drug Discov., 9, 465-482 (2010 ). [ Links ]
88. B. Cannon, J. Nedergaard, Brown adipose tissue: function and physiological significance, Physiol. Rev., 84, 277-359 (2004). [ Links ]
89. K.A. Virtanen et al., Functional brown adipose tissue in healthy adults, The New England Journal of Medicine, 360, 1518-1525 (2009). [ Links ]
90. G. Fruhbeck, S. Becerril, N. Sainz, P. Garrastachu, M.J. García-Velloso, BAT: a new target for human obesity?, Trends Pharmacol. Sci., 30, 387-396 (2009). [ Links ]
91. M. N.M., Obesity and corticosteroids: 11beta-hydroxysteroid type 1 as a cause and therapeutic target in metabolic disease, Mol. Cell Endocrinol., 316, 154-164 (2010). [ Links ]
92. S.P. Gathercole-L.L., Targeting the pre-receptor metabolism of cortisol as a novel therapy in obesity and diabetes, J. Steroid Biochem. Mol. Biol., 122, 21-27 (2010). [ Links ]
93. J.V. Silha, M. Krsek, P. Sucharda, L.J. Murphy, Angiogenic factors are elevated in overweight and obese individuals, Int. J. Obes. (Londres), 29, 1308-1314 (2005). [ Links ]
94. M. Evans et al., Conjugated linoleic acid suppresses triglyceride accumulation and induces apoptosis in 3T3-L1 preadipocytes, Lipids, 35, 899-910 (2000). [ Links ]
95. D. Langin, Adipose tissue lipolysis as a metabolic pathway to define pharmacological strategies against obesity and the metabolic syndrome, Pharmacol. Res., 53, 482-491 (2006). [ Links ]
96. F.L. Greenway et al., Rational design of a combination medication for the treatment of obesity, Obesity (Silver Spring), 17, 30-39 (2009). [ Links ]
97. F.L. Greenway et al., Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): A multicentre, randomised, doubleblind, placebo-controlled, phase 3 trial, Lancet, 376, 595-605 (2010). [ Links ]
98. F.L. Greenway, G.A. Bray, Combination drugs for treating obesity, Curr. Diab. Rep., 10, 108-115 (2010). [ Links ]
99. M.O. Dietrich, T.L. Horvath, Limitations in anti-obesity drug development: the critical role of hunger-promoting neurons, Nat. Rev. Drug Discov., 11, 675-691 (2012). [ Links ]
100. K.M. Gadde, D.M. Franciscy, H.R. Wagner, K.R. Krishnan, Zonisamide for weight loss in obese adults: a randomized controlled trial, JAMA, 289, 1820-1825 (2003). [ Links ]
101. J.D. Roth et al., Leptin responsiveness restored by amylin agonism in diet-induced obesity: evidence from nonclinical and clinical studies, Proc. Natl Acad. Sci. USA, 105, 7257-7262 (2008). [ Links ]
102. E. Ravussin et al., Enhanced weight loss with pramlintide/metreleptin: an integrated neurohormonal approach to obesity pharmacotherapy, Obesity (Silver Spring), 17, 1736-1743 (2009). [ Links ]
103. Milton Londoño, L.A. Tellez, R. Gutierrez, Physiological Low Doses of Leptin and Cholecystokinin Induces Body Weight-Loss in Juvenile and Lean, but not in Adult-Obese Rats. International Journal of Peptide Research and Therapeutics, 18, 77-88 (2012). [ Links ]
104. E. Colman et al., The FDAs assessment of two drugs for chronic weight management, N. Engl. J. Med., 367, 1577-1579 (2012). [ Links ]
105. S.P. Vickers, C.T. Dourish, G.A. Kennett, Evidence that hypophagia induced by d-fenfluramine and d-norfenfluramine in the rat is mediated by 5-HT2C receptors, Neuropharmacology, 41, 200-209 (2001). [ Links ]
106. S.R. Smith et al., Lorcaserin (APD356), a selective 5-HT(2C) agonist, reduces body weight in obese men and women, Obesity (Silver Spring), 17, 494-503 (2009). [ Links ]
107. B.M. Smith et al., Discovery and structure-activity relationship of (1R)-8-chloro- 2,3,4,5-tetrahydro-1-methyl-1H-3-benzazepine (Lorcaserin), a selective serotonin 5-HT2C receptor agonist for the treatment of obesity, Journal of Medicinal Chemistry, 51, 305-313 (2008). [ Links ]
108. D. Wong, K. Sullivan, G. Heap, The pharmaceutical market for obesity therapies, Nat. Rev. Drug Discov., 11, 669-670 (2012). [ Links ]
109. WHO, Prevalence of overweight & obesity map (2010). [ Links ]
110. M.K. Badman, J.S. Flier, The gut and energy balance: visceral allies in the obesity wars, Science, 307, 1909-1914 (2005). [ Links ]
111. C.S. Elangbam, Review paper: Current strategies in the development of antiobesity drugs and their safety concerns, Vet. Pathol., 46, 10-24 (2009). [ Links ]
112. C. Beglinger, L. Degen, Fat in the intestine as a regulator of appetite-role of CCK, Physiol. Behav., 83, 617-621 (2004). [ Links ]